2. 中国科学院大学 北京 100049;
3. 安徽大学 健康科学研究院 合肥 230601;
4. 中国科学院高能物理研究所 北京同步辐射装置 北京 100049
2. University of Chinese Academy of Sciences, Beijing 100049, China;
3. Institute of Health Sciences, Anhui University, Hefei 230601, China;
4. Beijing Synchrotron Radiation Facility, Institute of High Energy Physics, Chinese Academy of Sciences, Beijing 100049, China
近期的研究表明,二次细颗粒物(Secondary Fine Particulate Matter, SFPM),即自然和人为排放的一次污染物进入大气后经氧化、成核、生长和积聚等均相或多相反应过程形成的新颗粒物,是我国大气PM2.5的主要组成部分[1-4]。以2013年对北京、上海、广州和西安4个城市的重雾霾数据为例,二次气溶胶对PM2.5的贡献率为30%~77%,其中27%为二次有机气溶胶(Secondary Organic Aerosol, SOA,大气均相和多相反应形成的有机物),31%为二次无机气溶胶(Secondary Inorganic Aerosol, SIA,主要由硫酸盐、硝酸盐和铵盐等无机成分组成)[5]。
据估计全球每年进入大气中的颗粒物约50%以上为矿物质颗粒物(如SiO2、Al2O3、Fe2O3、Fe3O4、TiO2)[6]。矿物质细和超细颗粒物在大气中有很长的停留时间,是排放到大气中反应活性物质,如二氧化硫(SO2)、氮氧化物(NOx)、碳氢化合物(HC)等发生非均相反应的主要场所[7-8]。研究发现:气态污染物在细颗粒表面的反应可造成大气的氧化性增强,气体向颗粒物的转化加快。研究还发现:一些细颗粒表面可以固定氮氧化物,促进氮氧化物在表面转化成硝酸盐,这个过程会极大促进SO2在颗粒物表面转化成硫酸盐[9]。也有研究表明:SO2可在矿质颗粒物表面发生吸附并通过非均相反应形成亚硫酸盐、硫酸盐及它们的酸式盐,被认为是二次颗粒物的主要成分[10-13]。大气非均相反应(Heterogeneous reaction)又称大气“多相反应”,是大气中两相或两相以上物质之间的化学反应(如气-固、固-液、气-液-固)[14]。然而,目前对大气细和超细颗粒表面上气-固、固-液及有水汽存在发生的气-液-固多相界面反应的转化机制并不清楚。
铁是矿物气溶胶的主要成分之一[7],在城市气溶胶中铁的质量浓度高达7%,在大气中主要以铁氧化物的形式存在,如α-FeOOH、α-Fe2O3、Fe3O4、γ-Fe2O3和β-FeOOH等[15]。理论和实验研究表明:氧化铁气溶胶可作为催化剂催化SO2的氧化[16]。例如Fu等[17]发现SO2在α-Fe2O3 (0001)表面的化学吸附速率显著升高了,并被氧化成SO32-或者SO42-。在本研究中我们以Fe3O4超细颗粒(Ultrafine Particles, UFPs)为模型,采用同步辐射X射线近边吸收谱(X-ray Absorption Near Edge Structure, XANES)技术研究SO2气体在Fe3O4 UFPs表面的反应,并探讨在不同环境条件,如相对湿度(Relative Humidity, RH)、紫外光照(Ultra-Violet, UV)和臭氧浓度(O3)条件下,对二次颗粒物形成的影响。
1 材料与方法 1.1 材料和试剂超细Fe3O4颗粒购自美国Sigma公司,采用透射电子显微镜(Transmission Electron Microscope, TEM,JEOLJSM-2100)对颗粒物进行物理化学性质表征。将Fe3O4用无水乙醇在合适浓度下超声分散,取10μL分散液于洁净干燥的铜网上,待干燥后于透射电镜下观察并记录图像。
1.2 SO2在Fe3O4 UFPs表面的多相反应SO2与Fe3O4 UFPs在有水蒸气存在条件进行多相反应,反应于石英反应器中进行,如图 1所示。反应前用玛瑙研钵对Fe3O4超细颗粒进行研磨,研磨成粒径均匀的颗粒,将其平铺在载玻片上。反应前吹洗气路15 min,然后在SO2体积浓度3×10-5 (φ)、紫外和O3体积浓度1×10-5 (φ)条件下与Fe3O4 UFPs进行反应,反应持续2 h,得到Fe3O4+SO2+RH、Fe3O4+SO2+RH+UV、Fe3O4+SO2+RH+O3反应产物。反应过程中SO2浓度、UV的控制可参考文献[18]。O3浓度的控制通过臭氧发生器和质量流量控制器控制。相对湿度由水汽发生器控制,用湿度记录器检测标定为40%。
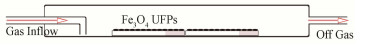
|
图 1 石英反应器示意图 Figure 1 Schematic diagram of quartz reactor |
同步辐射XANES可在分子水平上识别目标元素价态和配位结构信息,是测定元素形态变化的最灵敏技术。XANES方法可直接原位测定固体样品和液体样品中元素化学种态[19-20],是研究颗粒物-气态、颗粒物-液态、颗粒物-气-液态复杂界面反应强有力的工具。在北京同步辐射装置4B7A中能实验站进行产物及标准样品中S元素XANES分析。标样采用全电子产额模式(Total Electron Yield, TEY)进行测量,反应产物采用荧光模式进行测量。硫化合物标样包括硫酸铁、硫酸亚铁、亚硫酸钠、亚硫酸氢钠、单质硫、二硫化亚铁和硫化亚铁。根据指纹效应,将未知样品图谱与标准样品进行比对,可获得未知样品中S元素的化学形态信息。
用IFEFFIT软件包中的Athena软件解析XANES谱,对吸收谱进行归一化、一阶导数处理及线性组合拟合分析S的化学形态。
2 结果与讨论我们以Fe3O4超细颗粒物为模型,研究了氧化铁颗粒物与SO2的界面反应。图 2是Fe3O4的透射电镜图,从图 2中可以看到,Fe3O4颗粒形状为球形,颗粒的尺寸约为(27.2±3.3) nm。
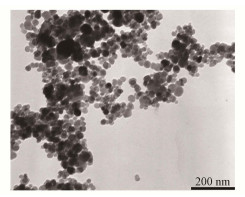
|
图 2 Fe3O4超细颗粒的TEM图 Figure 2 TEM image of Fe3O4 UFPs |
图 3是硫化合物标样与SO2@Fe3O4多相反应产物的XANES谱。图 3(a)为不同氧化态的硫化合物的XANES谱。从图 3(a)中可以看出,单质硫的K边吸收谱白线峰的能量为2472.8 eV,为S的1s电子向3p轨道的跃迁[19-21]。随着S价态的升高,吸收边能量向高能方向移动,如S(Ⅵ)白线峰的位置为2482.8 eV,而低价态S2-白线峰的位置为2468.6eV,白线峰能量随S价态变化详见表 1。从图 3(b)、(c)、(d)可以看出,非均相反应产物中S均有一个较强的吸收峰(2482.8 eV),表明S主要是以高价氧化态的S(Ⅵ)形式存在。图 3(b)为体积浓度3×10-5 (φ)的SO2与Fe3O4 UFPs在不同环境条件(40% RH,1×10-5 (φ) O3共存,UV光照)下反应2h形成的二次颗粒物中硫的XANES谱,结果显示UV光照和O3可以促进硫酸盐的生成。图 3(c)为体积浓度3×10-5 (φ)的SO2与Fe3O4 UFPs反应不同时间后形成的二次颗粒物中硫的XANES谱,从图 3(c)中显示SO2在Fe3O4超细颗粒表面可快速反应生成高价态硫酸盐,反应进行到30 min时,几乎99%的S转化成硫酸盐。图 3(d)为体积浓度3×10-5 (φ)的SO2与Fe3O4 UFPs在1×10-5 (φ) O3共存下反应2 h形成的二次颗粒物中硫的XANES谱,结果显示O3浓度增加有利于硫酸盐生成。
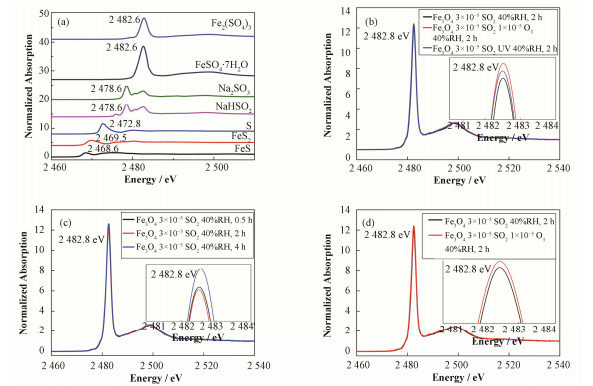
|
图 3 SO2在Fe3O4超细颗粒表面多相反应后产物中硫的K边XANES谱 Figure 3 S K-edge XANES spectra of SFPM via heterogeneous reactions of SO2 at the interface of Fe3O4 UFPs |
| 表 1 硫化合物标样的电子氧化态、白线峰能量和强度 Table 1 Electronic oxidation states, white-line energies, and intensities of reference S compounds |
为了更清楚地分辨产物中硫的化学态,对S的K边XANES谱图进行求导处理[22-23](对图 3中对应谱线进行求导后作图见图 4),可以看到,产物在2479 eV处有一个微弱的谱峰,与亚硫酸盐的峰相对应,说明产物中还存在少量的亚硫酸盐,推测SO2在Fe3O4颗粒物表面首先生成亚硫酸盐,进而亚硫酸盐被快速氧化生成硫酸盐。
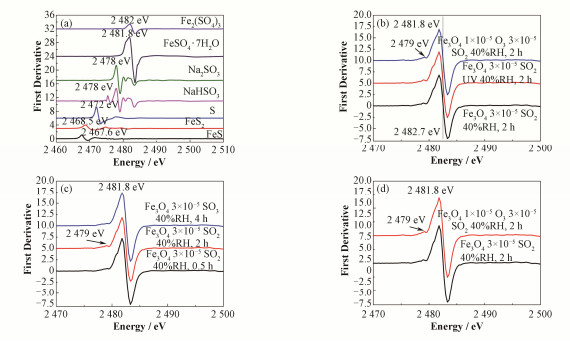
|
图 4 SO2与Fe3O4超细颗粒表面反应生成产物中S的K边XANES谱的一阶导数图 Figure 4 First derivative S K-edge XANES spectra of SFPM via heterogeneous reactions of SO2 at the interface of Fe3O4 UFPs |
SO2是大气中主要的无机气态污染物,其转化为硫酸盐S(Ⅵ)有气相氧化、气相光化学氧化、液相氧化以及颗粒物表面非均相氧化几种途径。传统的SO2转化成硫酸盐的途径主要是气相和液相氧化。SO2可被大气中的自由基如·OH、·HO2、RO2·CH2OO氧化成硫酸盐或在云雾或水滴中被O3、H2O2、NO2等氧化剂氧化成硫酸盐。然而在中国重雾霾天气下,自由基的浓度是很低的,因此SO2气相氧化成硫酸盐的贡献是较低的。Cheng等[24]运用外场观测、模型模拟及理论计算等手段发现,在北京及华北地区雾霾期间,硫酸盐主要是由二氧化硫和二氧化氮溶于空气中的“颗粒物结合水”经液相氧化而生成,反应速率为1~7mg·m-3·h-1,在中国北方地区特有的偏中性环境下迅速反应生成。近年来,野外观测和模型模拟也表明,NO2可催化矿物氧化物表面的SO2氧化生成硫酸盐[9]。因此,目前SO2液相催化氧化或界面非均相催化氧化反应被认为是其转化成硫酸盐的主要途径。近年来,虽然越来越多的研究表明,SO2在矿物颗粒表面的非均相氧化反应是形成硫酸盐二次气溶胶的主要途径,然而在颗粒物表面转化的非均相反应机制尚不清楚。
氧化铁是矿尘气溶胶中的主要金属氧化物,其中Fe3O4又是氧化铁中的主要组成成分。已有研究表明矿尘气溶胶中含铁氧化物可以提高大气SO2向硫酸盐的转化速率[25]。以前研究表明氧化铁表面溶解的Fe(Ⅲ)或Fe(Ⅱ)可以催化S(Ⅳ)与分子氧的氧化[26]。此外也有研究表明SO2首先吸附在氧化铁表面的氧缺陷位点或羟基位点,进一步被表面活化的氧(O2-)氧化生成硫酸根[27]。然而迄今为止,大多数矿物质氧化物的研究都是以微米尺度的颗粒为模型,很少有研究关注SO2在纳米尺度下超细颗粒表面的多相反应。
SO2在氧化铁表面的吸附和氧化与超细颗粒表面活化的O位点密切相关[28]。理论和实验研究表明:过渡金属氧化物表面含有大量的氧空位,有利于O2分子优先吸附并捕获电子形成吸附态的超氧阴离子(O2-ads)、过氧阴离子(O22-ads)及Oads-,并在其表面最终解离成O2-。表面吸附的SO2可与O2-反应生成亚硫酸根,生成的亚硫酸根进一步被Oads-氧化生成硫酸根[29-30]。研究结果证实:SO2无机气态污染物可以在Fe3O4超细颗粒界面快速被催化生成S(Ⅵ),与上述理论研究相符。
3 结语本文以超细Fe3O4颗粒为模型,通过SO2在Fe3O4超细颗粒表面经多相反应生成二次细颗粒物,采用同步辐射XANES研究SFPM表面S的化学形态。结果表明:SO2在Fe3O4超细颗粒表面可快速反应生成高价氧化态的硫酸根(SO42-),其中UV光照和O3可以促进硫酸根的生成。二次颗粒物中发现有亚硫酸根的峰,推测SO2在Fe3O4颗粒物表面首先生成亚硫酸根,进而被快速氧化形成硫酸根。
| [1] |
Yang S, Ma Y L, Duan F K, et al. Characteristics and formation of typical winter haze in Handan, one of the most polluted cities in China[J]. Science of the Total Environment, 2018, 613-614: 1367-1375. DOI:10.1016/j.scitotenv.2017.08.033 |
| [2] |
Ma P K, Zhang P, Shu J N, et al. Characterization of secondary organic aerosol from photo-oxidation of gasoline exhaust and specific sources of major components[J]. Environmental Pollution, 2018, 232: 65-72. DOI:10.1016/j.envpol.2017.09.018 |
| [3] |
Qiao X, Ying Q, Li X H, et al. Source apportionment of PM2.5 for 25 Chinese provincial capitals and municipalities using a source-oriented community multiscale air quality model[J]. Science of the Total Environment, 2018, 612: 462-471. DOI:10.1016/j.scitotenv.2017.08.272 |
| [4] |
Tian Y Z, Liu J Y, Han S Q, et al. Spatial, seasonal and diurnal patterns in physicochemical characteristics and sources of PM2.5 in both inland and coastal regions within a megacity in China[J]. Journal of Hazardous Materials, 2018, 342: 139-149. DOI:10.1016/j.jhazmat.2017.08.015 |
| [5] |
Huang R J, Zhang Y L, Bozzetti C, et al. High secondary aerosol contribution to particulate pollution during haze events in China[J]. Nature, 2014, 514(7521): 218-222. DOI:10.1038/nature13774 |
| [6] |
Usher C R, Michel A E, Grassian V H. Reactions on mineral dust[J]. Chemical Reviews, 2003, 103(12): 4883-4939. DOI:10.1021/cr020657y |
| [7] |
马庆鑫, 马金珠, 楚碧武, 等. 矿质和黑碳颗粒物表面大气非均相反应研究进展[J]. 科学通报, 2015, 60(2): 122-136. MA Qingxin, MA Jinzhu, CHU Biwu, et al. Current progress towards the heterogeneous reactions on mineral dust and soot[J]. Chinese Science Bulletin, 2015, 60(2): 122-136. DOI:10.1360/N972014-01190 |
| [8] |
Park J Y, Jang M. Heterogeneous photooxidation of sulfur dioxide in the presence of airborne mineral dust particles[J]. Royal Society of Chemistry Advances, 2016, 6(63): 58617-58627. DOI:10.1039/c6ra09601h |
| [9] |
He H, Wang Y S, Ma Q X, et al. Mineral dust and NOxpromote the conversion of SO2to sulfate in heavy pollution days[J]. Scientific Reports, 2014, 4(1): 4172. DOI:10.1038/srep04172 |
| [10] |
Yu Z C, Jang M, Park J. Modeling atmospheric mineral aerosol chemistry to predict heterogeneous photooxidation of SO2[J]. Atmospheric Chemistry and Physics, 2017, 17(16): 10001-10017. DOI:10.5194/acp-17-10001-2017 |
| [11] |
Ullerstam M, Vogt R, Langer S, et al. The kinetics and mechanism of SO2 oxidation by O3 on mineral dust[J]. Physical Chemistry Chemical Physics, 2002, 4(19): 4694-4699. DOI:10.1039/b203529b |
| [12] |
Zubieta C E, Fortunato L F, Belelli P G, et al. Theoretical study of SO2adsorption on goethite (110) surface[J]. Applied Surface Science, 2014, 314(10): 558-563. DOI:10.1016/j.apsusc.2014.06.147 |
| [13] |
Long Y, Zhang C C, Wang X X, et al. Oxidation of SO2 to SO3 catalyzed by graphene oxide foams[J]. Journal of Materials Chemistry, 2011, 21(36): 13934-13941. DOI:10.1039/c1jm12031j |
| [14] |
Ravishankara A R. Heterogeneous and multiphase chemistry in the troposphere[J]. Science, 1997, 276(5315): 1058-1065. DOI:10.1126/science.276.5315.1058 |
| [15] |
Dupart Y, King S M, Nekat B. Mineral dust photochemistry induces nucleation events in the presence of SO2[J]. Proceedings of the National Academy of Sciences, 2012, 109(51): 20842-20847. DOI:10.1073/pnas.1212297109 |
| [16] |
Toledano D S, Henrich V E. Kinetics of SO2adsorption on photoexcited α-Fe2O3[J]. Journal of Physical Chemistry B, 2001, 105(18): 3872-3877. DOI:10.1021/jp003327v |
| [17] |
Fu H B, Wang X, Wu H B, et al. Heterogeneous uptake and oxidation of SO2 on iron oxides[J]. Journal of Physical Chemistry C, 2007, 111(16): 6077-6085. DOI:10.1021/jp070087b |
| [18] |
俞淼, 汪冰, 张丹, 等. SO2与CeO2超细颗粒非均相反应产物的细胞毒性效应[J]. 生态毒理学报, 2017, 12(2): 63-70. YU Miao, WANG Bing, ZHANG Dan, et al. Cytotoxicity study of secondary ultrafine particles forming from SO2 reactionon CeO2 ultrafine particles[J]. Asian Journal of Ecotoxicology, 2017, 12(2): 63-70. DOI:10.7524/AJE.1673-5897.20170103004 |
| [19] |
陆尔东, 张新夷. 固体表面结构的同步辐射研究:X射线吸收近边结构(XANES)[J]. 物理学进展, 1998, 18(3): 261-282. LU Erdong, ZHANG Xinyi. Synchrotron radiation studies on solid surface structures:introduction to X-ray absorption near edge structure[J]. Progress in Physics, 1998, 18(3): 261-282. |
| [20] |
王荫淞, 李爱国, 魏仑, 等. 用X射线吸收近边结构谱研究大气颗粒物中元素的种态[J]. 核技术, 2004, 27(11): 810-813. WANG Yinsong, LI Aiguo, WEI Lun, et al. Study on elemental speciation in airborne particulate matter by XANES[J]. Nuclear Techniques, 2004, 27(11): 810-813. DOI:10.3321/j.issn:0253-3219.2004.11.003 |
| [21] |
冼鼎昌. 北京同步辐射装置及其应用[M]. 广西: 广西科学技术出版社, 2016. XIAN Dingchang. Being synchrotron radiation facility and application[M]. Guangxi: Guangxi Science and Technology Press, 2016. |
| [22] |
张龙力, 王春岚, 赵元生, 等. 石油沥青质含硫结构的XANES导数光谱研究[J]. 燃料化学学报, 2013, 41(11): 1328-1335. ZHANG Longli, WANG Chunlan, ZHAO Yuansheng, et al. Speciation and quantification of sulfur compounds in petroleum asphaltenes by derivative XANES spectra[J]. Journal of Fuel Chemistry and Technology, 2013, 41(11): 1328-1335. |
| [23] |
George G N, Gorbaty M L. Sulfur K-edge X-ray absorption spectroscopy of petroleum asphaltenes and model compounds[J]. Journal of the American Chemical Society, 1989, 111(9): 3182-3186. DOI:10.1021/ja00191a012 |
| [24] |
Cheng Y F, Zheng G J, Wei C, et al. Reactive nitrogen chemistry in aerosol water as a source of sulfate during haze events in China[J]. Science Advances, 2016, 12: 1-11. DOI:10.1126/sciadv.1601530 |
| [25] |
Fu H B, Xu T G, Yang S G, et al. Photo induced formation of Fe(Ⅲ)-sulfato complexes on the surface of α-Fe2O3 and their photochemical performance[J]. Journal of Physical Chemistry C, 2009, 113(26): 11316-11322. DOI:10.1021/jp8088275 |
| [26] |
张秋菊, 王晓, 陈建民, 等. SO2与Fe2O3生成Fe(Ⅱ)(aq)和硫酸盐的复相反应机理[J]. 高等学校化学学报, 2006, 27(7): 1347-1350. ZHANG Qiuju, WANG Xiao, CHEN Jianmin, et al. Formation of Fe(Ⅱ)(aq) and sulfate via heterogeneous reaction of SO2 with Fe2O3[J]. Chemical Journal of Chinese Universities, 2006, 27(7): 1347-1350. |
| [27] |
Setvín M, Aschauer U, Scheiber P, et al. Reaction of O2with subsurface oxygen vacancies on TiO2anatase (101)[J]. Science, 2013, 341(12): 988-990. DOI:10.1126/science.1239879 |
| [28] |
Li Y F, Aschauer U, Chen J, et al. Adsorption and reactions of O2on anatase TiO2[J]. Accounts of Chemical Research, 2014, 47(11): 3361-3368. DOI:10.1021/ar400312t |
| [29] |
Baltrusaitis J, Cwiertny D M, Grassian V H. Adsorption of sulfur dioxide on hematite and goethite particle surfaces[J]. Physical Chemistry Chemical Physics, 2007, 9(41): 5542-5554. DOI:10.1039/b709167b |
| [30] |
Zhou D N, Chen L, Zhang C B, et al. A novel photochemical system of ferrous sulfite complex:kinetics and mechanisms of rapid decolorization of acid orange 7 in aqueous solutions[J]. Water Research, 2014, 57(5): 87-95. DOI:10.1016/j.watres.2014.03.016 |


