2. 中国科学院大学 北京 100049;
3. 上海科技大学 上海 201210
2. University of Chinese Academy of Sciences, Beijing 100049, China;
3. Shanghai Tech University, Shanghai 201210, China
环境中氚的监测被广泛地应用于地下水溯源、土木建筑背景调查、核设施的放射性测量等方面,任何形态的氚都可以经过一定的方式转化成氚化水(HTO、DTO、T2O等)。为研究氚在环境介质中的迁移转化规律,准确测定水中氚的活度是非常重要的。由于氚的自然衰变以及禁核令的签署,水中氚的比活度正逐年降低,接近天然环境氚的本底,陆地表层水及降水中氚浓度可能低于1 Bq∙L-1 [1-3],这样给液体闪烁计数法直接测量带来了困难。为了准确测定低浓度氚化水的活度,有必要进行氚化水的电解浓缩[4-5]。常见的氚化水电解浓缩法主要有碱式和固体聚合物电解(Solid Polymer Electrolysis, SPE)浓缩法。后者利用固体聚合物膜优越的电解性能,具有电解槽体积小、电流密度高、安全性高、操作简易、没有碱式电解槽的腐蚀性含氚碱液生成等优点,因此SPE氚电解浓缩法被认为是低水平氚化水浓缩的主流方法[6]。SPE电解浓缩系统的关键是确定系统的氚回收率,氚回收率关键参数是分离系数β和体积浓缩倍数α。体积浓缩倍数取决于电解前后的水样体积,受限于系统装置的容器体积,因此国际上普遍用分离系数β作为评价氚电解浓缩系统性能的指标。目前,国外的SPE电解装置分离系数在6~12[7-9]不等,国内设备的β值与国际优秀水平差距较大。本文从SPE电解系统基本原理出发,以分离系数β作为评价指标,筛选SPE电解系统中的阴阳极材料、优化电解电流和电解温度,从而研制性能较好的固体聚合物氚电解浓缩系统。
1 原理与实验 1.1 原理SPE电解浓缩系统的关键是确定系统的氚回收率R[6]:
| $ R = \exp \left[{\frac{{\ln \left( {{V_{\rm{f}}}/{V_{\rm{i}}}} \right)}}{\beta }} \right] $ | (1) |
式中:Vi和Vf代表电解前后水样的体积,Vi/Vf比值为体积浓缩倍数α,取决于实验设计,可视为常数;β为分离系数,指氚电解浓缩过程中,H2O电解生成H2的反应平衡速率和HTO电解生成HT的反应平衡速率之比,由式(1)可得:
| $ \beta = \frac{{\ln \left( {\frac{{{V_{\rm{f}}}}}{{{V_{\rm{i}}}}}} \right)}}{{\ln \left( {\frac{{{T_{\rm{f}}}{V_{\rm{f}}}}}{{{T_{\rm{i}}}{V_{\rm{i}}}}}} \right)}} $ | (2) |
式中:Ti表示电解初始时液相中氚浓度(本实验中Ti=27.8Bq∙mL-1);Tf表示电解终止时液相中氚浓度。
分离系数β直接受SPE电解过程的影响,β越大说明氚在液相富集越多。因此,要提高氚回收率,必须提高分离系数β。图 1为SPE水电解槽膜电极(Membrane Electrode Assembly, MEA)的工作原理示意图。可以看出,SPE电解过程中可能发生H、T分离的步骤有:
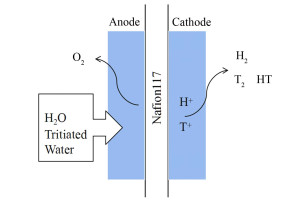
|
图 1 SPE水电解槽膜电极的工作原理示意图 Figure 1 Schematic diagram of working principle of membrane electrode assembly in SPE water electrolyzer |
第一步,阳极侧H2O、HTO等分解发生阳极析氧反应(Oxygen Evolution Reaction, OER)。OER速率取决于水分子的零点能,零点能低的水分子需要较高的活化能,表现为较低的电极反应速度。如表 1所示,含T水分子比H2O的零点能低,使得分解电压高,导致含T水分子的电极反应速率低于H2O水分子,H2O在电解过程中优先在阳极氧化成H+,使HTO等氚化水保留在阳极液相中。
| 表 1 氢同位素水的可逆分解电压(25 ℃) Table 1 Reversible decomposition voltage of hydrogen isotope water (25 ℃) |
第二步,H+与T+在质子交换膜中的迁移步骤。T+和H+在质子交换膜中的传输满足同位素效应动力学,即氢同位素离子在膜内迁移速率存在差异[10],H+的迁移速度大于T+,使得H+快速达到阴极,从而获得氚浓缩的效果。
第三步,阴极侧水合质子放电发生阴极析氢反应(Hydrogen Evolution Reaction, HER)。吸附在阴极催化剂表面上的氢原子相互结合成氢分子,这个过程中由于电极反应速度的差异使得H尽可能进入气相,达到氚化水在阴极的浓缩。
从上述电解过程中可知,工作电流、电极材料、电解水温度等[10-17]将影响分离系数β值,本实验从优化工作电流、选择合适的电极材料、优化并控制电解水温度三方面来提高自制的氚电解浓缩系统的分离系数β。
1.2 实验搭建的固体聚合物氚电解浓缩系统如图 2所示,主要由外供直流电源、电解槽装置、贮水箱及保温装置和气体端的冷却回凝系统组成。电解实验时,提前打开温控装置,使其温度稳定。向阴阳极侧连通的贮存水箱中注入水样(水样经蒸馏去除电解干扰杂质,电导率≤0.5 mS∙m-1),用导线将电解池串联后接到可调直流稳压电源上,将起始工作电流缓慢升至相应工作电流进行电解,同时将电解水产生的氢气和氧气安全地引到室外,到达设置时间电解自动结束。电解结束后,等待贮存水箱内表面没有挂壁水珠时,取出电解后剩余溶液,称重加闪烁液后静置12 h后,由LB-7 (Aloka, Japan)测定水中氚的活度,由式(2)得到分离系数β值。
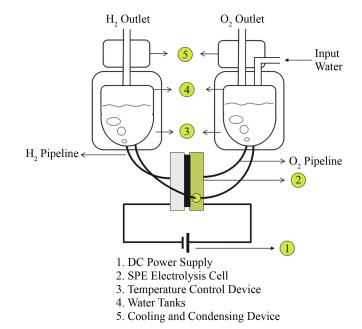
|
图 2 固体聚合物氚电解浓缩系统示意图 Figure 2 Schematic diagram of solid polymer tritium concentration system |
本实验中的电解体积浓缩倍数为16倍,电解初始水样体积为400 mL,结束时水样体积降为25mL。采用喷涂热压转印法将混有一定含量Nafion溶液[18-19]的贵金属纳米粉体(上海河森)催化层与Nafion膜组合形成电解槽核心部件膜电极。通过控制喷雾流量、喷头口径及移动线速度确保每次制成膜的厚度、均匀性完全一致,并用X射线衍射(X-ray Diffraction, XRD)、扫描电镜(Scanning Electron Microscope, SEM)等表征手段进行质控。
2 结果与讨论 2.1 工作电流对分离系数β的影响电解电流的增大导致电解装置中电解水的温度会不断攀升,如表 2所示,为了忽略水温对氚分离系数的影响,本实验的水温被严格控制在25 ℃,采用电极材料(阳极Ir、阴极Pt)的膜电极,探究不同工作电流对氚分离系数β的影响。在水温25 ℃和电解体积浓缩倍数为16倍的条件下,不同工作电流的氚分离系数β及相应的电流密度与氚回收率见图 3和表 3。从图 3和表 3中可以看出,分离系数β随着工作电流先升高后降低,电流为15 A,即电流密度339.4 mA∙cm-2时,分离系数β值最高,数值达到5.4,氚回收率可达到60%,证明了工作电流越小并不是更有利于氚的富集,只有适宜的工作电流才能获得较高的氚回收率[9]。孟建波[13]的SPE水电解氢同位素分离实验表明:分离系数随电流密度(90~300 mA∙cm-2)而增大,并未有高电流密度的数据。周锡煌[17]以铁为阴极,电流密度22~ 421mA∙cm-2的碱式电解实验表明:电解分离系数随着电流密度而增大,到达一最大值(电流密度约309 mA∙cm-2)后下降,本实验得到的参数曲线与上述二者研究结果基本一致。这可能是由于电流密度较低时,电极的极化现象明显,随电流密度增加,同位素效应增强,分离系数增加;但当电流密度过大后,氚化水分解速率加快,使电解过程中氚化水的选择性逐渐降低,不利于同位素的分离。
| 表 2 电解水温度与工作电流的关系 Table 2 Relationship between electrolysis water temperature and working current |
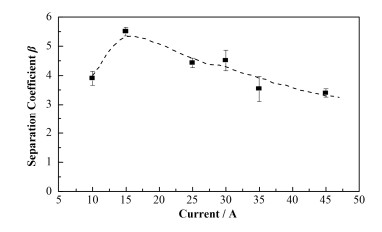
|
图 3 不同工作电流的分离系数β Figure 3 The separation coefficient β of the electrolysis concentration system under different operating current |
| 表 3 不同工作电流相应的电流密度与氚回收率 Table 3 The current density and tritium recovery factor corresponding to different working current |
为考察电极材料对分离系数β的影响,我们优选了耐腐蚀性强且催化反应活性高的金属材料,分别制备了Ir/Nafion117/Pt、Pt/Nafion117/Ni、Pt/Nafion117/Ag、Ag/Nafion117/Ir膜电极,其中固体聚合物质子交换膜Nafion117左边材料Ir、Pt、Ag为阳极,右边材料Pt、Ni、Ag、Ir为阴极。当工作条件为25 ℃、15 A、体积浓缩倍数16倍时,4种膜电极的分离系数β值如图 4所示。可以看出阳极采用Ir、阴极采用Pt的膜电极所得到的分离系数β最大,约为5,且偏差较小。这是由于在阳极,析氧反应活性:Ir>Pt>Ag,Ir是稳定且催化活性高的阳极催化剂,促进阳极反应的同位素分馏;在阴极,由于Pt与H的吸附键能较大,达到280 kJ∙mol-1,其他阴极催化剂材料Ir、Ni、Ag与H的吸附能均小于Pt,因此,采用Pt是目前实验得到的最佳阴极催化剂材料。

|
图 4 不同电极材料的分离系数β Figure 4 The separation coefficient β of tritium concentration of different electrode materials |
以Ir/Nafion117/Pt膜电极为例,考察恒定电流为15 A、体积浓缩倍数为16倍时,电解水温度对分离系数β和氚回收率R的影响,其结果如图 5所示,分离系数β值随温度的升高呈现下降的趋势。为了解低温条件下工作电流的影响,控制水温为5 ℃,体积浓缩倍数为16,改变工作电流,其结果如表 4所示。从表 4可以得出结论,水温度控制在5 ℃时,15 A的工作电流得到的氚浓缩效果最佳,氚电解浓缩系统的分离系数可以达到6.5,氚回收率在65%左右。
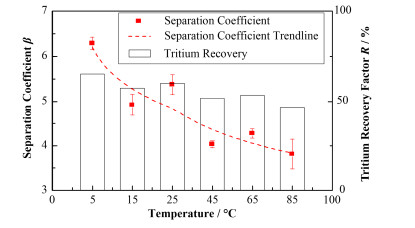
|
图 5 不同温度下Ir/Nafion117/Pt膜电极的分离系数β和氚回收率R Figure 5 At different temperatures, the separation coefficient β of Ir/Nafion117/Pt MEA and the tritium recovery factor R |
| 表 4 低温下不同工作电流下得到的分离系数β Table 4 Separation coefficient β under different operating currents at low temperature |
本研究以氚分离系数作为评价氚电解浓缩系统性能的指标,从控制工作电流、温度条件、选择适宜的阴阳极催化剂材料等方面对SPE氚电解浓缩系统进行优化。该SPE氚电解浓缩系统在电解初始体积≥400 mL、电解装置电流15 A、电解水温度5 ℃、电解剩余体积≤25 mL的电解条件下,氚分离系数可以达到6.5以上,回收率≥65%,达到较高水平。阳极Ir、阴极Pt的膜电极有良好的氚分离效果,但是并不代表它就是最终选定最佳膜电极材料,后期的研究我们想通过添加一些材料,比如石墨烯来优化膜电极。
| [1] |
Saito M, Takata S, Shimamune T, et al. Tritium enrichment by electrolysis using solid polymer electrolyte[J]. Radioisotopes, 1996, 45: 285-292. DOI:10.3769/radioisotopes.45.285 |
| [2] |
王华, 殷建军, 杨会, 等. 聚合膜电解浓集法测量低水平氚环境水样的氚比活度[J]. 岩矿测试, 2011, 30(6): 745-750. WANG Hua, YIN Jianjun, YANG Hui, et al. Application of the solid polymer electrolysis enrichment method for low level tritium in environmental water and the calculation of tritium specific activity[J]. Rock & Mineral Analysis, 2011, 30(6): 745-750. DOI:10.3969/j.issn.0254-5357.2011.06.017 |
| [3] |
Saito M, Imaizumi H, Kato N, et al. Comparison between anode side and cathode side for tritium enrichment of solid polymer electrolysis[J]. Electrochemistry, 2009, 77(5): 370-372. DOI:10.5796/electrochemistry.77.370 |
| [4] |
张向阳, 张琳, 贾艳琨, 等. 氘-氚分馏系数法确定氚的电解回收率[J]. 核电子学与探测技术, 2016, 36(3): 321-324. ZHANG Xiangyang, ZHANG Lin, JIA Yankun, et al. Attainment the electrolytic recovery of tritium by the relationship between deuterium and tritium separation factors[J]. Nuclear Electronics & Detection Technology, 2016, 36(3): 321-324. DOI:10.3969/j.issn.0258-0934.2016.03.020 |
| [5] |
Walker P. Deuterium and heavy water-a selected bibliography[J]. Journal of Nuclear Materials, 1977, 64(3): 320-320. DOI:10.1016/0022-3115(77)90089-7 |
| [6] |
张向阳, 刘福亮, 张琳, 等. 电解法浓缩环境氚水样的性能研究[J]. 核电子学与探测技术, 2012, 32(11): 1301-1304. ZHANG Xiangyang, LIU Fuliang, ZHANG Lin, et al. Study on properties of electrolytic method enriching the environmental tritium[J]. Nuclear Electronics & Detection Technology, 2012, 32(11): 1301-1304. DOI:10.3969/j.issn.0258-0934.2012.11.017.issn.0258-0934.2012.11.017 |
| [7] |
Muranaka T, Shima N. Electrolytic enrichment of tritium in water using SPE film[A]. Vladimir L, Janis K. Electrolysis[C]. Japan: InTech, 2012: 62-141. DOI: 10.5772/52705. http://www.researchgate.net/publication/300239620_Electrolytic_Enrichment_of_Tritium_in_Water_Using_SPE_Film
|
| [8] |
Saito M. Enrichment reliability of solid polymer electrolysis for tritium water analysis[J]. Journal of Radioanalytical & Nuclear Chemistry, 2008, 275(2): 407-410. DOI:10.1007/s10967-007-6894-8 |
| [9] |
Ivanchuk O M, Goryanina V G, Rozenkevich M B. Isotopic effects of hydrogen during the decomposition of water in electrolysis with a solid polymer electrolyte[J]. Atomic Energy, 2000, 89(3): 745-749. DOI:10.1023/A:1009416417912 |
| [10] |
Kornyshev A A, Kuznetsov A M, Spohr E, et al. Kinetics of proton transport in water[J]. Cheminform, 2003, 34(25): 183-184. DOI:10.1021/jp020857d |
| [11] |
朱正和, 傅依备, 孙颖, 等. CECE法重水电解分离氚的热力学研究[J]. 中国工程科学, 2008, 10(5): 19-24. ZHU Zhenghe, FU Yibei, SUN Ying, et al. Thermodynamic study for the separation of tritium by CECE method from heavy water[J]. Engineering Sciences, 2008, 10(5): 19-24. DOI:10.3969/j.issn.1009-1742.2008.05.004 |
| [12] |
Ogata Y, Sakuma Y, Ohtani N, et al. Tritium separation by electrolysis using solid polymer electrolyte[J]. Fusion Science & Technology, 2005, 48(1): 136-139. DOI:10.13182/FST05-A897 |
| [13] |
孟建波, 桑革, 薛炎, 等. SPE水电解进行H/D同位素分离研究[C]. 中国核学会核材料分会2007年度学术交流会, 2007. DOI: 10.3969/j.issn.1000-0518. 2007. 12. 017. MENG Jianbo, SANG Ge, XUE Yan, et al. H/D isotope separation in SPE water electrolysis[C]. 2007 Annual Academic Meeting of Nuclear Materials Branch of China Nuclear Society, 2007. DOI: 10.3969/j.issn.1000-0518. 2007. 12. 017. |
| [14] |
Takahashi Y, Sekiya Y, Imaizumi H, et al. Effects of magnetic field and temperature on the tritium separation factor under the SPE electrolysis[J]. Radioisotopes, 2009, 58(7): 469-475. DOI:10.3769/radioisotopes.58.469 |
| [15] |
Reier T, Nong H N, Teschner D, et al. Electrocatalytic oxygen evolution reaction in acidic environments-reaction mechanisms and catalysts[J]. Advanced Energy Materials, 2017, 7(1): 1601275. DOI:10.1002/aenm.201601275 |
| [16] |
孟建波, 桑革, 薛炎, 等. 多种电极的SPE水电解性能研究[J]. 电化学, 2007, 13(2): 156-159. MENG Jianbo, SANG Ge, XUE Yan, et al. The research of several electrodes for SPE water electrolysis[J]. Electrochemical, 2007, 13(2): 156-159. DOI:10.3969/j.issn.1006-3471.2007.02.009.issn.1006-3471.2007.02.009 |
| [17] |
周锡煌, 徐大钢, 徐文蕊, 等. 铁阴极电流密度对氢同位素电解分离因数的影响[J]. 化学通报, 1982(9): 000056-000057. ZHOU Xihuang, XU Dagang, XU Wenrui, et al. Effect of iron cathode current density on electrolysis separation factor of hydrogen isotope[J]. Chemistry, 1982(9): 000056-000057. |
| [18] |
马霄平, 宋世栋, 谭忠印, 等. 固体聚合物电解质水电解池电极的优化研究[J]. 电源技术, 2006, 30(8): 621-624. MA Xiaoping, SONG Shidong, TAN Zhongyin, et al. Optimization of membrane electrodes for SPE water electrolysis[J]. Journal of Power Sources, 2006, 30(8): 621-624. DOI:10.3969/j.issn.1002-087X.2006.08.005 |
| [19] |
Su K, Yao X, Sheng S, et al. Ionomer content effects on the electrocatalyst layer with in-situ grown Pt nanowires in PEMFCs[J]. International Journal of Hydrogen Energy, 2014, 39(7): 3219-3225. DOI:10.1016/j.ijhydene.2013.12.117 |


