2. 中国科学院上海应用物理研究所 上海 201800
2. Shanghai Institute of Applied Physics, Chinese Academy of Sciences, Shanghai 201800, China
细菌为了适应恶劣的生存环境,会粘附于界面形成菌膜(Biofilm)[1]。菌膜是细菌粘附于基底形成的、由细菌及其分泌的胞外基质(Extracellular Polymeric Substance, EPS)组成的三维复合物。胞外基质的成分主要包括多糖、蛋白质和胞外脱氧核糖核酸(Deoxyribonucleic Acid, DNA)分子等[2],这些生物大分子互相交联形成网状结构,网络的间隙充满水分子,这样的菌膜结构非常类似于水凝胶,由此,菌膜也被认为是一种水凝胶类似物。菌膜的类水凝胶结构极大地提高了细菌抵抗外界不利条件的能力,使其包裹的细菌对抗生素的耐受性提高10~1000倍[3-4],对环境和人类健康造成极大的危害[5-6]。然而,这种结构却有利于对有机污染物的吸附,作为一种生物除污法被用于污水处理;同时,菌膜组成成分的分离和自组装也成为新型生物工程材料领域关注的焦点[7-9]。因此,简单而有效地调控菌膜结构和性质对于其在生产实践中的应用尤为重要。
目前,菌膜形成和结构的调控技术主要包括以下几类:第一,通过影响细菌生长的环境因素(例如,细菌生长的温度、体系氧含量以及培养基的酸碱度、营养成分和盐浓度等),可以调节菌膜形成和结构[10-13]。武运等[11]发现温度可以影响蜡样芽孢杆菌菌膜的形成量,当温度从4~50℃变化时,菌膜生物量先升高后降低。谢红梅等[12]发现培养基的组分也影响到菌膜形成,营养丰富时,铜绿假单胞菌更易形成菌膜。Cherifi等[14]也发现营养物质的丰富程度会显著影响菌膜结构。Eldyasti等[15]发现调节培养基中Ca2+的浓度也会影响菌膜,当Ca2+升高到120 mg·L-1时,菌膜形成量会降低,出现断裂,强度降低。第二,通过加入干扰物(如抗生素、抗菌纳米材料等)调控菌膜形成及结构是常见手段[16-17]之一。Techaruvichit等[16]发现卡那霉素和链霉素会显著增加空肠弯曲杆菌菌膜的生物体积、表面覆盖度、粗糙度和生物膜的表面粘附力。Rodrigues等[17]发现碳纳米管显著降低大肠杆菌菌膜的生物体积。第三,理论和实验证明发现调节界面的理化性质会影响到菌膜结构。夏俊芳等[18]研究不同界面影响蜡样芽孢杆菌形成菌膜的能力,优越性依次为:玻璃 > 不锈钢 > 聚氯乙烯 > 聚丙烯。Anutrakunchai等[19]发现在周围培养基呈静态时,伯克霍尔德氏菌在全培养基中形成的菌膜显示出蜂窝状结构;在0.1x培养基中,观察到针织样结构;当培养基呈流动态时,在全培养基中菌膜显示出多层结构,在0.1x培养基中只观察到大量分散的单细菌。第四,基因工程是最广泛的调控菌膜结构的方法[20-21]。Klausen等[21]发现绿脓杆菌的Ⅳ型菌毛突变株,形成的菌膜呈现结构复杂的蘑菇状;Zhu等[20]发现霍乱弧菌的luxO-hap (lumines-cence- hemagglutinin/protease)基因发生突变时,形成的菌膜有皱褶、厚度更厚。综上所述,现有技术已可以有效地调节菌膜的生长和结构,但均存在明显的缺点。例如,调节细菌生长的影响因素和添加干扰物极易造成细菌发生突变(营养缺失型突变或耐药性);界面调控和基因工程成本高、操作复杂。
因此,建立一种易操作、低成本的菌膜结构的调控方法是人们关注的热点;同时,菌膜作为一种类水凝胶材料,菌膜结构变化对其类凝胶特性的影响也尚不清楚。基于此,我们选用革兰氏阳性菌枯草芽孢杆菌(Bacillus subtilis)和革兰氏阴性菌绿脓杆菌(Pseudomonas aeruginosa)作为模式生物,通过流变学测试和扫面电子显微镜等手段研究不同相态(固体和液体)培养基对菌膜的结构特点和凝胶性质的影响,以期为防治菌膜危害和开发菌膜应用提供参考依据。
1 材料与方法 1.1 主要试剂及仪器试剂:Luria-Bertan (LB)营养琼脂培养基和LB肉汤培养基,购于青岛高科园海博生物技术有限公司。配制MSgg培养基所需的苯磺酸钠、甘油、谷氨酸、磷酸钾、色氨酸、苯丙氨酸、氯化镁、氯化钙、氯化铁、氯化锌、氯化锰、硫胺素均为分析纯,均购于美国Sigma-Aldrich公司。
菌种:枯草芽孢杆菌(B. subtilis)和绿脓杆菌(P. aeruginosa)购于中国普通微生物菌种保藏管理中心。
仪器:Millipore Elix 5型超纯水仪(美国Millipore公司)提供实验中所用的超纯水;TOMY SX-700型高温高压灭菌锅(日本TOMY公司)用于高温灭菌;SHELLAB LI5-2型恒温培养箱(美国SHELLAB公司)用于细菌恒温培养;LEO 1530VP扫描电子显微镜(德国LEO公司)用于菌膜微观结构观察,Christ ALPHA 2-4型冷冻干燥机(德国Christ公司)用于菌膜样品制备。ARES-RFS流变仪(美国TA仪器公司)用于菌膜流变性质的测试。
1.2 实验方法 1.2.1 培养基制备LB液体培养基配制:取8 g LB营养琼脂培养基粉末加到300 mL超纯水中,120℃高温灭菌20min。
LB固体培养基配制:在LB液体培养基中加1.5%琼脂,120 ℃高温灭菌20 min。培养基冷却至低于60 ℃,倒入细菌培养皿,冷却凝固备用。
MSgg液体培养基配制:在500 mL超纯水中依次加入100 mmol·L-1苯磺酸钠(pH 7.0),0.5%甘油,0.5%谷氨酸,5 mmol·L-1磷酸钾,50 μg mL-1色氨酸,50 μg·L-1苯丙氨酸,2 mmol·L-1氯化镁,700μmol·L-1氯化钙,50 μmol·L-1三氯化铁,1μmol·L-1氯化锌,50 μmol·L-1氯化锰,2 μmol·L-1硫胺素,所列浓度均为配制完成后物质的终浓度,最后将培养基用过滤除菌法除菌。
MSgg固体培养基配制:在MSgg液体培养基中加1.5%琼脂,120℃高温灭菌20 min。培养基冷却至60 ℃左右,倒入细菌培养皿,冷却凝固备用。
1.2.2 菌液制备将冻存于-20℃中的B.subtilis和P.aeruginosa各取10 μL于2 mL LB培养基中,37℃ 220 r·min-1培养12 h左右,采用划线法在LB琼脂平板上活化两次,4℃保存备用。开始制备菌液时,挑取单菌落接种于2 mL LB液体培养基中,将其置于摇床中,37℃ 220 r·min-1培养12 h左右(OD600为1.8),符合正常细菌在对数期的浓度范围[22](OD600为0.2~2.0)。然后,将菌液以10000 r·min-1转速离心1 min,去上清并用生理盐水(0.9% NaCl)重悬,重复离心重悬两次,制备OD600=1(细菌浓度109CFUmL-1,CFU为菌落形成单位(Colony- Forming Units))的菌液备用。
1.2.3 菌膜培养1) 液体培养基培养菌膜:将40 μL浓度为1.0×108 CFU mL-1的菌液加入16 mL液体培养基,混合均匀,静置放于37 ℃恒温培养箱中培养48 h。MSgg液体培养基用于培养B. subtilis菌膜,LB液体培养基用于培养P. aeruginosa菌膜。2)固体培养基培养菌膜:接种10 μL浓度为1.0×108 CFU mL-1的菌液于固体培养平板,37℃恒温培养箱中静置培养48 h。
1.2.4 流变测试收集培养基表面的菌膜,进行流变测试,测量体积1 mL。采用25 mm锥板,测量平板间隙高度为0.35 mm,固定频率1 Hz,应变1%,进行时间扫描200s。
1.2.5 扫描电子显微镜观察收集培养基表面的菌膜,-20℃放置6 h后,转移至-80℃放置12 h,然后在冷冻干燥仪中冷冻干燥36 h。最后,将样品贴于样品台,喷金180 s,扫描电子显微镜观察。
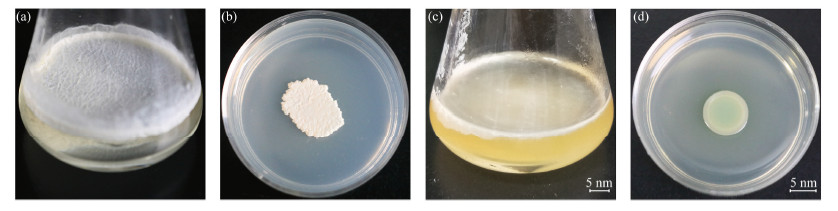
2 结果与讨论 2.1 菌膜的宏观形态细菌增殖分裂周期较短导致细菌接种于培养基(固体或液体)到达指数增长期后,会出现生存空间拥挤、营养物质缺乏的状况。细菌为了适应这种不利情况,分泌胞外基质将菌体自身包裹起来形成菌膜[1]。菌膜结构有别于单细菌形成的菌落。如图 1所示,细菌培养48 h后,B. subtilis在液体培养基表面形成一层肉眼可见的薄膜(图 1(a)),即菌膜。在固体培养基表面的B. subtilis菌膜粘稠、厚实(图 1(b))。P. aeruginosa在液体培养基(图 1(c))和固体培养基表面(图 1(d))均形成菌膜,在液体培养基中形成的菌膜要更薄。同时,我们发现菌膜结构和性质存在物种差异性,P. aeruginosa菌膜透光性比B. subtilis菌膜更强。因此,细菌菌膜形态与其所属种属和培养基的相态相关。
|
图 1 菌膜形态图 液体培养基(a)和固体培养基(b)表面的B. subtilis菌膜,液体培养基(c)和固体培养基(d)表面的P. aeruginosa菌膜 Figure 1 Morphologic images of biofilms B. subtilis biofilm cultured with liquid (a) and solid (b) medium, P. aeruginosa biofilm cultured with liquid (c) and solid (d) medium |
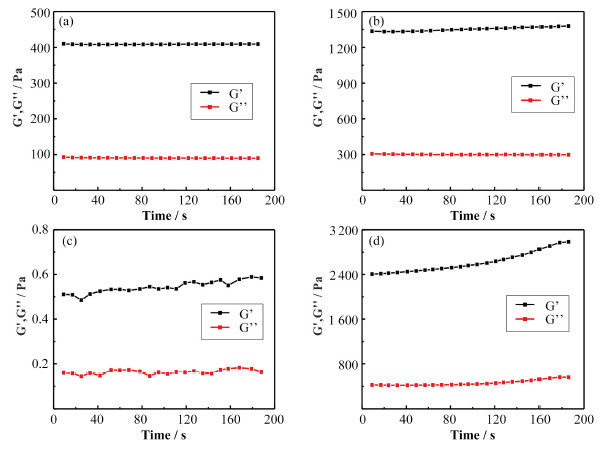
菌膜的组成包括细菌及其分泌的多糖、蛋白质、脂质、DNA等生物大分子组成的胞外基质[2]。胞外基质是生物大分子通过相互作用聚集形成的网络,间隙充满水分子,形成类水凝胶结构[3]。我们运用流变测试分析菌膜的储存模量G’和损耗模量G’’(图 2),结果显示:4种菌膜的储存模量G’均大于损耗模量G’’,说明4种菌膜均具有水凝胶特性[4]。同时,我们发现固体培养基表面形成的菌膜的强度大于液体培养基培养形成的菌膜强度。固体培养形成B. subtilis菌膜的强度是液体培养的三倍左右;固体培养形成P. aeruginosa菌膜强度是液体培养的4800倍左右。这说明菌膜的类凝胶性质与培养基相态相关,固态培养基更利于形成机械强度高的菌膜结构。这种现象的形成可能是因为液体和固体界面的表面张力不同导致细菌粘附力、增殖和胞外基质分泌不同,进而显示截然不同的力学性质[23-24]。
|
图 2 菌膜的流变学测试 液体培养基(a)中和固体培养基(b)形成的B. subtilis菌膜,液体培养基(c)和固体培养基(d)形成的P. aeruginosa菌膜 Figure 2 Rheology analysis of biofilms B. subtilis biofilm cultured with liquid (a) and solid (b) medium, P. aeruginosa biofilm cultured with liquid (c) and solid (d) medium |
为了深入观察菌膜的微观结构,我们对不同相态培养基形成的菌膜进行了扫描电子显微成像。图 3为B. subtilis分别在固液界面的菌膜微观结构图。固体培养基表面的B. subtilis菌膜横截面(图 3(a))显示,48 h培养形成的菌膜厚度约150 μm,整个侧面为一个多孔结构,类似水凝胶的立体网状结构。固体培养基表面的B. subtilis菌膜的扫描显微成像正视图(图 3(b))显示,菌膜形成孔径大小约20 μm的孔洞,这类似于多聚物形成凝胶的多孔结构[25]。液体培养基培养的B. subtilis菌膜与固体培养的截然不同。图 3(c)的截面图显示,液体形成菌膜厚度比固体形成薄很多,只有其厚度的1/7左右,这与图 1宏观结构图一致。相比于固体界面的菌膜,液体界面的B. subtilis菌膜几乎没有形成规则的孔洞,只是裂纹,说明液体界面的菌膜要比固体的更加致密(图 3(d))。图 3(a)和(c)的高分辨显示细菌在液体培养界面的增殖明显高于固体界面,这也许是液体界面菌膜更致密的原因。

|
图 3 扫描电子显微镜表征B. subtilis菌膜结构 固体培养基表面菌膜的横截面(a)和正视图(b),液体培养基表面菌膜横截面(c)和正视图(d) Figure 3 Scanning electron microscope images of B. subtilis biofilm Side view (a) and top view (b) of biofilm cultured with solid medium, side view (c) and top view (d) of biofilm cultured with liquid medium |
我们也观察了P. aeruginos在固体、液体界面形成菌膜的微观结构图(图 4)。类似于B. subtilis菌膜,固体培养基表面的P. aeruginosa菌膜横截面(图 4(a))显示,48 h培养形成的菌膜厚度约40 μm,而液体培养基表面的P. aeruginosa菌膜厚度为14μm(图 4(c)),约为固体的1/4。固体界面形成的P. aeruginosa菌膜表面有少量孔洞(图 4(b)),而液体界面形成的菌膜表面平整致密、无孔洞(图 4(d))。这些结果说明,培养基的相态(固态或液态)是影响革兰氏阳性菌和阴性菌菌膜的结构的主要因素之一。因此,我们可以通过调控培养基的相态实现对菌膜结构和性能的调节。相比于已有的菌膜调控技术[14-16, 19],此方法绿色环保、操作便捷、成本低廉且有普适性,在工业和生物医学的应用中极具潜力。

|
图 4 扫描电子显微镜表征P. aeruginosa菌膜结构 固体培养基表面菌膜的横截面(a)和正视图(b),液体培养基表面菌膜横截面(c)和正视图(d) Figure 4 Scanning electron microscope images of P. aeruginosa biofilm Side view (a) and top view (b) of biofilm cultured with solid medium, side view (c) and top view (d) of biofilm cultured with liquid medium |
本研究中,利用不同相态的培养基(固体和液体)分别培养模式微生物(B. subtilis和P. aeruginosa)形成菌膜,并观察了其形态结构和机械性能。研究发现菌膜具备水凝胶的特性,菌膜的结构和性能依赖于培养基的相态。与液体培养基相比,固体培养基可以促使细菌形成厚度厚且机械性强的菌膜,但这种菌膜的结构通常比液体培养基形成的松散多孔洞。同时,菌膜结构也存在着显著的种属差异性。这些结果有助于我们有效地调控菌膜的结构和性能,实现对有害菌膜的预防和治理以及菌膜特性的工业和医学应用。
| [1] |
Donlan R M, Costerton J W. Biofilms:survival mechanisms of clinically relevant microorganisms[J]. Clinical Microbiology Reviews, 2002, 15(2): 167-193. DOI:10.1128/cmr.15.2.167-193.2002 |
| [2] |
Flemming H C, Wingender J. The biofilm matrix[J]. Nature Reviews Microbiology, 2010, 8(9): 623-633. DOI:10.1038/nrmicro2415 |
| [3] |
Ahmed E M. Hydrogel:preparation, characterization, and applications:a review[J]. Journal of Advanced Research, 2015, 6(2): 105-121. DOI:10.1016/j.jare.2013.07.006 |
| [4] |
Douarche C, Allain J M, Raspaud E. Bacillus subtilis bacteria generate an internal mechanical force within a biofilm[J]. Biophysical Journal, 2015, 109(10): 2195-2202. DOI:10.1016/j.bpj.2015.10.004 |
| [5] |
Bryers J D. Medical biofilms[J]. Biotechnology and Bioengineering, 2008, 100(1): 1-18. DOI:10.1002/bit.21838 |
| [6] |
Yan J, Nadell C D, Stone H A, et al. Extracellularmatrix-mediated osmotic pressure drives vibrio cholerae biofilm expansion and cheater exclusion[J]. Nature Communications, 2017, 8(1): 327-337. DOI:10.1038/s41467-017-00401-1 |
| [7] |
Ding Z, Bourven I, Guibaud G, et al. Role of extracellular polymeric substances (eps) production in bioaggregation:application to wastewater treatment[J]. Applied Microbiology and Biotechnology, 2015, 99(23): 9883-9905. DOI:10.1007/s00253-015-6964-8 |
| [8] |
Dranguet P, LeFaucheur S, Slaveykova V I. Mercury bioavailability, transformations, and effects on freshwater biofilms[J]. Environmental Toxicology and Chemistry, 2017, 36(12): 3194-3205. DOI:10.1002/etc.3934 |
| [9] |
Xiao R, Zheng Y. Overview of microalgal extracellular polymeric substances (eps) and their applications[J]. Biotechnology Advances, 2016, 34(7): 1225-1244. DOI:10.1016/j.biotechadv.2016.08.004 |
| [10] |
Dourou D, Beauchamp C S, Yoon Y, et al. Attachment and biofilm formation by escherichia coli o157:H7 at different temperatures, on various food-contact surfaces encountered in beef processing[J]. International Journal of Food Microbiology, 2011, 149(3): 262-268. DOI:10.1016/j.ijfoodmicro.2011.07.004 |
| [11] |
Xia J, Liu X, Li X, et al. Effects of stress factors on the formation of bacillus cereus biofilm on glass surfaces[J]. Science & Technology of Food Industry, 2017, 38(7): 105-110. DOI:10.13386/j.issn1002-0306.2017.07.012 |
| [12] |
Xie H M, Hu B J, Zhou Z Y, et al. Impact factors of pseudomonas aeruginosa biofilms formation[J]. Chinese Journal of Nosocomiology, 2007, 17(12): 1475-1477. |
| [13] |
Yun M A, Yeon K M, Park J S, et al. Characterization of biofilm structure and its effect on membrane permeability in mbr for dye wastewater treatment[J]. Water Research, 2006, 40(1): 45-52. DOI:10.1016/j.watres.2005.10.035 |
| [14] |
Cherifi T, Jacques M, Quessy S, et al. Impact of nutrient restriction on the structure of listeria monocytogenes biofilm grown in a microfluidic system[J]. Frontiers In Microbiology, 2017, 8(8): 864-896. DOI:10.3389/fmicb.2017.00864 |
| [15] |
Eldyasti A, Nakhla G, Zhu J. Impact of calcium on biofilm morphology, structure, detachment and performance in denitrifying fluidized bed bioreactors (dfbbrs)[J]. Chemical Engineering Journal, 2013, 232(2): 183-195. DOI:10.1016/j.cej.2013.07.084 |
| [16] |
Techaruvichit P, Takahashi H, Kuda T, et al. Adaptation of campylobacter jejuni to biocides used in the food industry affects biofilm structure, adhesion strength, and cross-resistance to clinical antimicrobial compounds[J]. Biofouling, 2016, 32(7): 827-839. DOI:10.1080/08927014.2016.1198476 |
| [17] |
Rodrigues D F, Elimelech M. Toxic effects of single-walled carbon nanotubes in the development of E. Coli biofilm[J]. Environmental Science & Technology, 2010, 44(12): 4583-4589. DOI:10.1021/es1005785 |
| [18] |
夏俊芳, 卢岩, 古丽娜孜, 等. 四种不同接触表面蜡样芽孢杆菌菌膜形成的影响[J]. 食品工业科技, 2018, 39(10): 159-163. XIA Junfang, LU Yan, GULI Nazi, et al. Effects of four kinds of contact surfaces on formation of Bacillus cereus biofilm[J]. Science and Technology of Food Industry, 2018, 39(10): 159-163. DOI:10.13386/j.issn1002-0306.2018.10.030 |
| [19] |
Anutrakunchai C, Bolscher J G M, Krom B P, et al. Impact of nutritional stress on drug susceptibility and biofilm structures of burkholderia pseudomallei and burkholderia thailandensis grown in static and microfluidic systems[J]. PloS One, 2018, 13(3): e0194946. DOI:10.1371/journal.pone.0194946 |
| [20] |
Zhu J, Mekalanos J J. Quorum sensing-dependent biofilms enhance colonization in vibrid cholerae[J]. Developmental Cell, 2003, 5(4): 647-656. DOI:10.1016/s1534-5807(03)00295-8 |
| [21] |
Klausen M, Aaes-Jorgensen A, Molin S, et al. Involvement of bacterial migration in the development of complex multicellular structures in pseudomonas aeruginosa biofilms[J]. Molecular Microbiology, 2003, 50(1): 61-68. DOI:10.1046/j.1365-2958.2003.03677.x |
| [22] |
Zhu Y. Experimental method of bacteria growth curve determination[J]. Journal of Mirobiology, 2016, 36(5): 108-112. |
| [23] |
Vella D, Bico J, Boudaoud A, et al. The macroscopic delamination of thin films from elastic substrates[J]. Proceedings of the National Academy of Sciences of the United States of America, 2009, 106(27): 10901-10906. DOI:10.1073/pnas.0902160106 |
| [24] |
Velankar S S, Lai V, Vaia R A. Swelling-induced delamination causes folding of surface-tethered polymer gels[J]. ACS Applied Materials & Interfaces, 2012, 4(1): 24-29. DOI:10.1021/am201428m |
| [25] |
Xu Y, Wu Q, Sun Y, et al. Three-dimensional self-assembly of graphene oxide and DNA into multifunctional hydrogels[J]. ACS Nano, 2010, 4(12): 7358-7362. DOI:10.1021/nn1027104 |


