镎是重要的核材料[1]。237Np的热辐照产品238Pu是重要的α放射源,以238Pu制备的同位素电池比功率比较高,使用寿命长,在宇航事业和医疗卫生行业具有十分重要的应用价值[2-3]。此外,镎的生物毒性比较强,半衰期为2.14×106 a,其在环境中的含量必须进行严格限制。因此,在乏燃料后处理过程中控制镎的走向并分离回收镎,具有重要意义。
目前,商业后处理厂均采用水法PUREX流程进行乏燃料后处理。其中,镎与钚的分离是研究的重点之一。中国原子能科学研究院张先业等[4]在微型混合澄清槽上用甲基肼进行了在Tc洗槽除镎的研究。实验结果表明,镎的净化系数为16.8,但是1AP(共去污单元含铀、钚萃取有机相)中有28.2%的Pu被反萃到水相。日本学者Yasutoshi等[5]则采用烯丙基肼进行了镎与铀、钚分离的研究,在微型混合澄清槽中进行逆流反萃取实验,结果9%的Np保留在有机相U-Pu产品中,91%的Np进入到水相,约1%的Pu被反萃到水相Np产品中。
甲基肼是乏燃料后处理APOR流程中使用的支持还原剂。水溶液中甲基肼还原Np(Ⅵ)和Pu(Ⅳ)的反应机理、动力学等研究已经有文献报道[6-10],它还原Np(Ⅵ)的反应速率远快于Pu(Ⅳ),因此有可能应用于镎钚分离中。在溶剂萃取过程中,除了发生水相中的化学反应以外,还涉及了镎和钚在两相间的分配过程。因此,研究甲基肼还原反萃动力学更贴近实际工艺,在判断工艺可行性和筛选工艺条件等方面有重要意义。基于以上想法,本工作采用单级反萃试验研究了单甲基肼还原反萃取Np(Ⅵ)和Pu(Ⅳ)的反应动力学,并考察了硝酸浓度、甲基肼浓度、搅拌速率和温度等因素的影响。由反应动力学的计算表明,甲基肼应用于PUREX流程中镎的分离回收具有一定的可行性,它能够将有机相中的Np(Ⅵ)还原反萃到水相,而使大部分Pu(Ⅳ)保留在有机相,将镎集中于单一液流,便于后续工艺中对镎的分离回收。得到的镎产品(含少量钚)可与铀、钚混合后制成快堆混合氧化物核燃料(Mixed Oxide Fuel, MOX)燃料,镎在快堆中嬗变,有利于核废物的最小化。
1 实验部分 1.1 仪器与装置FJ414型低本底α闪烁探头,北京核仪器厂;LS-6000L型液体闪烁谱仪,美国Bechman公司;Elan DRC-e型电感耦合等离子体质谱,美国Perkin Elmer公司;UV-1000紫外可见分光光度计,Lab-Tech公司;T-50型全自动电位控制滴定仪,瑞士梅特勒-托利多公司。图 1为自行研制加工单级实验装置。

|
图 1 单级实验装置 Figure 1 Single stage experiment device. |
镎储备液:NpO2粉末在8.0 mol·L-1的HNO3溶液中恒电流电解,完全溶解后取出阳极区中的电解液,用氨基磺酸亚铁将Np(Ⅵ)还原到Np(Ⅳ),再用2606阴离子交换树脂(苯乙烯二乙烯基苯交联树脂)纯化,得到镎储备液。
Np(Ⅵ)溶液:将含镎硝酸溶液恒电流电解,采用H型带隔膜的玻璃电解池,铂网作为阳极,钛片作为阴极,控制电流密度为30 mA·cm-2进行电解氧化制备Np(Ⅵ)溶液,阳极溶液显玫瑰红色时即有Np(Ⅵ)生成。对阳极液进行光谱扫描,当1225 nm (Np(Ⅵ))处有吸收峰,980 nm (Np(Ⅴ))和960 nm (Np(Ⅳ))处无吸收峰时收集阳极室中溶液即为Np(Ⅵ)储备液。α计数法测定其浓度。
Pu(Ⅳ)溶液:调节含钚料液的硝酸浓度、钚的价态,再采用2606阴离子交换树脂进行离子交换制备Pu(Ⅳ)溶液,以液体闪烁计数法测定其浓度。
Np(Ⅵ)和Pu(Ⅳ)有机相料液:调节Np(Ⅵ)或Pu(Ⅳ)溶液的硝酸浓度至设定值,采用硝酸预平衡的30% TBP(磷酸三丁酯)/煤油对含Np(Ⅵ)或Pu(Ⅳ)的溶液进行萃取,分析Np(Ⅵ)或Pu(Ⅳ)浓度。浓硝酸、甲基肼、磷酸三丁酯等均为分析纯,北京试剂公司产品。
1.3 实验方法和数据处理单级实验时,将确定组成的水相和有机相按体积1:1加入单级萃取池中,开启搅拌后控制其转速为(2200±20) r·min-1,保证两相混合均匀。按预定时间从取样口取混合样,快速离心分相,分析水相、有机相样品中Np和Pu浓度。
参考相关反应动力学文献[4, 10],假设[Np(Ⅵ)]o和[Np(Ⅴ)]a为一级反应。Np(Ⅵ)还原反萃速率表达式为:
| $ - {\rm{d}}{[{\rm{Np}}(Ⅳ)]_{\rm{o}}}/{\rm{d}}t = k{[{\rm{Np}}(Ⅳ)]_{\rm{o}}}{[{\rm{HN}}{{\rm{O}}_3}]^n}{[{\rm{MMH}}]^m} $ | (1) |
依据物料衡算得出式(2):
| $ \begin{array}{l} V \times {[{\rm{Np}}\left( {{\rm{Ⅴ}}} \right)]_{\rm{a}}} + V \cdot {[{\rm{Np}}(Ⅳ)]_{\rm{o}}} + L \cdot {[{\rm{Np}}\left( {{\rm{Ⅴ}}} \right)]_a} + \\ \begin{array}{*{20}{c}} {}&{} \end{array}L \cdot {[{\rm{Np}}(Ⅳ)]_o} = {\rm{N}}{{\rm{p}}_{{\rm{total}}}} \end{array} $ | (2) |
式中:[Np(Ⅵ)]o和[Np(Ⅴ)]a分别为有机相Np(Ⅵ)浓度和水相Np(Ⅴ)浓度;V为水相体积;L为有机相体积。
假设Np(Ⅴ)不被TBP (Ture Boiling Point)萃取,相比1:1的条件下由式(2) 简化得到式(3):
| $ x + \frac{{1 + D}}{D}y = 1 $ | (3) |
式中:D为Np(Ⅵ)分配比;x=[Np(Ⅴ)]a/[Np(Ⅵ)]o0;y=[Np(Ⅵ)]o/[Np(Ⅵ)]o0。其中:[Np(Ⅵ)]o0为初始有机相Np(Ⅵ)浓度。
在保持水相硝酸浓度和MMH浓度恒定的条件下,结合式(1) 和(3),得到式(4):
| $ - {\rm{d}}{[{\rm{Np}}(Ⅳ)\left] {_{\rm{o}}/{\rm{d}}t = k'} \right[{\rm{Np}}(Ⅳ)]_{\rm{o}}} $ | (4) |
式中:k' = k[HNO3]n[MMH]m。
对式(4) 积分,并整理得式(5):
| $ {\rm{ln\{ }}{[{\rm{Np}}(Ⅳ)]_{\rm{o}}}^t/{[{\rm{Np}}(Ⅳ)]_{\rm{o}}}^0\} = -{k'_{}}t $ | (5) |
式中:[Np(Ⅵ)]ot/[Np(Ⅵ)]o0为t时刻有机相Np(Ⅵ)浓度与初始有机相Np(Ⅵ)浓度的比值。
以上推导表明:以ln([Np(Ⅵ)]ot/[Np(Ⅵ)]o0)对t作图,所得图形应为直线。该直线的斜率即为相应条件的k'。再以ln(k')分别对相应的ln[HNO3]和ln[MMH]作图,其直线的斜率为硝酸和甲基肼的反应级数。进一步计算k值,得出甲基肼还原反萃Np(Ⅵ)的动力学方程。求取甲基肼还原反萃取Pu(Ⅳ)动力学方程的方法同上。
2 结果与讨论 2.1 甲基肼还原反萃Np(Ⅵ) 2.1.1 硝酸反应级数的确定在T=18 ℃、[Np(Ⅵ)]o0=100 mg·L-1、[MMH]= 0.1mol·L-1条件下,考察[HNO3]=0.5-3.0 mol·L-1时,有机相镎浓度随时间的变化。由实验结果绘出不同硝酸浓度下ln([Np(Ⅵ)]ot/[Np(Ⅵ)]o0)与反应时间t的关系图(图 2),线性拟合均呈直线关系,这表明还原反应对于[Np(Ⅵ)]o是一级反应。

|
图 2 不同硝酸浓度甲基肼还原Np(Ⅵ)反应的ln([Np(Ⅵ)]ot/[Np(Ⅵ)]o0)与t的关系 Figure 2 Relationship between ln([Np(Ⅵ)]ot/[Np(Ⅵ)]o0) and t of Np(Ⅵ) reduced by methyl hydrazine with different HNO3 concentrations. |
由线性拟合的直线斜率求得相应硝酸浓度下的表观速率常数k'值,以ln(k')对ln([HNO3])作图。如图 3所示,图 3中直线斜率代表硝酸浓度反应级数,其斜率值为-1.42,即水相硝酸浓度的反应级数为n=-1.42。结果表明,增大水相HNO3浓度,Np(Ⅵ)还原反萃速率降低。

|
图 3 在18 ℃时甲基肼还原Np(Ⅵ)反应的ln(k')与ln([HNO3])的关系 Figure 3 Relationship between ln(k') and ln([HNO3]) of Np(Ⅵ) reduced by methyl hydrazine at 18 ℃. |
在T=18 ℃、[Np(Ⅵ)]o0=100 mg·L-1、[HNO3]= 1.0mol·L-1、甲基肼浓度为0.05-0.3 mol·L-1条件下,得到ln([Np(Ⅵ)]ot/[Np(Ⅵ)]o0)随时间t的变化曲线,如图 4所示,通过曲线拟合确定k'。

|
图 4 单甲基肼还原Np(Ⅵ)反应的ln([Np(Ⅵ)]ot/[Np(Ⅵ)]o0)与t的关系 Figure 4 Relationship between ln([Np(Ⅵ)]ot/[Np(Ⅵ)]o0) and t of Np(Ⅵ) reduced by methyl hydrazine at 18 ℃. |
Np(Ⅵ)以ln(k')对ln[MMH]作图,线性拟合后呈直线关系,如图 5所示。直线斜率为0.38,即求得甲基肼浓度对Np(Ⅵ)的反应级数m=0.38。该结果表明,增大甲基肼浓度能够加快Np(Ⅵ)还原反萃的反应速率。

|
图 5 在18 ℃时单甲基肼还原Np(Ⅵ)反应的ln(k')与ln([MMH])的关系 Figure 5 Relationship between ln(k') and ln([MMH]) of Np(Ⅵ) reduced by methyl hydrazine at 18 ℃. |
同样反应物浓度和介质条件,改变反应体系温度,研究温度对甲基肼还原Np(Ⅵ)反应速度的影响。在[Np(Ⅵ)]o0=100 mg·L-1、[HNO3]=1.0 mol·L-1、[MMH]=0.10 mol·L-1的条件下,考察25 ℃、30 ℃、35 ℃、40 ℃和45 ℃时镎的还原反萃速率的变化,对ln([Np(Ⅵ)]ot/[Np(Ⅵ)o0])随t的变化曲线进行拟合,得出k'值。以ln(k')对1/T作图(图 6),拟合后呈线性关系,根据阿伦尼乌斯公式lnk=lnA-Ea/(RT),计算得到甲基肼还原Np(Ⅵ)反应的表观活化能Ea=(23.1±4.6) kJ·mol-1。提高温度,Np(Ⅵ)还原速度明显加快。

|
图 6 单甲基肼还原Np(Ⅵ)反应的ln(k')与1/T的关系 Figure 6 Relationship between ln(k') and 1/T of Np(Ⅵ) reduced by methyl hydrazine. |
由上述实验结果可以得到,甲基肼还原反萃取Np(Ⅵ)的动力学速率方程式为:
| $ \frac{{{\rm{d}}{{[{\rm{Np}}(Ⅴ)]}_a}}}{{{\rm{d}}t}} = k{[{\rm{Np}(Ⅳ)]_o}}{[{\rm{HN}{O_3}]_a}}^ {- {1.42}}{[{\rm{MMH}]_a}}^{0.38} $ | (6) |
根据表 1的实验数据计算得到,在18 ℃时k=(7.67±1.75)×10-3 (mol·L-1)-1.04·s-1。
| 表 1 18 ℃时的实验数据及动力学参数 Table 1 Experiment data and kinetic parameters at 18 ℃. |
在T=18 ℃、[Pu(Ⅳ)]o0=24 mg·L-1、[HNO3]= 1.0mol·L-1条件下,考察水相甲基肼浓度为0.05-0.20mol·L-1时对Pu(Ⅳ)还原反萃的影响。以ln([Pu(Ⅳ)]ot/[Pu(Ⅳ)]o0)对t作图(图 7),对曲线进行拟合均符合线性关系,表明甲基肼对Pu(Ⅳ)的还原反应为一级反应,所设的甲基肼还原反萃Pu(Ⅳ)动力学方程正确。由线性拟合的直线斜率求得相应甲基肼浓度下的表观速率常数k'值。

|
图 7 单甲基肼还原Pu(Ⅳ)反应的ln([Pu(Ⅳ)]ot/[Pu(Ⅳ)]o0)与t的关系 Figure 7 Relationship between ln([Pu(Ⅳ)]ot/[Pu(Ⅳ)]o0) and t of Pu(Ⅳ) reduced by methyl hydrazine. |
以ln(k')对ln[MMH]作图,如图 8所示,图 8中的直线斜率代表甲基肼浓度的反应级数,线性拟合后得到直线的斜率为-0.61,即求得甲基肼浓度对Pu(Ⅳ)的反应级数m=-0.61。由此可知,增大甲基肼浓度,降低了Pu(Ⅳ)还原反萃的反应速率。
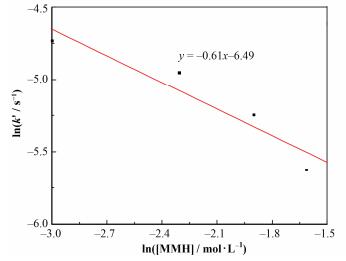
|
图 8 在18 ℃时单甲基肼还原Pu(Ⅳ)反应的ln(k')与ln([MMH])的关系 Figure 8 Relationship between ln(k') and ln([MMH]) of Pu(Ⅳ) reduced by methyl hydrazine at 18 ℃. |
在T=18 ℃、[Pu(Ⅳ)]o0=24 mg·L-1、甲基肼浓度为0.15 mol·L-1的条件下,考察了水相硝酸浓度为0.5-2.5 mol·L-1时对Pu(Ⅳ)还原反萃的影响。由实验结果绘出不同硝酸浓度下ln([Pu(Ⅳ)]ot/[Pu(Ⅳ)]o0)与t的关系图(图 9),由线性拟合的直线斜率求得相应硝酸浓度下的表观速率常数k'值。

|
图 9 不同硝酸浓度下甲基肼还原Pu(Ⅳ)反应的ln([Pu(Ⅳ)]ot/[Pu(Ⅳ)]o0)与t的关系 Figure 9 Relationship between ln([Pu(Ⅳ)]ot/[Pu(Ⅳ)]o0) and t of Pu(Ⅳ) reduced by methyl hydrazine with different HNO3 concentrations. |
以ln(k')对ln([HNO3])作图(图 10),图 10中直线斜率代表硝酸浓度反应级数,即水相硝酸浓度的反应级数为n=-1.98。该结果表明,增大水相HNO3浓度,Pu(Ⅳ)还原反萃速率降低。

|
图 10 在18 ℃时甲基肼还原Pu(Ⅳ)反应的ln(k')与ln([HNO3])的关系 Figure 10 Relationship between ln(k') and ln([HNO3]) of Pu(Ⅳ) reduced by methyl hydrazine at 18 ℃. |
在反应温度为18-45 ℃内,将ln([Pu(Ⅳ)]ot/ [Pu(Ⅳ)]o0)对t作图,得到不同反应温度下的k'值。以ln(k')对1/T作图(图 11),拟合后呈线性,根据阿伦尼乌斯公式lnk=lnA-Ea/(RT),由图 11的直线斜率可以计算出单甲基肼还原Pu(Ⅳ)反应的表观活化能为Ea=(63.9±6.0) kJ·mol-1。提高温度,Pu(Ⅳ)还原速率加快。

|
图 11 单甲基肼还原Pu(Ⅳ)反应的ln(k')与1/T的关系 Figure 11 Relationship between ln(k') and 1/T of Pu(Ⅳ) reduced by methyl hydrazine at 18 ℃. |
由上述实验结果可以得到,在速控步骤为氧化还原反应控制的条件下,甲基肼还原反萃Pu(Ⅳ)的动力学速率方程式为:
| $ - \frac{{{\rm d{{[Pu(Ⅳ)]}_o}}}}{{{\rm d}t}} = k{[{\rm Pu(Ⅳ)]_o}}{[{\rm HN{O_3}]_a}}^{ - 1.98}{[{\rm MMH]_a}}^{ -0.61} $ | (7) |
根据表 2的实验数据计算得到,在18 ℃时k=(2.1±0.7)×10-3 (mol·L-1)2.59·min-1。
| 表 2 18 ℃时的实验数据及动力学参数 Table 2 Experiment data and kinetic parameters at 18 ℃. |
在还原反萃取过程中同时存在着氧化还原反应和两相传质,因而相间的传质速率会影响到镎、钚的还原反萃取速率。两相搅拌强度的变化会改变传质过程中的速控步骤,例如,通常在转速较低时扩散是传质的速控步骤,而当转速较高时化学反应是速控步骤。
在T=18℃、[Np(Ⅵ)]o0=100 mg·L-1、[HNO3]= 1.0mol·L-1、c(CH3N2H3)=0.10 mol·L-1、相比1:1的条件下,考察了搅拌速率分别为1800 r·min-1、2200r·min-1、3000 r·min-1时,不同转速对还原反萃取镎的影响。图 12显示不同搅拌速率时,三条曲线基本重合,镎的还原反萃取速率受转速变化的影响不明显。表明在较高转速范围内,镎在两相间的传质速率很快,其还原反萃取速控步骤主要为化学反应控制。

|
图 12 不同转速条件甲基肼还原Np(Ⅵ)的影响 Figure 12 Effect of the rotational speed on the Np(Ⅵ) reduced by methyl hydrazine. |
在T=18 ℃、[Pu(Ⅳ)]o0=24 mg·L-1、[HNO3]= 1.0mol·L-1、c(CH3N2H3)=0.10 mol·L-1、相比1:1的条件下,考察了转速对甲基肼还原反萃Pu(Ⅳ)的影响。图 13为有机相钚浓度随时间的变化关系。
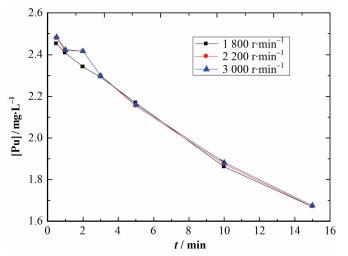
|
图 13 不同转速条件甲基肼还原Pu(Ⅳ)的影响 Figure 13 Effect of the rotational speed on the Pu(Ⅳ) reduced by methyl hydrazine. |
从图 13中可以看出,在1800-3000 r·min-1范围内,钚的还原反萃取速率受转速变化影响不明显,在较高转速范围内,钚的还原反萃取速控步骤主要为化学反应控制。
2.4 硝酸肼分离Np(Ⅵ)/Pu(Ⅳ)工艺可行性分析根据甲基肼还原反萃Np(Ⅵ)和Pu(Ⅳ)的动力学方程,计算还原半反应时间,温度为18 ℃,如表 3所示。表 3中τ50(Pu(Ⅳ))/τ50(Np(Ⅵ))的数值越高表明分离效果越好。从表 3中数据可以看出,随着硝酸浓度、甲基肼浓度的增加,τ50(Pu(Ⅳ))/τ50(Np(Ⅵ))的数值变大,Np(Ⅵ)/Pu(Ⅳ)的分离效果更好。
| 表 3 半反应时间 Table 3 Required time for 50% completion of reduction. |
基于以上分析,结合所得的动力学方程,模拟了甲基肼分离Np(Ⅵ)和Pu(Ⅳ)的单级过程。图 14显示硝酸浓度为3 mol·L-1、反应温度18 ℃、甲基肼浓度0.1 mol·L-1条件下,分离系数βPu/Np与反应时间的关系。

|
图 14 βPu/Np与t的关系 Figure 14 Relationship between βPu/Np and t. |
从图 14可以看出,随着反应时间的延长,分离系数βPu/Np数值变小,Np(Ⅵ)/Pu(Ⅳ)分离效果变差。表 4列出了Np(Ⅵ)和Pu(Ⅳ)的还原率随反应时间的变化关系,从表 4可以看出,当反应时间为0.5 min时,有2.0%的Np(Ⅵ)被还原反萃取到Np(Ⅴ),有0.049%的Pu(Ⅳ)被还原反萃取到Pu(Ⅲ)。
| 表 4 Np(Ⅴ)和Pu(Ⅲ)随时间变化的百分比 Table 4 Variation of percentage of Np(Ⅴ) and Pu(Ⅲ) with time. |
结合所得动力学方程,计算了在水相硝酸浓度为3 mol·L-1、甲基肼浓度为0.1 mol·L-1、反应时间为60 s的条件下,Np(Ⅵ)和Pu(Ⅳ)反萃率随温度的变化(表 5),从表 5数据可以看出,随着温度的升高,Np(Ⅵ)的反萃率高于Pu(Ⅳ)的反萃率,升高温度,有利于镎钚分离。
| 表 5 Np(Ⅵ)和Pu(Ⅳ)反萃率随温度变化的百分比 Table 5 Variation of back-extraction percentage of Np(Ⅵ) and Pu(Ⅳ) with temperature. |
研究了硝酸浓度、甲基肼浓度、温度对甲基肼还原反萃有机相Np(Ⅵ)和Pu(Ⅳ)的过程,得出甲基肼还原反萃Np(Ⅵ)和Pu(Ⅳ)的动力学方程式。结果表明,增大硝酸浓度、增大甲基肼浓度及升高温度,有利于Np(Ⅵ)/Pu(Ⅳ)的分离。从分离系数随时间的关系图看出,随着反应时间的延长,Np(Ⅵ)/Pu(Ⅳ)的分离效果变差。
| [1] | Lange R G, Carroll W P. Review of recent advances of radioisotope power system[J]. Energy Conversion and Management, 2008, 49(3): 393–401. DOI: 10.1016/S0265-9646(99)00056-9 |
| [2] |
罗璋琳. 核废料核素价值研究[J].
原子能科学技术, 2004, 38(3): 283–288.
LUO Zhanglin. The value of radionuclide in nuclear waste[J]. Atomic Energy Science and Technology, 2004, 38(3): 283–288. |
| [3] |
刘学刚, 许景明. 2020年前我国核燃料循环情景初步研究[J].
核科学与工程, 2005, 25: 21–25.
LIU Xuegang, XU Jingming. Preliminary study on nuclear fuel cycle scenarios of China before 2020[J]. Chinese Journal of Nuclear Science and Engineering, 2005, 25: 21–25. |
| [4] |
张先业, 叶国安, 肖松涛, 等. 单甲基肼还原Np(Ⅵ)-Ⅱ:PUREX流程中U-Np分离的研究[J].
原子能科学与技术, 1997, 31(3): 193–198.
ZHANG Xianye, YE Guo'an, XIAO Songtao, et al. Reduction of Np(Ⅵ) with monomethylhydrazine Ⅱ:studies on reaction kinetics[J]. Atomic Energy Science and Technology, 1997, 31(3): 193–198. |
| [5] | Yasutoshi Ban, Toshihide Asakra, Yasuji Morita. Separation of Np from U and Pu using a salt-free reductant for Np(Ⅵ) by continuous counter-current back-extraction[C]. The 7th International Conference GLOBAL 2005, Tsukuba, Japan, 2005:371. http://jolissrch-inter.tokai-sc.jaea.go.jp/search/servlet/search?31702&language=1 |
| [6] | Uchiyama G, Fujine S, Ku S, et al. New separation process for neptunium, plutonium, and uranium using butyraldehydes as reductants in reprocessing[J]. Nuclear Technology, 1993, 102: 341–352. DOI: 10.13182/NT93-A17033 |
| [7] | Srinivasan N, Ramaniah M V, Patil S K, et al. Estimation of neptunium in a fuel reprocessing plant[J]. Journal of Radioanalytical Chemistry, 1971, 8: 223–229. DOI: 10.1007/BF02518186 |
| [8] | Koltunov V S, Baranov S M, Zharova T P. Organic derivative of hydrazine and hydroxylamine in future technology of spent fuel reprocessing[J]. Radiokhimija, 1993, 35(6): 11–19. |
| [9] | Koltunov V S, Tikhonov M F. Kinetics of actinide reaction with ascorbic acid.6. Np(Ⅴ) reduction catalyzed by plutonium ion[J]. Radiokhimija, 1981, 23(4): 537–554. |
| [10] | Kolotunov V S, Baranov S M, Zharova T P. Reaction kinetics of Np and Pu ions with hydroxylamine derivatives[J]. Radiokhimiya, 1993, 35(4): 42–48. |


