2. 中国科学院大学 北京 100049
2. University of Chinese Academy of Sciences, Beijing 100049, China
基因治疗是癌症[1-2]和心脏衰竭[3]等多种疾病的重要治疗手段之一,如何提高基因药物的转运效率和体内稳定性是当前药物研发的重点。基因药物中的核酸带有较强负电性,难以自由进入细胞,并且核酸类药物的靶向位点在细胞核,从而发挥干扰基因复制和转录的作用[4]。因此选择高效率、高安全性的药物转运载体对于基因治疗至关重要。非病毒载体如阳离子脂质体和聚合物被认为比病毒载体具有更高的安全性[5]。其中,阳离子脂质体因其毒性和免疫原性低、无组织特异性[6]和较强的渗透和滞留效应 (Enhanced Permeability and Retention effect, EPR)[7]被认为是较好的选择。然而基因转运效率低仍是这类载体的主要缺陷[8]。
脱氧核糖核酸 (Deoxyribonucleic acid, DNA) 纳米结构是一类由外源DNA经碱基互补配对构成的立体结构,具有很高的安全性、结构精确可控、较高的化学反应活性、载体容量大、可寻址性等特点[9],在生命科学、医学、信息等领域得到广泛应用[10]。科学家已经利用DNA纳米结构载带各种药物进入细胞和活体,例如小分子药物(阿霉素)[11]、功能核酸 (CpG)[12]、siRNA[13]和适配体[14]、蛋白类药物(疫苗)[15]和转录活化蛋白[16]等均展现出了很高的转运效率。且DNA纳米结构产率高易纯化[17],在生理条件下保持较高的稳定性,具有极高的生物相容性[18]和较高的荷载效率[19],因此展现出良好的应用前景。研究发现DNA纳米结构主要通过内吞途径进入细胞,然而目前尚未有研究表明DNA纳米结构可以穿透核孔,不能将药物转运进入细胞核成为制约其发挥作用的一大因素。
利用核定位序列 (Nuclear Localization Signal, NLS) 来引导外源材料进入细胞核是常用的手段,它通过与核孔复合体作用来引导进核。NLS的核心序列是一段长度为7个氨基酸、来源于病毒SV-40大T抗原的碱性多肽——PKKKR KV[20],它能介导亲核蛋白与输入蛋白α/β形成三元复合物,在GTP酶Ran的辅助下穿过核孔。目前常用的序列是CGYGP KKKRK VGG[4]、CGGGP KKKRK VGG[21]、PKKKR KVEDP YC[22]。前期研究发现NLS可以载带单链DNA进入细胞核[22]。然而在大多数利用NLS引导的基因治疗中,主要是带正电荷的NLS与带负电荷的DNA简单混合后形成复合体,直接应用于细胞和活体,存在着稳定性不够、DNA容易脱离NLS而难以顺利到达细胞核的情况,影响了基因治疗的效果。
本工作拟采用共价连接方式,将DNA四面体结构与NLS通过“点击化学”反应连接在一起,提高稳定性。同时选择不同长度和不同等电点的NLS序列,包括长度为12个氨基酸、等电点为10.48以及长度为29个氨基酸、等电点为4.84的序列,探索降低非特异性结合和提高连接产率的方法。进一步验证不同NLS-DNA四面体的结合活性,并用于细胞核的靶向成像。
1 实验部分 1.1 试剂与仪器本实验所用NLS和DNA四面体序列分别见表 1和2,其中未修饰DNA序列和NLS序列均购自生工生物(中国);叠氮化及Alexa-488荧光修饰DNA序列购自Takara(中国);硫酸铜、抗坏血酸、二甲基亚砜、三乙基碳酸氢铵缓冲液购自Sigma-Aldrich公司(美国);Hela细胞购自上海生命科学研究所;DMEM (Dulbecco’s Modified Eagle Medium) 培养基购自英潍捷基(中国);其他试剂购自国药集团化学试剂公司(中国);C18色谱柱购自Waters公司(美国),型号为XBridgeTMC18 4.6×150 mm。实验用水为Milli Q水,18 MΩ∙cm。
| 表 1 不同NLS序列 Table 1 Different NLS sequences |
| 表 2 DNA四面体序列及修饰 Table 2 DNA tetrahedron sequence and modification |
紫外-可见分光光度计(Hitachi U-3010,日本);PCR仪(Applied Biosystems Veriti 96 well Thermo Cycler,美国);聚丙烯酰胺 (Polyacrylamide Gel Electrophoresis, PAGE) 凝胶电泳仪(DYY-6C型,中国);化学发光成像系统(Syngene G:Box Chemi-XL,英国);高效液相色谱 (High Performance Liquid Chromatography, HPLC) 系统:Waters 1525泵(美国)、Waters 2998光电二极管阵列检测器(美国);化学发光成像系统(Syngene G:Box Chemi-XL,英国);激光共聚焦显微镜(Leica SP8,德国)。
1.2 实验过程 1.2.1 单链DNA与NLS的共价连接将叠氮化修饰的DNA单链S3-N3 (200 μmol∙L-1,10 μL) 与炔基修饰的NLS (200 μmol∙L-1,20 μL) 混合,随后加入10 μL二甲基亚砜,硫酸铜溶液 (10mmol∙L-1,10 μL) 和抗坏血酸 (10 mmol∙L-1,10 μL),充分混匀后室温静置过夜。产物用12%的PAGE凝胶电泳表征,电压100 V,电泳时间2 h。计算连接产率。
产物S3-NLS经反相HPLC进行纯化,流动相A为0.1 mol∙L-1三乙基碳酸氢铵缓冲液,流动相B为乙腈,梯度洗脱方法见表 3。260 nm和280 nm波长分别监测DNA和NLS,并收集S3-NLS。
| 表 3 反相HPLC梯度洗脱方案 Table 3 Gradient elution procedure of reversed-phase HPLC |
纯化后的S3-NLS经重新定量后与S1、S2、S4在TM缓冲液 (0.01 mol∙L-1 Tris,5 mmol∙L-1 MgCl2,pH 8.0) 中等摩尔混匀,各链终浓度均为1×10-6mol∙L-1。95 ℃加热10 min后迅速降温至4 ℃并维持30 min。合成的四面体用8% PAGE表征,电压80 V,冰浴电泳2 h。
1.2.3 细胞培养及NLS-四面体的细胞摄取Hela细胞37 ℃培养在含10%灭活FBS的DMEM培养基中。用于荧光成像的Hela细胞以每孔8万孵育在有载玻片的24孔板中。转染前30 min,将原培养基换为无血清的DMEM培养基继续孵育。
设计两组,分别为NLS12-DNA四面体组和NLS29-DNA四面体组。首先,每组各取50 μL opti-MEM和5 μL lipofect AMINE混合,37 ℃孵育5 min。然后分别加入两组连接物,使四面体终浓度为100 nmol∙L-1,孵育20 min。将两组与无血清培养基混合后加入24孔板中。转染4 h后固定,用Hochest33258染核并贴片。
1.2.4 共聚焦显微镜成像利用激光共聚焦显微镜观察NLS-DNA四面体的复合结构进入细胞并靶向细胞核的情况。Alexa-488标记的DNA四面体由488 nm Ar-Kr激光器激发,Hochest33258染色的细胞核由405 nm二极管激光器激发,成像通道分别设置为500-550 nm和450-500 nm。
2 结果与讨论 2.1 序列的选择第一个NLS是在SV40病毒大T抗原中发现的PKKKR KV活性序列[23]。目前研究中常用的NLS12序列为保留原活性序列的12个氨基酸的碱性多肽:GPKKK RKVED PY,等电点 (pI) 为10.48。NLS12在pH 7.4的溶液环境中呈正电性 (pI > pH),由于正负电荷相互作用,极易与带负电的DNA发生非特异性结合而沉淀,影响进一步的共价连接反应。因此设计具有活性,且等电点较低的NLS序列对于改善这一反应具有重要意义。考虑到尽量保持原序列靶向细胞核的能力,我们选择从原SV40病毒大T抗原中截取相应片段,本着控制等电点小于7且不影响水溶性的原则,保留中间原10个氨基酸序列,分别在上游延伸13个、下游延伸6个,共29个氨基酸来替代原NLS12序列。经测试该NLS29序列 (DDEAT ADSQH STPPK KKRKV EDPKD FPSE) 的等电点为4.84,在pH 7.4的缓冲体系中带负电荷,可以显著降低与负电DNA的非特异性结合。
2.2 单链ssDNAS3-N3与NLS的连接单链ssDNA与NLS的连接是通过“点击”化学[24-25]实现的,反应原理见图 1。“点击”化学具有极高反应效率和稳定性,在制药、生命科学中得到广泛应用。ssDNA上的叠氮基与NLS修饰的炔丙基甘氨酸在Cu (Ⅰ) 催化下发生环加成反应形成咪唑,实现DNA与NLS的连接。
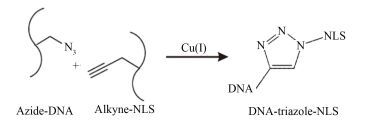
|
图 1 “点击”化学偶联叠氮修饰ssDNA和炔基修饰NLS形成ssDNA-NLS复合物 Figure 1 "Click" chemistry reaction between an azide-ssDNA and an alkyne-NLS to produce ssDNA-NLS complex |
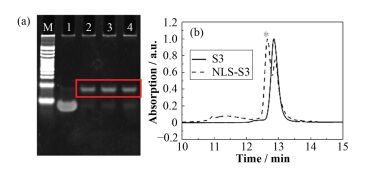
NLS12与S3混合后,管底出现沉淀(图 2(a)),而NLS29与S3-N3室温静置过夜后溶液清亮,无沉淀产生(图 2(b))。利用PAGE分别表征两者的连接效率(图 2(c)),条带1中NLS12-S3组在上样孔中有大量的产物聚集,而条带2的NLS29-S3组则只有非常少的产物滞留在孔内。经Image J定量分析NLS12-S3的连接效率为37.3%,NLS29-S3的连接效率提高至72.3%。

|
图 2 直观及电泳观察NLS12和NLS29分别与S3的连接情况 (a) NLS12-S3,(b) NLS29-S3,(c) 12% PAGE表征NLS-S3的连接效率 Figure 2 Intuitive and electrophoresis observation of the conjugation of S3 with NLS12 or NLS29 (a) NLS12-S3, (b) NLS29-S3, (c) Characterization conjugated efficiency by 12% PAGE |
对NLS29-S3组进行仔细观察,分别从反应体系的上、中、下三个位置各取5 μL样品,用PAGE电泳进行表征(图 3(a))。图 3(a)中M为20个碱基对 (base pair, bp) 的标记 (marker);条带1为S3;条带2为反应体系上部取样;条带3为反应体系中部取样;条带4为反应体系下部取样。其中2、3、4三条泳道条带亮度基本一致,说明经延伸后的NLS29与DNA连接无沉淀现象产生;每泳道都有上下两条带,分别为NLS29-S3连接产物(框选出的条带)和未连接的S3。
|
图 3 NLS29-S3的分析与分离 (a) 12% PAGE表征连接结果,(b) 反相HPLC纯化NLS29-S3 Figure 3 Conjugated characterization and purification of NLS29-S3 (a) Characterization by 12% PAGE, (b) Purification of NLS29-S3 by reversed-phase HPLC |
利用反相HPLC对NLS29-S3产物进行分离纯化。反相色谱法是以非极性载体为固定相,以极性强的溶剂为流动相的液相色谱分离模式。反相色谱柱固定相大多是硅胶基团键合疏水烷基链,根据样品中不同组分与疏水表面作用强度的不同而分离,因而极性强的组分先出峰。在本实验中NLS-S3的极性比S3极性强,出峰时间早(图 3(b),*标记的峰即为产物峰)。
2.3 四面体的组装和稳定性分析纯化后的NLS12-S3和NLS29-S3经重新定量后,分别与其余三条链S1、S2和S4组装形成NLS12-DNA四面体 (Tetrahedron, TH) 和NLS29-TH,并用6% PAGE表征(图 4(a)),其中条带1为未连接NLS的TH,2和3分别代表NLS12-TH和NLS29-TH。结果表明,四面体均可形成,且产率与未连接NLS的四面体相同,均在50%左右。
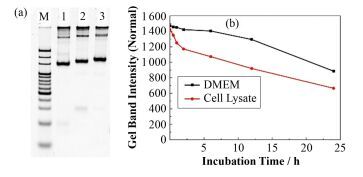
|
图 4 NLS-TH的合成及细胞环境稳定性表征 (a) 6% PAGE表征NLS-TH的合成,(b) Image J定量NLS29-TH在DMEM培养基和Hela细胞裂解液的时间稳定性 Figure 4 Characterization of the assembly of NLS-TH and stability in cell environment (a) Characterization of the assembly of NLS-TH by 6% PAGE, (b) Quantification time stability of NLS29-TH in DMEM medium and Hela cell lysate by Image J |
对NLS29-TH在细胞环境中的稳定性进行研究,分别将其与DMEM培养基和Hela细胞裂解液37 ℃孵育0 h、0.5 h、1 h、2 h、6 h、12 h、24 h,6% PAGE表征结构的稳定性,并用Image J将孵育后的条带定量分析(图 4(b))。结果表明,NLS29-TH在DMEM培养基中6 h后有95.3%的产物稳定存在,24 h之内有60%左右;在细胞裂解液中有部分降解,6 h后有75.5%稳定存在,24 h后为46.8%。该数据说明NLS29-TH可以作为稳定的载体用于基因载带。
2.4 NLS-TH在细胞内的分布研究两种产物NLS12-TH和NLS29-TH在细胞内的分布情况,其中四面体用Alexa-488标记,细胞核用Hochest进行染色,分析二者的共定位情况。共聚焦显微镜分别观察TH、NLS12-TH和NLS29-TH与细胞孵育之后,进入细胞核的情况。图 5表明单纯的TH结构不能进入细胞核,Alexa-488标记的TH主要存在于细胞质,无法与细胞核共定位。而NLS12-TH和NLS29-TH均可以进入细胞核,与Hochest染色的细胞核能很好的共定位,这说明经延伸后的NLS29仍具有很好的靶向细胞核的能力。
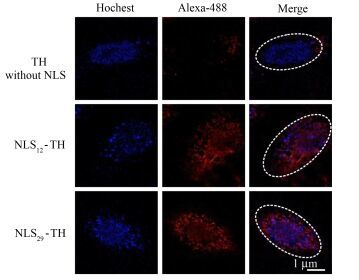
|
图 5 激光共聚焦显微镜对TH、NLS12-TH、NLS29-TH在Hela细胞内的分布成像 Figure 5 Laser confocal microscope images of the distribution of TH, NLS12-TH and NLS29-TH in Hela cells |
本文旨在发展以DNA四面体作为基因载带的有效载体。为解决NLS与DNA之间具有较强静电吸引容易沉淀的问题,选择了不同的NLS序列进行探索。研究结果表明,在已有NLS12序列的基础上进行进一步延长,改变等电点后,可以显著降低NLS与DNA之间的静电相互作用。等电点为4.84的NLS29可以与DNA通过“点击”化学反应进行高效连接,反应效率比NLS12显著提高 (72.3% vs. 37.3%)。经HPLC纯化和重新定量后,可以很好地形成四面体结构。进一步的稳定性研究显示,NLS29-TH具有很好的稳定性。在对细胞核的成像研究中,NLS29-TH具有很好的靶向细胞核的能力,与细胞核的共定位结果与NLS12-TH相似,远高于单纯的TH结构。该研究为DNA纳米结构作为基因转运的载体提供了有效途径,在生命科学和临床医学中具有极高的潜在应用价值。
| [1] | Qin B, Cheng K. Silencing of the IKKε gene by siRNA inhibits invasiveness and growth of breast cancer cells[J]. Breast Cancer Research, 2010, 12(5): R74. DOI: 10.1186/bcr2644 |
| [2] | Anwer K, Barnes M N, Fewell J, et al. Phase-I clinical trial of IL-12 plasmid/lipopolymer complexes for the treatment of recurrent ovarian cancer[J]. Gene Therapy, 2010, 17(3): 360–369. DOI: 10.1038/gt.2009.159 |
| [3] | Kawase Y, Ladage D, Hajjar R J. Rescuing the failing heart by targeted gene transfer[J]. Journal of the American College of Cardiology, 2011, 57(10): 1169–1180. DOI: 10.1016/j.jacc.2010.11.023 |
| [4] | Kim B K, Kang H, Doh K O, et al. Homodimeric SV40 NLS peptide formed by disulfide bond as enhancer for gene delivery[J]. Bioorganic & Medical Chemistry Letters, 2012, 22(17): 5415–5418. DOI: 10.1016/j.bmcl.2012.07.051 |
| [5] | Zhang S, Zhao B, Jiang H, et al. Cationic lipids and polymers mediated vectors for delivery of siRNA[J]. Journal of Controlled Release, 2007, 123(1): 1–10. DOI: 10.1016/j.jconrel.2007.07.016 |
| [6] | Karmali P P, Chaudhuri A. Cationic liposomes as non-viral carriers of gene medicines:resolved issues, open questions, and future promises[J]. Medicinal Research Reviews, 2007, 27(5): 696–722. DOI: 10.1002/med.20090 |
| [7] | Maeda H, Wu J, Sawa T, et al. Tumor vascular permeability and the EPR effect in macromolecular therapeutics:a review[J]. Journal of Controlled Release, 2000, 65(1-2): 271–284. DOI: 10.1016/S0168-3659(99)00248-5 |
| [8] | Moon I J, Kang H, Seu Y B, et al. Marked transfection enhancement by the DPL (DNA/peptide/lipid) complex[J]. International Journal of Molecular Medicine, 2007, 20(4): 1840–1844. |
| [9] | Yu Y, Li J, Zhang Z, et al. Advances on self-assembled DNA nanostructures[J]. Biotechnology Bulletin, 2015, 31(4): 120–133. DOI: 10.13560/j.cnki.biotech.bull.1985.2015.03.011 |
| [10] | Chao J, Liu H, Su S, et al. Structural DNA nanotechnology for intelligent drug delivery[J]. Small, 2014, 10(22): 4626–4635. DOI: 10.1002/smll.201401309 |
| [11] | Jiang Q, Song C, Nangreave J, et al. DNA origami as a carrier for circumvention of drug resistance[J]. Journal of the American Chemical Society, 2012, 134(32): 13396–13403. DOI: 10.1021/ja304263n |
| [12] | Li J, Pei H, Zhu B, et al. Self-assembled multivalent DNA nanostructures for noninvasive intracellular delivery of immunostimulatory CpG oligonucleotides[J]. Acs Nano, 2011, 5(11): 8783–8789. DOI: 10.1021/nn202774x |
| [13] | Lee H, Lyttonjean A K, Chen Y, et al. Molecularly self-assembled nucleic acid nanoparticles for targeted in vivo siRNA delivery[J]. Nature Nanotechnology, 2011, 7(6): 389–393. DOI: 10.1038/nnano.2012.73 |
| [14] | Douglas S M, Bachelet I, Church G M. A logic-gated nanorobot for targeted transport of molecular payloads[J]. Science, 2012, 335(6070): 831–834. DOI: 10.1126/science.1214081 |
| [15] | Liu X, Yang X, Yu T, et al. A DNA nanostructure platform for directed assembly of synthetic vaccines[J]. Nano Letters, 2012, 12(8): 4254–4259. DOI: 10.1021/nl301877k |
| [16] | Kuzyk A, Schreiber R, Fan Z, et al. DNA-based self-assembly of chiral plasmonic nanostructures with tailored optical response[J]. Nature, 2012, 483(7389): 311–314. DOI: 10.1038/nature10889 |
| [17] | Chao J, Xing S, Feng B, et al. Purification of rectangle DNA origami by rate-zonal centrifugation[J]. Nuclear Science and Techniques, 2015, 26(5): 050504. DOI: 10.13538/j.1001-8042/nst.26.050504 |
| [18] | Pan L, Kong H, Sun Y, et al. The biocompatibility of DNA nanostructures[J]. Scientia Sinica Chimica, 2016, 46(2): 188–194. DOI: 10.1360/N032015-00242 |
| [19] | Li J, Fan C, Pei H, et al. Smart drug delivery nanocarriers with self-assembled DNA nanostructures[J]. Advanced Materials, 2013, 25(32): 4386–4396. DOI: 10.1002/adma.201300875 |
| [20] | Adam S A, Gerace L. Cytosolic proteins that specifically bind nuclear location signals are receptors for nuclear import[J]. Cell, 1991, 66(5): 837–847. DOI: 10.1016/0092-8674(91)90431-W |
| [21] | Tkachenko A G, Xie H, Coleman D, et al. Multifunctional gold nanoparticle-peptide complexes for nuclear targeting[J]. Journal of the American Chemical Society, 2003, 125(16): 4700–4701. DOI: 10.1021/ja0296935 |
| [22] | Zanta M A, Belguise-Valladier P, Behr J P. Gene delivery:a single nuclear localization signal peptide is sufficient to carry DNA to the cell nucleus[J]. Proceedings of the National Academy of Sciences of the United States of America, 1999, 96(1): 91–96. DOI: 10.1073/pnas.96.1.91 |
| [23] | Dingwall C, Laskey R A. Nuclear targeting sequences-a consensus?[J]. Trends in Biochemical Sciences, 1991, 16(12): 478. DOI: 10.1016/0968-0004(91)90184-W |
| [24] | El-Sagheer A H, Brown T. Click chemistry with DNA[J]. Chemical Society Reviews, 2010, 39(4): 1388–1405. DOI: 10.1039/b901971p |
| [25] |
许梅, 匡春香. 正电子放射性药物的点击合成[J].
核技术, 2009, 32(8): 626–631.
XU Mei, KUANG Chunxiang. Click synthesis of PET radiopharmaceuticals[J]. Nuclear Techniques, 2009, 32(8): 626–631. |


