2. 成都中医药大学 基础医学院 成都 611137
2. School of Basic Medicine, Chengdu University of Traditional Chinese Medicine, Chengdu 611137, China
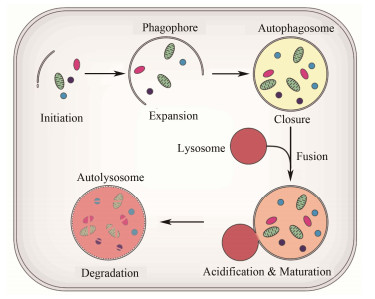
细胞自噬(autophagy)是真核生物细胞对自身内部物质进行回收和周转的重要过程。自20世纪60年代起,研究者们开始观察到细胞可将自身组分(如细胞器)包裹在膜内形成囊泡结构(自噬小泡),并将其运输至溶酶体(动物细胞)中或液泡(酵母和植物细胞)中降解(见图 1),于是将这种细胞自己吃自己的现象命名为“自噬”。20世纪90年代,日本的大隅良典使用酵母突变细胞进行了一系列实验,观察到了自噬小泡在酵母细胞中的大量累积,进而发现了一种自噬的关键基因(自噬相关基因,autophagy related gene)ATG1,首次对自噬现象的分子生物学机制做出了解释[1-2]。此后,科学家们又陆续发现了30多种自噬相关基因。今年,大隅教授的研究小组报道了细胞自噬的启动机制,即ATG13蛋白质会与其他4种蛋白质通过网状结构进行连接,形成一个巨大的细胞自噬启动装置[3]。在此过程中,细胞质中的LC3(微管相关蛋白1轻链3,microtubule-associated protein 1 light chain 3)蛋白与磷脂酰乙醇胺共价结合(形成LC3-Ⅱ)并大量分布于自噬小泡膜上,因此可作为研究自噬水平的分子标记。2016年,诺贝尔生理学或医学奖颁给了大隅良典教授,以表彰他为自噬机制的研究所做出的突出贡献。
|
图 1 细胞自噬的基本原理示意图 Figure 1 Schematic illustration of autophagy. |
自噬对于人体健康而言是一把双刃剑[4]。一方面,对于正常细胞而言,在面临不利的环境压力时(如乏氧、饥饿、感染、物理损伤等),自噬作用可以帮助细胞降解和回收自身非必需的成分来提供营养和能量,从而度过难关;自噬也可以帮助细胞清除受损的细胞组分,维护细胞内环境的有序稳定状态(保护性自噬)。如果损伤严重,自噬也可以引发细胞程序性死亡(即所谓Ⅱ型细胞程序性死亡),这是有别于细胞凋亡(apoptosis,也称I型程序性死亡)的一种细胞死亡,可防止危机进一步扩散至周围的正常细胞。自噬也参与了发育过程中受精卵的父系线粒体消失和细胞分化等过程,对于机体的正常发育至关重要。此外,衰老过程也被认为伴随着自噬作用的减弱。因此,一些年龄相关的神经退行性疾病,如帕金森症和阿兹海默症,都与自噬异常、不能有效清除错误蛋白有着密切的关联。然而,已经癌变的细胞也可以利用保护性的自噬作用抵御药物和电离辐射等治疗手段幸存下来,造成耐药性和肿瘤复发,从而对人体健康造成危害。
由此可见,细胞自噬与人体健康有着非常密切的关系。健康的机体状态离不开正常细胞有序的自噬作用,而有效抑制肿瘤细胞的自噬作用则是研究癌症治疗者们亟需攻克的难题。考虑到许多环境因素都可以诱导自噬发生,如果可以通过人为控制这些环境条件来调节细胞自噬作用,我们就能对人体健康施加积极影响,乃至治疗相关疾病。因此,对于细胞自噬的过程的调控研究一直受到国内外的广泛关注。
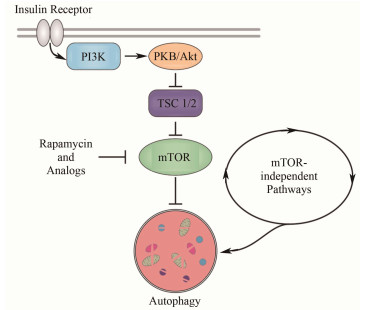
可以诱导自噬的环境刺激很多。其中,雷帕霉素(rapamycin)作为一种可以诱导自噬的化学药物,其引发自噬的分子生物学机制研究相对较为清楚,即所谓mTOR信号通路(mechanistic target of rapamycin,见图 2)。因此,雷帕霉素及其类似物可用于多种自噬相关疾病的治疗。但是,这些药物带来的毒副作用也是显而易见的。
|
图 2 简化的自噬信号通路模型 Figure 2 Simplified model of autophagy signaling pathways. |
本文将主要回顾近年来国内外在相关方向的研究进展,我们尤其关注电离辐射、运动、针灸、按摩等物理刺激与自噬的关系。相对化学药物,这些物理刺激与我们的日常生活更加息息相关,其背后与自噬相关的分子机制也更加不明确,值得我们进一步深究。
1 自噬与癌症癌症目前已经成为人类健康的头号杀手,自噬与癌症的相关性也是受到最多关注的研究方向之一。大量研究显示,癌症的发生与自噬水平的异常高度相关。一方面自噬可以抑制肿瘤的发生发展,另一方面也可能对肿瘤起到保护和促进的作用,难以一概而论。
相对正常组织的细胞而言,很多类型的肿瘤细胞自噬水平较低。在40%-75%的人类乳腺癌、口腔癌和前列腺癌的癌细胞当中,自噬相关基因beclin1发生了单等位缺失。对于小鼠的研究表明,对beclin1基因的破坏会降低细胞自噬的活性,同时增加淋巴癌、肺癌、肝癌等癌症和各种癌前病变的风险。此外,带有beclin1杂合缺陷的永生化上皮细胞在被植入小鼠体内后也更容易引发肿瘤形成。除了自噬相关基因对肿瘤的抑制作用以外,也有很多研究证据表明自噬信号通路与肿瘤发生的信号通路高度关联。例如,磷脂酰肌醇3-激酶抑制剂(Phosphatidylinositol 3-kinase inhibitor, PI3K-I)、蛋白激酶B (Protein kinase B, PKB)、雷帕霉素靶蛋白(Target of rapamycin, TOR)、B细胞淋巴瘤基因2 (B-cell lymphoma 2, Bcl-2)等致癌基因的活化可能导致自噬作用受到抑制,而p53蛋白、同源性磷酸酶-张力蛋白(Phosphatase and tension homolog, PTEN)、死亡相关蛋白激酶(Death associated protein kinase, DAPk)、结节状硬化症基因(Tuberous sclerosis-1/2, TSC1/TSC2)等肿瘤抑制基因的沉默或突变可能诱发自噬[5]。此外,自噬对于脱氧核糖核酸(Deoxyribonucleic acid, DNA)损伤也有明显的防护作用,后者被认为是导致肿瘤发生的重要原因。例如,研究者们观察到,在自噬缺陷型的酵母细胞中,线粒体DNA的突变频率明显上升。而正常的自噬可以帮助回收受损的线粒体等细胞器。近来的研究表明,自噬相关的beclin1与自噬蛋白5 (Autophagy protein 5, atg5)基因对于细胞基因组而言也有保护作用。在这两个基因存在缺失的永生型上皮细胞中,研究者们可以观察到DNA损伤、基因扩增和基因的非整倍性频率上升,从而导致肿瘤发生的概率上升[6]。所以,正常的自噬可以被看作是机体对于细胞癌变的一道重要防线。
但是在另一方面,自噬也可能起到保护肿瘤细胞存活的作用。在肿瘤发展的过程中,肿瘤内部的细胞往往面临供氧和供血不足的代谢压力,这种压力可能引发自噬,以保证肿瘤细胞的代谢平衡,使其能够回收无法经过血液循环被带走的有害代谢产物,为肿瘤细胞提供给养。同时,自噬还可能引发慢性的坏死。所以在这里,适当水平的自噬不仅能够避免癌细胞凋亡或严重坏死而被免疫细胞清除,反而可以导致局部的炎症,从而加快肿瘤生长的速度[6]。因此,自噬活性对于肿瘤的生长和转移也起到了帮助的作用。
对于这种矛盾,在设计自噬相关的癌症治疗方案中,我们可能需要针对具体情况在不同阶段给出相反的处置方式。一方面在肿瘤发生前或早期,我们可能需要诱导高水平自噬来防止肿瘤的形成与发展;而另一方面对于已经形成的肿瘤,我们可能需要通过自噬抑制来促使肿瘤消退。
2 自噬与神经退行性疾病越来越多的证据表明,自噬的异常与帕金森综合症、亨廷顿综合症等神经退行性疾病密切相关。在正常情况下,细胞中的自噬会呈现一种基础水平的表达,以确保细胞的正常状态。在不同的组织中,这个基础水平也是不尽相同的。对于像神经元这样分化成熟之后就不再增殖的细胞而言,这种基础自噬尽管水平较低,但对于神经系统仍然非常重要。在特异性地敲除小鼠神经组织中的自噬相关基因之后,研究者发现,这些小鼠表现出渐进的运动障碍和异常的条件反射,即使它们并不表达与神经退行性疾病相关的变异蛋白。综合上述例子可知,自噬对神经退行性疾病确实有显著的预防作用,但是其中的分子生物学机制迄今仍然不够明晰。一种观点认为,自噬可以直接清除与神经退行相关的蛋白聚集和内涵体。参与这种机制的一种可能的配体是p62/死骨片-1 (Sequestosome-l, SQSTM1),这种蛋白一端有LC3结合域,另一段有泛素结合域。而几乎所有的蛋白聚集都有泛素修饰,因此SQSTM1能让形成中的自噬小泡(含LC3蛋白)识别这些蛋白聚集[7]。而且,p62蛋白的正常回收对于防止蛋白聚集的形成至关重要。但是近来也有相反的假说认为,蛋白聚集其实可能是一种保护机制[8]。自噬的主要回收目标实际上是溶解于胞浆中的蛋白,而不是内涵体。之所以自噬缺陷型的细胞中有大量的内涵体出现,可能是因为受损的蛋白无法回收。
相对于其它神经退行性疾病,自噬在阿兹海默症中的作用更为复杂。例如,在阿兹海默症患者和模型鼠的营养不良的神经突中,研究者可以观察到类似自噬小泡的结构的累积。这可能是由于自噬小泡发育为自噬性溶酶体的过程遭到破坏所致。并且在这些自噬小泡结构中,存在淀粉样蛋白前体(Amyloid precursor protein, APP)与蛋白水解酶,它们可以产生毒性的蛋白水解产物--淀粉样蛋白β(amyloid-β,被认为是阿兹海默症的元凶)[9]。所以有理论认为,受损的自噬系统为淀粉样蛋白β提供了新的来源。
总而言之,因为自噬机制对神经系统的保护作用,将自噬作为神经退行性疾病的治疗目标是一个值得考虑的选择。
3 自噬与辐射众所周知,电离辐射可以造成DNA突变和损伤,进而诱发正常细胞的死亡或癌变。因此整体而言,辐射是一种极为有害的物理刺激;但另一方面,对于癌症治疗而言,辐射则担负着杀死肿瘤细胞的使命。已有研究表明,电离辐射也可以诱导细胞自噬。例如,早在2001年,美国的Paglin等[10]就发现,遭受电离辐射的肿瘤细胞内部会产生大量的酸化囊泡结构(可能包括自噬性溶酶体等),这种酸化囊泡结构也是高水平自噬的特征之一。另外,他们发现,3-甲基腺嘌呤作为一种自噬阻断药物,也可以阻止大量酸化囊泡结构的形成,这些都是电离辐射可以引发肿瘤细胞自噬的证据。但是,由于自噬具有两面性:在通常的压力下,自噬倾向于保护细胞存活;而当压力过高时,自噬作用则会过度消化细胞组分,引发细胞的程序性死亡。对于辐射治疗而言,这会导致一些受损程度不高的癌细胞借助保护性的自噬作用逃脱辐射治疗的杀伤存活下来,从而导致癌症的复发。例如,德国的Apel等[11]选取了一些对辐射(γ射线)具有抗性的人类肿瘤细胞进行实验。他们发现,如果用核糖核酸(Ribonucleic Acid, RNA)干扰的方法敲除这些抗性肿瘤细胞的一系列自噬相关基因,抑制它们的自噬途径,辐射对于这些细胞的杀伤效果就能得到显著的增强。这种策略对于多种肿瘤细胞(例如乳腺癌细胞、鼻咽癌细胞、肺癌细胞等)都有不同程度的效果。类似的,如果抑制了肿瘤细胞中参与自噬小泡酸化过程的质子泵(H+-ATPase),也会显著增加这些细胞在辐射后的死亡率[10]。在这些例子当中,自噬对于肿瘤细胞主要起到了保护作用。这些结果提示我们,在将来的肿瘤治疗当中,应当考虑将电离辐射等细胞杀伤手段与自噬阻断药物联合使用,以增强肿瘤治疗效果,降低耐受性和癌症复发的概率。
4 自噬与衰老衰老可以被看作是损伤的细胞组分不断积累的过程,所以和自噬也有密切的关系。这个过程通常也伴随着细胞自噬水平的减弱,对错误的蛋白和细胞器的回收能力降低。在已经高度分化且不再分裂的细胞(如神经元细胞和心肌细胞)中,这种损伤积累是不可逆的。所以,与其它细胞类型相比,这些细胞的机能随年龄增长下降更为明显。最近,对于自噬系统受损的小鼠模型的研究显示,在动物衰老的过程中,自噬水平的降低对于多种生理机能的退行起到了重要的作用。相应的,如何阻止或恢复随年龄衰减的自噬水平就成为了延年益寿的一种可能的途径。作为一种已被证明有效的延缓衰老的手段,限制膳食热量的摄取可能对于提高自噬诱导水平有所帮助。这可能是由于这种限制降低了体内的胰岛素水平,而胰岛素是一种自噬抑制剂(图 2)[12]。此外,研究者们也开始关注一些抗脂肪分解的药物对于抗衰老的作用。因为这些药物可能也模仿了类似饥饿的自噬诱导作用[13]。
5 自噬与物理疗法很多物理疗法(包括锻炼、针灸、按摩等)对于人体健康而言似乎有着不言自明的作用,然而人们对其背后的分子机制则长期以来缺乏足够的认识。以体育锻炼为例,近年来,研究者们发现在体育运动对人体的诸多影响当中,运动诱导的细胞自噬所发挥的作用至关重要[14]。运动对骨骼肌产生的影响是首当其冲的。骨骼肌由于经常处于代谢压力(例如高强度运动导致的供氧供能不足)和机械压力(高强度的拉伸和挤压)下,很容易发生损伤。研究者发现,有效的自噬可以有效防止受损的线粒体和蛋白沉淀在肌肉组织中累积。如果自噬效应不足,这种累积就容易导致肌肉萎缩症。例如,意大利的Grumati等[15]的实验表明,VI型胶原蛋白基因缺失的小鼠在进行大量的奔跑运动之后并不会引发细胞自噬效应,导致肌肉中受损的线粒体大量累积,从而引发肌细胞的凋亡和肌纤维的降解,呈现肌肉萎缩的症状。而对于VI型胶原蛋白表达正常的野生型个体来说,运动的机械刺激则可以诱导细胞自噬效应的产生,因此在同样的运动过后不会呈现明显的肌肉损伤。所以,运动诱导的自噬作用对于维护骨骼肌肉组织的健康非常重要。
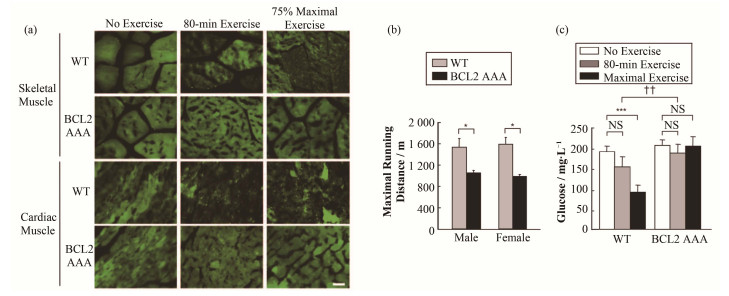
除了对于骨骼肌的直接影响之外,运动对糖尿病等代谢疾病的预防作用也已经受到了广泛的认可。为了从自噬角度探索运动与代谢疾病的关系,美国的He等[16]建立了Bcl-2基因突变的模型小鼠作为研究对象。Bcl-2是一个抗细胞凋亡和抗自噬的蛋白,可以抑制自噬作用。对Bcl-2基因磷酸化位点的突变可以阻止运动诱导的细胞自噬。野生型小鼠在运动后肌细胞中出现大量的自噬小泡(荧光标记自噬小泡的LC3蛋白上,见图 3(a)),说明产生了明显的细胞自噬现象,而Bcl-2基因突变的小鼠(BCL2 AAA)没有明显的自噬表现。而且,突变的小鼠在一定程度的运动过后,表现出耐力下降和葡萄糖代谢异常的症状(见图 3(b)、(c)),且更容易患上高脂肪饮食诱导的葡萄糖不耐症(一种与糖尿病高度相关的症状)。作为对照,Bcl-2基因正常的野生型小鼠则没有这些问题。即便给予高脂肪饮食,它们也能通过日常的运动所引发的自噬提高自己的代谢水平,从而有效降低罹患糖尿病的风险。这些研究表明,运动诱导的自噬对于维持体内葡萄糖代谢的正常和稳定也有积极的作用[16]。
|
图 3 对野生型与Bcl-2突变小鼠运动后的骨骼肌细胞和心肌细胞的荧光成像(a)、对小鼠的最长奔跑距离测试(b)、对运动后小鼠的葡萄糖水平测试(c)[16] Figure 3 Fluorescent images of skeletal and cardiac muscles from wide-type mice (WT) and Bcl-2 mutant mice (BCL2 AAA) (a), results of long-distance running test (b), glucose level test after exercise (c)[16]. |
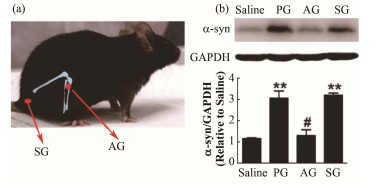
针灸作为中华传统医学中的瑰宝,已被纳入了现代科学研究的体系当中。已有的研究表明,针灸对于神经退行性疾病有显著的治疗效果,已得到了世界卫生组织(World Health Organization, WHO)和美国国立卫生研究院(National Institute of Health, NIH)等国际权威组织的认可[17]。由于针灸可以被看作一种对机体的机械刺激,中国科学院上海应用物理研究所的研究团队从细胞自噬的角度入手研究针灸治疗神经退行性疾病的分子生物学机制[18]。他们以患有帕金森症的模型小鼠作为实验对象,研究表明,对小鼠的阳陵泉穴的针灸刺激可以引发小鼠细胞的自噬作用,清除小鼠脑组织中一种与帕金森症密切相关的蛋白--ɑ突触核蛋白(ɑ-synuclein,如图 4所示)。该蛋白大量存在于动物大脑的黑质致密带中,很容易发生聚集进而引发帕金森症。作为对照,未经针灸处理或在错误位置扎针的小鼠则有很高的ɑ-synuclein水平。在对这些帕金森模型小鼠实施针灸治疗后,研究者们发现它们的运动协调能力有了明显的恢复[18-19]。研究者们还发现,针灸引发自噬的通路与雷帕霉素药物引发的通路并不相同,是一个独立于mTOR的信号通路(图 2),因而可以避免雷帕霉素在该通路上引起的毒副作用。这一发现从细胞自噬的角度为针灸治疗神经退行性疾病的机理提供了分子生物学依据。尤其重要的是,由于在腿部的阳陵泉穴针灸可以“远程”诱导脑内的自噬过程,这为突破血脑屏障治疗大脑相关疾病提供了一条切实可行的“绿色”治疗道路。
|
图 4 对帕金森模型小鼠针灸治疗引发自噬效应清除的ɑ突触核蛋白(a)阳陵泉穴(AG)与伪针灸部位(SG)在小鼠身上的位置,(b) Western印迹实验结果[18] Figure 4 Acupuncture on Parkinson's disease (PD) mouse model can induce autophagy to clean ɑ-synuclein. (a) AG: acupoint of Yanglingquan on the mouse; SG: control point, (b) The expression of ɑ-synuclein[18] |
此外,按摩作为一种被动的肌肉物理刺激,也可能起到与运动类似的诱导自噬效果,对肌肉损伤的恢复起到积极作用[14]。英国的King等[20]发现,对哺乳动物细胞施加类似按摩的压力刺激之后,可以在细胞中观察到自噬小泡的明显增多,对于LC3等蛋白的检测也表明它们的自噬水平明显上升。这一诱导途径同样独立于mTOR通路。有趣的是,相对于持续恒定的压力,细胞对于压力的变化更加敏感,而变化的压力也正符合按摩的特征。所以,这相当于是从自噬角度对按摩的保健功效做出了一个可能的解释。
6 结语综上所述,细胞自噬与人体健康息息相关。由于细胞自噬受到多种环境因素的诱导,我们可以通过人为控制这些因素来调节自噬作用。例如,通过针灸、身体锻炼和按摩等物理刺激来诱导有益的自噬,进而对我们的健康施加有益的影响。同时,我们也可以通过发展可控条件的手段来抑制肿瘤细胞的自噬,从而抑制癌症的发展。我们相信,随着对自噬作用更加深入的研究,我们可以有更多的手段对其进行更明确的调控,从而利用这种自然演化赋予的天然工具,实现更为便利且低毒副作用的疾病治疗方法,为攻克癌症、神经退行性疾病提供新的途径。而对锻炼、针灸等物理疗法与自噬之间密切关系的理解则为人类了解自身、攻克疾病以及发展传统东方医学提供了新的思路。
| [1] | Takeshige K, Baba M, Tsuboi S, et al. Autophagy in yeast demonstrated with proteinase-deficient mutants and conditions for its induction[J]. The Journal of Cell Biology, 1992, 119(2): 301–311. DOI: 10.1083/jcb.119.2.301 |
| [2] | Tsukada M, Ohsumi Y. Isolation and characterization of autophagy-defective mutants of saccharomyces cerevisiae[J]. FEBS Letters, 1993, 333(1-2): 169–174. DOI: 10.1016/0014-5793(93)80398-E |
| [3] | Yamamoto H, Fujioka Y, Suzuki S W, et al. The intrinsically disordered protein Atg13 mediates supramolecular assembly of autophagy initiation complexes[J]. Developmental Cell, 2016, 38(1): 86–99. DOI: 10.1016/j.devcel.2016.06.015 |
| [4] | Shintani T, Klionsky D J. Autophagy in health and disease: a double-edged sword[J]. Science, 2004, 306(5698): 990–995. DOI: 10.1126/science.1099993 |
| [5] | Botti J, Djavaheri-Mergny M, Pilatte Y, et al. Autophagy signaling and the cogwheels of cancer[J]. Autophagy, 2006, 2(2): 67–73. DOI: 10.4161/auto.2.2.2458 |
| [6] | Mathew R, Karantza-Wadsworth V, White E. Role of autophagy in cancer[J]. Nature Reviews Cancer, 2007, 7(12): 961–967. DOI: 10.1038/Nrc2254 |
| [7] | Bjorkoy G, Lamark T, Brech A, et al. p62/SQSTM1 forms protein aggregates degraded by autophagy and has a protective effect on huntingtin-induced cell death[J]. The Journal of Cell Biology, 2005, 171(4): 603–614. DOI: 10.1083/jcb.200507002 |
| [8] | Arrasate M, Mitra S, Schweitzer E S, et al. Inclusion body formation reduces levels of mutant huntingtin and the risk of neuronal death[J]. Nature, 2004, 431(7010): 805–810. DOI: 10.1038/nature02998 |
| [9] | Yu W H, Cuervo A M, Kumar A, et al. Macroautophagy-a novel beta-amyloid peptide-generating pathway activated in Alzheimer's disease[J]. The Journal of Cell Biology, 2005, 171(1): 87–98. DOI: 10.1083/jcb.200505082 |
| [10] | Paglin S, Hollister T, Delohery T, et al. A novel response of cancer cells to radiation involves autophagy and formation of acidic vesicles[J]. Cancer Research, 2001, 61(2): 439–444. |
| [11] | Apel A, Herr I, Schwarz H, et al. Blocked autophagy sensitizes resistant carcinoma cells to radiation therapy[J]. Cancer Research, 2008, 68(5): 1485–1494. DOI: 10.1158/0008-5472.CAN-07-0562 |
| [12] | Mizushima N, Levine B, Cuervo A M, et al. Autophagy fights disease through cellular self-digestion[J]. Nature, 2008, 451(7182): 1069–1075. DOI: 10.1038/nature06639 |
| [13] | Bergamini E. Targets for antiageing drugs[J]. Expert Opinion on Therapeutic Targets, 2005, 9(1): 77–82. DOI: 10.1517/14728222.9.1.77 |
| [14] | King J S. Mechanical stress meets autophagy: potential implications for physiology and pathology[J]. Trends in Molecular Medicine, 2012, 18(10): 583–588. DOI: 10.1016/j.molmed.2012.08.002 |
| [15] | Grumati P, Coletto L, Schiavinato A, et al. Physical exercise stimulates autophagy in normal skeletal muscles but is detrimental for collagen VI-deficient muscles[J]. Autophagy, 2011, 7(12): 1415–1423. DOI: 10.4161/auto.7.12.17877 |
| [16] | He C, Bassik M C, Moresi V, et al. Exercise-induced BCL2-regulated autophagy is required for muscle glucose homeostasis[J]. Nature, 2012, 481(7382): 511–515. DOI: 10.1038/nature10758 |
| [17] | Bonafede M, Dick A, Noyes K, et al. The effect of acupuncture utilization on healthcare utilization[J]. Medical Care, 2008, 46(1): 41–48. DOI: 10.1097/MLR.0b013e3181589b7d |
| [18] | Tian T, Sun Y, Wu H, et al. Acupuncture promotes mTOR-independent autophagic clearance of aggregation-prone proteins in mouse brain[J]. Scientific Reports, 2016, 6: 19714. DOI: 10.1038/srep19714 |
| [19] |
黄庆, 孙艳红, 王璐, 等. 针灸对帕金森小鼠模型运动机能调节的分子机制研究[J].
核技术, 2012, 35(11): 877–880.
HUANG Qing, SUN Yanhong, WANG Lu, et al. Acupuncture improve motor function in a mouse model of Parkinson's disease[J]. Nuclear Techniques, 2012, 35(11): 877–880. |
| [20] | King J S, Veltman D M, Insall R H. The induction of autophagy by mechanical stress[J]. Autophagy, 2011, 7(12): 1490–1499. DOI: 10.4161/auto.7.12.17924 |


