2. 兰州大学 生命科学学院 兰州 730000;
3. 兰州大学 教育部中子应用技术工程研究中心 兰州 730000
2. School of Life Sciences, Lanzhou University, Lanzhou 730000, China;
3. Engineering Research Center for Neutron Application Technology, Ministry of Education, Lanzhou University, Lanzhou 730000, China
生物体受到射线辐射会产生辐射生物效应进而诱发突变,因此一直以来是科学家们探索的重要研究方向。自1927年Muller用X射线辐射果蝇开始,科学家们历经数十年的研究历程,已经利用各种不同射线在辐射生物效应及诱变育种等方面取得了大量的成就,并积累了丰富的研究资料[1-9]。我国开展射线辐射植物研究始于20世纪50年代后期。目前,我国在射线辐射植物研究中采用的放射源还主要集中在γ射线源和X射线源上,除中国科学院近代物理研究所这些年利用重离子开展了较多的相关研究[3, 9]之外,利用其他放射源(电子、质子等)的报道相对较少,虽然以往利用中子开展植物辐射研究的不多,但近些年来有逐步增多的趋势[10-12]。
中子是由Chadwich等[13]在实验过程中发现的,它是原子核结构的重要组分,存在于除氢以外的所有原子核中。与γ射线相比,中子具有穿透能力强、变异谱较宽、变异率高、变异后代性状相对稳定等特点,因此中子能够产生更明显且更高的辐射生物效应,因而备受研究者关注。
胡麻(Linum usitatissimum L.)又名亚麻,是亚麻科、亚麻属,一年生草本植物。胡麻是世界十大油料作物之一,产量约居世界油料产量的第7位。我国的胡麻种植历史已有千年之久,由于胡麻喜干旱湿润的气候,因此在我国西北、华北等地均有广泛种植,是当地主要油料作物之一,统计资料显示胡麻已居我国油料作物产量的第4位[14]。
1 材料和方法 1.1 中子源本文所用中子源为252Cf同位素源,其中子发射率为2.314×1012n∙s-1∙g-1,半衰期为2.646 a,252Cf自发裂变中子谱接近于纯裂变谱,中子的平均能量为2.158 MeV。
1.2 生物材料及其辐射剂量胡麻品名为“陇亚8号”,是由甘肃省农业科学院经济作物研究所选育的抗寒耐旱、抗倒伏品种。挑选颗粒饱满、色泽鲜亮、发芽率在95%以上的胡麻干种子,分9组进行不同剂量的中子辐射,辐射后9组胡麻种子样品的中子吸收剂量如表 1所示。
| 表 1 样品中的中子吸收剂量 Table 1 Absorbed dose of neutron in samples. |
将9组经过不同中子吸收剂量辐射处理的辐照组胡麻干种子和未经辐射处理的对照组胡麻干种子播种于田间,进行M1和M2代的田间种植试验。种植方式采用点播,小区田间管理采用均一原则,实验数据记录方式为所有植株全记录。
选取准确度为mm的刻度尺,对成长中所有胡麻的株高进行测量。采用富士Finepix S5800数码照相机对试验田中出苗的胡麻进行详细拍照,对比辐射组和对照组的形态差异,寻找变异性状的植株,对具有形态差异和明显变异性状的植株跟踪记录。
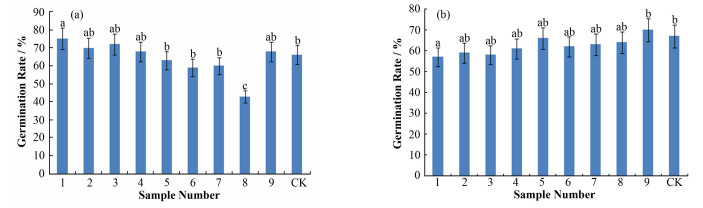
1.3.2 出苗率和分枝率的测算以子叶出土作为胡麻出苗的标志,从观察到第一颗胡麻出苗开始记录,准确记录当天出苗胡麻的编号,每天记录一次,记录9 d,然后统计第9 d各组胡麻的出苗数,计算相应各组的出苗率,如图 1所示。
|
图 1 M1 (a)和M2 (b)代胡麻各样品组的出苗率 不同小写字母表示差异显著(p < 0.05),n≥3 Figure 1 Germination rate of M1 (a) and M2 (b) generation of flax The different small letters represent significant difference (p < 0.05), n≥3. |
胡麻有分枝特性,成苗后的胡麻可以发生侧芽,开始分枝生长,本研究选择两个不同的时间(开始发现有出苗植株的第18 d和第23 d)对所有胡麻的侧芽进行记录,以式(1)计算胡麻的分枝率:
| $ {\eta _1} = \frac{{{N_1}}}{N} $ | (1) |
式中:N1为各组胡麻出现侧芽的植株数;N为各组胡麻的成苗总数。
1.3.3 数据分析方法田间实验过程中记录的M1和M2代胡麻性状的各项数据开展One-way ANOVA方差分析及LSD (Least significant difference)多重比较(SPSS软件),计算相应的标准差并作图。
2 结果与分析 2.1 中子辐射对M1代胡麻出苗的影响不同剂量中子辐射胡麻种子,对M1代胡麻的出苗率产生了不同的影响。受较高剂量辐射的样品1-4组的出苗率分别为75.0%、70.0%、72.0%和68.0%,与对照组相比分别提高了9.0%、4.0%、6.0%和3.0%,比较分析后(图 1(a))发现,第1组差异明显(p < 0.05);而受较低剂量辐射的样品5-9组的出苗率相比于对照组略低,除第8组外(第8组初步分析的原因是田间环境异常造成的),其他4组与对照之间无显著差异。由此可见,在目前的辐射剂量范围内,胡麻的出苗率没有随剂量变化的线性规律,但具有一定范围低剂量的中子辐射可以促进M1代胡麻出苗的辐射生物效应。
2.2 中子辐射对M2代胡麻出苗的影响在对胡麻M2代出苗率的分析后,发现中子辐射的影响持续到了胡麻的M2代。受较高剂量辐射的样品1-4组的出苗率分别比对照组降低了10.0%、8.0%、9.0%和6.0%,比较分析后(图 1(b))发现,第1组差异还是较为明显(p < 0.05);图 1(b)还显示,受较低剂量辐射的样品5-9组的出苗率相比于对照组无明显差异。因此,中子辐射胡麻种子对出苗率的辐射效应可以持续到M2代,但与M1代辐射效应不同的是,样品1-4组胡麻M2代的出苗却出现了抑制效应,分析其原因应是中子辐射胡麻M1代的刺激效应使胡麻发生了一定物理和生化的损伤,所以才会在M2代表现出抑制效应。
2.3 中子辐射对M1代胡麻株高的影响因农作物苗期株高与出苗时间存在密切关联,因此苗期的株高不能简单地对各组平均株高进行比较,而是应该对各组间出苗时间相同胡麻的株高进行比较。表 2为就两种不同出苗时间对M1代胡麻苗期株高进行处理的结果。由表 2可以看出,样品1-4组的株高均明显高于对照组,样品5-9组的株高与对照组之间无明显规律性变化,也无差异显著性出现,其中出苗12 d中子吸收剂量为2.55 Gy和4.33 Gy的M1代胡麻的株高与对照组差异显著,而出苗16 d中子吸收剂量为2.55 Gy和4.33 Gy的M1代胡麻的株高与对照组无差异显著性。以上结果表明,一定范围低剂量的中子辐射对M1代胡麻苗期株高的生长有促进作用,但随着胡麻的生长,其株高的中子辐射促进效应出现了逐步减弱的现象。
| 表 2 中子辐射对M1代胡麻株高的影响(平均值±标准差) Table 2 Effect of neutron radiation on plant height of M1 generation of flax (average±standard deviation). |
表 3为就两种不同出苗时间对M2代胡麻苗期株高进行处理的结果,由表 3可以看出,出苗12 d中子吸收剂量为2.55 Gy和4.33 Gy的M2代胡麻的株高还明显高于对照组,但已无差异显著性,而出苗16 d中子吸收剂量为2.55 Gy和4.33 Gy的M2代胡麻的株高与对照组的差别更不明显。这表明一定范围低剂量的中子辐射对M2代胡麻苗期株高的生长保持了促进效应,但该效应相比M1代胡麻已经减弱。
| 表 3 中子辐射对M2代胡麻株高的影响(平均值±标准差) Table 3 Effect of neutron radiation on plant height of M2 generation of flax (average±standard deviation). |
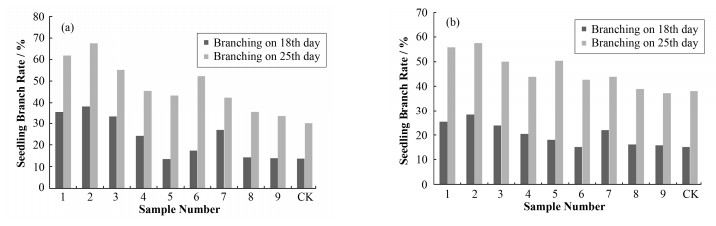
不同剂量中子辐射胡麻种子对其M1代的分枝率产生了普遍影响。如图 2(a)所示,出苗第18 d的M1代胡麻的分枝率除第5组样品与对照组的分枝率均为13.6%外,其他各辐照组的分枝率均明显高于对照组,而出苗第23 d的M1代胡麻的所有辐照组的分枝率均明显高于对照组。LSD多重比较结果显示,第18 d和第23 d中子吸收剂量为2.55 Gy和4.33 Gy(1、2样品组)的M1代胡麻的分枝率与对照组之间一直保持显著差异,其中中子吸收剂量为2.55 Gy的样品2组一直保持着最高的分枝率。这说明一定低剂量的中子辐射胡麻种子,具有促使其M1代侧芽发生的效应,且存在最佳促进剂量。
|
图 2 M1 (a)和M2 (b)代胡麻各样品组的分枝率 Figure 2 Seedling branch rate of M1 (a) and M2 (b) generation of flax. |
中子辐射胡麻种子对其M2代的分枝率还保持着一定程度的影响。如图 2(b)所示,出苗第18 d的M2代胡麻的分枝率除第6组样品与对照组的分枝率均为15.0%外,其他各辐照组的分枝率均高于对照组;出苗第23 d的M2代胡麻的分枝率除第9组样品比对照组略低0.8%外,其他各辐照组的分枝率均高于对照组,但M2代的促进效应不如M1代明显。这也表明了较低剂量的中子辐射对M2代胡麻苗期侧芽的发生还保持着一定的促进效应。
2.7 中子辐射引起M1和M2代胡麻植株形变分析关于M1代胡麻形态变化的田间研究发现,有辐照组胡麻出现叶片及株型发生疑似变异的现象。经统计分析,发生疑似变异现象的M1代植株占1-9组辐射样品植株总数的5%,具体可分为:1)第一对真叶有突变小叶出现(图 3);2)真叶局簇不展(图 4),茎的颜色也有变化;3)双头和三头株型(图 5),出苗后直接生长两个头或三个头。在M2代辐照组胡麻中也发现了一些形态疑似变异植株,而主要发现的是双头和三头株型。这些疑似变异现象在比照组中均未出现,以上研究发现表明,在本研究的中子剂量范围内,可以诱发M1和M2代胡麻产生一定程度的变异。

|
图 3 突变小叶变异株(左)与对照株(右)的比较 Figure 3 Comparison between the mutant leaflet (left) and control plant (right). |

|
图 4 真叶局簇变异株(左)与对照株(右)的比较 Figure 4 Comparison between the true leaf cluster (left) and control plant (right). |

|
图 5 三头变异株(左)、双头变异株(中)与对照株(右)的比较 Figure 5 Three headed mutant (left) and double headed mutant (middle) comparison with control plant (right). |
从本研究可以看出,低剂量的中子辐射胡麻种子能够引起其M1和M2代产生辐射生物效应。且辐射生物效应与中子剂量之间存在着关联:较低剂量(1.12−4.33 Gy)的中子辐射可以促进M1代胡麻出苗、抑制M2代胡麻出苗、对M1代胡麻苗期株高的生长有促进作用,其中2.55 Gy和4.33 Gy中子辐射的促进作用具有显著性并在M2代胡麻中还表现明显的促进作用;低剂量(0.24−4.33 Gy)的中子辐射胡麻种子具有促使其M1和M2代侧芽发生效应,并且存在最佳促进剂量。
本研究还发现,低剂量的中子辐射胡麻种子,胡麻M1和M2代产生的辐射生物效应存在差异:一种是截然相反的效应,关于胡麻出苗的结果分析反应了这一点,M1代是促进作用而M2代是抑制作用,可见中子辐射胡麻种子对M1代胡麻的出苗产生了刺激作用,这种刺激可能对M1代胡麻的某些发育有一定的损伤,因此M2代胡麻的出苗发生了抑制效应;另一种是相似的效应,如M1、M2代胡麻的株高和分枝的发育均出现了促进效应,但M1代的效应比M2代表现的更为明显,由此可知中子辐射胡麻种子对M1代胡麻株高的生长和侧芽的发生产生了刺激作用,这种刺激是有益的,可以持续到M2代,在传代的过程中随着胡麻生理的调整,刺激作用被减弱。
γ辐射具有低剂量辐射的兴奋效应[15],且表现为对种子出苗的促进作用[16]。我们在中子辐射豌豆种子的研究中发现[17],低剂量的中子辐射可以促进M1代豌豆出苗,说明低剂量的中子辐射有与γ辐射类似的可以促进作物M1代出苗的特性,比较后还发现不同作物所产生促进作用的剂量范围不同,M1代胡麻产生促进作用的剂量高于豌豆。前期研究发现[12],较低剂量的中子辐射对M1代豌豆苗期株高的生长有促进作用,较高剂量的中子辐射对M1代豌豆苗期株高的生长有抑制作用。而M1代胡麻只表现出了低剂量中子辐射对苗期株高生长的促进作用,且产生促进作用的剂量高于豌豆。分析原因是由于中子辐射剂量偏低未达到胡麻产生抑制作用的剂量,因此胡麻未出现抑制作用。此外,与低剂量的中子辐射能够明显促使M1代豌豆发生分枝的效应[17]一样,低剂量的中子辐射也能促进胡麻M1代侧芽的发生从而产生分枝并且都存在最佳的促进剂量。这说明中子辐射促进作物侧芽发生的生物学效应具有普适性,在作物成长初期一般不会被明显修复。另外,分析发现胡麻的最佳促进剂量也较豌豆高。
4 结语通过研究证明中子吸收剂量在0.24-4.33Gy之间,可以引起M1和M2代胡麻产生不同的辐射生物效应,且M1和M2代辐射生物效应之间存在着密切的关系;辐射生物效应与剂量之间存在着一定的关联,中子吸收剂量在1.12-4.33 Gy之间,胡麻产生的辐射生物效应更多更明显。另外,在本研究的剂量范围内还可以诱发M1和M2代胡麻发生形态变异。这些对中子辐射植物的进一步研究和中子辐射育种都具有重要意义。
| [1] | Muller H J. X-ray nduced mutation of drosophila virilis[J]. Science, 1927, 66: 84–87. DOI: 10.1126/science.66.1699.84 |
| [2] | Zhang W Y, Kazou F, Satoru E, et al. Energy-dependent RBE of neutrons to induce micronuclei in root-tip cell of Allium cepa onion irradiated as dry dormant seeds and seedlings[J]. Journal of Radiation Research, 2003, 44(2): 171–177. DOI: 10.1269/jrr.44.171 |
| [3] |
周利斌, 李文建, 曲颖, 等. 重离子束辐照育种研究进展及发展趋势[J].
原子核物理评论, 2008, 25(2): 165–170.
ZHOU Libin, LI Wenjian, QU Ying, et al. Progress and tendency in heavy ion irradiation mutation breeding[J]. Nuclear Physics Reviews, 2008, 25(2): 165–170. |
| [4] |
赵剑, 李建国. 60Co γ射线辐射诱变提高长春花生物碱含量[J].
分子植物育种, 2009, 7(3): 607–611.
ZHAO Jian, LI Jianguo. Improving the content of terpenoid indole alkaloids in catharanthus roseus by 60Co γ radiation[J]. Molecular Plant Breeding, 2009, 7(3): 607–611. DOI: 10.3969/mpb.007.000607 |
| [5] |
段雪梅, 田新会, 姚泽恩, 等. 辐射对巫溪红三叶种子发芽率及幼苗生长的影响[J].
贵州农业科学, 2009, 27(6): 123–125.
DUAN Xuemei, TIAN Xinhui, YAO Ze'en, et al. Effects of radiation on seed germination and seedling growth characteristic of Wuxi Red Clover[J]. Guizhou Agricultural Sciences, 2009, 27(6): 123–125. DOI: 10.3969/j.issn.1001-3601.2009.06.038 |
| [6] |
曲颖, 王弋博, 冯虎元, 等. UV-B辐射对豌豆伸长生长和细胞壁多糖组分的影响[J].
辐射研究与辐射工艺学报, 2012, 30(5): 303–308.
QU Ying, WANG Yibo, FENG Huyuan, et al. Effects of UV-B radiation on stems elongation and cell wall polysaccharides of pea seedlings[J]. Journal of Radiation Research and Radiation Processing, 2012, 30(5): 303–308. |
| [7] | Jegadeesan S. Effect of gamma irradiation on germination, growth, and biochemical parameters of Terminalia arjuna Roxb[J]. Radiation Protection & Environment, 2013, 36: 38–44. DOI: 10.4103/0972-0464.121826 |
| [8] |
李明浩, 侯金艳, 吴丽芳. 60Co γ射线对小麦愈伤组织的诱变效应研究[J].
核技术, 2013, 36(12): 120203.
LI Minghao, HOU Jinyan, WU Lifang. Mutagenic effects of wheat callus induced by 60Co γ-ray irradiation[J]. Nuclear Techniques, 2013, 36(12): 120203. DOI: 10.11889/j.0253-3219.2013.hjs.36.120203 |
| [9] |
冯慧, 骆善伟, 杜艳, 等. 氩离子束辐照拟南芥干种子的生物学效应[J].
辐射研究与辐射工艺学报, 2016, 34(1): 010401.
FENG Hui, LUO Shanwei, DU Yan, et al. Biological effects of argon ion beams on dry seeds of Arabidopsis thaliana[J]. Journal of Radiation Research and Radiation Processing, 2016, 34(1): 010401. DOI: 10.11889/j.1000-3436.2016.rrj.34.010401 |
| [10] |
王莉莉, 赵明霞, 乔利仙, 等. 快中子辐照对花生胚小叶体细胞胚胎发生的影响[J].
核农学报, 2011, 25(4): 652–656.
WANG Lili, ZHAO Mingxia, QIAO Lixian, et al. Effect of neutron irradiation on somatic embryogenesis from embryonic leaflets of peanut (Arachis hypogaea L.)[J]. Journal of Nuclear Agricultural Sciences, 2011, 25(4): 652–656. |
| [11] |
韩微波, 张月学, 唐凤兰, 等. 快中子辐照紫花苜蓿的生物学效应与RAPD分析[J].
核农学报, 2011, 25(4): 704–707.
HAN Weibo, ZHANG Yuexue, TANG Fenglan, et al. Biological effects and RAPD analysis of alfalfa (medicago sativa L.) irradiated by fast neutrons[J]. Journal of Nuclear Agricultural Sciences, 2011, 25(4): 704–707. |
| [12] |
徐大鹏, 姚泽恩, 冯虎元, 等. 不同剂量中子辐射针叶豌豆的M1代效应研究[J].
中国农学通报, 2015, 31(12): 200–204.
XU Dapeng, YAO Ze'en, FENG Huyuan, et al. Effects of different dosages of neutron radiation on seed germination and seedling growth of needle leaf pea[J]. Chinese Agricultural Science Bulletin, 2015, 31(12): 200–204. |
| [13] | Chadwick J, Goldhaber M. The nuclear photoelectric effect[J]. Proceedings of the Royal Society of London A, 1935, 151: 479–493. DOI: 10.1098/rspa.1935.0162 |
| [14] |
施树, 赵国华. 胡麻籽功能成分的研究与应用进展[J].
中国食品添加剂, 2007, 6: 117–119.
SHI Shu, ZHAO Guohua. Research progress on the functional composition of flaxseed[J]. China Food Additives, 2007, 6: 117–119. DOI: 10.3969/j.issn.1006-2513.2007.06.022 |
| [15] | Calabrese E J, Baldwin L A. Radiation hormesis: its historical foundations as a biological hypothesis[J]. Human and Experimental Toxicology, 2000, 19(1): 41–75. DOI: 10.1191/096032700678815602 |
| [16] |
王文恩, 包满珠, 张俊卫. 60Co γ射线对日本结缕草干种子的辐射效应研究[J].
草业科学, 2009, 26(5): 155–160.
WANG Wen'en, BAO Manzhu, ZHANG Junwei. The effect of 60Co γ irradiation on dry seeds of Zoysia japonica[J]. Pratacultural Science, 2009, 26(5): 155–160. |
| [17] |
徐大鹏, 姚泽恩, 冯虎元, 等. 252Cf裂变中子辐照豌豆种子生物学效应的初步研究[J].
核技术, 2013, 36(11): 110207.
XU Dapeng, YAO Ze'en, FENG Huyuan, et al. Preliminary study on biological effects of pea seeds (Pisum sativum L.) induced by 252Cf neutron source[J]. Nuclear Techniques, 2013, 36(11): 110207. DOI: 10.11889/j.0253-3219.2013.hjs.36.110207 |
