氚是核环境评价的主要放射性核素之一,与其它核素相比,氚一旦进入环境中被生物体摄入,便会在某一部位产生放射性,威胁生物生长和生物圈安全。在核环境评价中,氚作为单独的核素进行处理,因此,氚由于自身的放射生物学特征,一直备受人们关注[1]。
氚在生物介质中主要以组织自由水氚(Tissue Free Water Tritium, TFWT)和有机结合氚(Organically Bound Tritium, OBT)两种形式[2-3]存在。在核设施周围,氚通过空气、土壤等介质被动物、植物吸收,并进一步通过动植物食品传输到人体内[4]。进入人体内的OBT以蛋白质、碳水化合物等不同的化学形态存在[5],其在人体中的生物半衰期为40d,对人体的食入剂量转换因子为TFWT的两倍多[6],因此,需要分析生物中的OBT水平。同时,由于植物是动物和人类的主要食物来源,所以分析植物中的OBT活度水平在剂量学上具有重要的意义[7]。
目前国内外关于OBT分析方法的研究主要集中在制样阶段,采用的方法主要为湿法氧化法和高温氧化燃烧法。湿法氧化法普遍存在氧化不完全和氧化效率低的问题,而高温氧化燃烧法经验证具有氧化彻底和氧化效率高的特点,因此高温氧化燃烧法具有较好的发展前景[4, 8-9]。
本文在购置Pyrolyser高温分解熔炉的基础上,通过大量的条件实验,结合厂商建议和同行经验优化了植物样中OBT的样品制备条件,获得了核设施周围典型植物中OBT的最佳制样条件。并在此基础上,对OBT测量的不确定度进行了分析,获得了不同植物中OBT分析的不确定度。
1 实验部分 1.1 样品的干燥根据普适性原理,分别选择核设施周围一年生植物——野棉花(叶片较小,根须丰富,可充分从土壤中摄取HTO)、扁竹根(叶片扁平肥厚,可充分从空气中摄入HTO)和常年生植物——松针作为研究对象,进行OBT的分析测量。常用的样品干燥方法有冷冻脱水法、烘箱干燥除水法(与冷却装置连接来捕集水分)、共沸蒸馏法等[10-12]。冷冻脱水法在样品干燥处理时使用较多,但是所需时间太长,一般需要至少2000min。
为了提高OBT制样效率和缩短制样时间,本文采用“低温解析+烘箱干燥”的方法进行样品中TFWT的移除。制样开始时将新鲜样品分别装入低温解析装置的解析管中,对样品进行115°C的低温解析,待收集管中解析液大于10mL之后,取出样品置于烘箱内进行进一步干燥,整个过程约需240min,因此,采用“低温解析+烘箱干燥”的方法能够有效缩短样品前处理周期。
1.2 实验设备和材料实验设备:热重分析仪:型号为梅特勒(METTLER)TGA/DSC2-HT/1600,瑞士;元素分析仪:型号为vario EL cube,德国;高温分解熔炉:型号为Pyrolyser-6 Trio,英国;低温解析装置:型号为DWR-1,中国工程物理研究院核物理与化学研究所;烘箱:型号为DHG-9030A,上海鸿都电子科技有限公司,中国;液闪计数仪:型号为1220,PE公司;分析天平:型号为CPA225D,德国。
实验材料:干燥空气、氧气、闪烁液和聚四氟乙烯计数瓶等。
Pyrolyser-6 Trio高温分解熔炉主要由工作管(内含6根子工作管)、三温区管式炉(包含催化区、保护区和氧化区)、温控单元、coolsafe冷阱(采用R507作为冷却介质,在-110°C对水分进行捕集)、收集瓶和一些玻璃配件组成,其结构示意图如图 1所示。
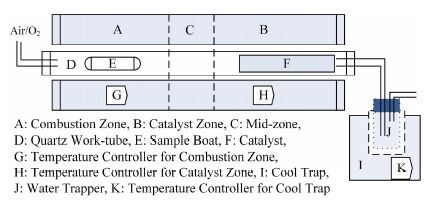
|
图 1 氚碳氧化炉结构示意图 Figure 1 Schematic design of OBT combustion furnace. |
对于高温分解熔炉的使用,厂家建议使用时先用干燥空气吹扫样品管,同时进行催化区的加热,待催化区达到所需温度时,再放入样品进行氧化燃烧。实验中催化剂温度需要根据所选的催化剂进行确定,样品的燃烧温度需要根据样品特征进行选择。本文基于这些原因,进行了大量的条件实验,确定了植物中OBT制备的最佳条件。
1.3 有机物氧化燃烧率采用元素分析仪测定经过氧化燃烧后的植物样灰烬中的氢含量,获得W1。根据植物干样燃烧后获得的水量以及水中氢的比重计算得到W2,根据式(1) 计算可获得有机物的氧化燃烧率。
| ${W_0} = \frac{{{W_2}}}{{{W_1} + {W_2}}} \times 100\% $ | (1) |
式中:W0为有机物的燃烧率;W1为未完全燃烧的有机物当量;W2为完全燃烧的有机物当量。
1.4 OBT回收率将植物样品干燥后,采用元素分析仪测定干燥样品的含氢率,根据式(2) 计算获得OBT的回收率。
| $W = \frac{{{m_{{\rm{water}}}}}}{{9 \times H\% \times {m_{{\rm{dry}}}}}} \times 100\% $ | (2) |
式中:W为OBT回收率,%;mwater为捕集到的生成水的重量,%;H%为干燥样品的含氢率,%;mdry为进行燃烧的干燥样品的重量,g。
2 OBT制备条件 2.1 燃烧区通氧量在氧化燃烧试验中,样品管中氧气和空气的通入量对样品能否完全氧化燃烧至关重要。然而,若氧气含量较高,样品燃烧将会更加剧烈,甚至引起样品管的破裂和管中样品的飞溅,影响测量结果。若氧气含量太低,样品的氧化将不充分,也会对样品的OBT分析结果造成影响。在OBT分析中,建议氧气和空气的通入量比为1:1[13]。为了获得最佳通氧量,固定空气通入量为100mLmin-1,选择松针、扁竹根、野棉花这三种碳氢元素含量不同的植物样品,以5 °Cmin-1的升温速率,在80-120mLmin-1的通氧量范围内进行了样品的氧化燃烧实验,结果如表 1所示。在较低的通氧量下样品能够正常燃烧,而当通氧量达到120mLmin-1时,样品管中出现了轻微爆燃,因此,从实验安全性以及样品氧化燃烧的充分性考虑,选择100mLmin-1作为样品管中通入氧气的最佳流量。
| 表 1 不同样品在不同通氧气量下的燃烧试验 Table 1 Burning test of different samples at various oxygen flow rates. |
选择Pt-Al2O3催化剂进行植物样品的催化氧化。为了确定最佳催化氧化温度,进行了不同温度下植物样品生成OBT的实验。实验时,以松针样品为例,控制空气和氧气流速分别为100mL∙min-1,样品区燃烧温度为500 °C,进行300-900 °C的催化氧化实验,结果如图 2所示。在300-400 °C时,主要是植物样品中低沸点的有机氚的催化燃烧,在400-600 °C时植物中OBT的比活度相对较高,温度上升到700 °C时,植物样品中的OBT已经充分催化氧化为HTO,继续升温后样品中OBT的比活度基本不变。为保证样品的充分催化氧化,选择800°C进行植物中有机氚的催化氧化实验。
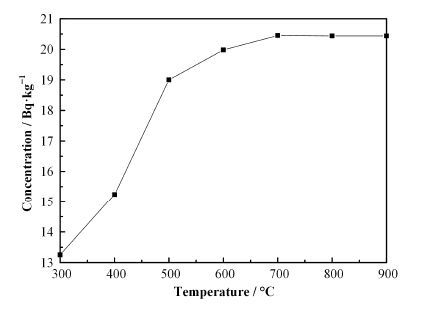
|
图 2 不同催化温度下松针中OBT比活度 Figure 2 Specific activity of OBT in pine needles under different catalytic temperatures. |
在样品舟中装入一定量的松针样品,在空气和氧气流速分别为100mLmin-1、催化氧化区温度为800°C时,于200-700°C下进行样品氧化燃烧实验,结果如图 3所示。可以看出,在氧化温度为200-400°C时,松针中OBT的比活度随着时间的增加急剧增大,温度达到400 °C以上时,增加的非常缓慢,待温度达到600°C时,样品比活度基本不变,此时,样品中的OBT已经全部取出。结合松针、扁竹根和野棉花干样的热重分析(图 4)可以看出,植物样的失重主要发生在400 °C以前,在氧化温度为600°C时,植物样中已有60%以上的失重率,由于所取样品量较少(只有0.012g左右),因此,其余的30%左右的重量可能为样品里面的矿物质含量。为保证样品的充分燃烧,选择 600°C进行植物样的氧化燃烧实验。
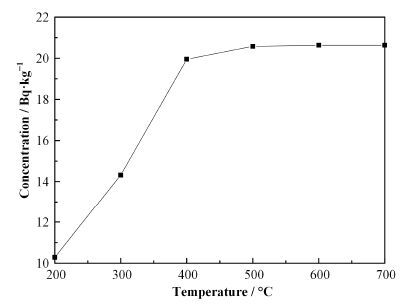
|
图 3 不同氧化温度下松针中OBT比活度 Figure 3 Specific activity of OBT in pine needles under different combustion temperatures. |
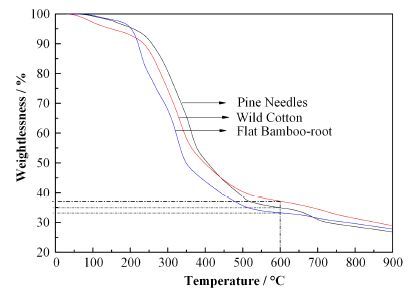
|
图 4 植物样干样失重曲线 Figure 4 Weightlessness of dry samples in plant. |
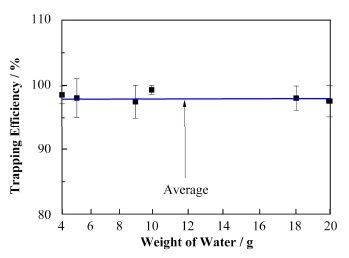
系统的冷凝收集效率直接影响系统对OBT的分析准确度。如果系统的冷凝收集效率太低,样品氧化后形成的HTO蒸汽会被载气载带出去,影响OBT的分析结果。为了评估系统的收集效率,在样品舟中放入不同质量的水样(模拟不同的样品量),连接coolsafe冷凝装置,进行系统冷凝收集效率实验,结果如图 5所示。可以看出,不同样品量下该系统的冷凝收集效率大于95%,平均收集效率可达97.64%。
|
图 5 OBT制样系统的收集效率 Figure 5 Trapping efficiency of the cold trap for OBT. |
在通氧量为100mLmin-1、催化氧化温度为800°C和氧化燃烧温度为600°C的条件下进行了高温分解熔炉燃烧所需样品量的研究,发现当每根子工作管的样品量在4-8g时,均能获得2g以上的氧化水,若需要更多的氧化水,只需将两根或两根以上的子工作管装入同一样品即可。为保证获得足够多的氧化水,以满足液体闪烁测量分析,本装置的最小样品量为4g,而最大样品燃烧量可达45g,能够完全满足环境样品中OBT的分析制样要求。
在最佳OBT制备条件下进行了植物样有机物燃烧率测定实验,实验结果如表 2所示。对典型植物样品进行了OBT回收率实验,结果如表 3所示。植物样经过本系统氧化燃烧后,会产生少量白色灰烬,灰烬中氢含量小于0.3%,对灰烬进行元素分析和计算表明,样品中有机物的氧化燃烧率可达99%以上,说明样品已经充分氧化燃烧。由表 3结果可知,典型植物中OBT的回收率均在85%以上,表明采用优化后的样品制备条件,在制备OBT样品时具有较高的回收率,可以用于植物样品中OBT水平的分析。
| 表 2 灰烬中H元素分析结果 Table 2 Analysis results of H in the ash. |
| 表 3 植物样OBT回收率 Table 3 Recovery rate of the combustion water in plant. |
本实验中影响OBT回收率的主要因素为催化剂的催化氧化效率、样品氧化燃烧率以及冷阱冷凝效率,由于冷阱冷凝效率为97.64%,样品氧化燃烧率大于99%,而选用的催化剂为Pt-Al2O3催化剂,课题组前期在对催化剂的催化效率研究时发现此催化剂在300°C时,对氢气的催化效率已经大于99.9%,本实验在800°C下进行,故催化剂的催化效率对OBT的回收率不会有太大的影响,因此,考虑OBT的回收率可能还有其他影响因素,例如样品预处理的影响、样品HTO测量时液闪测量的影响、样品氧化燃烧时在高温分解熔炉中的残留沾污等。对OBT的影响因素的分析正在进一步研究中。
3 结语本文通过大量的实验,采用高温分解熔炉的催化氧化燃烧法,对核设施周围典型植物样中OBT的制备条件做了优化选择,并在此基础上,进行了典型植物中OBT分析的不确定度研究。主要获得以下结论:
1) 植物样中OBT制备的条件确定为:高温分解熔炉每根工作管的通氧量选择为100mLmL-1,最佳催化氧化温度为800°C,最佳样品氧化燃烧温度为600°C,在此基础上,植物样OBT的回收率可达85%以上,能满足植物样中OBT分析的要求。
2) 本研究获得的典型植物中OBT分析测量方法可推广到环境生物氚水平测量及评价方面,这对涉氚活动后期氚水平测量以及产生剂量的评价具有重要的意义。
| [1] |
Canadian Nuclear Safety Commission.Tritium studies [OL].2010-05-18[2016-01-06].http://www.nuclearsafety.gc.ca/eng/readingroom/tritium/tritium_studies.cfm
( 0) 0)
|
| [2] |
Baglan N, Alanic G, Le Meignen R, et al. A follow up of the decrease of non exchangeable organically bound tritium levels in the surroundings of a nuclear research center[J].
Journal of Environmental Radioactivity, 2011, 102 : 695 –702.
DOI: 10.1016/j.jenvrad.2011.03.014 ( 0) 0)
|
| [3] |
Diabate S, Strack S. Organically bound tritium[J].
Health Physics, 1993, 65 (6) : 698 –712.
DOI: 10.1097/00004032-199312000-00008 ( 0) 0)
|
| [4] |
杨怀元.
氚的安全与防护[M]. 北京: 原子能出版社, 1997 : 207 -223.
YANG Huaiyuan. Tritium safety and protection[M]. Beijing: Atomic Energy Press, 1997 : 207 -223. (  0) 0)
|
| [5] |
任天山, 赵秋芬, 陈炳如, 等. 我国食物和环境氚所致居民剂量[J].
中华放射医学与防护杂志, 2001, 21 (6) : 463 –467.
REN Tianshan, ZHAO Qiufen, CHEN Bingru, et al. Committed effective dose to Chinese residents caused by tritium in food and environmental water[J]. Chinese Journal of Radiological Medicine and Protection, 2001, 21 (6) : 463 –467. (  0) 0)
|
| [6] |
中华人民共和国国家质量监督检验检疫总局.GB18871-2002:电离辐射防护与辐射源安全基本标 准[S].北京:中国标准出版社, 2003
The State Administration for Quality Supervision and Inspection and Quarantine of the People's Republic of China.GB18871-2002:Basic standards for protection again simonizing radiation and for the safety of radiation sources[S].Beijing:China Standards Press, 2003 (  0) 0)
|
| [7] |
杨怀元. 我国核设施与环境氚的监测[J].
辐射防护通讯, 1994, 14 (3) : 4 –14.
YANG Huaiyuan. China's nuclear facilities and environmental tritium monitoring[J]. Radiation Protection Communication, 1994, 14 (3) : 4 –14. (  0) 0)
|
| [8] |
Workman W J G, Kim S B, Kotzer T G. Inter-laboratory comparison of organically bound tritium measurements in environmental samples[J].
Fusion Science and Technology, 2005, 48 : 763 –766.
( 0) 0)
|
| [9] |
Bacchetta A, Baglan N.Speciation of tritium in environmental samples[C].10th International Conference - on Tritium Science and Technology, Vienna, Austria, 2013
( 0) 0)
|
| [10] |
郑晓敏, 吴宗梅. 松针中组织自由水氚[J].
辐射防护, 1993, 13 (4) : 308 –309.
ZHENG Xiaomin, WU Zongmei. The tissue free water tritium in pine needle[J]. Radiation Protection, 1993, 13 (4) : 308 –309. (  0) 0)
|
| [11] |
康厚军, 张东, 石正坤. 植物中组织自由水氚的测量方法[J].
原子能科学技术, 2009, 43 (3) : 221 –223.
KANG Houjun, ZHANG Dong, SHI Zhengkun. Measurement of tissue free water tritium in plant[J]. Atomic Energy Science and Technology, 2009, 43 (3) : 221 –223. (  0) 0)
|
| [12] |
邱永梅, 但贵萍, 文玮, 等. 退役核设施环境植物中氚的分析[J].
同位素, 2012, 25 (2) : 33 –36.
QIU Yongmei, DAN Guiping, WEN Wei, et al. Analysis of tritium in environmental plant samples around nuclear facilities[J]. Journal of Isotopes, 2012, 25 (2) : 33 –36. (  0) 0)
|
| [13] |
Huang Y J, Zeng F, Zhang B, et al. Method validation and uncertainty evaluation of organically bound tritium analysis in environmental sample[J].
Journal of Environmental Radioactivity, 2014, 134 : 83 –88.
DOI: 10.1016/j.jenvrad.2014.03.010 ( 0) 0)
|
