2. 中国人民解放军总医院 核医学科 北京 100853
2. Department of Nuclear Medicine, The People's Liberation Army(PLA) General Hospital, Beijing 100853, China
氟[18F]脱氧葡萄糖(18F-FDG)是目前临床正电子发射断层显像/X射线计算机体层成像(Positron emission tomography/computer tomography, PET/CT)最常用的正电子示踪剂[1],已广泛应用于肿瘤、肝移植及神经疾病等方面的诊断与研究[2-4]。美国药典中收录的第一个正电子类放射性药物就是18F-FDG,我国2015版药典将之收录。目前成熟商品化合成18F-FDG方法有酸水解法[5]和碱水解法[6],两者相比碱水解法速度快、水解温度低,但碱水解方法合成18F-FDG产品的检测中会存在未知杂质、18F-FDM(2-脱氧-2-[18F]氟-D-甘露糖)含量高等问题,其中18F-FDM为碱水解法合成18F-FDG产生的副产物,未知杂质为气相色谱检测溶剂残留时发现;而酸水解的主要问题是合成时间较长。FDG模块一般只能采用一种工艺,在模块上改变生产工艺对产品质量会造成较大影响。本研究在Padgett等[7]双管酸水解基础上,改进国产固相碱水解FDG模块,去掉加碱部件及C-18柱水解部件,酸水解后的反应液直接经纯化装置得到产品;对改进的国产模块酸水解进行研究,寻求在国产碱水解模块上采用酸水解方法制备合格的18F-FDG,以避免副产品FDM及未知杂质产生,研究两种不同工艺在同一模块上合成18F-FDG的可行性。
1 实验部分 1.1 仪器与设备AR-2000薄层放射性扫描仪:美国Eckert & Ziegler公司;全自动化FDG合成模块PET-FDG-IT-І:派特(北京)科技有限公司;Endosafe-PTS细菌内毒素快速检测仪:USA Charles River公司;活度计:CRC-15R型,美国Capintec公司;Sep-PakC-18柱、Alumina N柱:美国Waters公司。
1.2 材料与试剂AG11.A8和Dowex50树脂、18O-H2O、2-三氟甲基磺酰基-β-D-甘露糖(三氟甘露糖)、氨基聚醚(K2.2.2):江苏华益科技有限公司;碳酸钾:美国Sigma Aldrich公司;浓HCl:AR级,北京化学试剂公司;无水乙醇:AR级,国药集团;无水乙腈:HPLC级,美国TEDIA公司。
1.3 制备过程HM-20加速器质子束流65μA轰击18O-H2O产生18F-,合成分为4个过程:用K2.2.2/K2CO3溶液洗脱阴离子捕获柱(QMA柱)捕获的18F离子,加热除水至干;加入乙腈溶解的三氟甘露糖前体,反应生成18F-FDG中间体(18F-FDG-OAc);加入HCl溶液,加热到120℃水解反应得到粗产品18F-FDG;粗产品经AG11·A8和Dowex50、C-18柱、Alumina N柱纯化,过无菌滤膜得到注射药品18F-FDG。生产的18F-FDG与国产碱水解模块合成的18F-FDG作对照[8],比较产品质量。
1.4 制备系统本研究使用的合成模块由国产碱水解FDG合成模块经改进优化而成,合成模块示意图见图 1。改进模块的酸水解反应直接在反应管内进行,反应液从反应管出来直接经纯化装置纯化得到产品,18F-FDG整个合成程序为计算机全程控制,产品制备结束后传送至真空收集瓶,计算机提示合成完成。
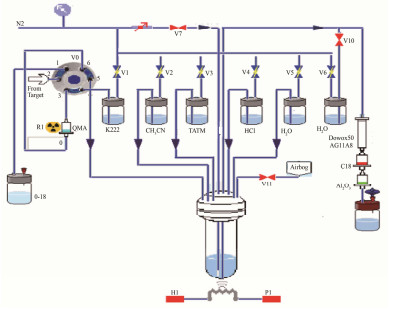
|
图 1 全自动合成18F-FDG模块 Figure 1 Module of auto-synthesis for 18F-FDG. |
改进的FDG合成模块合成及自动化制备过程为:由加速器18O(p, n)18F反应产生18F-,经氮气传输到合成器上,18F-经六通阀后被QMA捕获,18O废水进入收集瓶。
1)打开六通阀V0、V1,QMA捕获的18F-由含碳酸钾的K2.2.2乙腈溶液经六通阀,将QMA上吸附的18F-淋洗下来进入反应管,时间为40 s。淋洗完毕,打开H1、V7,风浴加热114℃,同时向反应瓶内通入120 mL·min-1的氮气流,除水至剩余0.1mL左右;打开V2,加2 mL无水乙腈至反应管中,重复上一步除水,时间为240 s,除水至干,降低温度至90℃,同时负压除水50 s。
2)打开V3、H1,将1 mL无水乙腈的三氟甘露糖前体液加入到反应管中,进行亲核反应,风浴加热83℃,时间为60 s。风浴温度升高至114℃,时间为90 s,蒸发乙腈至0.1 mL左右。
3)打开P1,冷却反应管至40℃以下,时间为30 s;打开V4、H1,将2.5 mL 1 mol·L-1 HCl溶液加入反应管中,反应温度120℃,水解600 s。
4)打开P1,将反应管温度降至100℃,同时开启负压除乙腈,时间为120 s;打开V5,加水稀释反应液;将反应液从反应瓶转移,经AG11.A8和Dowex50柱、Alumin N柱、C-18柱和无菌滤膜进入真空收集瓶;再用10 mL水分两次清洗反应管,再传输到收集瓶中。以上各个程序步骤为计算机控制,全自动化合成完成,全程用时27 min。
1.2 产品的质量控制按中国药典2015年版的标准对产品进行检测:检查产品的外观、澄明度,用精密pH试纸检测产品pH值,细菌检测,使用细菌内毒素快速检测仪(Endosafe-PTS)检测终产品;薄层层析法(Thin-Layer Chromatography, TLC)测产品放化纯,展开剂为95%乙腈,展开完毕用AR-2000薄层放射性扫描仪进行扫描;使用碘铂酸钾方法测定K2.2.2,使用气相色谱仪检测产品的溶剂残留[9]。
2 结果与讨论 2.1 合成结果分析改进的国产全自动化FDG合成模块经酸水解生产18F-FDG,运行次数已超过37次,没有出现失误或差错,本研究采用三氟甘露糖的前体量均为19mg,与碱水解方法用量无明显区别[8]。酸水解制备的18F-FDG平均活度为30.45 GBq(25.31-35.78GBq),合成效率为60.27%±2.29%(未校正效率(End of Synthesis, EOS)),与文献[8]报道的碱水解法合成效率无太大差别。
2.1.1 亲核反应时间对产率的影响亲核反应在18F-FDG合成过程中至关重要,本研究调试不同的亲核反应时间,寻求最佳反应时间。采用反应时间分别为30 s、60 s、90 s、120 s、150 s、300 s,合成效率分别为:46.56%±0.71%、60.87%±1.45%、60.96%±1.08%、61.30%±0.80%、61.53%±1.69%、61.91%±1.18%(n=3,图 2)。亲核时间降低至30 s,合成效率45.7%±2.16%;亲核时间大于90 s,产品合成效率并没有太大的提高。为保证合成效率和缩短反应时间,本研究采用亲核时间60 s。
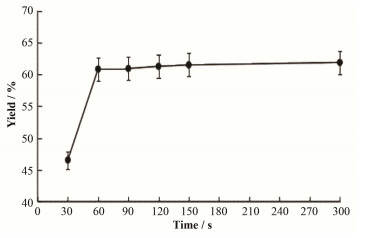
|
图 2 亲核时间对合成的影响 Figure 2 Effect of nucleophilic time on synthesis. |
酸水解合成18F-FDG是国内常用的制备方法之一,但盐酸对18F-FDG中间体(18F-FDG-OAc)的水解能力不是很强,酸水解是一个可逆过程,需要较高反应温度、较长反应时间。本文采用2.5 mL 1mol·L-1的盐酸溶液,通过观察6 min、7 min、8 min、9 min、10 min、12 min、15 min,对中间体的水解情况进行估算,结果分别为44.87%±2.5%、64.57%±1.09%、85.71%±2.48%、92.37%±0.86%、93.73%±1.47%、94.4%±0.32%、95.6%±0.62%,结果示于图 3。由图 3可知,8 min约85.71%的中间体发生水解,10 min约93.73%的中间体水解。水解时间过少,水解反应不完全;水解反应时间不宜过长,如果时间过长不会太多提高水解程度,但会延长总合成时间,本研究认为水解时间10 min为宜。
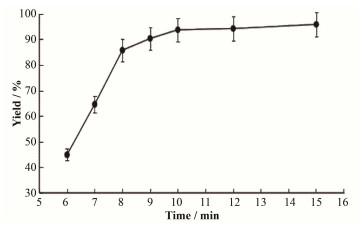
|
图 3 时间对水解效率的影响 Figure 3 Effect of time on the hydrolysis efficiency. |
18F-FDG中间体(18F-FDG-OAc)有4个酯基需要水解,水解反应是可逆的吸热反应,较低温度不利于水解反应,适当提高反应温度有利于加快反应速率和提高反应程度,本研究设定水解反应温度为120℃[5, 10];加入适量盐酸催化水解反应,可以加快其反应速率。本文采用不同浓度的盐酸量进行研究,分别使用0.5 mol·L-1、1 mol·L-1、1.5 mol·L-1、2mol·L-1、3 mol·L-1盐酸各2.5 mL进行水解试验,结果见图 4。盐酸对18F-FDG中间体的水解能力不是很强,本研究试图通过加大HCl的使用量来加快水解反应速度,盐酸用量为3 mol·L-1 2.5 mL时,终产品的pH值为4.0-5.0,需另外调节pH值或增加中和酸所用填料,同时增加了反应液中盐的浓度,不适合直接用于临床注射;当盐酸使用量较小,中间体水解效果不佳,使用2.5 mL 0.5mol·L-1盐酸进行水解反应,水解时间20 min,仍有23%的中间体未水解。本研究选用2.5 mL 1mol·L-1的盐酸溶液作催化水解且温度控制在120℃为最佳实验方案。
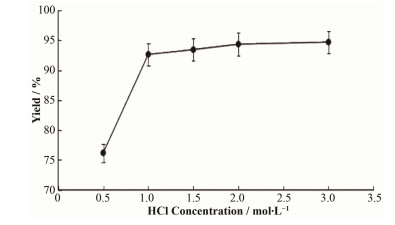
|
图 4 盐酸量对水解效率的影响 Figure 4 Effect of HCl concentration on the hydrolysis efficiency. |
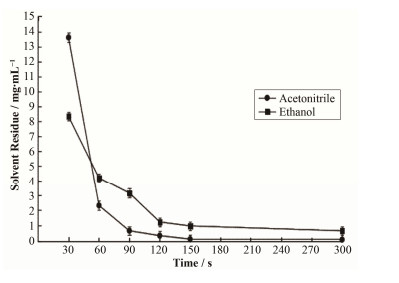
本研究采用酸水解方法合成18F-FDG,产品的外观、pH值、放射化学纯度、氨基聚醚残留等均符合药典要求,但溶剂残留存在超标问题,本节研究了除乙腈时间对乙腈残留的影响。酸水解反应结束后,反应管内乙腈蒸除时间不足,产品溶剂残留检测时会出现溶剂残留超标;而除乙腈时间过长,会造成部分放射性损失,同时还延长合成时间。本研究采用不同的乙腈蒸除时间,时间分别为:30 s、60 s、90 s、120 s、150 s、300 s,最后使用气相色谱仪(Gas chromatography, GC)检测各个时间得到产品的溶剂残留量,分析乙腈、乙醇残留量的具体数值见表 1,分析结果见图 5。蒸除残留溶剂时间降低至30 s,乙腈残留量(13.6±1.30)mg·mL-1。如果蒸除时间较大时(≥150s),产品的乙腈残留量并无太大变化。降低产品中溶剂残留量,同时减少合成时间,提高生产效率,本研究认为蒸除残留溶剂时间120-150 s为宜。产品中乙醇含量主要为防止18F-FDG辐射分解加入少量乙醇(约0.1%)[11]。
| 表 1 不同时间的溶剂残留 Table 1 Table 1 Result of the solvent residue for different time. |
|
图 5 时间对溶剂残留的影响 Figure 5 Effect of time on the solvent residue. |
碱水解合成模块生产工艺中,在冷却反应液后需将中间体富集于C-18柱,再用蒸馏水清洗C-18柱以除去未反应的18F-、残留溶剂等杂质,再加入适量碱溶液使中间体进行碱水解反应;改进的合成模块在结构上比原合成模块更简单,省去了柱水解和加碱等部件,减少了中间体富集于C-18柱、蒸馏水清洗C-18柱、在柱碱水解等过程;酸水解合成法的亲核反应、酸水解过程可先后在同一反应管内进行,可减少中间体在转移过程中的损失。碱水解制备18F-FDG的纯化装置由IC-H柱、Alumin N柱及C-18柱等组成,本研究以AG11.A8和Dowex50柱、Alumin N柱、C-18柱等组成一套纯化装置,从反应管出来的反应液直接使用此纯化装置进行纯化。碱水解合成模块的其它部件及装置则进行了保留使用,未进行更多的改进或拆除,而省去未用的柱水解和加碱等部件并未进行真正拆除,可方便、简单地重新改回碱水解合成模块装置,为同一合成模块上实现两种不同生产工艺制备18F-FDG提供了硬件保障。
国内外文献报道[5-10],一台FDG合成模块一般仅能采用一种生产工艺,同一模块上实现不同工艺的生产,且达到质量要求是目前的难点之一。本研究以改进的国产碱水解合成模块经酸水解生产出合格的18F-FDG,实现了两种不同工艺在同一模块上制备合格的18F-FDG,对FDG合成模块制备18F-FDG生产工艺的申报有借鉴意义。酸水解生产18F-FDG的合成工艺可以避免副产品18F-FDM的产生,气相色谱检测碱水解生产的18F-FDG溶剂残留时,发现在4.5 min左右可能会产生一未知杂质,这一未知杂质可能由强碱溶解C-18柱上硅烷而产生,虽然目前18F-FDG的质量标准并未将其收录,但将来的企业标准或国家标准会对其重视,而酸水解生产工艺可以避免未知杂质的产生。常用酸水解制备18F-FDG的方法为双管或单管法,合成时间为33-50 min不等,本研究的酸水解生产工艺缩短合成时间至27min。
2.2 参数优化后的合成优化的国产FDG合成模块酸水解全自动化合成18F-FDG条件为:洗脱QMA柱捕获的18F-离子,在氮气保护下与乙腈共沸除水两次;密闭条件下,反应温度为115℃,亲核反应时间为1 min,生成中间体(18F-FDG-OAc);盐酸的使用量为1 mol·L-1的盐酸2.5 mL,反应时间10 min,温度120℃;酸水解反应结束后,蒸除残留溶剂时间120 s为宜;最终产品为无色澄明液体、pH值6.5-7.0,细菌内毒素检查合格,溶剂残留检测均在药典规定范围内,放化纯度均大于98%,平均活度30.45 GBq(25.31-35.78 GBq),合成效率60.27%±2.29%(EOS),放射性浓度(2.92±0.31)GBq·mL-1,与文献[8]报道碱水解法合成效率无太大差别。
2.3 产品的质量控制本法生产的18F-FDG质量与碱水解法生产的18F-FDG相比,无明显区别。最终产品外观与碱水解合成法一致,均为无色澄明液体,符合药典要求;放射性浓度为0.37-3.0 GBq·mL-1,pH值为6.5-7.0,氨基聚醚(K2.2.2)检测符合药典要求;经TLC检测,放化纯度大于98%;经细菌内毒素检查,产品符合药典要求;气相色谱仪检测产品溶剂残留,乙腈、乙醇溶剂残留均符合药典要求,与碱水解比较结果见表 2。
| 表 2 酸水解与碱水解制备18F-FDG质控结果(n=5) Table 2 Result of quality control of 18F-FDG by acidicand basic hydrolysis (n=5). |
本研究以国产碱水解FDG合成模块为基础,对此模块进行了改进和优化,改进的合成模块经酸水解合成18F-FDG,并优化了酸水解制备18F-FDG的工艺条件。改进的国产FDG合成模块经酸水解生产的18F-FDG可以满足临床需求,酸水解生产工艺可以避免18F-FDM和未知杂质的产生,实现了同一模块采用两种不同工艺合成18F-FDG,提升了FDG合成模块的利用价值。
| [1] |
Rudroff T, Kindred J H, Kalliokoski K K, et al. [18F]-FDG positron emission tomography-an established clinical tool opening a new window into exercise physiology[J].
Journal of Applied Physiology, 2015, 118 (10) : 1181 –1190.
DOI: 10.1152/japplphysiol.01070.2014 ( 0) 0)
|
| [2] |
李洪生, 吴湖炳, 王巧愚, 等. 呋塞米介入18F-FDG PET/CT双时相显像对膀胱癌的诊断价值[J].
核技术, 2014, 37 (2) : 020301 .
DOI: 10.11889/j.0253-3219.2014.hjs.37.020301 LI Hongsheng, WU Hubing, WANG Qiaoyu, et al. Value of the dual phase 18F-FDG PET/CT with oral diuretic in the diagnosis of bladder cancer before therapy[J]. Nuclear Techniques, 2014, 37 (2) : 020301 . DOI: 10.11889/j.0253-3219.2014.hjs.37.020301 (  0) 0)
|
| [3] |
Bailly M, Venel Y, Orain I, et al. 18F-FDG PET in liver transplantation setting of hepatocellular carcinoma:predicting histology?[J].
Clinical Nuclear Medicine, 2016, 41 (3) : e126 –e129.
DOI: 10.1097/RLU.0000000000001040 ( 0) 0)
|
| [4] |
陈志丰, 王晓燕, 梁瑾瑜, 等. 18F-FDG PET/CT与超声造影在肝细胞癌复发判断中的对比研究[J].
中华核医学与分子影像杂志, 2014, 34 (2) : 91 –95.
DOI: 10.3760/cma.J.issn.2095-2848.2014.02.003 CHEN Zhifeng, WANG Xiaoyan, LIANG Jinyu, et al. Comparison of 18F-FDG PET/CT and contrast enhanced ultrasound for detection of hepatocellular carcinoma recurrence after therapy[J]. Chinese Journal of Nuclear Medicine and Molecular Imaging, 2014, 34 (2) : 91 –95. DOI: 10.3760/cma.J.issn.2095-2848.2014.02.003 (  0) 0)
|
| [5] |
Hamacher K, Coenen H H, Stocklin G, et al. Efficient stereospecific synthesis of no-carrier-added 2-[18F]-fluoro-2-deoxy-D-glucose using aminopolyether supported nucleophicic substitution[J].
The Journal of Nuclear Medicine, 1986, 27 (2) : 235 –238.
( 0) 0)
|
| [6] |
Meyer G J, Matzke K H, Hamacher K, et al. The stability of 2-[18F]fluoro-deoxy-D-glucose towards empimerisation under alkaline conditions[J].
Applied Radiation and Isotopes, 1999, 51 : 37 –41.
DOI: 10.1016/S0969-8043(98)00193-6 ( 0) 0)
|
| [7] |
Padgett H C, Schmidt D G, Luxen A, et al. Computer-controled radio-chemical synthesis:chemistry process control unit for automated production of radiochemicals[J].
Applied Radiation and Isotopes, 1989, 40 (5) : 433 –445.
DOI: 10.1002/jlcr.25802601201 ( 0) 0)
|
| [8] |
刘晓飞, 张锦明, 田嘉禾, 等. 固相柱水解和IC-H柱中和法制备18F-FDG及放射性损失分析[J].
国际药学研究杂志, 2008, 35 (1) : 1 –4.
DOI: 10.3969/j.issn.1674-0440.2008.01.001 LIU Xiaofei, ZHANG Jinming, TIAN Jiahe, et al. Preparation of 18F-FDG by hydrolysis on solid phase cartridge and neutralization with IC-H cartridge and analysis of the loss of radioactive nuclide[J]. International Journal of Pharmaceutical Research, 2008, 35 (1) : 1 –4. DOI: 10.3969/j.issn.1674-0440.2008.01.001 (  0) 0)
|
| [9] |
李云钢, 张晓军, 刘健, 等. 气相色谱法测量正电子放射性药物中有机溶剂残留及原因分析[J].
同位素, 2013, 26 (3) : 152 –157.
DOI: 10.7538/tws.2013.26.03.0152 LI Yungang, ZHANG Xiaojun, LIU Jian, et al. Analysis of residual solvents in PET radiopharmaceuticals by GC[J]. Journal of Isotopes, 2013, 26 (3) : 152 –157. DOI: 10.7538/tws.2013.26.03.0152 (  0) 0)
|
| [10] |
何山震, 王淑侠, 王朋, 等. 单管法酸水解合成18F-FDG中反应条件的探讨[J].
中山大学学报(医学科学版), 2009, 30 (3S) : 61 –63.
DOI: 10.3321/j.issn:1672-3554.2009.z1.016 HE Shanzhen, WANG Shuxia, WANG Peng, et al. Study of influence factors on preparing 18F-FDG by hydrolyzing with HCl in single vessel[J]. Journal of Sun Yat-sen University (Medical Sciences), 2009, 30 (3S) : 61 –63. DOI: 10.3321/j.issn:1672-3554.2009.z1.016 (  0) 0)
|
| [11] |
Walters L R, Martin K J, Jacobson M S, et al. Stability evaluation of 18F-FDG at high radioactive concentrations[J].
Journal of Nuclear Medicine Technology, 2012, 40 (1) : 52 –56.
DOI: 10.2967/jnmt.111.097287 ( 0) 0)
|


