2. 中国科学院大学 北京 100049
2. University of Chinese Academy of Sciences, Beijing 100049, China
熔盐堆燃料在线处理进行裂变产物分离是钍基熔盐反应堆(Thorium Molten Salt Reactor,TMSR)核能系统主要的研究内容之一[1]。Cs是核裂变的主要产物之一,在熔盐堆液态燃料内以CsF的化学形态存在,其物理化学性质与载体盐7LiF-BeF2相近,能稳定存在于燃料盐中[2]。Cs的同位素137Cs是核燃料233U裂变生成的重要核素,裂变产额可达约6.8%[3],137Cs半衰期长达30 a,是出堆燃料盐中主要的短寿命放射性毒物和热源。而另两种同位素135Cs和133Cs的中子俘获截面分别达到2.5×10-27 m2和1.27×10-26 m2,在堆内长期积累不利于反应堆的正常运行,是中子毒物。
在TMSR燃料在线处理流程概念设计中,提出了干法在线分离并循环经济价值高的物质(U和载体盐7LiF-BeF2)、离线分离233U(233Pa衰变得到)和Th的思路,在所设计的流程中选用氟化挥发技术用于铀的分离,减压蒸馏技术用于载体盐的分离和纯化[4]。减压蒸馏技术是利用载体盐与其他物质的挥发性差异实现载体盐的纯化。与氟化挥发技术相比,根本的差别在于减压蒸馏分离不需要通过任何化学反应,仅利用物质间物理化学性质的差异。在20世纪60-70年代,美国橡树岭国家实验室(Oak Ridge National Laboratory,ORNL)在发展熔钍基盐增殖堆(Molten Salt Breeder Reactor,MSBR)时,也提出采用减压蒸馏净化和回收载体盐的方案,并用熔盐实验反应堆(Molten Salt Reactor Experiment,MSRE)的真实燃料盐进行了减压蒸馏分离裂变产物并回收载体盐的试验,所回收的载体盐中稀土裂变产物的去污系数超过102,验证了该方法的可行性[5, 6]。但研究也表明熔盐减压蒸馏分离稀土类裂变产物所需温度高达1000℃,该温度下CsF会和载体盐一起被蒸馏收集并回收,无法实现载体盐中CsF的分离和去除[7]。
20世纪90年代,美国阿贡国家实验室(Argonne National Laboratory,ANL)用电化学的方法对MSRE的乏燃料盐进行分离研究,发现最困难的是分离与载体盐中Li和Be同族的Cs和Sr,并提出利用BeF2、LiF和CsF在高温下的挥发性差异,可行的分离方法还是蒸馏[8]。在一定的温度范围内,CsF的饱和蒸气压比载体盐组分LiF和BeF2的饱和蒸汽压略高,700℃时CsF的饱和蒸汽压为100 Pa,而FLiBe(LiF-BeF2摩尔比66%-34%)共晶盐的蒸汽压小于10 Pa[9]。这些研究数据表明,通过控制蒸馏条件(温度和压力等),可以从载体盐中分离CsF。同时,ORNL也利用Li金属在氟盐体系中极强的还原性还原并分离Cs[10, 11],在金属还原萃取实验中采用Li金属将CsF还原成金属Cs并用液态Bi金属将Cs从氟盐中萃取出来,获得了较好的结果,但金属还原萃取存在熔盐中Bi夹带的问题,在Cs得到分离时会引入另一杂质Bi。
本工作采用与熔盐堆载体盐FLiBe物化性质相近的FLiNaK(LiF-NaF-KF摩尔比46.5%-11.5%- 42%)共晶盐,研究了CsF在减压蒸馏条件下的蒸发行为和分离率。同时利用金属还原产物Cs较低的沸点和在高温下具有高挥发性,用金属Li直接还原蒸发的方式替代金属还原萃取法进行CsF与载体盐分离的可行性研究。
1 实验部分 1.1 试剂与仪器试剂:LiF,纯度99.99%,上海中锂实业公司;NaF,成都西亚试剂公司;KF,纯度99.99%,黄河精细化工有限公司;CsF,纯度99.99%,Sigma-Aldrich;Li(颗粒,4-10目),纯度99%,Sigma-Aldrich;氩气,纯度99.999%,上海娄氧气体罐装有限公司。
仪器:Optima 8000电感耦合等离子体原子发射光谱仪(Inductively Coupled Plasma Atomic Emission Spectroscopy,ICP-AES),美国PerkinElmer公司;NexION 300 D电感耦合等离子体质谱仪(Inductively Coupled Plasma Mass Spectrometry,ICP-MS),美国PerkinElmer公司;X射线多晶衍射仪(X-ray diffraction,XRD;X' Pert Pro MPD),荷兰帕纳科公司。
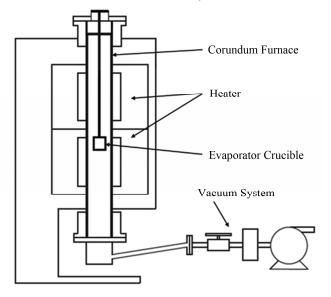
1.2 实验装置减压蒸馏装置采用立式真空管式炉(图 1)[12],由刚玉材质炉膛、蒸发坩埚、加热器、数字压力传感器和真空系统组成,蒸发坩埚截面积为3.8 cm2。还原蒸发实验在与氩气气氛覆盖的手套箱相连的电加热炉中进行,炉膛内和手套箱内的水和氧气含量均小于0.1 mg·m-3,炉内压力为1.01×105 Pa。所有实验实际温度均用数显热电偶进行了温度校正,温度误差±3℃。
|
图 1 立式真空管式炉的结构示意图 Fig.1 Schematic diagram of a vertical vacuum tubular furnace. |
将LiF、NaF、KF在真空干燥箱中300-400℃下干燥4 h除水,然后按LiF-NaF-KF为46.5%- 11.5%-42%的比例称重,添加质量比为10%-15%的高纯氟化氢铵(经重结晶提纯后含量≥99.9%),密封、混匀。转移至真空熔炼炉中高真空除水2 h,充高纯N2(含量为99.999%)至常压,程序升温:室温至300℃,升温时间为1 h;300-450℃,升温时间为2 h;450-750℃,升温时间为1 h;750℃ 保温时间为2-3 h。冷却至600℃左右,倒料至连接的熔盐储罐中冷却至室温[13]。取块状熔盐,在手套箱内研磨备用。
1.4 FLiNaK-CsF熔盐的制备将FLiNaK熔盐粉末和CsF按照质量比99:1称量,并机械混合均匀,称量和混合过程均在手套箱中进行。将混合均匀的熔盐粉末置于加热炉内的纯镍坩埚中,以10℃·min-1升温至570℃,保温5 h,自然冷却至室温。对冷却盐的不同部位取样,进行均匀性分析,确保CsF在本体盐中分布的均匀性。将冷却后的盐在手套箱内粉碎并研磨后作为后续实验的原料盐。
1.5 减压蒸馏实验在氩气气氛的手套箱内称取10 g FLiNaK-CsF粉末于蒸发坩埚内,坩埚置于蒸发炉中,密封后抽真空至压力为(5±2) Pa,在200℃下除去炉膛内的水汽,升至530℃并保温1 h使熔盐充分熔融,再升至实验温度(分别为645℃、690℃、740℃、780℃),在实验温度下蒸发30 min,实验结束后继续抽真空,自然冷却,粉碎后取样分析。
1.6 金属还原蒸发实验在氩气气氛的手套箱内称取10 g FLiNaK-CsF粉末盐和0-0.5 g的金属Li颗粒,将两者混合于镍质坩埚中,置于氩气气氛的电阻炉炉膛中,以10℃·min-1升温至700℃,保温3 h,实验结束后自然冷却至室温,粉碎后取样分析。
1.7 样品分析样品中的Cs采用ICP-MS分析,Li、Na、K采用ICP-AES分析。每次实验后将整体熔盐粉碎成粉末,准确称量3-4份熔盐粉末平行样,用浓HNO3在190℃溶解30 min,用去离子水稀释至相应浓度进行测试,实验结果为平行样测试结果的平均值。熔盐样品整体蒸发量由实验前后熔盐质量差获得。
CsF蒸发比例的计算公式为:
| $\Psi = \frac{{{m_{\rm{0}}} - m'}}{{{m_0}}} \times 100\% $ | (1) |
式中:m0为实验前熔盐中CsF的质量;m'为实验后熔盐中CsF的质量。还原蒸发实验中Cs的蒸发比例计算公式同式(1),所用质量以元素Cs计。
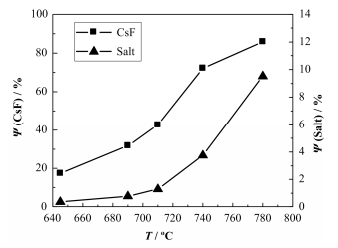
2 结果与讨论 2.1 减压蒸馏实验研究了不同温度(645℃、690℃、740℃、780℃)和5 Pa的真空度下CsF的蒸发行为,得到了CsF和熔盐本体在不同温度下的蒸发比例(图 2)。
|
图 2 CsF和熔盐的蒸发比例随温度的变化曲线 Fig.2 Evaporation ratios of CsF and molten salts at different temperature. |
从图 2可知,温度条件对CsF的蒸发有较大的影响,随着温度的升高,CsF的蒸发比例呈线性上升趋势,780℃下蒸馏30 min,熔盐中CsF的含量由1%降到0.14%,FLiNaK本体盐随温度也有不同程度的蒸发。当蒸发温度升高时,熔盐本体的蒸发量升高,在710℃以前,载体盐蒸发率增加平缓,在710℃以后蒸发率增加显著,熔盐蒸发比例从710℃时的1.3%增加至780℃时的9.5%。在现有实验条件下,馏分较难收集,我们对实验前后坩埚中的熔盐进行Li、Na和K元素含量分析,获得蒸发前后熔盐中Li、Na、K的含量,所蒸发掉盐中的三个元素的含量即为两者的差值,分析和计算结果如表 1所示,表明蒸发盐中Li、Na、K、Cs元素的质量比约为1:1:18:2.6,在此实验条件下以KF蒸发为主。
| 表 1 780℃、5 Pa条件下蒸馏30 min前后的熔盐组分 Table 1 Molten salt components before and after distillation under the condition of 780℃, 5 Pa. |
Choi等根据20世纪70年代Chao[14]得出的碱金属氟化物蒸发的热力学数据,计算出FLiNaK在各纯组分熔点以下温度时各组分的分压关系[15],得出在500-1000℃,在FLiNaK(组分摩尔比为46.5%LiF-11.5%NaF-42%KF)中,KF的分压比LiF和NaF的分压明显要高,即KF的蒸发比例比LiF和NaF要高,实验结果也表明,在蒸发出来的馏分中三者的摩尔比约为3.3:1:10.4,KF在该实验条件下最容易蒸发。
从本实验得到的CsF和FLiNaK随温度变化时各自的蒸发比例来看,通过减压蒸馏能有效降低熔盐中CsF的含量,但同时存在分离率和熔盐损失率的平衡问题。美国ORNL的Hightower等[16]提出的MSBR燃料盐在线处理流程概念设计中,选用减压蒸馏来回收和纯化载体盐(LiF-BeF2),其实验研究表明在该减压蒸馏(1000℃)条件下CsF会随载体盐FLiBe一并被分离,表 2数据也表明,在此温度下CsF与BeF2的蒸汽压相当。基于CsF积累会影响反应堆经济性的考虑,他们建议对减压蒸馏分两段进行:第一段为CsF分离,通过控制分离温度和压力,使大部分CsF从载体盐中分离除去,同时保证载体盐的损失量尽量小;第二段实施载体盐的蒸发净化回收。但由于美国熔盐反应堆工程停止,CsF的分离研究也被搁置。
| 表 2 700℃和1000℃下熔盐的蒸汽压[7, 15, 17] Table 2 Vapor pressure of molten salts at 700℃ and 1000℃[7, 15, 17] |
需要指出的是,在一定的温度范围内,CsF的蒸汽压虽大于熔盐堆载体盐的主要成分BeF2,但两者蒸汽压之比小于CsF和FLiNaK之比。如在780℃、5 Pa的实验条件下,FLiNaK的蒸发量约为CsF的10倍,这表明即使在BeF2和CsF蒸汽压相差最大的温度下实施减压蒸馏分离,因体系中BeF2的浓度远大于CsF,会有较大量的BeF2随CsF一并分离。
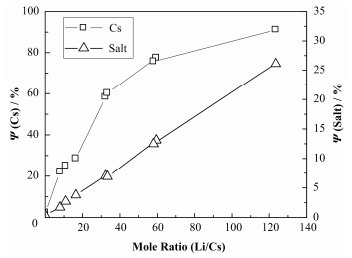
2.2 金属还原蒸发实验金属还原蒸发分离利用金属Li对Cs离子的还原作用和金属Cs的低沸点(678℃)实现对CsF的分离。本工作研究了700℃时不同还原剂用量下CsF从FLiNaK熔盐体系分离的情况。图 3显示了随着所添加Li和熔盐中Cs的摩尔比的增加,Cs的蒸发比例的变化。
|
图 3 不同Li/Cs摩尔比下Cs和熔盐的蒸发比例 Fig.3 Evaporation ratios of CsF and molten salt at different mole ratios of Li/Cs. |
从图 3可知,在不添加Li的实验中,700℃下蒸发3 h,Cs的蒸发比例仅为2%左右;随着金属Li加入量的增加,Cs的蒸发比例明显增加,当Li/Cs=11:1时,Cs的蒸发比例达到25%,33:1时达到60%,金属Li的添加提高了CsF分离率。在加入金属Li后,700℃下,熔盐中发生了如下反应:
| ${\rm{Li(l) + CsF(l)}} \to {\rm{LiF(l) + Cs(g)}} \uparrow $ | (2) |
众所周知,金属Cs的熔点较低,仅有28.4℃,沸点也仅有678℃,在该条件下,由于金属Cs蒸汽的不断蒸发,促使反应不断向右进行。
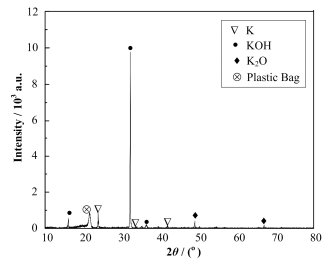
对实验后所剩的熔盐进行称量,得出不同Li用量下熔盐质量的变化,如图 3所示,随着Li用量的增加,熔盐的蒸发比例线性增加,并在实验过程中发现有大量金属光泽的产物蒸出,在室温下呈液态,如图 4所示。由于选择的本体盐为FLiNaK共晶盐,其中Na和K的含量远大于Cs,金属Li极可能将Na和K还原成金属并蒸发出来。为证实上述的推测,我们取少量蒸出冷凝产物涂在载玻片上,置于塑封袋中进行XRD分析,分析结果如图 5所示,蒸出产物主要的组成为KOH、K2O和金属K。

|
图 4 还原蒸发蒸出产物实物图 Fig.4 Picture of the products after reducing evaporation. |
|
图 5 金属还原蒸发蒸出产物的XRD图 Fig.5 XRD analysis of the products after reducing evaporation. |
KOH、K2O的存在是由于金属K非常活泼,在XRD测试过程中发生了氧化反应。又将少量冷凝产物溶于稀硝酸中,通过ICP-AES分析Li、Na、K的含量,结果显示Li、Na、K的摩尔比为1:45:640,说明蒸出产物的主要元素为K,只有极少量的Li。通过以上现象和测试结果,推测蒸出冷凝的金属为低熔点钾钠合金。
虽然KF和NaF大量消耗了金属Li,但式(2)的发生确实促进了Cs的蒸发,Li金属还原蒸发分离CsF的方法在提高CsF分离效率的同时,由于反应在低温常压下进行,避免了本体盐的挥发。在FLiNaK中,Na和K很容易被Li还原蒸发,而真实的熔盐堆载体盐FLiBe中Be2+相对稳定,不会产生如同FLiNaK体系的情况,还原剂的用量会大大减少,载体盐的损失也会降低。
3 结语Cs作为碱金属,其氟化物的物理化学性质与熔盐堆载体盐主要成分LiF极为相近,在熔盐堆燃料干法处理流程中具有区别于钍铀及其它裂变产物的化学行为。本工作研究了减压蒸馏和金属Li还原对CsF-FLiNaK熔盐体系中CsF的蒸发行为和分离的可能性研究。研究结果表明,减压蒸馏能有效从熔盐体系中分离CsF,在5 Pa蒸馏压力下 CsF分离率达86%,但此时本体盐的蒸发量达9.5%,存在载体盐蒸发损失的问题,在这种情况下需要考虑对随CsF蒸发的熔盐进行再处理,以回收利用尽可能多的载体盐。金属还原蒸发实验中,CsF的分离率随还原剂Li的添加量而提高,本工作研究中获得91%的分离率。还原蒸发的方式仅在常压、较低温度下便可进行,是可以在保证载体熔盐回收率的同时提高Cs的去污的一种方法,但该方法最大的技术挑战之一是所蒸发的金属Cs的截留和收集。
| 1 | 江绵恒, 徐洪杰, 戴志敏. 未来先进核裂变能——TMSR 核能系统[J]. 中国科学院院刊, 2012, 27(3):365-374. DOI:10.3969/j.issn.1000-3045.2012.03.016 JIA Mianheng, XU Hongjie, DAI Zhimin. Advanced fission energy program-TMSR nuclear energy system[J]. Bulletin of Chinese Academy of Sciences, 2012, 27(3):365-374. DOI:10.3969/j.issn.1000-3045.2012.03.016( 1) 1) |
| 2 | Campbell D O, Cathers G I. Processing of molten salt power reactor fuels[J]. Industrial & Engineering Chemistry, 1960, 52(1):41-44. DOI:10.1021/ie50601a034( 1) 1) |
| 3 | 林灿生. 裂变产物元素过程化学[M]. 北京:中国原子能出版社, 2012:295 LIN Cansheng. Process chemistry of fission products[M]. Beijing:China Atomic Energy Press, 2012:295( 1) 1) |
| 4 | 李晴暖. 钍基熔盐堆核能系统的放射化学[C]. 中国化学会第29 届学术年会, 北京, 2014 LI Qingnuan. Radiochemistry of TMSR[C]. The twenty-ninth annual meeting of the Chinese Chemical Society, Beijing, 2014( 1) 1) |
| 5 | Scott C D, Carter W L. Preliminary design study of a continuous fluorination-vacuum distillation system for regenerating fuel and fertile streams in a molten salt breeder reactor[R]. ORNL-3791, Tennessee, USA:Oak Ridge National Laboratory, 1966( 1) 1) |
| 6 | Rosenthal M W, Haubenreich P N, Briggs R B. The development status of molten-salt breeder reactors[R]. ORNL-4812, Tennessee, USA:Oak Ridge National Laboratory, 1972( 1) 1) |
| 7 | Hightower J R. Relative volatilities of fluorides of Ce, La, Pr, Nd, Sm, Eu, Ba, Sr, Y and Zr in molten mixtures of LiF and BeF2 at 1 000℃[J]. Journal of Chemical and Engineering Data, 1972, 17(3):342-343. DOI:10.1021/je60054a022( 3) 3) |
| 8 | Ingersoll D T, Forsberg C W, Ott L J, et al. Status of pre-conceptual design of the advanced high-temperature reactor (AHTR)[M]. United States:Department of Energy, 2004( 1) 1) |
| 9 | Olander D R, Fukuda G T, Baes Jr C F.Equilibrium pressures over BeF2/LiF (FLiBe) molten mixtures[J]. Fusion Science and Technology, 2002, 41(2):141-150( 1) 1) |
| 10 | Rosenthal M W. Molten salt reactor program semiannual progress report for the period[R]. ORNL-4548, Tennessee, USA:Oak Ridge National Laboratory, 1970:3( 1) 1) |
| 11 | Perry A M. Molten salt reactor program semiannual progress report for the period[R]. ORNL-4676, Tennessee, USA:Oak Ridge National Laboratory, 1971:8( 1) 1) |
| 12 | 窦强, 付海英, 杨洋, 等. 温度与气压对LiF 蒸发速率的影响[J]. 核化学与放射化学, 2014, 36(6):357-362. DOI:10.7538/hhx.2014.36.06.0357 DOU Qiang, FU Haiying, YANG Yang, et al. Distillation behaviors of LiF salt under different pressures and evaporation temperatures[J]. Journal of Nuclear and Radiochemistry, 2014, 36(6):357-362. DOI:10.7538/hhx. 2014.36.06.0357( 1) 1) |
| 13 | 宗国强, 陈博, 张龙, 等. FLiNaK 熔盐的制备[J]. 核技术, 2014, 37(5):050604. DOI:10.11889/j.0253-3219. 2014.hjs.37.050604 ZONG Guoqiang, CHEN Bo, ZHANG Long, et al. Preparation of FLiNaK molten salt[J]. Nuclear Techniques, 2014, 37(5):050604. DOI:10.11889/j.0253-3219.2014. hjs.37.050604( 1) 1) |
| 14 | Chao J. Thermodynamics of vaporization of alkali fluorides[J]. Thermochimica Acta, 1970, 1(1):71-86. DOI:10.1016/0040-6031(70)85031-6( 1) 1) |
| 15 | Choi Y S, Park H J, Lho T. Evaporation properties of FLiNaK with plasma interaction[J]. Fusion Science and Technology, 2013, 63(1T):221-224( 3) 3) |
| 16 | Hightower Jr J R, NcNeese L E. Low-pressure distillation of molten mixtures of lithium fluoride, beryllium fluoride, and zirconium fluoride for removal of rare-earth fission products[J]. Industrial & Engineering Chemistry Process Design and Development, 1973, 12(3):232-236. DOI:10.1021/i260047a004( 1) 1) |
| 17 | Yaws C L. Handbook of vapor pressure:inorganic compounds and elements[M]. Vol 4. Gulf Professional Publishing, 1995( 3) 3) |


