2. 中国科学院大学 北京 100049
2. University of Chinese Academy of Sciences, Beijing 100049, China
水土砷污染对环境和人类健康造成了严重的危害,是世界性的环境问题[1-3]。自然环境中的As主要来源于人为砷排放与自然砷释放,水体中砷的自然释放过程主要是Fe、Mn氧化物上的As的解吸和含砷矿物的氧化溶解[4-5]。自然界中的含As矿物主要有毒砂、雄黄、雌黄以及含As黄铁矿等。毒砂和含砷黄铁矿的氧化溶解,产生大量的高浓度含As酸性废水[6-8]。导致大量的As排放到水体中[9-13]。对生态环境造成了严重的危害,如西班牙中部和中国卡林型金矿,由于毒砂和含砷黄铁矿的氧化溶解导致非常严重的地下水As污染[14]。
温度、pH、溶解氧(Dissolved Oxygen,DO)、Fe(Ⅲ)浓度、微生物等是影响毒砂氧化溶解的主要因素[15-18],前人主要研究了pH、颗粒大小的影响[19-20],以及液相化学或是利用X射线光电子能谱分析(X-ray Photoelectron Spectroscopy,XPS)来进行毒砂的表面光谱学研究[20-22]。而对毒砂氧化过程及As、Fe的最终形态及分配研究很少。
前期毒砂氧化溶解研究认为,在不同的实验参数和有限的实验条件下,毒砂的氧化动力学研究中,一些基础过程的结论仍存在分歧[23-24]。例如:毒砂表面S的形成、化学计量溶解、氧化速率的变化、氧化速率与DO之间的相关性以及出现不规则的速率与Arrhenius的行为。
本文主要研究了在不同的氧化条件(pH、DO)下,毒砂的氧化动力学。分析了中碱性条件下,Fe氧化物沉淀对毒砂氧化溶解的影响,并采用X射线吸收精细结构(X-ray Absorption Fine Structure,XAFS)分析了毒砂氧化溶解过程中As的形态转化。研究的结果可为含砷矿物的氧化溶解导致的As释放而引起的环境危害提供一定的理论依据。
1 材料与方法 1.1 毒砂的制备将块状毒砂经过研磨后过100目筛,乙醇中洗涤10 min,之后用超声清洗三次,每次1 min,去除晶体表面的细小颗粒,最后用去离子水清洗三次,丙酮清洗两次,晾干后储存于干燥器中待用。
1.2 毒砂的氧化实验毒砂氧化实验使用生物反应器Fermac320(英国Electrolab),可自动记录并精确控制pH、DO、温度。实验时,称量0.8 g毒砂粉末放入反应器中,加入3.5 L的蒸馏水,以3.3 g∙L-1的KCl作为电解质,调节不同的反应参数(pH、DO)进行实验。分别进行了pH=4、7、9实验,每组pH实验进行4 d,每天的取样时间为0 h、2 h、4 h、6 h、8 h、10 h、12 h、 14 h、24 h。通入空气和氮气调DO,每24 h调节一次,该仪器通过气体百分比控制体系中的DO,调至90% DO、70% DO、50% DO、30% DO,DO浓度分别为7.3 mg∙L-1、5.8 mg∙L-1、4.2 mg∙L-1、2.5 mg∙L-1。体系温度保持在25 ℃,转速为400 r∙min-1。pH计与DO电极采用标准方法定期校正。
每个取样点取样两次,每次取5 mL样品经过0.22 μm滤膜过滤,测定液相中As、Fe含量。另取1 mL样品,加入1 mL HCl (1 mol∙L-1)溶解无定型铁氧化物,0.5 h后用0.22 μm滤膜过滤后,测定溶液中的As、Fe含量。
1.3 砷、铁的分析方法砷含量测定:采用原子荧光光度计分析液相中As(T)和As(Ⅲ)的含量,仪器检测线为0.01 μg L-1,分析精度为±5%。
As(T)浓度测定时,预先向样品中加入1 mL还原剂(5%硫脲和5%抗坏血酸的混合液),用5% HCl定容至5 mL,放置至少6 h后,泵入原子荧光光谱仪测定,以5% HCl作为载液,硼氢化钾溶液(0.03% NaOH和2%硼氢化钾的混合液)作为还原剂[25]。
As(Ⅲ)浓度测定时,直接用柠檬酸-柠檬酸三纳缓冲液(pH约为5)定容,泵入原子荧光光谱仪测定,柠檬酸-柠檬酸三纳缓冲液作为载液,硼氢化钾溶液作为还原剂[26]。
铁含量测定:将待测样品用1% HNO3溶液稀释后,采用原子吸收分光光度计(AA240,美国Varian)测定,检出限为0.1 mg∙L-1。
1.4 X射线衍射分析X射线衍射分析(X-ray Diffraction Analysis,XRD)谱图在D/MAX 2400型X射线衍射仪上测定。实验采用Cu Kα射线(λ=0.5418 nm),石墨单色器,工作电压56 kV,工作电流182 mA,发散狭缝1°,接受狭缝1°,室温下收集10°-90° (2θ)衍射数据。
1.5 同步辐射表征As的K边XAFS光谱在北京同步辐射装置XAFS站获得。测样时,将毒砂氧化前后的固体粉末样品均匀地涂在Kapton胶带上,固定在样品架上,室温下采集,As的K吸收边能量为11867 eV,XAFS光谱能量采集范围11667-12667 eV,X射线吸收近边结构( X-ray Absorption Near Edge Structure,XANES)光谱段的步长为0.5 eV,高浓度样品采用透射模式测定,低浓度样品采用荧光模式测定,每个样品重复扫描三次。As标准物为砷酸钠(Na3AsO4∙12H2O)、亚砷酸钠(Na3AsO3)、硫代亚砷酸钠(Na3AsO2S)、硫代砷酸钠(Na3AsO3S)、雌黄(As2S3)、雄黄(AsS)和毒砂(FeAsS)。XAFS光谱数据的线性拟合(Linear Combination of Fits,LCF)采用(D)Athena(5.12.3)进行分析。
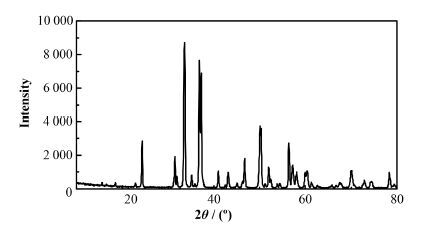
2 结果与分析 2.1 固体表征XRD结果如图 1所示。实验所采用的样品的主要矿物形式为FeAsS (PDF#85-1723)。样品比表面积和平均孔径分别为1.64 m2∙g-1和1.63 nm。
|
图 1 毒砂的XRD表征 Figure 1 XRD pattern of FeAsS. |
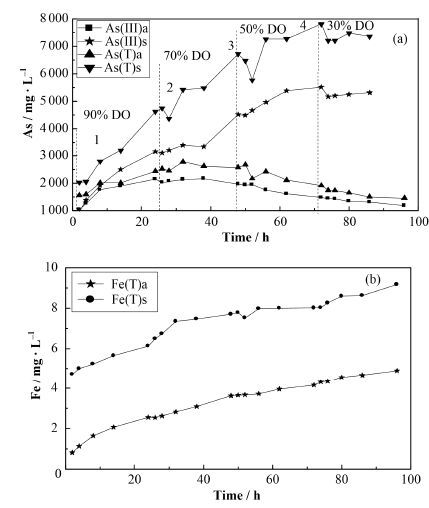
如图 2所示,pH=4时,毒砂表面的细小颗粒首先被氧化[27],导致体系盐酸可提取态的As、Fe的起始值约为2 mg∙L-1和5 mg∙L-1。在90% DO时,As和Fe的释放量都随时间增加;在70% DO阶段,As(T)和Fe(T)释放量呈增加趋势,而As(Ⅲ)在固相和液相中已达到平衡;50% DO和30% DO阶段,毒砂氧化过程中固液相As(Ⅲ)含量逐渐降低,而As(T)和Fe(T)含量逐渐增加。图 2中As(Ⅲ)a、As(T)a、Fe(T)a分别代表液相中As(Ⅲ)含量、总砷含量、总铁含量(mg∙L-1),As(Ⅲ)s、As(T)s、Fe(T)s代表固相中盐酸可提取As(Ⅲ)含量、总砷含量、总铁含量(mg∙kg-1)。
如图 2(a)所示,由于在每个DO转换点上,毒砂氧化释放的As含量短时间内先下降后上升,而液相中As没有出现类似现象,说明固相中盐酸可提取态As含量降低导致As(T)暂时降低。这可能是由于DO交换点,Eh值突然下降,使得毒砂释放S2-,与As反应形成AsS或As2S3沉淀,而AsS、As2S3不溶于HCl,因此造成盐酸可提取As含量降低,但随着Eh逐渐增加,AsS、As2S3被氧化,盐酸可提取态砷含量迅速增加,发生的反应如下:
AsS+2.25O2+2.5H2O=H3AsO3+SO42-+2H+[28]
2As2S3+7.5O2+9H2O=4H3AsO3+3H2SO4+3S0[29]
之后As(Ⅲ)再被O2氧化:
H3AsO3+0.5O2=HAsO42-+2H+
由图 2(b)中固相和液相Fe(T)的差值可知,在pH=4时,毒砂氧化过程中形成了少量的Fe的氧化物沉淀,但并没对As的释放造成影响。
|
图 2 pH=4毒砂氧化过程中液相与盐酸可提取As (a)和Fe (b)的含量变化 Figure 2 Variation of the aqueous and HCl extractable As (a) and Fe (b) concentration at pH=4. |
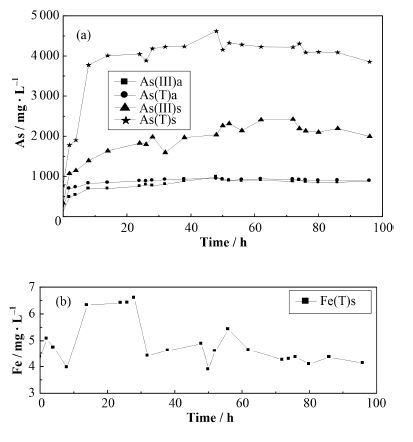
pH=7时,DO的调节时间与pH=4时相同。实验期间,DO波动的相对偏差小于5%,pH的范围在6.7-7.2,实验过程中氮气和空气的交替通入会导致Eh突然降低后升高,Eh在-75-25 mV内变化。
如图 3所示,在90% DO阶段,在反应初8 h内,盐酸可提取态的As(Ⅲ)和As(T)含量快速增加,从约0.2 mg∙L-1和1 mg∙L-1迅速增加到1.1 mg∙L-1和3.8 mg∙L-1。随后盐酸可提取态的As(Ⅲ)呈缓慢升高趋势,而盐酸可提取的As(T)、液相As(T)和As(Ⅲ)则几乎达到平衡。
|
图 3 pH=7毒砂氧化过程中液相与盐酸可提取As (a)和Fe (b)的含量变化 Figure 3 Variation of the aqueous and HCl extractable As (a) and Fe (b) concentration at pH=7. |
与酸性条件下(pH=4)的变化类似,在DO切换点,中性条件下盐酸可提取的As(T)含量也有所降低,但降低幅度小于酸性条件,表明在毒砂表面可能形成了As的硫化物沉淀,但AsS和As2S3在酸性条件下较为稳定,而在中碱性条件下不稳定,因此产生量会低于酸性条件。
从毒砂的氧化比例看,中性条件下毒砂的氧化量低于酸性条件,这也是盐酸可提取态As(T)降低幅度较小的原因。中性条件下,毒砂反应释放的Fe(Ⅱ)很快被氧化为Fe(Ⅲ)并形成Fe氧化物沉淀,所以测得液相中Fe(T)的含量低于仪器的检测限,固相中Fe(T)也在24 h内迅速升高,之后在4-6.8mg∙L-1内波动。
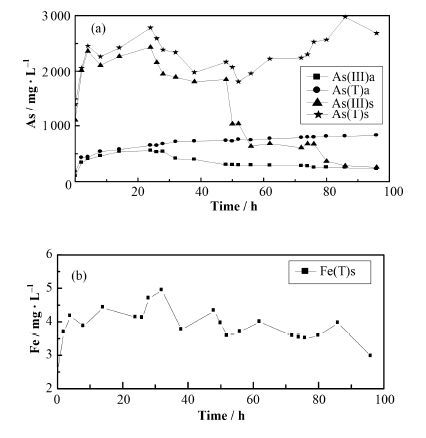
2.4 碱性条件下毒砂的氧化溶解pH=9实验中,DO切换时间与pH为4、7相同,且可较为精确地控制,pH的变化范围在8.9-9.1,Eh在-30-46 mV内变化。碱性条件下(pH=9),毒砂氧化释放的Fe完全氧化生成Fe的氧化物沉淀,此时液相中Fe(T)的含量低于仪器检测限。
如图 4所示,毒砂在碱性条件下生成的Fe氧化物沉淀最大值为5 mg∙L-1,比pH=7小,反应过程中Fe的变化不大。在90% DO阶段,固相和液相中的As(Ⅲ)和As(T)在氧化初期的5 h内随时间迅速增加并达到一个平台。当DO降至70%时,盐酸可提取态As(Ⅲ)和As(T)以及液相As(Ⅲ)含量开始降低。在50% DO-30% DO中,液相As(Ⅲ)和As(T)都逐渐达到平衡,固相中的As(Ⅲ)出现大幅度降低,As(T)开始升高,大量的As(Ⅲ)被氧化生成As(V)。
|
图 4 pH=9毒砂氧化过程中液相与盐酸可提取As (a)和Fe (b)的含量变化 Figure 4 Variation of the aqueous and HCl extractable As (a) and Fe (b) concentration at pH=9. |
不同pH条件毒砂氧化释放的As形态以及固相和液相之间的分配不同。pH=4时,没有形成过多的Fe的氧化物沉淀,对As的释放几乎没有影响,As和Fe按照化学计量释放。
与前人研究[16, 19, 30]得到的酸性条件下毒砂的氧化机制相同,按照下列反应方程式:
4FeAsS+11O2+6H2O=4Fe2++H3AsO3+4H2SO42-
然后H3AsO3氧化成HAsO42-和H2AsO4-:
2H3AsO3+O2=2HAsO42-+4H+
2H3AsO3+O2=2H2AsO4-+2H+
pH=4时,固相和液相中As(T)、Fe(T)含量相差很少,说明铁氧化物吸附的As较少;pH=7时,毒砂氧化快速达到了平衡,释放的Fe完全转化生成铁氧化物。液相中As(Ⅲ)和As(T)含量几乎相同,说明毒砂氧化释放出的As均为As(Ⅲ)。固相中的As(Ⅲ)比液相多,所以部分的As(Ⅲ)被铁氧化物吸附,同时吸附的As(Ⅲ)被氧化为As(V)。pH=9时,固相和液相As的差值表明铁氧化物沉淀吸附了大量的As,48 h后固相中出现As(Ⅲ)和As(T)的较大差值,表明了吸附在铁氧化物上的As(Ⅲ)被氧化为As(V)。
如图 5和表 1所示,pH=9时,毒砂几乎不发生氧化,表面只存在少量的硫代亚砷。pH=7时,毒砂氧化强度不大,毒砂氧化释放的As(Ⅲ)被氧化过程形成的铁氧化物吸附,表面存在少量的类似雄黄(AsS)的物质。而pH=4,从图 5可以明显看出,有As(V)生成,发生较强的氧化反应,同时生成的铁氧化物吸附了As(V),与pH=7相比,表面形成了较多类似雄黄的物质,这就与前面pH=4实验中,在DO 转换点上出现As突然下降的现象吻合,是形成了类似雄黄的物质导致的。

|
图 5 氧化毒砂反应产物的同步辐射表征与线性拟合 Figure 5 Linear combination fitting of XANES spectra of oxidized arsenopyrite. |
| 表 1 毒砂氧化反应产物的As K边XANES的LCF拟合结果 Table 1 Products of arsenopyrite oxidization deduced from LCF results of As K-edge spectra. |
毒砂的氧化溶解是环境As污染的重要来源之一,而pH是影响毒砂氧化的重要因素。酸性条件下,毒砂易发生较强烈的氧化反应,导致大量As释放到液相中;中碱性条件下,毒砂反应释放出的Fe快速形成了Fe的氧化物沉淀,包裹在毒砂的表面,阻碍毒砂继续氧化。酸性条件下毒砂的氧化,产物倾向于进入液相中,因此采矿过程中产生的高浓度的酸性矿山废水,可导致大量砷进入土壤、地表或地下水体,从而对生态环境造成严重危害。
| [1] |
Aposhian H V, Zakharyan R A, Avram M D, et al. A review of the enzymology of arsenic metabolism and a new potential role of hydrogen peroxide in the detoxication of the trivalent arsenic species[J].
Toxicology & Applied Pharmacology, 2004, 198 (3) : 327 –335.
( 0) 0)
|
| [2] |
Bunnell J E, Finkelman R B, Centeno J A, et al. Medical geology:a globally emerging discipline[J].
Geologica Acta, 2007, 5 (3) : 273 –281.
( 0) 0)
|
| [3] |
Rossman T G, Uddin A N, Burns F J. Evidence that arsenite acts as a cocarcinogen in skin cancer[J].
Toxicology and Applied Pharmacology, 2004, 198 (3) : 394 –404.
DOI: 10.1016/j.taap.2003.10.016 ( 0) 0)
|
| [4] |
Casiot C, Leblanc M, Bruneel O, et al. Geochemical processes controlling the formation of As-rich waters within a tailings impoundment (Carnoules, France)[J].
Aquatic Geochemistry, 2003, 9 (4) : 273 –290.
DOI: 10.1023/B:AQUA.0000028985.07557.39 ( 0) 0)
|
| [5] |
Pfeifer H R, Haussermann A, Lavanchy J C, et al. Distribution and behavior of arsenic in soils and waters in the vicinity of the former gold-arsenic mine of Salanfe, Western Switzerland[J].
Journal of Geochemical Exploration, 2007, 93 (3) : 121 –134.
DOI: 10.1016/j.gexplo.2007.01.001 ( 0) 0)
|
| [6] |
Acero P, Ayora C, Torrento C, et al. The behavior of trace elements during schwertmannite precipitation and subsequent transformation into goethite and jarosite[J].
Geochimica Et Cosmochimica Acta, 2006, 70 (16) : 4130 –4139.
DOI: 10.1016/j.gca.2006.06.1367 ( 0) 0)
|
| [7] |
Asta M P, Cama J, Ayora C, et al. Arsenopyrite dissolution rates in O-2-bearing solutions[J].
Chemical Geology, 2010, 273 (3-4) : 272 –285.
DOI: 10.1016/j.chemgeo.2010.03.002 ( 0) 0)
|
| [8] |
Sanchez-Rodas D, Gomez-Ariza J L, Giraldez I, et al. Arsenic speciation in river and estuarine waters from southwest Spain[J].
Science of the Total Environment, 2005, 345 (1-3) : 207 –217.
DOI: 10.1016/j.scitotenv.2004.10.029 ( 0) 0)
|
| [9] |
Frau F, Ardau C. Geochemical controls on arsenic distribution in the Baccu Locci stream catchment (Sardinia, Italy) affected by past mining[J].
Applied Geochemistry, 2003, 18 (9) : 1373 –1386.
DOI: 10.1016/S0883-2927(03)00057-X ( 0) 0)
|
| [10] |
Lazareva E V, Shuvaeva O V, Tsimbalist V G. Arsenic speciation in the tailings impoundment of a gold recovery plant in Siberia[J].
Geochemistry Exploration Environment Analysis, 2002, 2 (3) : 263 –268.
DOI: 10.1144/1467-787302-030 ( 0) 0)
|
| [11] |
Lee P, Kang M J, Choi S H, et al. Sulfide oxidation and the natural attenuation of arsenic and trace metals in the waste rocks of the abandoned Seobo tungsten mine, Korea[J].
Applied Geochemistry, 2005, 20 (9) : 1687 –1703.
DOI: 10.1016/j.apgeochem.2005.04.017 ( 0) 0)
|
| [12] |
Smedley P L, Kinniburgh D G. A review of the source, behaviour and distribution of arsenic in natural waters[J].
Applied Geochemistry, 2002, 17 (5) : 517 –568.
DOI: 10.1016/S0883-2927(02)00018-5 ( 0) 0)
|
| [13] |
Williams M. Arsenic in mine waters:an international study[J].
Environmental Geology, 2001, 40 (3) : 267 –278.
DOI: 10.1007/s002540000162 ( 0) 0)
|
| [14] |
Hernaandez-Garcia M E, Custodio E. Natural baseline quality of madrid tertiary detrital aquifer groundwater (Spain):a basis for aquifer management[J].
Environmental Geology, 2004, 46 (2) : 173 –188.
( 0) 0)
|
| [15] |
Breed A W, Harrison S T L, Hansford G S. A preliminary investigation of the ferric leaching of a pyrite/arsenopyrite flotation concentrate[J].
Minerals Engineering, 1997, 10 (9) : 1023 –1030.
DOI: 10.1016/S0892-6875(97)00081-2 ( 0) 0)
|
| [16] |
Walker F P, Schreiber M E, Rimstidt J D. Kinetics of arsenopyrite oxidative dissolution by oxygen[J].
Geochimica Et Cosmochimica Acta, 2006, 70 (7) : 1668 –1676.
DOI: 10.1016/j.gca.2005.12.010 ( 0) 0)
|
| [17] |
Craw D, Falconer D, Youngson J H. Environmental arsenopyrite stability and dissolution:theory, experiment, and field observations[J].
Chemical Geology, 2003, 199 (1-2) : 71 –82.
DOI: 10.1016/S0009-2541(03)00117-7 ( 0) 0)
|
| [18] |
McArthur J M, Ravenscroft P, Safiulla S, et al. Arsenic in groundwater:testing pollution mechanisms for sedimentary aquifers in Bangladesh[J].
Water Resources Research, 2001, 37 (1) : 109 –117.
DOI: 10.1029/2000WR900270 ( 0) 0)
|
| [19] |
McKibben M A, Tallant B A, del Angel J K. Kinetics of inorganic arsenopyrite oxidation in acidic aqueous solutions[J].
Applied Geochemistry, 2008, 23 (2) : 121 –135.
DOI: 10.1016/j.apgeochem.2007.10.009 ( 0) 0)
|
| [20] |
Nesbitt H W, Muir I J. Oxidation states and speciation of secondary products on pyrite and arsenopyrite reacted with mine waste waters and air[J].
Mineralogy and Petrology, 1998, 62 (1-2) : 123 –144.
DOI: 10.1007/BF01173766 ( 0) 0)
|
| [21] |
Mikhlin Y L, Romanchenko A S, Asanov I P. Oxidation of arsenopyrite and deposition of gold on the oxidized surfaces:a scanning probe microscopy, tunneling spectroscopy and XPS study[J].
Geochimica Et Cosmochimica Acta, 2006, 70 (19) : 4874 –4888.
DOI: 10.1016/j.gca.2006.07.021 ( 0) 0)
|
| [22] |
Richardson S, Vaughan D J. Arsenopyrite-a spectroscopic investigation of altered surfaces[J].
Mineralogical Magazine, 1989, 53 (370) : 223 –229.
DOI: 10.1180/minmag ( 0) 0)
|
| [23] |
Corkhill C L, Vaughan D J. Arsenopyrite oxidation-a review[J].
Applied Geochemistry, 2009, 24 (12) : 2342 –2361.
DOI: 10.1016/j.apgeochem.2009.09.008 ( 0) 0)
|
| [24] |
Lengke M F, Sanpawanitchakit C, Tempel R N. The oxidation and dissolution of arsenic-bearing sulfides[J].
Canadian Mineralogist, 2009, 47 (3) : 593 –613.
DOI: 10.3749/canmin.47.3.593 ( 0) 0)
|
| [25] |
Xu L, Zhao Z, Wang S, et al. Transformation of arsenic in offshore sediment under the impact of anaerobic microbial activities[J].
Water Research, 2011, 45 (20) : 6781 –6788.
DOI: 10.1016/j.watres.2011.10.041 ( 0) 0)
|
| [26] |
Wang S, Xu L, Zhao Z, et al. Arsenic retention and remobilization in muddy sediments with high iron and sulfur contents from a heavily contaminated estuary in China[J].
Chemical Geology, 2012, 314-317 : 57 –65.
DOI: 10.1016/j.chemgeo.2012.05.005 ( 0) 0)
|
| [27] |
Yu Y M, Zhu Y X, Williams-Jones A E, et al. A kinetic study of the oxidation of arsenopyrite in acidic solutions:implications for the environment[J].
Applied Geochemistry, 2004, 19 (3) : 435 –444.
DOI: 10.1016/S0883-2927(03)00133-1 ( 0) 0)
|
| [28] |
Lengke M F, Tempel R N. Natural realgar and amorphous AsS oxidation kinetics[J].
Geochimica Et Cosmochimica Acta, 2003, 67 (5) : 859 –871.
DOI: 10.1016/S0016-7037(02)01227-9 ( 0) 0)
|
| [29] |
Long H, Dixon D G. Pressure oxidation kinetics of orpiment (As(2)S(3)) in sulfuric acid[J].
Hydrometallurgy, 2007, 85 (2-4) : 95 –102.
DOI: 10.1016/j.hydromet.2006.08.005 ( 0) 0)
|
| [30] |
Yu Y M, Zhu Y X, Gao Z M, et al. Rates of arsenopyrite oxidation by oxygen and Fe(III) at pH 1.8-12.6 and 15-45 degrees C[J].
Environmental Science & Technology, 2007, 41 (18) : 6460 –6464.
( 0) 0)
|


