丁醇是一种重要的C4 平台化合物,广泛地应 用于各种精细化学品的制造,并作为继乙醇之后另 一种极具发展前景的新一代液体燃料,已被联合国 国际能源署列为第二代生物燃料[1, 2, 3]。由于生物丁醇 具有能量密度高、腐蚀性小、安全性好等优点[4], 使其作为生物燃料的生产前景十分诱人。因此,生 物法制备丁醇倍受各国的关注。目前,实验室和工业生产中使用的产丁醇菌种类型主要可分为4 种类 型:Clostridium acetobutylicum、C. beijerickii、C. saccharoacetobutylicum 及C. saccharoperbutylacetonicum[ 5]。然而,工业化发酵制备生物丁醇还存在诸 多问题,如原料成本高(红薯、糖蜜等淀粉质和糖 质原料)、丁醇产率低等缺点导致其生产成本高、市 场竞争力弱[4]。木质纤维素原料是一种价格低廉、 来源丰富的可再生资源[6],因此,如何高效利用木 质纤维素资源制备燃料丁醇是一个具有重大意义的 研究方向。
植物生物质是可用于制备液体运输燃料的可持 续资源[7],而充分利用这类资源的关键障碍是缺乏 可靠的经济与技术支持。与以石油为原料制备运输 燃料相比,利用植物生物质为原料制备液态燃料的 生产规模小、生产成本高。植物生物质资源是自然 界中非常丰富且廉价的资源,具有很大的应用潜力 和市场。美国能源部调查表明,截止2030 年,美国 可用于工业化生产的生物质原料将达11~16 亿t。 其中,森林生物质原料占有1.60~6.64 亿t,价格约 为60 美元/t,最低价格为40 美元/t;与此同时,农 业残留物和废物约占有4.04 亿t,每吨的价格约为 60 美元[8]。我国是农业大国,每年约产8 亿t 农作 物秸秆,相当于4 亿t 标准煤[9]。由此可见,利用生 物质原料制备生物燃料已成为必然的趋势,也成为 生物质能源发展战略的重要组成部分。
1 木质纤维素的预处理及酶解 1.1 木质纤维素的预处理木质纤维素中的纤维素被层层半纤维素覆盖, 并且木质素和半纤维素的紧密复合结构也包裹着纤 维素,相互之间又以共价键结合[10]。因此,其结构 不易降解,必须经过预处理手段(物理法、化学法、 生物法)将木质素和半纤维素分解,并达到破坏纤 维素晶体结构的目的,利于后续纤维素的酶解过程, 使其分解为单糖,也用于发酵生产。
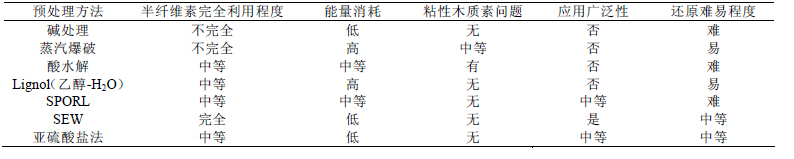
预处理方法主要包括碱处理、稀酸水解(0.1%~ 3%硫酸)、SPORL(1%~8%亚硫酸盐和0.5%~2% 的硫酸)、蒸汽爆破、氨爆破及生物法等方法[11]:碱 预处理后很难除去无机盐及铵根离子,所以碱处理 法很少受到关注[11, 12],石灰是一种便宜的碱资源, 但石灰预处理面临大规模应用的难题[13];酸法预处 理需要在高温(150~200℃)、高压下进行[14],操作 条件较苛刻,低固液比要求在发酵前必须进行酸的 中和及无机盐的去除,操作繁琐,腐蚀问题也是稀 酸水解的另一个严重缺陷,而且酸解过程形成的粘 性木质素沉淀在反应器壁和管道中不利于后续清 理[8],目前还没有解决此问题经济有效的方法;蒸 汽爆破、氨爆破属于物理化学法,主要通过高压蒸 汽使纤维发生一定的机械断裂,同时高温高压破坏 纤维内部氢键,从而改变纤维的物理化学性质;生 物法是利用分解木质素的一些微生物除去木质素, 解除其对纤维素的包裹作用,该方法耗能低、不污 染环境,但周期长、处理效率低。
表1 列出一些木质纤维素的预处理方法,除了 上述方法外,还包括亚硫酸盐法以及使用在AVAP 生物精炼过程中的SEW(SO2/乙醇/H2O)分解方法。 SEW 方法反应条件较低,只需要130~150℃及2~ 3 L/kg 的固液比,并且在分馏液中不存在碱性金属 离子(Mg、Na),只需要蒸发除去乙醇和SO2。这些 优点使得SEW 处理成为从木质纤维原料中释放糖 分并用于发酵的一种独特的方法。
| 表1 木质纤维素预处理方法的比较[8] |
木质纤维素经过预处理后,释放的纤维素需进 行纤维素酶水解为单糖用于发酵生产。水解过程需 要葡聚糖内切酶(EG)、葡聚糖外切酶(CBH)、β-葡萄 糖苷酶3 种酶。其中EG 即内切纤维素酶,作用于 较长的纤维素链,主要产物是纤维糊精,不能单独 作用于结晶纤维素;CBH 即外切纤维素酶,从纤维 素的还原端或非还原端依次切下,生成纤维二糖;β- 葡萄糖苷酶用来水解纤维二糖和短链的纤维寡糖生 成单糖葡萄糖。
1.3 木质纤维素水解液副产物对菌体的影响及脱毒木质纤维原料经预处理及酶解后,会生成了一 定量的发酵副产物,主要包括有机酸、醛类、酚类 等化合物。与乙醇发酵不同,产丁醇菌(C. beijerinckii) 不受糠醛、HFM(羟甲基糠醛)及乙酸的抑制,相 反,这些物质在较低浓度时可以被菌体代谢利用, 促进菌体的发酵。因为发酵培养基中的酵母膏会将 这些物质转化成NAD+(烟酰胺腺嘌呤二核苷酸), 从而降低甘油的生成量,提高丁醇的产量[15, 16]。而 C. acetobutylicum 易受甲酸、木质素及半纤维素的降 解产物(丁香醛、阿魏酸、香豆酸及一些硫酸盐类) 的抑制[17, 18]。甲酸是木质纤维素水解糖液中的副产 物,当甲酸浓度超过0.5 g·L-1 时就可严重抑制C. acetobutylicum 的生长[19]。Wang 等人发现甲酸浓度 在细胞内浓度为1 mM 或46 ppm 时,细胞的生长就 受到严重的抑制,因为ABE(丙酮-丁醇-乙醇)发 酵时的pH 为5,而甲酸的pKa 值为3.8,使胞内H+ 浓度增加,破坏了细胞膜电位,而细胞要消耗 ATP(三磷酸腺苷)来维持原细胞电位,使得细胞内用 于代谢的ATP 供应不足,导致细胞代谢缓慢,严重 时死亡[20]。当阿魏酸和对香豆酸的质量浓度在0.3 g·L-1 时,也会强烈抑制C. beijerinckii BA101 的生长 与发酵。酚类物质对C. acetobutylicum 的抑制作用 最严重,一般认为,酚类化合物可提高细胞膜的流 动性,造成细胞膜破裂,最终使细胞死亡。因此, 木质纤维素预处理糖液的脱毒对丁醇发酵起着至关 重要的作用。目前脱毒方法主要包括电渗析、石灰 澄清法、阴阳离子交换法和活性炭法[18, 21, 22, 23]。预处 理液的脱毒过程往往需要多种方法相结合,取长补 短综合利用,才可有效去除对丁醇发酵有害的有毒 副产物。
2 产丁醇菌株的选育进展 2.1 丁醇发酵微生物丁醇发酵具有悠久的发展历史,Pasteur 最早报 道了利用微生物发酵法生产丁醇,1914 年著名的 Weizmann 博士成功分离得到一株丙酮丁醇菌,其生 产性能有了很大的提高,这为ABE 发酵的工业化奠 定了基础。近年来,通过生物信息学以及发酵性能 等方面的研究和分析认为,工业产溶剂梭菌归为4 种,即C. acetobutylicum、C. beijerinckii、C. saccharobutylicum 和C. saccharoperbutylacetonicum[5]。
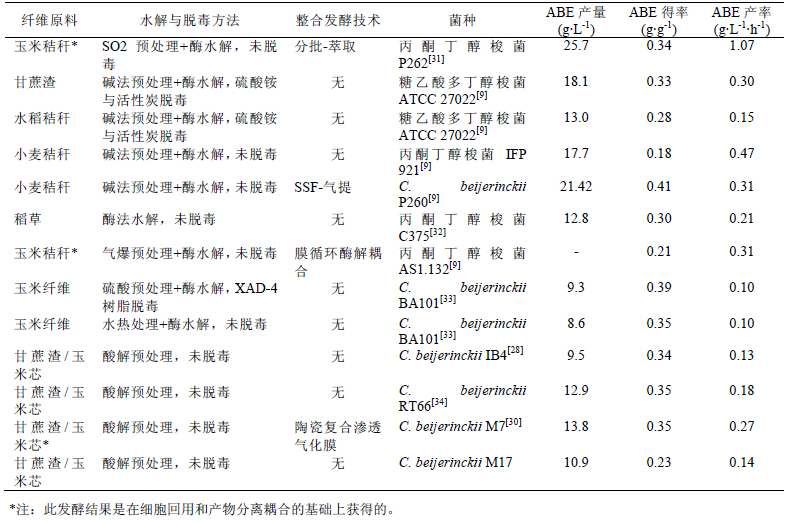
传统的丙酮丁醇梭菌发酵生产中的丁醇终浓度 维持在13 ~ 14 g·L-1 左右,生产效率低于0.3 g·L-1·h-1。以玉米原料为例,总溶剂产率一般只有 30%左右,低的溶剂产率进一步降低了原料的利用 率,进而提高了原料成本。因此,为了降低原料成 本,研究者们寻找一些廉价的木质纤维资源作为原 料生产丁醇。Qureshi 等以小麦和大麦秸秆、玉米秸 秆等的水解液作为碳源,利用C. beijerinckii P260 进行ABE 厌氧发酵,小麦秸秆进行稀酸预处理和酶 水解后得到60 g·L-1 的糖液,经过滤、超滤后用C. beijerinckii P260 进行丁醇发酵,总溶剂质量浓度为 25.0 g·L-1,其中丁醇产量为12.0 g·L-1,丁醇得率为 48%。但以未经任何脱毒处理的大麦秸秆、玉米秸 秆水解液中的糖分作为原料发酵时,菌株生长则受 到严重的抑制[23]。同样,Thaddeus Ezeji 等分别以 XAD-4 resin 方式脱毒的玉米芯酸解和酶解糖液为 底物发酵,利用突变株C. beijerinckii BA101 发酵制 备丁醇,总溶剂产量为9.30 g·L-1,其中丁醇浓度为 6.4 g·L-1,丁醇得率为69%。但是未经脱毒的玉米芯 预处理糖液对突变株BA101 的生长和产溶剂能力产 生严重的抑制,原因是该菌株耐毒性差,不能利用 未脱毒的酸解糖液发酵生产丁醇[24]。Soni 等也发现 C. saccharoperbutylacetonicum 的生长与发酵会受到 甘蔗渣和水稻秸秆水解液的强烈抑制[25]。由此可见, 产丁醇菌可利用木质纤维原料制备丁醇,但是其耐 受性差是导致以木质纤维素原料生产丁醇时低产率 的关键因素。因此,选育高抗逆性产丁醇菌株对以 木质纤维素为原料制备丁醇具有重要的意义,是实 现原料成本低、生产效率高的最佳突破口,也是最 迫切需要解决的问题。
2.2 高抗逆、高产丁醇菌种的选育目前主要采用传统的诱变方法筛选丁醇新菌 株,如紫外线诱变、化学诱变、粒子束诱变等。上 海植物生理研究所通过化学诱变的方法得到一株高 产丁醇的菌株C. acetobutylicum EA2018,发酵产溶 剂比为丁醇:丙酮:乙醇 = 7:2:1,在百吨发酵 罐实验中得到的丁醇比例为71.9%,比原始菌株提 高10%左右[26]。Annous[27]等用亚硝基胍做诱变剂, 以葡萄糖的类似物2-脱氧葡萄糖作为抗代谢阻遏物,筛选得到高产丁醇的菌株C. beijerinckii BA101。 郭亭等通过粒子束诱变育种得到C. beijerinckii IB4,该突变株对酚类化合物具有较高的耐受性,能 够以含总酚浓度为1.4 g·L-1 的未脱毒的玉米芯酸解 糖液作为碳源进行发酵,总溶剂产量可达9.5 g·L-1, 丁醇产量达6.8 g·L-1 ,丁醇占总溶剂比例为 71.6%[28]。杜腾飞等通过响应面法优化P2 发酵培养 基,以C. beijerinckii IB4 进行发酵,可产丁醇9.5 g·L-1,比未优化的发酵结果提高近40%[29]。同时, 研究发现,当玉米芯或甘蔗渣酸解糖液中的酚类化 合物的浓度提高到1.5 g·L-1 以上时,C. beijerinckii IB4 基本不生长,因此,在此基础上结合进化代谢 技术,进一步筛选出一株对于6 种模式酚类物质具 有最强抗逆性的突变株C. beijerinckii M7,该突变 株以玉米芯酸解糖液进行分批发酵时,总酚浓度为 1.9 g·L-1,其总溶剂和丁醇产量分别可达10.8 g·L-1 和7.7 g·L-1,丁醇所占总溶剂比例为71.3%[30]。另 外,中国专利201410086648.5 通过常温等离子体诱 变筛选获得一株高耐受性拜氏梭菌C. beijerinckii M17,在酚浓度高达2.0 g·L-1 的发酵液中,仍能非 常好地发酵生产丁醇,其总溶剂产量和丁醇产量分 别达到了10.9 g·L-1 和7.9 g·L-1,丁醇合成比例为 72.5%。甚至当酚浓度高达2.4 g·L-1,菌体也可较好 地生长,并具有可观的产溶剂能力,其总溶剂产量 和丁醇产量为8.7 g·L-1 和5.9 g·L-1。表2 列举了一些 以木质纤维素为原料的产丁醇菌株的现状。
| 表2 以木质纤维素为原料生产丁醇的生产菌株研究现状 |
随着科研工作者对产丁醇梭菌深入的研究,C. acetobutylicum ATCC824 和C. beijerinckii NCIMB8052 的基因组测序已经顺利完成[35, 36],发现 一些基因能够提高其对毒素物质的抗逆性,并开展 了基因工程育种的研究。Tomas 等在丙酮丁醇梭菌 中过量表达编码热激蛋白的groESL 基因,使丁醇对 菌体细胞的抑制作用降低了85%,最终使产物浓度 提高了33%[37]。Jang 等通过敲除负责酸生成的酶编 码基因,构建的基因工程梭菌C. acetobutylicum 以葡萄糖作为碳源进行分批发酵时,丁醇产量为18.9 g·L-1,丁醇得率达0.71(mol 丁醇/mol 葡萄糖),比 野生菌分别高出160%和245%[38, 39]。
另外,由于产丁醇梭菌对毒素物质的本底抗逆 性低、丁醇耐受性低,科研工作者开始寻找其他微 生物如大肠杆菌、酵母菌等非梭菌作为产丁醇的宿 主菌株。例如大肠杆菌构造相对简单,遗传背景清 晰,因此常常被作为基因工程对象加以使用。然而, 大肠杆菌缺乏对丁醇的自然耐受性,因此Zhou 等将 产溶剂梭菌Clostridium 中的基因thil、adhe2 和bcs 操纵子(crt、bcd、etfB、etfA 和hbd)在大肠杆菌中 表达,成功构建基因工程菌株E. coli MG1655 (DE3),丁醇产量为18.5 mg/L,再经导入GlpF 基因、 敲除副产物合成路径,丁醇产量可达97.9 mg/L[40], 提高效果显著。酵母菌也是一种具有比较完备的基 因表达调控机制和对表达产物的加工修饰能力的单 细胞真核生物,也是当前工业乙醇的生产菌株。 Maryam Karimi 等研究了在酵母启动子TEF1 和 PGK1 的调节下同时过量表达生物合成基因hbd、 crt、ter 和adhE,使得丁醇浓度从7.5 g·L-1 提高到 26.8 mg·L-1 [41]。
3 生物丁醇的发酵调控进展 3.1 pH 调控发酵制备丁醇发酵是典型的两阶段发酵,分为产酸期和产溶 剂期[1, 42, 43]。在产酸期,主要产物为乙酸、丁酸、 H2 和CO2,有机酸的产生导致pH 下降;当其积累 到一定程度,发酵进入产溶剂期,会将产生的乙酸 和丁酸转变为主产物丙酮、丁醇和乙醇。
Hubert 等研究发现,当pH 调控在6.0 时,以不 同流速添加葡萄糖连续培养丙酮丁醇梭菌DSM173 的主要产物为丁酸和乙酸,当pH 降到5.2~4.3 时 才生成丙酮和丁醇[44];丙酮丁醇梭菌B18 的发酵pH 调控在6.0 时,葡萄糖的消耗速率为4.37 g·L-1·h-1, 丁醇的生成速率为1.0 g·L-1·h-1,而丙酮丁醇梭菌B1 能够在相同的pH 条件下进行高速生长、高效发 酵[45]。Godin 等利用丙酮丁醇梭菌ATCC 824 在P2 培养基进行发酵,第一阶段将pH 维持在4.5,葡萄 糖补料速率0.08 h-1,第二阶段将pH 维持在4.5~5.0, 补料速率0.04 h-1(补料速率即稀释速率:单位时间 流加入发酵罐内的新鲜培养液与发酵体系培养液体 积的比值),使得总溶剂达到了21 g·L-1,糖转化率 达到0.36 g/g[46]。因此,发酵不同阶段采用不同的 pH 调控策略,可提高丁醇的生产效率。
3.2 补料分批发酵工艺底物浓度超过一定量时会对丙酮丁醇梭菌产生 抑制作用,因此,为避免过高浓度底物对菌体的毒 害作用,可采用补料分批发酵工艺,使发酵体系中 的底物浓度维持在较低浓度,减少底物对菌体生长 与发酵的抑制作用,使菌体在较高速率下生长,从 而合成更多的产物丁醇。Qureshi 等采用补料分批发 酵工艺使反应器的生产速率和ABE 质量浓度分别 达到了0.98 g·L-1·h-1 和165 g·L-1·h-1,而分批发酵只 达到了0.39 g·L-1·h-1 和25.3 g·L-1 [47]。
3.3 分离耦合技术发酵液中的产物丁醇积累到一定量时也会对产 丁醇菌株产生抑制,因此,目前广泛应用气提和渗 透汽化技术,移去发酵体系中的丁醇,降低其对发 酵的抑制,从而有效地提高丁醇的产量及效率。
Ezeji 等人[48]将气提分离工艺用于丁醇发酵,与 间歇发酵相比,该工艺使溶剂产率和产量分别提高 200%和118%;以H2 和CO2 为载气,采用半连续发 酵和气提产物回收耦联的工艺,发酵201 h,溶剂产 率提高400%,总溶剂产量可以达到232.8 g·L-1。 由此可见,气提应用于发酵-分离耦合体系不但可以 避免丁醇的产物抑制作用,也可大大提高ABE 的产 量及产率,降低发酵-分离耦合工艺的成本,但是其 性能受到发酵的操作方式、载气速率、底物种类等 因素的影响。此外,Qureshi 等人[47]将渗透汽化分离 与补料分批发酵技术耦合,补料葡萄糖浓度达到500 g·L-1,渗透液中的溶剂浓度达到165.1 g·L-1,与间歇 发酵相比,ABE 产率从0.35 g·L-1·h-1 提高到0.98 g·L-1·h-1。渗透汽化-发酵的耦合工艺不仅可有效提高 发酵产率,也是一种清洁、无污染的新型分离技术, 然而其分离性能及通量很大程度上取决于膜本身特 性,在一定程度上限制了其使用。
4 展望未来以糖为原料的极具有开发潜力的生物燃料 丁醇必然越来越受到关注,但其高成本、低产率仍 然是制约丁醇大规模工业化发展的重要障碍。木质 纤维素生物质是一种价格低廉、来源丰富的可再生 资源,利用其作为原料是丁醇的未来发展趋势。然 而,由于产丁醇菌株对木质纤维原料预处理液有毒 物质的耐受性差,导致丁醇产率低,间接提高了成本。因此,从目前主流产丁醇菌种的发酵情况可以 看出,要提高木质纤维原料制备丁醇的经济性和竞 争力,使丁醇发酵适应现代工业的要求,主要需从 以下方面考虑:探索木质纤维素原料转化成可利用 糖的新的方法,实现木质纤维原料的高效绿色转化; 利用基因工程、代谢工程相结合的手段改造菌种, 构建并筛选对水解液毒性物质具有高抗逆性的高产 丁醇的新型菌种,提高丁醇的发酵效率;优化发酵 过程,使菌株在发酵体系中保持较高的生产能力。
| [1] | LEE S Y, PARK J H, JANG S H. et al. Fermentativebutanol production by Clostridia[J]. Biotechnol Bioeng,2008, 101(2): 209-228.( 2) 2) |
| [2] | DURRE P. Biobutanol: an attractive biofuel[J].Biotechnol J, 2007, 2(12): 1525-1534( 1) 1) |
| [3] | 刘娅,刘宏娟,张建安,等.新型生物燃料-丁醇的研究进展[J].现代化工,2008,28(6):28-33( 1) 1) |
| [4] | 刘力强,李丽萍,李立强,等. 生物丁醇燃料产业化制造中的问题及发展趋势[J]. 生物产业技术,2008(5):36-38.( 2) 2) |
| [5] | 史仲平,华兆哲. 生物质和生物能源手册[M]. 北京:化学工业出版社,2007.( 1) 1) |
| [6] | JIN X Q, WANG G L, HE B F. Research progress andhigh yield strategy of acetone-butanol fermentation[J].Chem Ind Eng Prog, 2007, 26(12): 1727-1733( 1) 1) |
| [7] | HUBER G W, IBORRA S, CORMA. A synthesis oftransportation fuels from biomass: chemistry catalystsand engineering [J]. Chem Rev, 2006, 106(9): 4044-4096( 1) 1) |
| [8] | JURGENS G, SURVASE S, BEREZINA O, et al. Butanolproduction from lignocellulosics[J]. Biotechnol Lett,2012, 34(8): 1415-1434( 3) 3) |
| [9] | 王凤琴,楚乐然,谢慧,等.纤维燃料丁醇研究进展[J].生物加工过程,2009,7(1):1-6( 1) 1) |
| [10] | FENGEL D, WEGENER G. Wood-chemistry,ultrastructure, reactions[J]. Walter de Gruyter, Berlin,1985, 23(11): 601-602.( 1) 1) |
| [11] | MOSIER N, WYMAN C, DALE B, et al. Features ofpromising technologies for pretreatment oflignocellulosic biomass [J]. Bioresource Technol, 2005,96(6): 673-686( 1) 1) |
| [12] | WYMAN C E, DALE B E, ELANDER R T, et al.Coordinated development of leading biomasspretreatment technologies [J]. Bioresour Technol, 2005,96(18): 1959-1966( 1) 1) |
| [13] | ZHU J Y, PAN X J. Woody biomass pretreatment forcellulosic ethanol production: technology and energyconsumption evaluation [J]. Bioresource Technol, 2010,101(13): 4992–5002( 1) 1) |
| [14] | ZHU J Y, PAN X, ZALESNY R S. Pretreatment of woodybiomass for biofuel production: energy efficiency,technologies, and recalcitrance [J]. Appl MicrobiolBiotechnol. 2010, 87(3): 847–857( 1) 1) |
| [15] | PIENKOS P T, ZHANG M. Role of pretreatment andconditioning processes on toxicity of lignocellulosicbiomass hydrolysates[J]. Cellulose, 2009,16(4): 743–762( 1) 1) |
| [16] | EZEJI T, QURESHI N, BLASCHEK H P, et al. Butanolproduction frome agricultural residues: impact ofdegradation products on Clostridium beijerinckii growthand butanol fermentation [J]. Biotechnol Bioeng, 2007,97(6): 1460-1469( 1) 1) |
| [17] | EZEJI T, QURESHI N, BLASCHEK H P. Production ofacetone-butanol-ethanol (ABE) in a continuous flowbioreactor using degermed corn and Clostridiumbeijerinckii[J]. Process Biochem, 2007, 42(1): 34-39( 1) 1) |
| [18] | WANG L, CHEN H. Increased fermentability ofenzymatically hydrolyzed steam-exploded corn stover forbutanol production by removal of fermentationinhibitors[J]. Process Biochem, 2011, 46(2): 604-607( 2) 2) |
| [19] | 孙彦平,靳艳玲,郜晓峰,等.纤维素酸解副产物对Clostridium acetobutylicum CICC8012 发酵的影响[J].应用与环境生物学报, 2010, 16(6): 845-850( 1) 1) |
| [20] | WANG Y, BLASCHEK H P. Optimization of butanolproduction from tropical maize stalk juice byfermentation with Clostridium beijerinckii NCIMB8052[J]. Bioresour Technol, 2011, 102(21): 9985-9990( 1) 1) |
| [21] | QURESHI N, SAHA B C, HECTOR R E, et al. Removalof fermentation inhibitors from alkaline peroxidepretreated and enzymatically hydrolyzed wheat straw:production of butanol from hydrolysate using Clostridiumbeijerinckii in batch reactors[J]. Biomass Bioenergy,2008, 32(12): 1353-1358( 1) 1) |
| [22] | QURESHI N, SAHA B C, HECTOR R E, et al.Production of butanol (a biofuel) from agricultural residues: part II—use of corn stover and switchgrasshydrolysates[J]. Biomass Bioenergy, 2010, 34(4):566-571( 1) 1) |
| [23] | QURESHI N, SAHA B C, COTTA M A. Butanolproduction from wheat straw hydrolysate usingClostridium beijerinckii[J]. Bioproc Biosyst Eng, 2007,30(6): 419-427( 2) 2) |
| [24] | QURESHI N, EAEJI T C. Butanol production byClostridium beijerinckii part I: use of acid and enzymehydrolyzed corn fiber[J]. Bioresour Technol, 2008,99(13): 5915-5922( 1) 1) |
| [25] | SONI B K, DAS K, GHOSE T K. Bioconversion ofagro-wastes into acetone butanol[J]. Biotechnol Lett,1982, 4(2): 19-22.( 1) 1) |
| [26] | ZHANG Y F, CHEN J, YANG Y L, et al. The screeningand application of the Clostridium acetobutylicum withhigh butanol ratio[J]. Ind Microbiol, 1996, 26: 1-6.( 1) 1) |
| [27] | ANNOUS B A, BLASCHEK H P. Isolation andcharacterization of Clostridium acetobutylicum mutantswith enhanced amylolytic activity[J]. Appl EnvironMicrobiol, 1991, 57(9): 2544-2548( 1) 1) |
| [28] | GUO T, TANG Y, XI Y L, et al. Clostridium beijerinckiimutant with high inhibitor-tolerance obtained bylow-energy ion implantation[J]. J Ind MicrobiolBiotechnol, 2012, 39(3): 401-407.( 1) 1) |
| [29] | DU T F, HE A Y, WU H, et al. Butanol production fromacid hydrolyzed corn fiber with Clostridium beijerinckiimutant[J]. Bioresource Technology, 2013,135: 254-261( 1) 1) |
| [30] | 郭亭. 高抗逆产丁醇Clostridium beijerinckii 的选育及其发酵调控研究[D]. 南京:南京工业大学,2012.( 1) 1) |
| [31] | PAREKH S R, WAYMAN M. Ethanol and butanolproduction by fermentation of enzymatically saccharifiedSO2-prehydrolysed lignocellulosics[J]. EnzymeMicrobiol Technol, 1988, 10(11): 660-668. |
| [32] | 陈守文,马昕,汪履绥,等.稻草酶法水解液的丙酮丁醇发酵[J].工业微生物,1998,28(4):30-34 |
| [33] | QURESHI N, EZEJI T C. Butanol production byClostridium beijerinckii part I: use of acid and enzymehydrolyzed corn fiber[J]. Bioresour Technol, 2008,99(13): 5915-5922 |
| [34] | GUO T, HE A Y, DU T F, et al. Butanol production fromhemicellulosic hydrolysate of corn fiber by a Clostridiumbeijerinckii mutant with high inhibitor-tolerance[J].Bioresour Technol, 2013, 5(135): 379-385 |
| [35] | NOLLING J, BRETON G, OMELCHENKO M V, et al.Genome sequence and comparative analysis of thesolvent-producing bacterium Clostridiumacetobutylicum [J]. J Bacteril, 2001, 183(16): 4823-4838( 1) 1) |
| [36] | COPELAND A, LUCAS S, LAPIDUS A, et al.Clostridium beijerinckii NCIMB8052, complet genome.http://www.ncbi.nlm.nih.gov/entrez.viewer.fcgi?db=nucleotid&eoval=CP000721.( 1) 1) |
| [37] | TOMAS C A, WELKER N E, PAPOUTSAKIS E T.Overexpression of groESL in Clostridium acetobutylicumResults in Increased Solvent Production and Tolerance,Prolonged Metabolism, and Changes in the Cell'sTranscriptional Program[J].Appl Environ Microbiol,2003, 69(8): 4951-4965( 1) 1) |
| [38] | JANG Y, LEE J Y, LEE J. Enhanced butanol productionobtained by reinforcing the direct butanol-forming routein Clostridium acetobutylicum[J]. Microbiol, 2012, 3(5):1-9.( 1) 1) |
| [39] | JANG Y S, MALAVIYA A, CHO C, et al. Butanolproduction from renewable biomass by Clostridia[J].Bioresour Technol, 2012,123:653-663( 1) 1) |
| [40] | ZHOU P P, ZHANG Y, WANG P X, et al. Butanolproduction from glycerol by recombinant Escherichiacoli[J]. Ann Microbiol, 2014, 64: 219-227( 1) 1) |
| [41] | MARYAM K. Optimization of butanol pathway inmetabolically engineered Saccharomyces cerevisiae[D].Goteborg: Chalmers University of Technology, 2012.( 1) 1) |
| [42] | JONES D T, WOODS D R. Acetone-butanol fermentationrevisited[J]. Microbiol Rev, 1986, 50: 484-524( 1) 1) |
| [43] | 陈陶声,陆祖棋.发酵法丙酮和丁醇生产技术[M].北京:化学工业出版社,1991.( 1) 1) |
| [44] | HUBERT B, WOLFRAM A, KONSTANTIN B, et al.Effect of pH and butyrate concentration on the productionof acetone and butanol by Clostridium acetobutylicumgrown in continuous culture[J]. J Appl MicrobiolBiotechnol, 1982, 14(1): 17-20.( 1) 1) |
| [45] | GENG Q H, PARK C H. Controlled-pH batchbutanol-acetone fermentation by low acid producingClostridium acetobutylicum B18[J]. Biotechnol Let, 1993,15(4): 421-426.[46] GODIN C, ENGASSER J M. Two-stage continuousfermentation of Clostridium acetobutylicum: effects ofpH and dilution rate[J]. Appl Microbiol Biotechnol, 1990,33(3): 269-273( 1) 1) |
| [46] | QURESHI N, BLASCHEK H P. Butanol productionusing Clostridium beijerinckii BA101 hyper-butanolproducing mutant strain and recovery bypervaporation[J].Appl.Biochem.Biotechnol, 2000: 84-86,225-235.( 1) 1) |
| [47] | QURESHI N, LI X L, HUGHES S. Butanol productionfrom corn fiber xylan using Clostridium beijerinckii[J].Biotechnol Prog, 2006(22): 673-680( 2) 2) |
| [48] | EZEJI T C, QURESHI N, BLASCHEK H P. Acetonebutanol ethanol(ABE) production from concentratedsubstrate: reduction in substrate inhibition by fed-batchtechnique and product inhibition by gas stripping[J]. ApplMicrobiol Biotechnol, 2004, 63(6): 653-658.( 1) 1) |
 2014
2014