2. 喀什师范学院生物与地理科学系, 新疆喀什 844006;
3. 广西永鑫华糖集团有限公司, 广西南宁 530021
2. Department of Biological & Geographic Sciences, Kashi Teacher's College, Kashi 844006;
3. Guangxi Yongxinhua Sugar Group Co. Ltd., Nanchang 530021
目前在制糖领域糖浆精制仍局限于采用新技术 新方法进行糖浆脱色处理[1, 2],而甘蔗提汁过程中褐 变现象一直没有在生产中得到重视,也没有采取有效的措施控制褐变和抑制色素的生成,因此常导致 压榨提汁中混合汁色值明显高于初压汁[3, 4],而之后 的澄清阶段则千方百计地进行脱色处理。由于蔗汁 成分复杂,存在大量多糖类、蛋白质、蔗脂、蔗蜡、 有机酸、单宁等物质,致使甘蔗破碎、清净过程褐 变更为复杂。
传统制糖工艺在甘蔗压榨后,通常会采用预灰、 预热处理混合汁,由于加入石灰澄清剂及预热处理, 在石灰、加热的作用下,蔗汁的色质也会发生一定 的变化,除酶促褐变外,非酶褐变也是褐变的一个 重要原因,2 种褐变均会对澄清过程色值的变化有 影响 [5, 6]。通常褐变色素的颜色强度会随最初的酚类 和氧化反应环境因素的不同而不同。分析制糖压榨 及预处理过程中蔗汁色值变化的原因,对采取适当 措施加以防护具有重要的指导意义。
亚硫酸盐是一种广泛使用的多功能抑制剂,它 能阻止酶促褐变和非酶褐变,控制微生物生长,并 作为漂白剂、抗氧化剂或还原剂使用以及执行其他 不 同 技 术 功 能 。 常 用 的 亚 硫 酸 盐 有 亚 硫 酸 钠 (Na2SO3) 、 亚 硫 酸 氢 钠 (NaHSO3) 、 焦 亚 硫 酸 钠 (Na2S2O5)、低亚硫酸钠(Na2S2O4)等。对亚硫酸盐控 制褐变的机理目前还颇有争论,有人认为它具有抑 制酚酶活性的作用,也有人认为它能将醌还原为酚, 还有人认为它可与醌起加成反应从而防止了醌的聚 合 [7]。用亚硫酸盐抑制褐变操作简便,经济有效, 如果在制糖工艺的前阶段,只使用较少的亚硫酸盐 就能控制褐变色素的生成,那么在后续的脱色工艺 中,可以达到缓解硫熏处理,达到最终控制成品糖 低含硫量的目的。
本文旨在分析制糖压榨及预处理过程中蔗汁色 值变化的原因,研究常用亚硫酸盐抑制剂对酶促褐 变的抑制,减少蔗汁中酶促褐变色素的生成,为甘 蔗制糖工艺的改进提供依据。 1 材料与方法 1.1 材料和仪器
实验用甘蔗采自美国路易斯安娜州 St.Gabriel 蔗区,以新鲜成熟甘蔗为实验材料,密封于-20℃保 存使用;实验过程使用的初压汁取自美国路易斯安 娜州 Alma Plantation 糖厂;实验用氢氧化钠、盐酸、 氧化钙、亚硫酸氢钠来自美国 Sigma 公司,化学纯 级别;实验用干冰购自 Baton Rouge 化工厂。
中试生产压榨机组、 ARIAS 500 阿贝折射仪、 TC-502/TC-602 电热恒温水浴锅、紫外分光光度计、 微波装置分别由美国 Audubon Sugar Institute 公司、 美国 Reichert Refractometer 公司、美国 Brookfield 公司、 美国 Thermo Genesys 10 公司和美国 Audubon Sugar Institute 公司提供。 1.2 实验方法 1.2.1 甘蔗压榨过程褐变对蔗汁色值的影响
新鲜甘蔗压榨提汁后,迅速量取 20 mL 蔗汁,倒 入 50 mL 去离子水中,混匀,通过滴加 0.01 mol/L 的 NaOH,调整不同 pH,然后经过 0.45 μm 针式过滤器 过滤后,测定 420 nm 下吸光度变化。整个蔗汁提取 过滤在 2 min 内完成,同时记录过程操作时间。另外, 也分别量取多份 20 mL 新鲜蔗汁样品分装到几个塑 料样品袋中,经干冰快速冷冻后,贮藏于-80℃超低 温冰箱内,测定经冷冻贮藏的蔗汁快速解冻后褐变 过程的影响。 1.2.2 加灰对蔗汁色值的影响
取不同来源的新鲜甘蔗压榨汁(成熟蔗茎、蔗 梢以及路易斯安娜州 Alma Plantation 糖厂所获取的 初压汁),迅速加入一定量的 CaO(10%,w/w)混匀, 暴露于空气中放置 60 min 后,测定其色值;取一定 量新鲜蔗汁,迅速滴加一定量的 0.1 mol/L HCl 或 CaO(10%,w/w),测定 pH 对蔗汁中 PPO( Polyphenol oxidase,多酚氧化酶)活性的影响。 PPO 活性测定 采用分光光度法[8]。 1.2.3 石灰法澄清过程加灰时间对蔗汁褐变过程的 影响
石灰在制糖生产过程中是广泛使用的澄清剂, 为了更好地评价加灰时间在澄清过程对褐变色素生 成的抑制,采用目前常用的碱式亚硫酸法生产的主 要工艺流程进行实验设计,具体实验流程如下:
( 1 )对照实验流程(图 1 )

|
图1 对照实验流程 |
( 2)加灰时间提前处理实验流程(图 2)

|
图2 加灰时间提前处理实验流程 |
压榨甘蔗提汁后,迅速滴入亚硫酸氢钠,达到 浓度分别为 1 、 2、 3 mmol/L,搅拌均匀,然后经过 0.45 μm 过滤器抽滤后,把 1 mL 的滤汁加入放有 3 mL pH7.0 TEA/HCl 缓冲液的比色皿内,混匀,整个 过程在 5 min 内完成,开始测定吸光度变化。反应 温度为 25± 2℃,放置 60 min,让酶促反应充分完 全。测定 420 nm 和 720 nm 下的吸光度,并测定滤 汁的锤度。色值计算为:
S = 1000× (A420- A720)/bc………………( 1 )
式中: S——色值(IU); A420——用 420 nm 波长 测得样液的吸光度; A420——用 720 nm 波长测得样 液的吸光度; b——比色皿厚度(cm); c——样液固 溶物浓度(g/mL),可由下式求得: c = (折光锤度/4) ×相应视密度/105。
该方法是根据 ICUMSA GS2/3-9[9]和 Vickers[10] 方法进行改进。
酶促褐变程度定义如下:
酶促褐变= S 最初- S 特定时间………………( 2)
式中: S 最初为物料最初色值,S 特定时间为物料特 定时间后色值。 1.3 分析方法
蔗汁色值的测定按照 ICUMSA Method GS1/3-7 法[8],调整 pH7.0 测色值,并定义色值抑制率为:
色值抑制率=100%×(处理前蔗汁色值-处理 后蔗汁色值) /处理前蔗汁色值
所有分析测定至少重复 3 次,实验结果以平均 值±标准偏差(SD)表示。运用 SPSS15.0 统计分析软 件对实验结果进行方差分析和 LSD 检验,P<0.05 为 差异有统计学意义。 2 结果与讨论 2.1 甘蔗压榨过程褐变
传统的制糖过程甘蔗压榨后,通常经过预灰 (pH6.0~6.8)处理。为了研究酶促对压榨汁色素生成 的影响,迅速对预灰后蔗汁取样品 20 mL,加入 50 mL 去离子水,混匀,过滤,暴露于空气中 60 min, 测定其吸光度的变化。图 3 为 20± 2℃下蔗汁在不 同 pH 和时间内颜色变化。从图 3 可以看到,随着 时间的变化,蔗汁颜色逐渐加深,在最初的 10 min, 蔗汁颜色显著增加;随后的 20~60 min,颜色的增 加逐渐变慢。当暴露时间超过 60 min,颜色增加到 一定程度,酶促反应基本完成,颜色不再改变。图 3 还表明,鲜蔗汁和经过干冰冷冻后的蔗汁(测定 时,用 50~ 60℃流动热水迅速解冻),酶促过程基 本一致,干冰冷冻蔗汁用热水迅速解冻后,不影响 其酶促反应。褐变生成的色值超过蔗汁色值的 1/2。 干冰冰冻 720 min 蔗汁(C)的吸光值低于干冰冰冻 30 min 蔗汁(B)的吸光值,说明了蔗汁长时间低温冷冻, 解冻后酶的活性恢复比较慢,导致其褐变程度也有 所下降。在预灰的 pH 范围,蔗汁酶促反应正常发 生,说明了传统的制糖工艺并没能有效地抑制压榨 过程色素的增长。
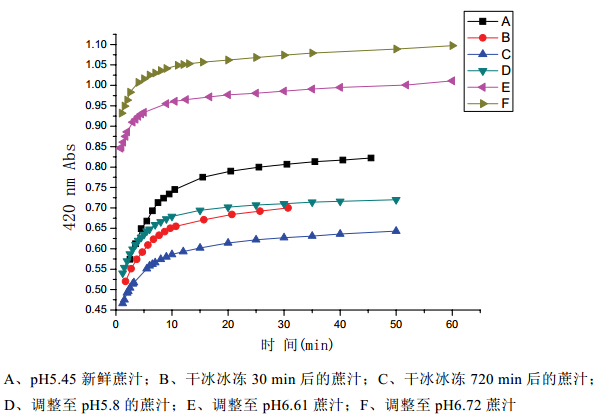
|
图3 蔗汁在不同 pH 和时间内颜色变化(20± 2℃ ) |
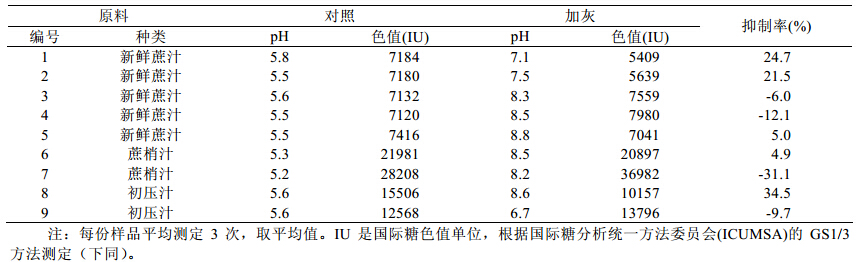
为了更好地考察加灰对不同品质蔗汁色值的影 响,分别以成熟的新鲜蔗茎汁、蔗梢汁以及糖厂初 压汁为研究对象,通过加入一定量的石灰,研究其 色值的变化。由于甘蔗的不同组织部位有不同的 PPO 活性,蔗梢(甘蔗顶部)相对蔗茎的中部和底 部而言,具有更强的 PPO 活性和多酚含量,因此通 常底部和中部蔗茎汁的色值比蔗梢汁的色值小很 多 [11],这从表 1 加灰对蔗汁色值的影响中可以反映 出来。从表 1 还可看出,并不是加灰量越大,色值 的抑制率也越大,这说明通过加灰不仅能抑制酶促 色素的生成,同时也会导致一些非酶褐变色素的产 生。前期的研究已表明,强碱水解会导致更多结合 态酚酸的释放及多酚多聚体成分的氧化降解,这些 释放出来的酚类成分和氧化降解的酚类物质,均会 对蔗汁色值造成影响。因此,预灰处理蔗汁,其色 值是酶促褐变和非酶褐变的综合作用结果。这些情 况的发生,与蔗汁中多酚含量以及 PPO 的活性都有 一定程度的影响。
| 表1 加灰对蔗汁色值的影响 |
图 4 是 pH 对蔗汁 PPO 活性的影响。从图中可 看出,在 pH6.0~6.5 范围内,PPO 相对酶活最高, 之后随着 pH 的升高,PPO 相对酶活开始下降,预 灰 pH>9.5,PPO 相对酶活为 0。高碱预灰可以有效 地抑制 PPO 的活性,但蔗汁的色值并非相应地减少。
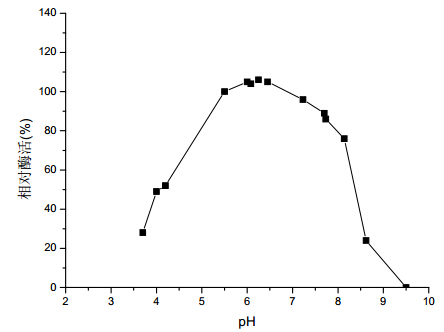
|
图4 pH 对蔗汁中 PPO 活性的影响 |
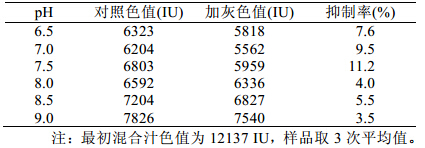
传统的亚硫酸法工艺,通常从提汁到预灰间隔 时间 5~10 min,为了评价在这段时间内提前预灰对 蔗汁澄清效果的影响,特进行了石灰澄清工艺的对 比实验,结果如表 2 所示。从表 2 中可知,甘蔗压 榨后迅速加灰进行澄清处理,均能有效地提高色素 的抑制率。其中,预灰至中性范围内 (pH7.0~7.5), 可达到最高的抑制效果,当预灰 pH7.5 时,抑制率 达到 11.2%; pH7.0 时,石灰法澄清后蔗汁的色值最 小,可能的原因是蔗汁的初始色值比 pH7.5 时小。 但 pH7.0 时石灰法澄清对蔗汁色值抑制率 9.5%小于 pH7.5 时的 11.2%。
| 表2 澄清过程对色值抑制的影响 |
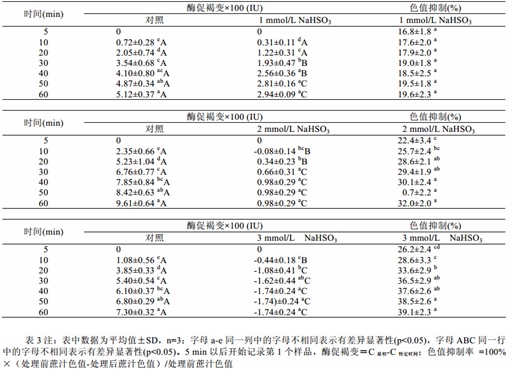
表 3 反映在 25± 2 ℃内,不同浓度的 NaHSO3 对蔗汁酶促褐变色值的影响。由表 3 可知,随着时 间的增加,在前 30 min 内,蔗汁酶促褐变导致色值 变化很显著(p<0.05),40 min 以后蔗汁颜色增加缓 慢,在 60 min 后,蔗汁酶促褐变基本结束,这些结 果与图 1 的研究一致。 NaHSO3 是一种广泛使用的 PPO 抑制剂,在 1 mmol/L 浓度的时候,蔗汁在 30 min 内褐变反应基本结束; 3 mmol/L 浓度时,能完全抑 制酶促过程的发生,表明了适宜地采用 NaHSO3 做 抑制剂,能有效地控制酶促的发生。
| 表3 不同浓度的亚硫酸氢钠对蔗汁酶促及色值变化的影响 |
( 1 )成熟甘蔗在压榨破碎时会发生褐变,褐变 生成的色值超过蔗汁色值的 1/2。常规条件下,酶促 过程基本在 60 min 内完成,前 10 min 是造成色泽增 加的最主要阶段,在传统的预灰 pH6.0~6.8 范围内, 并不能有效地抑制酶促过程的发生。
( 2)不同来源的蔗汁(蔗梢、成熟蔗茎、糖厂 初压汁),具有明显的色素差异,蔗梢汁颜色最深, 其次是糖厂初压汁,蔗茎汁色值最浅,其所含多酚 物质的种类和含量以及 PPO 活性的不同,造成其褐 变能力各异。
( 3)预灰 pH>9.5 时,PPO 活性为 0,但蔗汁 的加灰量并不和色值的抑制率有明显的相关性,即 并不是加灰量越大,色值的抑制率也越大。蔗汁压 榨加灰过程的褐变是多种褐变机制共同作用的结 果,在发生酶促褐变的同时伴随非酶褐变的发生, 在非酶褐变中,酚类化合物的氧化起到主要作用。
( 4) 3 mmol/L 的 NaHSO3 能完全抑制蔗汁酶 促褐变反应的发生。
| [1] | PATON N H, DUONG M Y, MANOFF C V, et al.Reversal of enzymic browning of sugarcane juice[J].International Sugar Journal 1994, 96(1150): 377-380.( 1) 1) |
| [2] | JIMENEZ P O, SAMANIEGO R L. Enzymic browning incane juice[J]. Crystallizer, 1981, 4: 4-11.( 1) 1) |
| [3] | PATON N H. Sugar cane phenolics and first expressedjuice color: Part II. Concentration of phenolics in sugarcane and color of first expressed juice[J]. InternationalSugar Journal, 1992, 94(1123): 157-160.( 1) 1) |
| [4] | PATON N H. Sugar cane phenolics and first expressedjuice color: Part I. Determination of chlorogenic acid andother phenolics in sugar cane by HPLC[J]. InternationalSugar Journal, 1992, 94(1121): 99-102, 108.( 1) 1) |
| [5] | CHEN C P, James. Cane Sugar Handbook[M]. New York:Elsevier, 1986.( 1) 1) |
| [6] | HUGOT E. Handbook of cane sugar engineering[M].New York: Elsevier, 1986.( 1) 1) |
| [7] | MADERO C F, FINNE G. Properties of phenoloxidaseisolated from gulf shrimp[R]. New Orleans:Proceedingsof the Seventh Annual Tropical and Subtropical FisheriesTechnological Conference of the Americas,1982.( 1) 1) |
| [8] | QUDSIEH H Y, YUSOF S, OSMAN A. et al. Effect ofMaturity on Chlorophyll, Tannin, Color, and PolyphenolOxidase (PPO) Activity of Sugarcane Juice (Saccharumofficinarum Var. Yellow Cane)[J]. Journal of Agriculturaland Food Chemistry, 2002, 50(6): 1615-1618.( 2) 2) |
| [9] | PHILLIPSON R T, PARKIN G, BURGE M L, et al.ICUMSA Methods Book(1994) with First(1998) andSecond(2000) Supplements[M]. Berlin: ICUMSA Press,2000: 41-43.( 1) 1) |
| [10] | VICKERS J E, GROF C P, BONNETT G D, et al.Overexpression of Polyphenol Oxidase in TransgenicSugarcane Results in Darker Juice and Raw Sugar[J].Crop Science, 2005, 45(1): 354-362.( 1) 1) |
| [11] | BUCHELI C S, ROBINSON S P. Contribution ofEnzymic Browning to Color in Sugarcane Juice[J].Journal of Agricultural and Food Chemistry, 1994, 42(2):257-261.( 1) 1) |
 2014
2014