2. 广州甘蔗糖业研究所 广东省甘蔗改良与生物炼制重点实验室, 广东广州510316;
3. 广西糖业研发中心, 广西南宁530002
2. Guangzhou Sugarcane Industry Research Institute, Guangdong Key Lab of Sugarcane Improvement & Biorefinery, Guangzhou 510316;
3. Guangxi Sugarcane Industry R&D Center, Nanning 530002
右旋糖酐(又称葡聚糖)是以葡萄糖单体形成 的聚合多糖,分子量由数万到数百万,其粘性随分 子量增大而增大。制糖中出现的右旋糖酐是由肠膜 明串珠菌分泌的右旋糖酐蔗糖酶催化合成产生[1], 它主要存在于砍收后甘蔗、火烧蔗、病虫害甘蔗和 压榨后的蔗汁中。右旋糖酐产生速度很快,在气温 比较高、生产卫生环境比较差的条件下,情况尤为 严重。国内研究人员作过调查发现:人工收割后的 新鲜甘蔗在自然条件下存放24 h后,初压汁中右旋 糖酐含量达到95.4 mg/kg°Bx,48 h 后达到150.3 mg/kg°Bx。机械收割甘蔗24 h 后右旋糖酐含量为 246.6 mg/kg°Bx,48 h后达到400 mg/kg°Bx 以上。 蔗汁中右旋糖酐可以每小时38%~44%的速度增长[2]。右旋糖酐的产生通常还伴随着蔗汁变酸变坏, 因为右旋糖酐蔗糖酶催化作用将蔗糖分子结构一半 的葡萄糖分子聚合形成右旋糖酐,而剩余的另一半 果糖分子随后被分解成有机酸[3]。右旋糖酐的存在 会对制糖生产造成不良后果,如蔗糖损失[4]、旋光 度虚假升高[5]、粘度增大、过滤性降低、影响沉降 速度和清净效率、降低传热效能、延长蒸发煮糖时 间、增加能耗、影响结晶[6]、影响产品的适用性等。
制糖生产中,主要通过提高甘蔗质量、重视生 产车间环境卫生以及使用一定量的杀菌剂,抑制肠 膜明串珠菌等微生物的生长繁殖,以减少甘蔗或蔗 汁中的右旋糖酐含量。但实际上很难做到完全避免 制糖原料中右旋糖酐的存在,尤其在榨季后期。除 去糖液中右旋糖酐最有效的方法是在制糖生产中加 入一定量的右旋糖酐酶,将右旋糖酐水解成小分子 量的寡糖或者葡萄糖单体,可有效地降低右旋糖酐 对制糖生产和产品质量的不良影响[7, 8, 9]。目前国内相 关研究主要应用外国生产的右旋糖酐酶,但是进口 的右旋糖酐酶价格较昂贵。本试验应用本研究室自 主研发生产的右旋糖酐酶进行除去蔗汁中右旋糖酐 的试验,探索其最佳条件,为其在制糖生产的应用 提供科学数据。 1 材料与方法 1.1 材料与仪器
甘蔗汁:广州甘蔗糖业研究所;右旋糖酐酶: 广州甘蔗糖业研究所;标准右旋糖酐:美国法玛西 亚公司;右旋糖酐单克隆抗体免疫比浊检测试剂盒: 广州甘蔗糖业研究所;氢氧化钠,盐酸为分析纯。
MCA-SucroseTM浊度计(配套四面透光型1 cm 的一次性塑料测试皿):美国Midland公司;pH测 定仪:梅特勒-托利多仪器(上海)有限公司;自动 阿贝折射仪:上海精密科学仪器有限责任公司; DK-S24型电热恒温水浴箱:上海精宏实验设备有限 公司;AL104电子分析天平:美国Mettler公司。 1.2 检测方法
右旋糖酐酶酶活测定:DNS法[10];蔗汁右旋糖 酐含量测定:免疫比浊法[11, 12]。 1.3 实验方法 1.3.1 原料预处理及酶活测定
取新鲜蔗汁,接入少量肠膜明串珠菌,在自然 条件下放置并不定时采样测定其右旋糖酐含量,待 含量达到800~900 mg/kg°Bx(对锤度)时用于实验, 取右旋糖酐酶发酵液准确测定其酶活,并适当稀释, 置于4℃冷藏,并于当天实验使用。 1.3.2单因素试验 1.3.2.1 pH值
取800 mL蔗汁,测定其右旋糖酐含量,再平 均分装到100 mL锥形瓶中,用NaOH或HCl溶液 分别将pH值调到4.5、5.0、5.5、6.0、6.5、7.0、7.5、 8.0,每个样品加入1 mL右旋糖酐酶稀释液(加入 量为0.1 U/mL蔗汁),置于60℃水浴中搅拌10 min, 迅速取出加热煮沸灭活2 min,冷却至室温后分别测 定各组样品的右旋糖酐含量。 1.3.2.2 温度
取5个编号的锥形瓶,分别装入100 mL蔗汁, 测定其右旋糖酐含量,再用NaOH或HCl溶液将pH 值调至6.0,然后分别都加入1 mL右旋糖酐酶稀释 液(加入量为0.1 U/mL蔗汁),分别置于40、45、 50、55、60℃(温度控制±1℃)的水浴中搅拌10 min, 之后操作与1.3.2.1同。 1.3.2.3 反应时间
取6个编号的锥形瓶,分别装入100 mL蔗汁, 测定其右旋糖酐含量,再用NaOH或HCl溶液将pH 值调至6.0,然后分别都加入1 mL右旋糖酐酶稀释 液(加入量为0.1 U/mL蔗汁),分别置于60℃水浴 中搅拌5、10、15、20、25、30 min,之后操作与 1.3.2.1同。 1.3.2.4 物料浓度
各取100 mL蔗汁用精糖将其锤度分别调成15、 20、25、30、35、40、45、50、55、60 °Bx(浓度 控制±1 °Bx)的蔗汁,测定其右旋糖酐含量,再用 NaOH或HCl溶液将pH值调至6.0,然后分别都加 入1 mL右旋糖酐酶稀释液(加入量为0.1 U/mL蔗 汁),再置于60℃水浴中搅拌10 min,之后操作与 1.3.2.1同。 1.3.2.5 酶剂量
取不同右旋糖酐含量的蔗汁(100±50、300±50、 500±50、700±50、900±50、1100±50、1300±50 mg/kg°Bx)各500 mL,准确测定其右旋糖酐含量, 再用NaOH或HCl溶液将pH值调至6.0,再分别将 每个右旋糖酐含量梯度的蔗汁分到5个编号锥形瓶 中,每个编号分别加入右旋糖酐酶稀释液0.2、0.5、 1.0、1.5、2.0 mL(酶加入量分别是0.02、0.05、0.1、 0.15、0.2 U/mL蔗汁),再置于60℃水浴中搅拌10 min,迅速取出加热煮沸灭活2 min,冷却至室温后 分别测定各组样品的右旋糖酐含量。 1.3.3 响应曲面优化试验
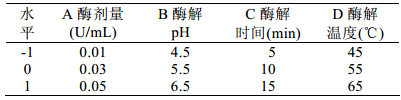
响应面法(RSM)是采用多元二次回归方程作 为函数估计的工具,将实验中多因素与指标的相互 关系用多项式近似拟合,依此可对函数的响应值进 行分析,研究因子与目标函数之间因子与因子之间 的相互关系[13]。在单因素对右旋糖酐酶水解右旋糖 酐效果基础上,通过响应曲面法对右旋糖酐酶除去 蔗汁中右旋糖酐的效果进行优化,得到右旋糖酐酶 应用于制糖生产除去蔗汁中右旋糖酐的最佳工艺条 件。响应面分析因素与水平见表1。
| 表1 Box-Behnken试验设计因素编码及水平 |
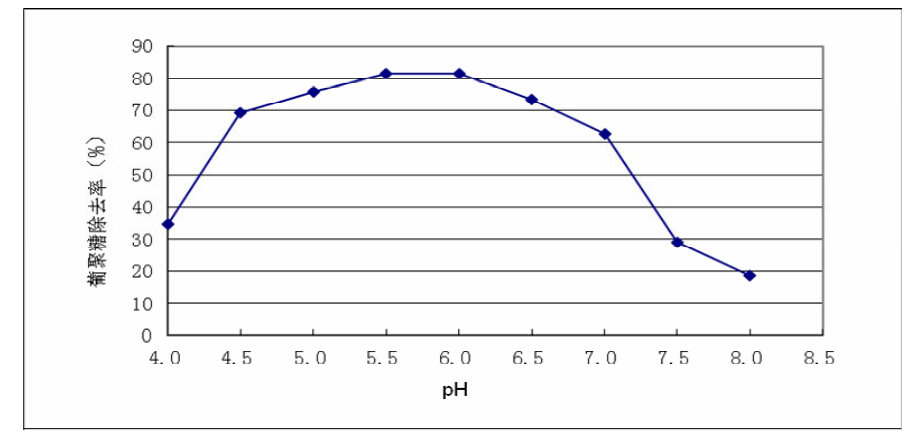
其影响见图1。从图1可知,在加酶量为0.1 U/mL蔗汁、反应温度为60℃、反应时间为10 min 条件下,随着pH升高,蔗汁中右旋糖酐的去除率 先升后降:当pH为5.5~6.0时,右旋糖酐的去除 率最高达到80%以上;此后随着pH升高,右旋糖 酐去除效果逐渐降低;当pH大于7.0时,酶的作用 效果急剧下降。说明右旋糖酐酶在pH为5.5~6.0 的条件下酶的活性最高,该条件与制糖生产过程中 的初压汁、预灰之前混合的pH范围一致。
|
图1 pH对右旋糖酐酶降解右旋糖酐效果的影响 |
其影响见图2。结合制糖生产中混合汁及渗浸 稀汁的温度条件,将试验温度范围设计在40~60℃ 之间。从图2可知:在温度为40~55℃范围,随着 温度的升高,右旋糖酐酶的作用效果越来越好,对 蔗汁中右旋糖酐去除率也随之增大,但增加幅度不 显著,去除率从40℃的75.89%提高到55℃的 82.00%;60℃比较55℃右旋糖酐去除率稍有下降。 实验表明在30℃~60℃之间该右旋糖酐酶的稳定性 良好,随着温度的升高酶蛋白的活化分子增加,酶 促反应加快,右旋糖酐去除率随之增加,但当温度 升高到酶蛋白的热变性点时,酶活性开始下降[14]。 温度在40~60℃范围内,该酶均保持较高活性,对 蔗汁中右旋糖酐去除率达到75%以上。

|
图2 温度对右旋糖酐酶降解右旋糖酐效果的影响 |
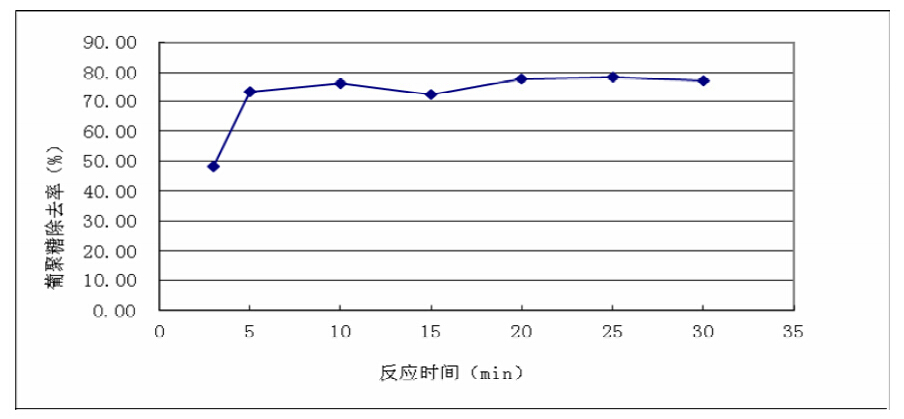
其影响见图3。从图3看出,在0~5 min范围 内,随着反应时间的增加,右旋糖酐去除率显著增 大,5 min时去除率达到76.35%,反应时间大于5 min 后去除率没有明显增大。酶是一种高效催化剂,在 反应中未被消耗,理论上,随着反应时间的增加, 右旋糖酐的去除率也逐渐增加,但实验结果显示并 非如此,说明在60℃的条件下作用5 min后使该α 右旋糖酐酶活性有所下降。
|
图3 反应时间对右旋糖酐酶降解右旋糖酐效果的影响 |
其影响见图4。从图4可知:在蔗汁浓度为15~ 35 °Bx范围内,蔗汁浓度的增大对右旋糖酐酶催化 水解右旋糖酐没有明显影响;当蔗汁浓度大于35 ゜Bx,随着浓度的增大,酶促反应速率逐渐下降; 达到65 °Bx时,右旋糖酐的去除率只有34.73%。其 原因可能是在浓度小于35 °Bx时,传质效果良好, 酶与底物接触充分;当蔗汁浓度大于35 °Bx时,随 着浓度增加、粘度增大,酶与底物不能有效充分接 触,或活化水减少使酶促反应下降[15]。
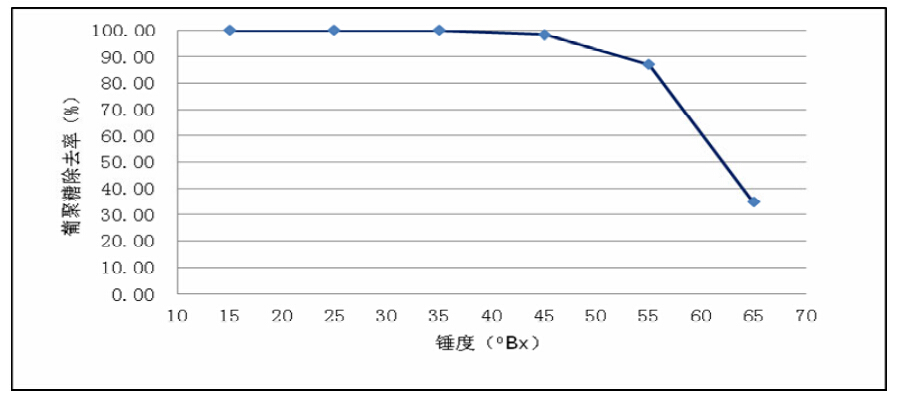
|
图4 物料锤度对右旋糖酐酶降解右旋糖酐效果的影响 |
其影响见图5。从图5可以看出:在反应温度 为60℃、反应时间为10 min的相同条件下,当蔗汁 中右旋糖酐含量只有89 mg/kg°Bx时,添加酶剂量 为0.02 U/mL对蔗汁,右旋糖酐去除率达100%;当 蔗汁中右旋糖酐含量为494 mg/kg°Bx时,添加酶剂 量为0.02 U/mL对蔗汁,去除率37.25%;当加酶量 为0.05 U/mL对蔗汁可去除全部右旋糖酐;当蔗汁 右旋糖酐达到870~1508 mg/kg°Bx时,添加0.05 U/mL对蔗汁的酶剂量,亦可去除80%以上右旋糖 酐;当加酶量增加到0.1 U/mL对蔗汁时,可全部除 去蔗汁中的右旋糖酐。
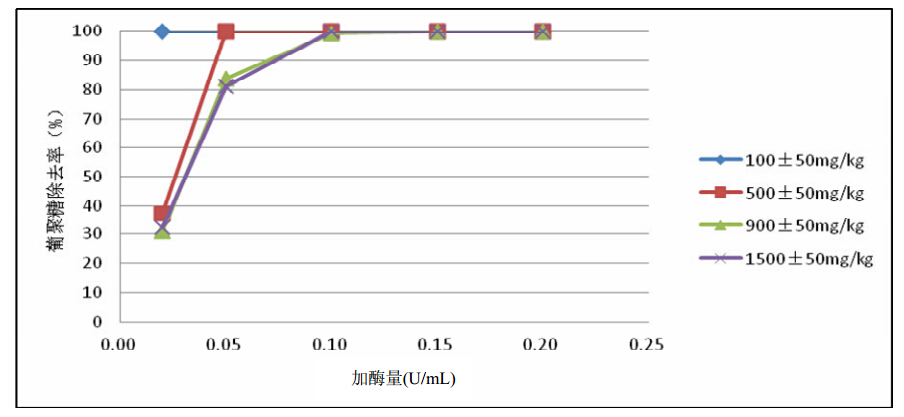
|
图5 酶剂量对右旋糖酐酶降解右旋糖酐效果的影响 |
根据Box Benhnken的中心组合试验设计原理, 综合单因素试验影响结果,选择酶剂量(A)、酶解 pH(B)、酶解反应时间(C)和酶解反应温度(D)4 个因 素,进行3水平响应面分析试验,利用Design Expert 软件试验数据进行二次多元回归拟合,得到右旋糖 酐酶作用的效果模型,即蔗汁中右旋糖酐去除率与 自变量A、B、C、D 的二次回归方程: R1=97.35+11.73A+0.34B+4.74C-34.69D-1.63AB-2.14 AC+2.57AD-2.01BC+0.91BD-0.027CD-3.11A2-9.40B2-1.513C2-42.98D2。
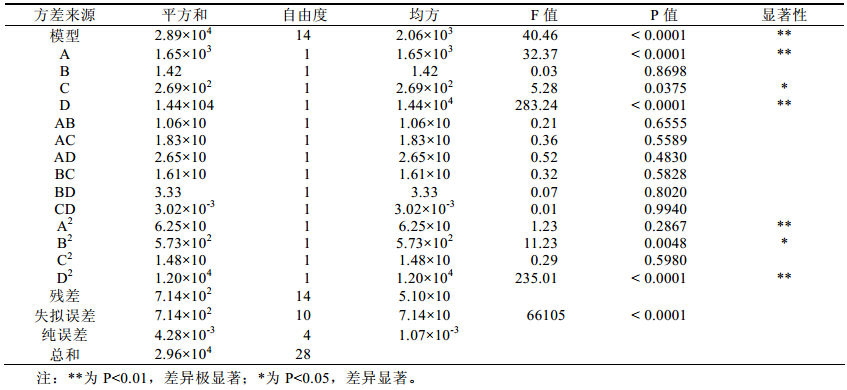
方差分析及显著性检验结果见表2、表3。结 果 表明:该回归模型极显著(P<0.0001),其决定系数 为R2=0.9759,Pred R2=0.8611,说明该模型预测性 良好;变异系数C.V<10%,表明实验数据的变异性 程度小。因此可以用该模型分析和预测右旋糖酐酶 水解蔗汁中右旋糖酐的效果。此外,一次项A、D 以及二次项A2、D2对右旋糖酐酶作用效果影响极显 著;一次项C和二次项B2对右旋糖酐酶作用效果影 响显著;交互项均不显著,说明各因素之间相互作 用不明显。
| 表2 回归方程方差分析 |
| 表3 模型的可信度分析 |
图6为响应面立体分析图及等高线图。通过观 察可以直观地反应A、B、C、D各因素对响应面值 的影响,如图6所示。从图6-1、6-2和6-3可知: 随着酶剂量的增加,酶解作用效果越来越明显,对 蔗汁中右旋糖酐的去除率越高,可观察到立体图向 酶剂量增加方向上扬趋势;当酶剂量一定时,随着 酶解pH值的增加,酶解作用对右旋糖酐去除率先 增大后减小,在pH 5.5处达到最高;随着酶解反应 时间的增加,右旋糖酐去除率也随之增加,但是超 过13 min后变化趋势很微弱,原因可能是反应13 min后酶活有较大损失;随着酶解反应温度的增加, 右旋糖酐去除率先增大后减小,在53℃达到最大; 从图6-4、6-5和6-6可以看出:酶解pH值固定时, 右旋糖酐去除率随时间的增加而增加、随着温度的 增加先增加后降低,在53℃处达到最高;当酶解反 应温度一定时,随着酶解pH增大右旋糖酐去除率 先增大后减小,在pH5.5达到最大,去除率随着反 应时间的增加而增加。从响应面立体图可看出,右 旋糖酐去除率对酶剂量(A) 及酶解反应温度(D)2 个 因素较敏感,曲面较陡;酶解反应时间和酶解pH 代表的曲面比较平缓,说明在4.5~6.5pH范围内, 该右旋糖酐酶较稳定且催化活性较高,5 min酶解反 应可分解大部分右旋糖酐。

|
图6 响应面立体分析图及等高线图 |
通过软件分析出右旋糖酐酶水解蔗汁中右旋糖 酐的最佳工艺条件:酶剂量为0.05 U/mL蔗汁,pH 为5.31,反应时间为14.94 min,反应温度为:51.35 ℃。根据优化条件进行验证试验,将条件选为:酶 剂量为0.05 U/mL蔗汁,pH为5.3,反应时间为15 min,反应温度为51℃,蔗汁右旋糖酐含量为859 mg/kg。试验结果表明,5组平行试验中4组样品酶 解反应后检测不出右旋糖酐,1 组测出7.21 mg/kg°Bx,所以在该优化条件下,右旋糖酐酶可以 很有效地除去蔗汁中右旋糖酐。 3 结论
通过单因素实验探讨了右旋糖酐酶剂量、酶解 pH、酶解反应时间、酶解反应温度和物料浓度对应 用右旋糖酐酶水解蔗汁中右旋糖酐效果的影响,并 在此基础上采用响应面法试验设计建立主要因素对 酶解作用效果影响的预测模型,确定了最佳工艺条 件:酶剂量为0.05 U/mL蔗汁,pH为5.3,反应时 间为15 min,反应温度为51℃,在此条件下可将蔗 汁中859 mg/kg°Bx的右旋糖酐除去。该工艺条件适 合在制糖生产压榨工段应用右旋糖酐酶,除去混合 汁中存在的右旋糖酐,为进一步研究右旋糖酐酶在 制糖工业上应用提供参考。
| [1] | CLARKE M A, ROBERTS E J, GOLDSHELL M A, et al. Sucrose loss in manufacture of cane sugar[J]. Sugar Y Azucar 1980, 75:64-68. ( 1) 1)
|
| [2] | 梁达奉, 曾练强, 郭亭, 等. 葡聚糖对制糖工业的影响及对策(上)[J]. 甘蔗糖业, 2008(3):28-33. ( 1) 1)
|
| [3] | EGAN B T. Gum content and pH as measures of the losses due to sour storage rot[J]. Proc Queensland Soc. Sugar Cane Technol 1967, 35:31-37. ( 1) 1)
|
| [4] | 贺湘, 赵振刚, 于淑娟, 等. 葡聚糖酶在甘蔗混合汁澄清中的应用[J]. 生物工程, 2012, 33(9):175-179. ( 1) 1)
|
| [5] | 周文红, 刘慧霞, 张建法, 等. 葡聚糖含量使糖度测定值虚假增加的影响研究[J]. 广西蔗糖, 2009(3):38-41. ( 1) 1)
|
| [6] | GILLIAN E. Deterioration of cane juice -sources and indicators[J]. Food Chemistry, 2002, 78:95-103. ( 1) 1)
|
| [7] | CLARKE M A, EDYE L, COLE F, et al. Sugarcane factory trials with dextranase enzme[J]. Sugar Journal, 1997:20-22. ( 1) 1)
|
| [8] | MADHU G L, PRABHU K A. Application of dextranase in the removal of dextran from cane juice[J]. Internatonal Sugar Journal, 1986, 1025:136-138. ( 1) 1)
|
| [9] | GILLIAN E, ADRIAN M, BELISARIO M. Application of dextranases in sugarcane factory: Overcoming practical problems[J]. Sugar Tech, 2009, 11(2):135-141. ( 1) 1)
|
| [10] | 黎志德, 蚁细苗, 黄思鸿, 等. 聚乙二醇一硫酸铵双水相体系萃取α-葡聚糖酶[J]. 甘蔗糖业, 2013(1):38-42. ( 1) 1)
|
| [11] | LIANG D F, YAN J H, ZENG L Q. Generation of anti-dextran monoclonal antibody and development of immunonephelometry for quantitative detection of dextran[J]. International Sugar Journal, 2011, 113:1354. ( 1) 1)
|
| [12] | 柳颖, 蚁细苗, 林荣珍, 等. 免疫比浊法定量检测葡聚糖的研究[J]. 甘蔗糖业, 2013(5):1-2. ( 1) 1)
|
| [13] | 慕运动. 响应面方法及其在食品工业中的应用[J]. 郑州工程学院学报, 22(3):91-94. ( 1) 1)
|
| [14] | 张佳程, 师进生. 食品物理化学[M]. 北京:中国轻工 业出版社, 2007:50-54. ( 1) 1)
|
| [15] | GILLIAN E, ADRIAN M, BELISARIO M. Application of dextranases in sugarcane factory: Overcoming practical Problems[J]. Sugar Tech, 2009, 11(12):135-141. ( 1) 1)
|
| [16] | 孙海涛, 邵信儒. 响应面法优化超声波提取山核桃壳色素工艺[J]. 东北林业大学学报, 2012, 40(2):75-77. ( 1) 1)
|
| [17] | 贺湘, 赵振刚, 于淑娟, 等. 葡聚糖酶应用于甘蔗混合汁的工艺优化[J]. 食品工业科技, 2012, 33(4):330-335. ( 1) 1)
|
 2013
2013