2. 广西大学轻工与食品工程学院, 广西南宁 530004;
3. 广东工业大学轻工化工学院, 广东广州 510006
2. Guangxi University, Institute of Light Industry and Food Engineering, Nanning 530004;
3. Guangdong University of Technology, Faculty of Chemical Engineering and Light Industry, Guangzhou 510006
α- 葡 聚 糖 酶 ( Dextranase , 1,6-α-D-glucan- 6-glucanohydrolase,EC 3.2.1.11)是一种可以随机 水解葡聚糖中 α-1,6 糖苷键的水解酶, 终产物包括了 异麦芽糖、异麦芽三糖、葡萄糖以及少量低聚糖[1]。 在制糖工业中,由于微生物感染形成的葡聚糖对工 艺流程的各个方面都有不同程度的不良影响,主要 体现在糖分损失、粘度上升、旋光度虚高、晶体变 形等方面,而 α-葡聚糖酶的应用可以在原有的工艺 条件下减轻上述不良影响[2]。本文中的 α-葡聚糖酶 是由毕赤酵母基因工程菌株发酵得到,由于发酵液 中杂质较多,因此需要研究一种成本较低,操作简 单的分离纯化方法。双水相萃取与传统分离纯化技 术相比,其两相含水量高,体系中的 PEG 等高聚物 亦可作为稳定剂,常温下操作酶活也不易损失,设 备简单操作方便,特别适用于含菌体或细胞碎片的 粗酶液纯化;另一方面,通过连续的萃取即可使酶 达到相当高的浓度,因此可以作为分离胞内或胞外酶的有效手段[3]。而正因为其相对温和的操作条件 以及高效的分离效率,使之被广泛应用在细胞器、 蛋白质、多肽、氨基酸、核酸等分离纯化工艺上[4]。 本文主要研究 α-葡聚糖酶在聚乙二醇-硫酸铵双水 相体系中的分配行为,并从中寻找该双水相体系中 分离纯化的最佳工艺条件。
α-葡聚糖酶粗酶液:毕赤酵母工程菌发酵液, 经 12000 r/min,离心 10 min 后取上清,置于 4℃冷 藏备用;聚乙二醇 4000、6000、8000,标准葡聚糖 底物 T-2000:美国法玛西亚公司;3,5-二硝基水杨 酸:国药集团化学试剂有限公司;考马斯亮蓝 G-250:北京鼎国生物技术有限公司;硫酸铵,85% 磷酸,95%酒精,氢氧化钠,无水亚硫酸钠,苯酚, 四水合酒石酸钾钠: 广州化学试剂厂 (均为分析纯) 。
Unico 2800 紫外-可见分光光度计,恒温水浴 锅,电子分析天平、高速离心机。
将小三角瓶放置于电子分析天平上,调零;向 三角瓶滴加一定量 50% (w/w) 浓度的 PEG 溶液 (简 称 P) , 记录重量后调零; 接着加入少量水 (简称 W) , 调零后再滴加 30%(w/w)浓度的硫酸铵溶液(简 称 Q) ,边振荡边滴加,直到混合物呈现混浊状态, 显示溶液中己形成不相溶的两相,记录加入 Q 的总 量,天平调零;然后,向混合物滴加一定重量的水, 经振荡后,重新呈现澄清状态,表明溶液又回复成 单相,记录加入水的重量,天平调零;接着,再一 次滴加 Q,重复上述步骤。累积到一定的点数后, 分别以两相点上的PEG质量分数和硫酸铵质量分数 作为纵坐标和横坐标,可得一系列以 PEG 和硫酸铵 构成的双水相系统的相图曲线。
以 50%(w/w)的 PEG 溶液、30%(w/w)的 硫酸铵溶液和蒸馏水组成双水相体系,加入 1.5 mL 的 α-葡聚糖酶粗酶液,总重量在 10 g 左右,总体积 在 9.5 mL 左右。 震荡、 摇匀, 以 2000 r/min 离心 5 min 帮助分成两相,并使酶液得到充分萃取。
每分钟在标准葡聚糖底物 T-2000 中释放出 1 μmol还原糖所需的酶量为 1 个酶活单位, 以 U表示。
取 900 μL 2%(w/w)的标准葡聚糖(T-2000)溶 液,置于 45℃恒温水浴中保温不少于 5 min,然后 加入经适当稀释的酶液 100 μL。精确反应 10 min, 立即置于沸水以终止反应并加入 2 mL DNS, 沸水浴 5 min,迅速将其冷却,用蒸馏水定容至 25 mL,于 540 nm 下测定吸光值。然后,从标准曲线的回归方 程求得相对应的葡萄糖的量,并折算出酶活。
相比 R = Vp/Vn
萃取率 Y(%)= Up×Vp/(Up×Vp+Un×Vn)
比活力 U0 = Up/Pp
回收率 Z(%)= Up×Vp/(Ue×Ve)
其中 Vp、Vn和 Ve分别表示上下相的体积以及 加入酶液的体积,Up、Un和 Ue分别表示上下相的 酶活和酶液的原始酶活, Pp表示上相中的蛋白浓度; 两相中,上相为 PEG 相,下相为无机盐相。
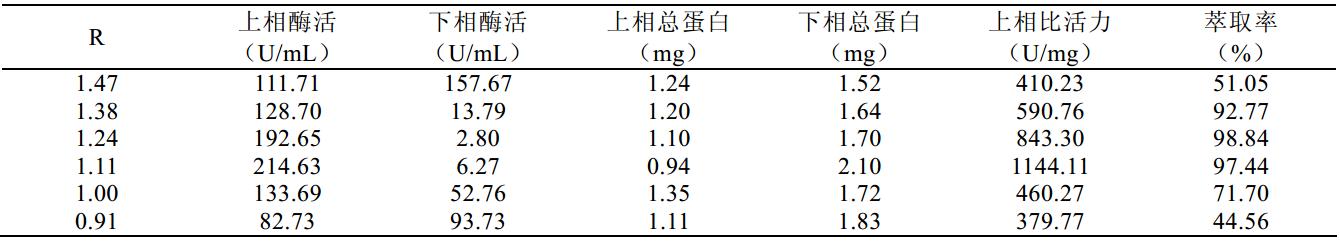
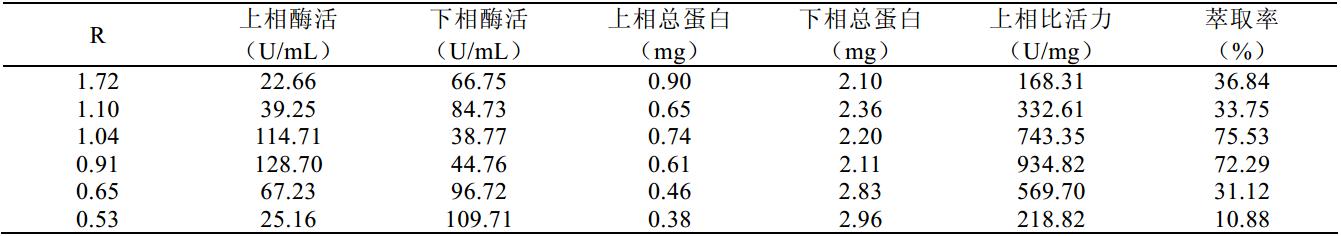
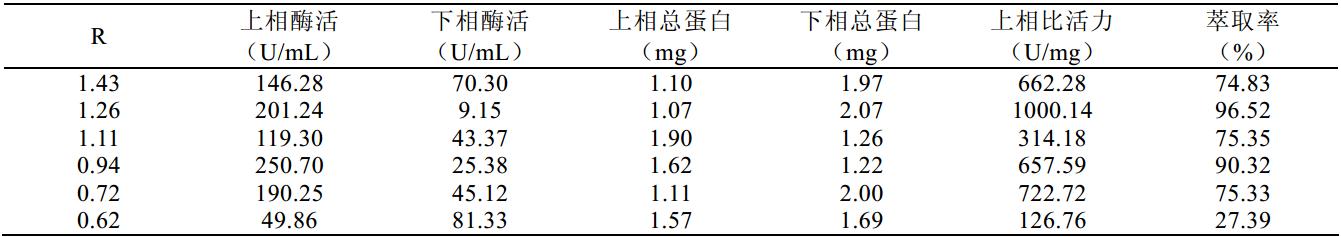
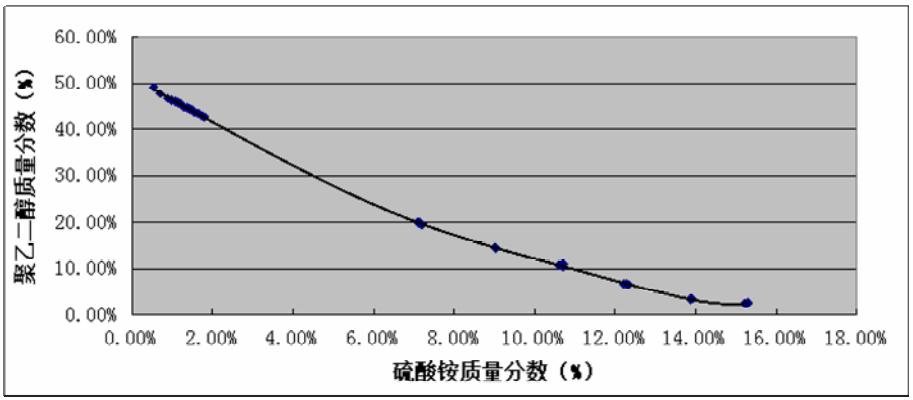
图 1~图 3 及表 1~表 3 分别是 PEG4000、 6000、 8000 与硫酸铵组成系统时的双水相相图及数据。由 图中结线可以得知不同分子量的聚乙二醇所构成的 系统,在临界分相浓度上是有较明显的差异:聚乙 二醇的分子量越大,临界分相浓度越低;反之,聚 乙二醇的分子量越小,临界分相浓度就增大。另一 方面,各个相图结线趋向于 x 轴的趋势,聚乙二醇 分子量越大也是越加明显。这可能是因为随着聚乙 二醇的分子量上升,单个分子的空间体积变大,受 到相互阻碍的程度也上升,渗透作用变小导致临界 浓度变低;从另一角度说,聚乙二醇的亲水性是来 源于分子中的羟基等亲水基团, 随着分子量的增大, 亲水基团的比例逐渐下降,分子的亲水性则慢慢减 弱,聚乙二醇溶液与硫酸铵溶液相互的排斥动力加 大,因而形成两相的临界浓度就变低。
|
图1 PEG4000双水相相图 |

|
图2 PEG6000双水相相图 |

|
图3 PEG8000双水相相图 |
| 表1 PEG4000双水相萃取α-葡聚糖酶 |
| 表2 PEG6000双水相萃取α-葡聚糖酶 |
| 表3 PEG8000双水相萃取α-葡聚糖酶 |
根据相图,以质量分数为 50%的不同分子量 (4000、6000、8000)的 PEG 溶液以及 30%的硫酸铵溶液组成多个不同相比的双水相系统,分别对每 个双水相系统样本的上、下相分别测定其酶活、蛋 白含量、上相的比活力和萃取率,再选择出效果最 佳的聚乙二醇分子量。值得注意的是,在实验过程 发现不同样本中两相界面可能会有少量的沉淀析 出,这可能是导致同一分子量体系不同样本中蛋白 含量存在差异的原因。
由以上图表可以看到,所得样本的比活力整体 上以 PEG4000 为高, PEG6000 所组成的双水相系统 中,上相酶活普遍是偏低的,而 PEG8000 所组成的 双水相体系获得的最高酶活与 PEG4000 比较接近, 但萃取率相对 PEG4000 显得比较低,另一方面,随 着相比变化萃取率的变化趋势没有前两者一致,在 实际操作中不容易把握,因此选取 PEG4000 比较适 宜。
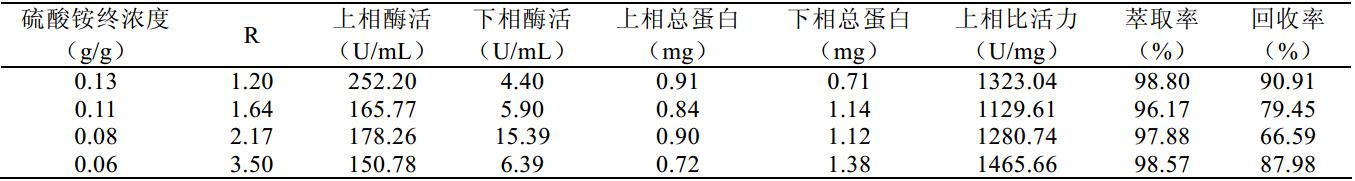
在调整 PEG4000 在最终形成双水相系统中的 浓度时,要注意所成相的的点要在相图结线以上的 区域,否则将无法稳定两相。同时,所在的点越接 近结线,两相稳定所需时间就越长。因此,根据相 图,在保证体系落在两相区内的前提下,逐渐下降 (NH4)2SO4浓度,以质量分数为 30%的 PEG4000, 不同浓度的硫酸铵以及粗酶液, 按照质量比为 4: 4: 1.5 的比例组成双水相体系进行萃取实验(表 4) 。
其中采用经预处理的粗酶液原始酶活为 778.98 U/mL, 总蛋白 1.97 mg/mL, 根据所获得样本的相比、 酶活、总蛋白量、上相比活力,萃取率以及最终回 收率进行比较,选取最优的(NH4)2SO4浓度。
| 表4 不同质量分数(NH4)2SO4双水相萃取α-葡聚糖酶 |
从表 4 上可以得知随着盐浓度的下降,上相的 比例迅速上升,单位体积的酶活也相应下滑。由于 系统整体上的萃取率并没有明显的改变,而且比活 力和回收率都相对接近的前提下,为了往下处理更 加方面,因此更倾向于相比相对更小的 13%。由上 述现象也可以得出推论,在 PEG-(NH4)2SO4的双水相体系中,α-葡聚糖酶更加倾向于溶解在 PEG 相, 且(NH4)2SO4浓度对其分配倾向没有明显的影响。 但 盐溶液的浓度和比例, 对两相相比有着明显的影响, 高盐浓度可有效压缩 PEG 相的体积,保证在萃取过 程中酶液没有被大幅度稀释,因而选择 13%终浓度 的硫酸铵是有利的。
根据相图,保证其它参数不变,以不同浓度的 PEG4000 溶液,30%的硫酸铵溶液与粗酶液,按 4: 4:1.5 的比例配成双水相系统,所得数据如表 5。
| 表5 不同质量分数PEG4000双水相萃取α-葡聚糖酶 |
由表 5 中数据可以得知,随着双水相系统中 PEG4000 浓度的下降,上相的比活力是逐渐上升, 这是由于两个方面的原因: 首先是两相比例的变化, 上相在系统中所占的体积逐渐变小,这有一定程度 的浓缩作用;其次,由于下相盐溶液比例的增加, 更有利于原来粗酶液中水溶性,盐溶性物质往下相 分配,使得上相的总蛋白含量在浓缩效应影响下还 是有一定程度的下降。综合来看,13%的 PEG4000 终浓度是最佳的,因为在这个浓度下,下相的酶活 是最低的,萃取率和回收率最高,而上相的蛋白浓 度处于一个低的水平,上相体积也比较小,有利于 下一步的处理。
经研究表明,以 PEG-(NH4)2SO4双水相系统从 经过离心处理的发酵液中,萃取 α-葡聚糖酶是可行 的,在 PEG4000 终浓度为 13%,(NH4)2SO4终浓度 为 13%时候,PEG 相的比活力达到 2364.97 U/mg, 萃取率为 99.94%,回收率为 97.98%。
| [1] | 梁达奉.α-葡聚糖酶的基因工程菌构建、发酵及其应用研究[D]. 广州:广东工业大学,2011. ( 1) 1)
|
| [2] | 梁达奉,曾练强,郭亭,等.葡聚糖对制糖工业的影响及对策(上)[J]. 甘蔗糖业,2008(3):28-33. ( 1) 1)
|
| [3] | 王金胜.酶工程[M]. 北京:中国农业出版社,2007:124-125. ( 1) 1)
|
| [4] | 郑楠,刘杰.双水相萃取技术分离纯化蛋白质的研究[J]. 化学与生物工程,2006,23(10):7-9. ( 1) 1)
|
| [5] | 赵亚华.生物化学与分子生物学实验技术教程[M]. 北京:高等教育出版社.2005:95-96. ( 1) 1)
|
 2013
2013