2. 广西大学轻工与食品工程学院, 广西, 南宁, 530004
2. Insiute of Light Industry and Food Engineering, Guangxi University, Nanning Guangxi 530004
随着当今制糖工业技术的进步,制糖副产物糖 蜜的纯度越来越低,糖蜜中含的非发酵性糖分、无 机盐灰分、胶体和有机酸越来越多[1],其中有机酸 会抑制酵母活性,灰分会导致载体和粗馏塔结垢, 焦糖色素及胶体会吸附在酵母细胞表面从而影响细 胞传质,严重时会引起细胞大片絮凝结团,最终导 致发酵不良、出酒率低等现象[2]。早期传统的 As 2.1189、As 2.1190 等菌种对这种新型的糖蜜显得越 来越不适应,所以驯化糖蜜酿酒酵母以适应低纯度 糖蜜对当今糖蜜酒精工业有重要意义。传统驯化方 法是把糖蜜酿酒酵母逐步接种于糖蜜锤度渐进升高 的发酵培养基中[3],此种方法是依靠酵母本身的基 因改变自动去适应外界环境因素,过程可想而知是 漫长而无序的, 一般驯化周期是长达一年甚至几年。 本文在此基础之上加上紫外诱变,让酵母基因组发 生人为快速的改变从而定向筛选到适应高锤度的糖 蜜培养基的诱变酵母[4],此诱变酵母在发酵培养基 中形成集体增殖优势,之后再分离纯化筛选得到诱 变酵母的单菌落。此过程比酵母自动适应要快,效 率要高。本文选育出 2 株较好适应糖蜜的菌株,显 微镜下观察细胞个体形态较原始出发株饱满,发酵 速度有较大提高。
菌种 As 2.1189,由广州甘蔗糖业研究所保存; 糖蜜,由广东徐闻三和发展有限公司提供;驯化培 养基: 34.5゜Bx 糖蜜、 37.5゜Bx 糖蜜, pH3.8, 10 ppm 杀菌剂,0.2%尿素;高糖平板:25゜Bx 糖蜜,pH 自然,0.2%尿素,1.5%琼脂粉;发酵培养基:36゜ Bx 糖蜜,pH4.0,0.2%尿素。
第 1 阶段:取 4.5 mL 驯化液至平皿,20 W 紫 外灯照射 20~25 min, 取 2 mL 诱变液分别接种至 2 瓶 40 mL 的 34.5゜Bx 糖蜜培养基中, 34℃静止培养 24 h,称重,选取失重大者作为下一代诱变出发菌 重复以上步骤,50 代后,失重速率缓慢提升,转入 第 2 阶段。
第 2 阶段:取 4.5 mL 第 1 阶段驯化液至平皿, 20 W 紫外灯照射 25~30 min,取 2 mL 诱变液分别 接种至 2 瓶 40 mL 的 37.5゜Bx 糖蜜培养基中,34 ℃静止培养 24 h,称重,选取失重大者作为下一代 诱变出发菌。重复以上步骤,50 代后,失重速率逐 渐提升,分离筛选单菌落,YPD 斜面保存。
初筛:取第 2 阶段最终诱变驯化液稀释涂布 25 ゜Bx 高糖平板, 每个平板菌落数在 20~30 个为宜, 放置 34℃培养 2 d,每个平板挑选 2 个菌苔边缘圆 整、饱满者做之字划线分离,将划线分离的平板置 于 34℃培养 2 d,继续挑取单菌落再做之字划线分 离,确保分离到纯种,最后挑取单菌落做斜面保藏 并编号。
复筛:将初筛的 10 株菌和初发菌接种于 YPD 活化液培养 16 h,测 OD600,调整至同一 OD 值,按 10%的接种量接种至发酵培养基。测残糖、酒度、 发酵周期。
由于一共有 100 代诱变驯化,数据量繁多,本 文只选取其中 12 代的数据
| 表1 川选2003-1的出苗数和出苗率及其与对照的比较 |
从以上数据看出第 1 阶段即 1~50 代,天失重 量阶段性提升,从最初的 2.41 g/d 增加到 2.63 g/d, 失重速率提升了 9.1%,这说明酵母发酵周期缩短, 同等渗透压下酵母发酵能力增强。第 2 阶段即 51~ 100 代,天失重量也是逐渐提升,由 2.12 g/d 上升至 2.32 g/d,天失重增加了 7.6%,但天失重量比第 1 阶段的每代都要少,主要原因是该酵母最高耐受糖 蜜锤度为 34.5゜Bx,如果锤度增加到 37.5゜Bx 以 后会抑制酵母的活力及发酵力。总体来讲,经过 2 个阶段的诱变驯化, 该酵母对 34.5゜Bx 和 37.5゜Bx 糖蜜的耐受能力都较初始出发菌有一定提高,即该 酵母更适应高浓度糖蜜发酵。
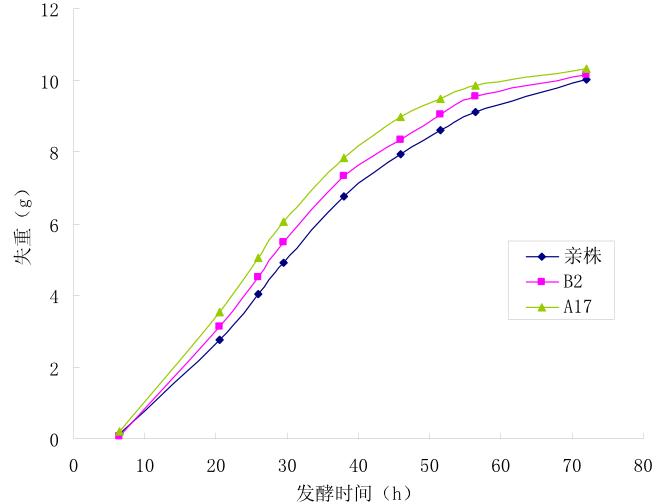
经过浓糖发酵实验,从 10 株初筛菌里挑选到 2 株诱变驯化株,分别命名为 B2 和 A17,图 1 为 3 株菌的发酵失重量对比,表 2 为发酵结束时 3 株菌 的产酒度和残糖数据。
图 1 可以看出,A17 比亲株发酵快 8~10 h,发 酵速率提升约 12%,B2 发酵速率提升约 6%,考虑 系统误差,3 株菌的最终发酵失重相当。 由表 2 可以看出驯化诱变株的产酒度相对提升 了 2%~3%(v/v) ,残糖相对亲株降低了 2%~3%。 总而言之,驯化诱变株的发酵速度提升相对较高, 说明诱变筛选株发酵活力更强,高渗透压等胁迫因 素对发酵酶系的抑制减弱。这有利于大生产中提高 设备利用率,增加酒精日产量,降低吨酒精所耗劳 务、折旧等生产成本。
|
图 1 亲株和诱变驯化株发酵失重对比 |
| 表 2 产酒度和残糖对比 |
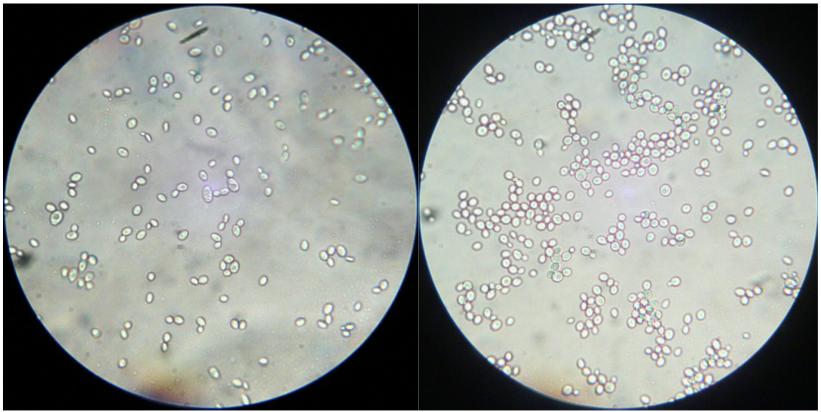
图 2 为显微镜放大 640 倍观察亲株和 A17 的细 胞形态。可以看出 A17 个体细胞形态较为饱满偏圆 状,而亲株个体多为椭圆状。有可能是胞内液压增 大导致细胞变圆,相应的表现为 A17 的抗高渗能力 增强。同时也看出,A17 细胞多趋于聚集状而亲株 的细胞则分散均匀。诱变驯化株的这种特性是进一 步研究的重点,这对解决工业大生产中酵母絮凝结 团将会有重大的指导意义。
|
图 2 640 倍显微镜观察亲株和 A17 的细胞形态 |
(1)经过 2 个阶段共 100 代的诱变驯化,该酵 母对 34.5゜Bx 和 37.5゜Bx 糖蜜的耐受能力都较初 始出发菌有一定提高,即该酵母更适应高浓度糖蜜 发酵。
(2)筛选到 2 株诱变驯化株,其中 A17 发酵 速率提升约 12%,B2 发酵速率提升约 6%,显微镜 下观察诱变驯化株个体细胞形态较为饱满偏圆状且趋于聚集状。
| [1] | 尚红岩,郭艺山,徐日益,等.糖蜜酒精生产积垢问题探讨[J]. 甘蔗糖业,2012(1):46-50. ( 1) 1)
|
| [2] | 尚红岩.甘蔗糖蜜酒精发酵过程酵母凝聚的成因与防治措施[J]. 甘蔗糖业,2005(3):43-51. ( 1) 1)
|
| [3] | 梁秉华,罗家骐.甘蔗糖蜜酒精生产检验方法[M]. 广州:轻工业部甘蔗糖业科学研究所,1986:77. ( 1) 1)
|
| [4] | 梁磊,张远平,黄向阳,等.基于基因组改组技术选育多重抗性乙醇酵母[J]. 现代食品工业,2009,25:1107-1114. ( 1) 1)
|
 2012
2012

