2. 广西糖业研发中心, 广西, 南宁, 530002
2. Guangxi Sugarcane Industry R & D Center, Nanning 530002
右旋糖酐是酵母和细菌的贮存多糖,它可由细 菌例如明串珠菌、变形链球菌等发酵产生[1],是目 前最佳的血浆代用品之一[2]。将重均分子量为 5000~7500的右旋糖酐与铁离子络合后制备的右旋 糖酐铁是一种抗贫血铁剂,专治缺铁性贫血。
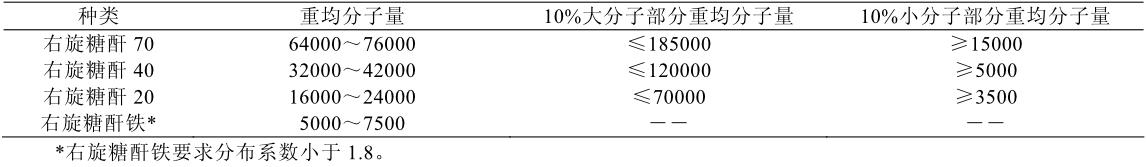
天然发酵生产的右旋糖酐分子量高达几百万乃 至几千万,不能直接作为药用右旋糖酐,必须通过降解把右旋糖酐的分子量降低到符合《中华人民共 和国药典 2010 年版二部》的要求[3],具体见表 1。
| 表 1 各药用右旋糖酐分子量分布要求 |
目前工业生产中,常用的右旋糖酐水解方法是 酸解法,能耗高,污染大,且酸碱对设备的腐蚀也 很严重。而酶解法反应条件温和,反应速度快[4], 可以在右旋糖酐发酵的同时进行,且可通过调节酶 的浓度和反应时间控制右旋糖酐的分子量,可大大 降低能耗,减轻污染。
本研究通过对右旋糖酐酸水解和酶水解产物的 结构和分子量分布的测定,比较两者的异同,分析 其优劣,为酶解法生产药用右旋糖酐新工艺打好基 础。
肠膜状明串珠菌-31208,广州甘蔗糖业研究所 保藏;右旋糖酐水解酶,广州甘蔗糖业研究所提供; 硫酸、蔗糖、磷酸氢二钠、磷酸二氢钾、95%乙醇、 碳酸钡均为国产分析纯试剂。
LC-20A 高效液相色谱仪,日本岛津;2800 紫 外/可见分光光谱仪,尤尼柯上海仪器有限公司; Vector 33 傅里叶变换红外谱仪,德国 Bruker 公司; WZZ-2S 旋光计,上海申光仪器仪表有限公司; GRJB-5D 5L 发酵罐,镇江格瑞生物工程有限公司; 膜过滤设备,厦门绿琻膜科技有限公司。
在 5 L 全自动发酵罐中接入肠膜状明串珠菌 -31208,培养基蔗糖浓度为 210 g/L,温度 26℃,pH 为 6.0 条件下发酵 36 h; 发酵液用 10 K 超滤膜处理, 截留液中加入乙醇,使乙醇终浓度为 50%(v/v),得 到沉淀,烘干,即为右旋糖酐样品。右旋糖酐样品 用红外光谱仪(FTIR)和紫外光谱仪扫描分析,红 外光谱扫描范围是 4000~400 nm-1,紫外光谱扫描 范围为 190~400 nm。再用旋光计测其旋光度,并 计算比旋度。
取 1 mL 10 mg/mL 的右旋糖酐样品溶液置于带 塞玻璃管,再加入 9 mL 2mol/L 硫酸溶液,沸水浴 水解 2 h 令右旋糖酐完全水解。完全水解后加入一 定量碳酸钡粉末中和 pH 为 6~7。10000 r/min 离心 分离 5 min, 取上清液用 GPC 分析其产物组成。 GPC 的进样条件为:采用 Shodex KS803 色谱柱,RI 检 测器,流动相为水,流速为 1.0 mL/min,柱温 50℃, 进样量 10μL。
取 5 mL 10 mg/mL 的右旋糖酐样品溶液,在 45 ℃中保温 15 min。 加入 30 个酶活单位右旋糖酐水解 酶液,开始酶解,反应到 1 h 和 2 h 时分别补加 20 个酶活单位右旋糖酐水解酶液,从反应到 3 h 开始 每小时补加 5 个酶活单位右旋糖酐水解酶液。反应 到 0.5、6、8、10 h 分别取样 1 mL,用 GPC 分析其 组成,进样条件同 1.2.2。
在 pH 为 0.5~2.0、温度在 80~100℃、反应时 间在 1~3 h 的条件范围内酸解右旋糖酐;自然 pH、 温度为 45℃、 反应时间在 15~60 min 的条件范围内 酶解右旋糖酐, 水解完成后用 GPC 分析其含量及分 布系数,进样条件同 1.2.2。
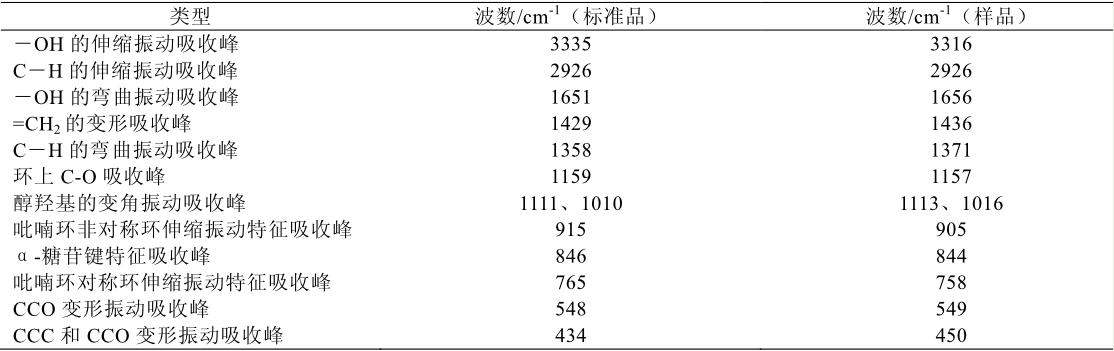
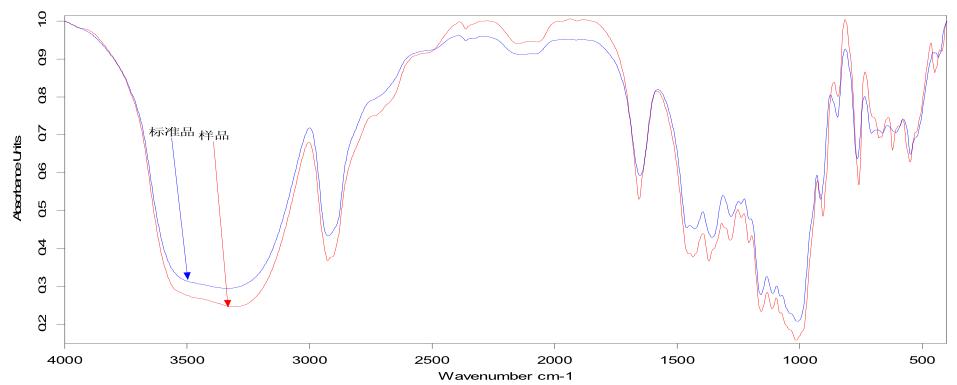
图 1 为右旋糖酐标准品和样品的红外光谱图, 表 2 为右旋糖酐标准品和样品的红外光谱部分峰的 波数比较。右旋糖酐样品的红外光谱图的各吸收峰 波数和波幅和标准品的基本一致,可说明右旋糖酐 样品纯度较高。
|
图 1 右旋糖酐标准品和样品的红外光谱图 |
| 表 2 右旋糖酐标准品和样品的红外光谱部分峰的波数比较 |
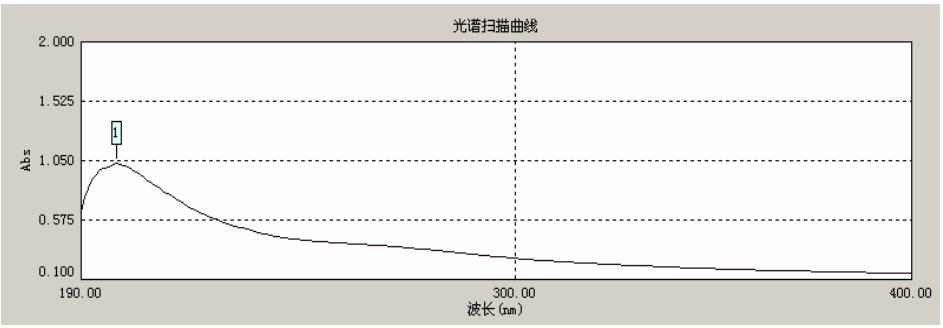
图 2 是右旋糖酐样品溶液的紫外光谱图。光谱 中 199 nm 处有一吸收峰,为糖类物质的吸收峰。紫 外光谱在 260 nm 和 280 nm 处没有显著吸收,说明 样品中基本不含有蛋白质、氨基酸和核酸等杂质[5]。
|
图 2 右旋糖酐样品溶液的紫外光谱图 |
表 3 为比旋度测量数据,通过[α]Dt=100α/(lc)公 式计算样品的比旋度。
| 表 3 比旋度测量数据 |
式中:[α]为比旋度;D 为钠光谱的 D 线;t 为 测量时的温度(℃) ;α 为测得的旋光度;l 为测定 管长度(dm) ;c 为每 100 mL 溶液中含有被测物质 的重量(g) 。
其中,测量温度为 25℃,测定管长度为 2 dm, 样品质量(含水)为 1.013 g,样品用蒸馏水溶解并 定容到 100 mL。计算出比旋度大于+190°,能达到 药典要求,说明纯度较高。
由右旋糖酐硫酸水解液的 GPC 图 (图 3) 可知, 峰 1 很小,保留时间短,可能是某些大分子杂质的 峰;峰 2 面积占总面积的 93.6%以上,保留时间 (10.123 min)与葡萄糖标准品几乎一致,可推断峰 2 是葡萄糖峰;峰 3 也很小,保留时间较长,分子 量应该比葡萄糖更小,而根据右旋糖酐硫酸水解液 的紫外光谱(图 4)可以看出,282 nm 处有明显吸 收,这很可能是葡萄糖在酸性条件下脱水生成的 5- 羟甲基糠醛的吸收峰[6,7]。
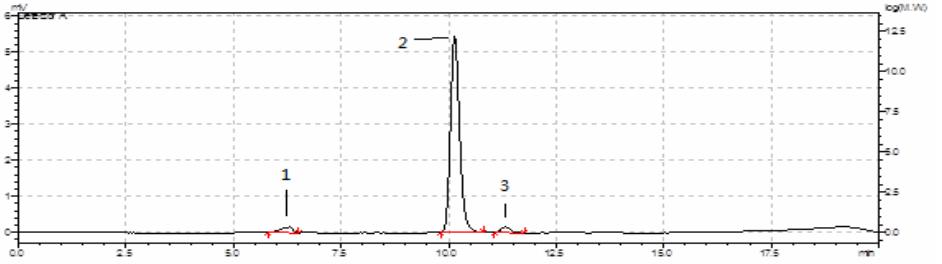
|
图 3 右旋糖酐硫酸水解液的 GPC 图 |
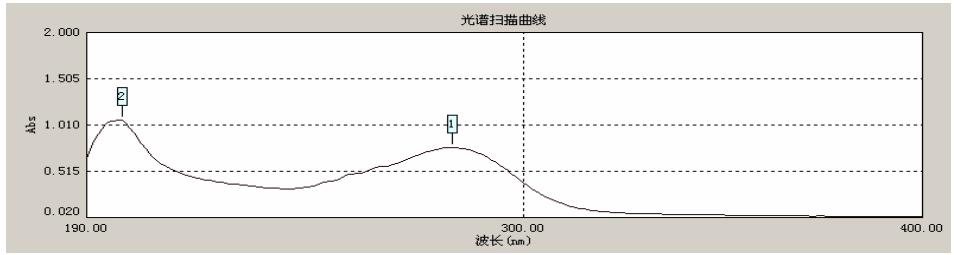
|
图 4 右旋糖酐硫酸水解液的紫外光谱 |
右旋糖酐在添加过量右旋糖酐水解酶、长时间 酶解、反复补充新鲜酶液以及在最适条件下反应, 结果见图 5。原样的峰保留时间较短,说明分子量 比较大;酶解 0.5 h 后,右旋糖酐分子量大大降低, 且出现与峰 2 保留时间接近的峰,根据右旋糖酐中 葡萄糖基是以α-1,6-键连接,推断此峰为异麦芽寡 糖峰;酶解 6 h、8 h 和 10 h 的 GPC 图几乎重合, 说明酶解至 6 h 后右旋糖酐基本不再降解,可认为 此时酶解产物为酶解终产物。
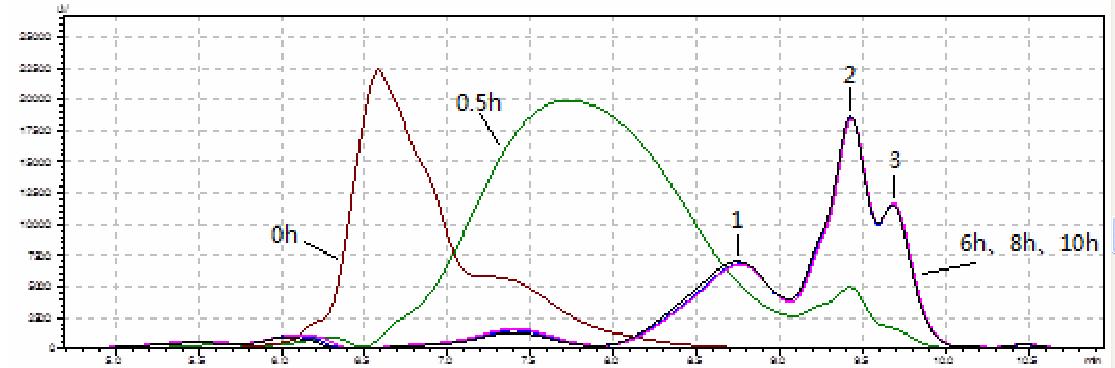
|
图 5 右旋糖酐酶解过程的 GPC 图 |
酶解终产物主要有 3 个峰,峰 1 是不能继续降 解的右旋糖酐峰,其重均分子量为 2545;峰 2 和峰 3 可能是异麦芽寡糖峰,但具体异麦芽寡糖中葡萄 糖单元数只通过液相图无法确定。酶解终产物中不 存在葡萄糖,说明该水解酶不可以任意水解 1,6-糖 苷键,其水解 1,6-糖苷键需遵循一定规则。
2 种水解终产物有很大区别,是由于 2 种水解 方法的作用机理是不同的。酸水解可以任意水解各 种糖苷键,所以其终产物就是葡萄糖;而酶水解是 有选择性地水解某些 1,6-糖苷键,生成异麦芽寡糖, 但不生成葡萄糖。
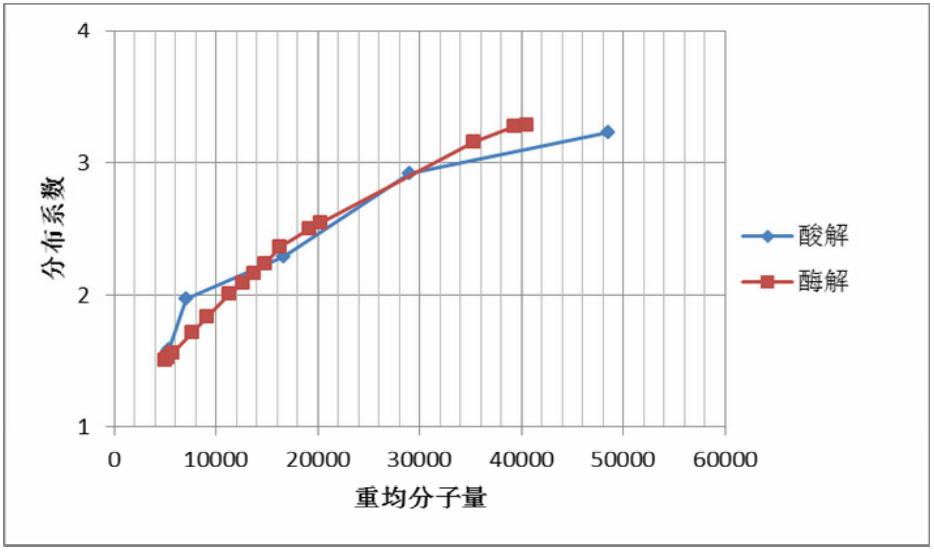
图 6 为右旋糖酐酸解或酶解到某个重均分子量 时右旋糖酐占总固形物的质量分数,图 7 为右旋糖 酐酸解或酶解到某个重均分子量时的分布系数。
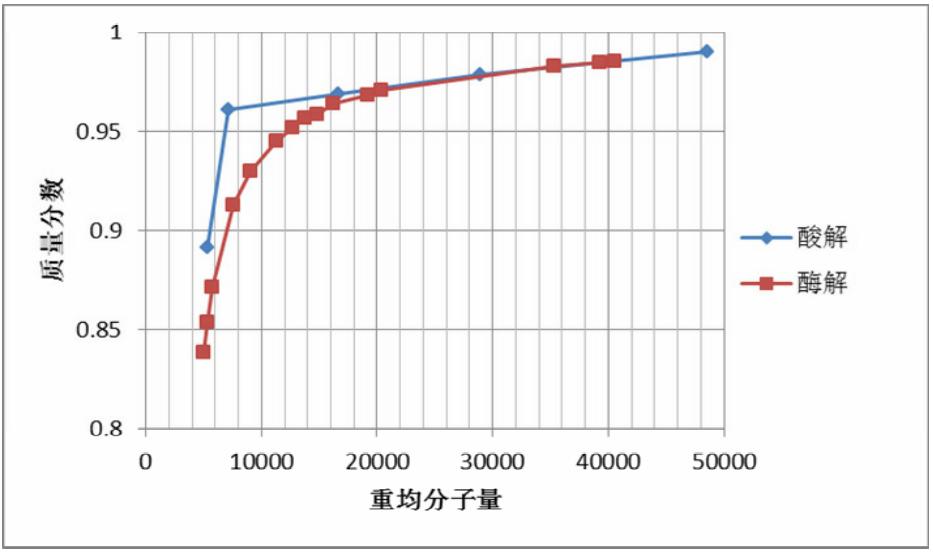
|
图 6 右旋糖酐酸解或酶解到某个重均分子量时右旋糖酐占总固形物的质量分数 |
因为重均分子量为 1000 Da(约 6 个葡萄糖基) 的右旋糖酐标准品保留时间是 9.183 min,本文假定 保留时间在 9.183 min 之前的峰为右旋糖酐峰, 右旋 糖酐含量即 9.183 min 前的峰面积与各峰总面积之比, 分布系数也是由 9.183 min 前的峰通过右旋糖酐 标准曲线来计算。
从图 6 可知,在水解到重均分子量为 20000 Da 之前,2 种水解方法对右旋糖酐含量的影响相似, 损失量不大;水解到重均分子量为 20000 Da 以下 时, 酶解令右旋糖酐含量加速下降, 酶解到 7500 Da 左右时,右旋糖酐剩下 90%,酶解到 5000 Da 左右 时,右旋糖酐剩下 85%;而酸解到 7500 Da 左右时, 右旋糖酐剩下 95%以上,5000 Da 左右时,右旋糖 酐仍有 90%。
如图 7 可知,酸解或酶解都能降低右旋糖酐分 布系数,而且 2 种水解方法的效果相似。
|
图 7 右旋糖酐酸解或酶解到某个重均分子量时的分布系数 |
本文比较了右旋糖酐酸水解和酶水解产物,结 果表明,酸水解的终产物基本上为葡萄糖,而酶水 解终产物为异麦芽寡糖; 水解到重均分子量为 20000 Da 以上时,2 种水解方法对右旋糖酐含量和分布系 数影响不大;水解到重均分子量小于 20000 Da 之 后,酶解产物右旋糖酐含量下降。但酶水解能在较 温和的条件下进行,只需极少量的酶,无需酸碱, 可大大减少污染。本研究对药用右旋糖酐的生产从 传统的酸水解工艺转变为酶水解工艺,并在发酵过 程调控右旋糖酐的分子量,有着重要的指导意义。
| [1] | 王镜岩,朱圣庚,徐长法.生物化学:第三版上册[M]. 北京:高等教育出版社,2002:43-44. ( 1) 1)
|
| [2] | 袁洪雨,董旭.血浆代用品的临床应用与研究进展[J]. 齐鲁药事,2010,29(1):30-33. ( 1) 1)
|
| [3] | 国家药典委员会.中华人民共和国药典:2010 年版二部[M]. 北京:中国医药科技出版社,2010:111-116. ( 1) 1)
|
| [4] | Elvira Khalikova,Retri Susi,Timo Korpela.Microbial Dextran-Hydrolyzing Enzymes:Fundamentals and Applications[J]. Microbiology and Molecular Biology Reviews,2005,69(2):306-325. ( 1) 1)
|
| [5] | 曹红翠.紫外分光光度法测定蛋白质的含量[J]. 广东化工,2007,8(34):93-94,84. ( 1) 1)
|
| [6] | 王军,张春鹏,欧阳平凯.5-羟甲基糠醛制备及应用的研究[J]. 化工进展,2008,27(5):702-707. ( 1) 1)
|
| [7] | 闫智培,林鹿,张俊华.紫外光谱法快速测定两相葡萄糖酸水解反应体系中的羟甲基糠醛[J]. 分析仪器,2009(5):45-47. ( 1) 1)
|
 2012
2012