巴斯德毕赤酵母(Pichia pastoris)表达系统是 近20 年来应用最广泛的真核表达系统之一,已有 500 多种来自细菌、真菌、病毒、动植物和人的蛋 白在该系统得到了成功表达[1,2]。毕赤酵母能够高效 表达外源蛋白,对外源蛋白具有翻译后修饰功能; 宿主本身背景蛋白少,还可通过合适的信号肽,使 产物能够顺利分泌至胞外,易于纯化分离;外源基 因可整合进入酵母基因组被稳定地遗传。然而在毕 赤酵母基因组中却缺少蔗糖酶基因,因此无法利用 蔗糖。甘蔗糖蜜中含有30%以上的蔗糖,这样就限 制了糖蜜作为碳源应用于毕赤酵母的大规模培养。 蔗糖酶(invertase)既能催化蔗糖水解生成葡萄糖和 果糖,也能催化棉子糖水解生成密二糖和果糖,是 酿酒酵母蔗糖代谢途径中的第一个关键酶。酿酒酵 母基因组中编码蔗糖酶的SUC2基因,能够转录形 成1.9kb和1.8kb 2种mRNA,前者的翻译产物被糖 基化并且分泌至胞外,而后者的翻译产物则留在胞 质中,成为胞内酶[3]。
本实验克隆了蔗糖酶基因SUC2。将蔗糖酶基 因整合进入毕赤酵母基因组,得到能够水解利用蔗 糖的毕赤酵母工程菌。该工程菌将能利用糖蜜进行 培养。
酿酒酵母AS2.1190由广州甘蔗糖业研究所保 存。毕赤酵母菌株KM71H、质粒pPICZαA 购自 Invitrogen公司;TransTaq DNA 聚合酶、pEASY-T1 TA克隆载体试剂盒、DNA marker 购自全式金公司; E. coli JM109感受态细胞、限制性内切酶、碱性磷 酸酶(CIAP)、T4 DNA连接酶、菌体裂解液试剂盒 (Lysis Buffer for Microorganism to Direct PCR)、质 粒小提试剂盒和DNA凝胶回收试剂盒均购自 Takara公司;Dextran T2000购自Pharmacia公司; 寡核苷酸引物由Invitrogen 公司合成;LLB(低盐 LB培养基)、YPD、YPDS培养基以及YPDS Zeocin 抗性平板均按照Invitrogen 公司的毕赤酵母表达手 册配制。
MJ Mini PCR仪,美国BIO-RAD公司生产; DY-6C核酸电泳仪,北京六一仪器设备有限公司生 产;SKY-200B全温度培养振荡器,上海苏坤实业有 限公司生产;2510电转仪,德国Eppendorf公司生 产。
根据目的基因SUC2的序列,扩增SUC2基因 及其上游的调控区域和下游的转录终止区,设计一 对基因扩增引物:P1(5'-GATCAGATCTTATGAAA GTAGTTCGTCGCAATTTG- 3')和P2(5'-GATCAG ATCTACATTCGTCACTCGTTGCTAAAGCC- 3'), 如下划线所示,上下游引物均引入Bgl II酶切位点。
酿酒酵母AS2.1190在YPD培养基中培养48 h 后,离心得到菌体沉淀,参照菌体裂解液试剂盒说 明书,裂解AS2.1190酵母菌体获得基因组后直接进 行PCR扩增,扩增条件为:94℃、5 min(94℃、 30 s;55℃、30 s;72℃、3 min 30 s;共32个循环); 72℃、10 min。将扩增产物进行TA 克隆,连接 pEASY-T1载体。在含有IPTG和X-gal的氨苄青霉 素抗性平板上进行蓝白斑筛选。选取平板上的白色 克隆,以P1、P2为引物,进行菌落PCR,筛选得 到克隆载体TA-SUC2。
用限制性内切酶BglII 分别对克隆载体 TA-SUC2 和pPICZαA进行酶切,37℃、8 h。酶切产物进行胶回收纯化之后,线性化的载体pPICZαA 经碱性磷酸酶处理,与SUC2基因片段16℃连接过 夜。连接产物转化感受态大肠杆菌,在含25 μg/mL Zeocin的LLB平板上挑选阳性克隆,进行菌落PCR 检测,之后送交测序确认,得到表达载体 pPICZαA-SUC2。
表达载体pPICZαA-SUC2使用Sac I 于37 ℃、 8 h酶切使之线性化。琼脂凝胶电泳检测重组质粒是 否酶切完全,检测后使用DNA纯化试剂盒纯化产 物。线性化质粒(10 μg)与感受态毕赤酵母KM71H (80 μL)混合,电击转化条件为:1500 V、25 μF、 200Ω。毕赤酵母细胞转化之后涂布于YPDS抗性平 板上(含100 μg/mL Zeocin),30 ℃培养。
以P1和P2引物通过PCR扩增蔗糖酶SUC2基 因,1%琼脂糖凝胶电泳显示得到单一DNA条带, 长度约为3.2K bp,其与设计的目的片段长度相符, 结果如图1所示。
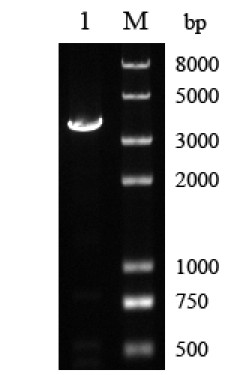
|
图1 PCR 扩增SUC2 基因 M-DNA 标准物;1-目的基因PCR 产物 |
经PCR扩增后得到的SUC2基因,与分泌表达 载体pPICZαA连接,得到重组质粒pPICZαA-SUC2 (见图2)。将质粒送交Invitrogen公司测序,表达 载体pPICZαA-SUC2构建完成。
测序结果表明,扩增片段中包含SUC2基因编 码区上游约1.5Kbp的区域,SUC2基因编码区和编 码区下游100bp左右的区域。其中SUC2基因编码 区长度为1599bp,编码的完整蛋白含532个氨基酸 残基。编码蛋白与酿酒酵母EC1118(GenBank: CAY80344.1)同源性最高,99%序列匹配。其中本实 验扩增的SUC2基因编码的蛋白在第425位、431 位分别为丝氨酸、丙氨酸。而EC1118的SUC2基因 相同位置编码的氨基酸则分别为亮氨酸、缬氨酸。
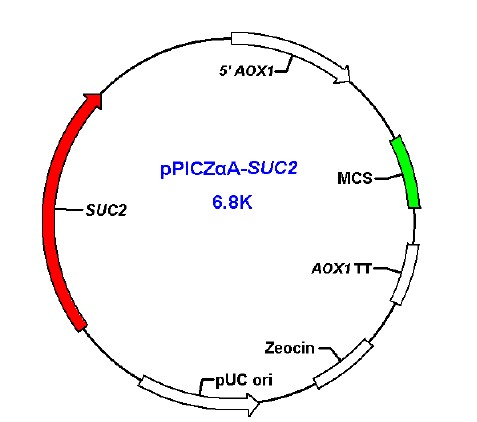
|
图2 重组质粒pPICZαA-SUC2 的结构示意图 |
毕赤酵母细胞转化之后涂布于YPDS Zeocin抗 性平板上,3~4 d后长出单菌落。这些阳性菌落表 明载体重组进入毕赤酵母基因组,得到了具有抗性 的重组工程菌KM71H/ pPICZαA-SUC2。
本文克隆酿酒酵母AS2.1190基因组中的蔗糖 酶基因SUC2,构建了表达载体pPICZαA-SUC2,该 表达载体具有博来霉素和蔗糖酶基因2种筛选标记,为今后的外源蛋白表达提供了便利。将蔗糖酶 基因整合进入毕赤酵母基因组,筛选得到阳性克隆, 为毕赤酵母直接利用糖蜜作为廉价碳源进行大规模 培养打下基础。
| [1] | Macauley-Patrick S,Fazenda ML,McNeil B,et al.Heterologous protein production using the Pichia pastoris expression system. Yeast,2005,22(4):249-270. ( 1) 1)
|
| [2] | Gellissen G.Heterologous protein production in methylotrophic yeasts.Appl Microbiol Biotechnol,2000,54(6):741-750. ( 1) 1)
|
| [3] | Carlson M,Bostein D.Two differentially regulated mRNAs with different 5 ends encode secreted and intracellular forms of yeast invertase. Cell,1982,28:145-154. ( 1) 1)
|
 2012
2012


