甘蔗宿根矮化病(Ratoon Stunting Disease, RSD) 是普遍存在于所有植蔗地区的一种世界性的重要病 害,自1944~1945 年在澳大利亚昆士兰首次发现 以来,已有美国、南非、毛里求斯、印度、巴西等 47 个国家和地区报道了该病的发生,现已遍布世 界各蔗区[1,2,3,4,5,6,7]。此病害由一种寄居木质部的较难培 养的细菌—木质部赖氏菌木质部亚种(Leifsonia xyli subsp. xyli, Lxx)引起[8],主要通过带病蔗种和收获、 砍种刀具等传播蔓延,且传播性极强,病蔗的蔗汁 稀释至10000 倍仍具有传染力。蔗株染病后变矮, 蔗茎变细,生长迟滞,宿根发株少,在干旱地区和 种植感病品种的蔗区所造成的损失尤其重要,病害 造成损失的程度随宿根年数的增加而增加,一般减 产10~30%,干旱缺水时可达60%以上,还可导 致品种退化。由于RSD 无明显的外部和内部症状, 病原菌难以分离、培养和检测,传统诊断方法极其 困难,导致病害任意传播、扩展蔓延,对甘蔗生产 危害极大。
甘蔗RSD 属维管束病害,用一般的物理、化 学方法难以消除,有效的防治方法是通过温水处理 法生产脱毒种苗用于甘蔗生产,已在澳大利亚、美 国、巴西、古巴、南非、菲律宾及我国台湾省等地 应用多年[1]。而摸清蔗区RSD 的分布、发生为害 情况,是科学有效推广温水脱毒健康种苗的关键。
本研究对云南耿马蔗区甘蔗宿根矮化病的发生 和分布进行了调查和田间采样,通过实验室利用分 子(PCR)和血清(I-ELISA)法等检测技术进行 RSD 检测,明确了耿马蔗区RSD 发病状况,为耿 马蔗区推广应用温水脱毒健康种苗、有效防控甘蔗 宿根矮化病提供了科学依据。
于2009 年12 月-2010 年1 月甘蔗成熟期,对 云南耿马贺派、耿马、华侨、四排、孟撒、勐永等 甘蔗主产乡镇宿根矮化病的发生和分布进行了调查 和田间采样。采样选择具有代表性的主栽或主推品 种,根据品种、蔗地(旱地、水田)、植期分类, 随机取样,共采集97 个样本。每个样本取10 条蔗 茎,每条蔗茎截取中下部茎节,用砍刀切成7 cm 左右长,再用钳子挤压25 mL 左右的甘蔗汁于50 mL 离心管内充分混匀(每取一个样品后均用清水冲洗 砍刀和钳子,再用70%的酒精消毒),放于4℃和 -20℃冰箱保存待用。
RSD 抗血清和阳性对照由澳大利亚甘蔗试验 总局(BSES)提供,检测方法参考文献[9]进行。
引物序列采用已报道的RSD 病原细菌Lxx 16S-23S rDNA 基因间隔区特异引物[10],预期扩增 片段大小为438 bp ( 上游引物Lxxl : 5′- CCGAAGTGAGCAGATTGACC-3′ ; 下游引物 Lxx2: 5′-ACCCTGTGTTGTTTTCAACG-3′),委托 上海生工生物技术有限公司合成。
用改进的CTAB 法提取蔗汁总DNA。每个样 品取2 mL 蔗汁放入离心管中,12000 r/min 离心10 min,弃上清;沉淀加入300 μL 灭菌去离子水稀释 混匀;加入600 μL 经65℃预热的2%CTAB 抽提 缓冲液,65℃水浴1 h(期间每隔20 min 摇匀一次); 加入600 μL 氯仿/异戊醇(24:1)剧烈振荡30 s,12000 r/min 离心10 min;取上清液700 μL 置于新的1.5 mL 离心管中,加入等体积氯仿/异戊醇(24:1)温和地 混匀,12000 r/min 离心10 min;取上清液650 μL 置于新的1.5 mL 离心管中,加入2/3 体积(455 μL) 的异丙醇,混匀后置-2O℃冰箱中沉淀4 h 或过夜; 4℃下12000 r/min 离心10 min;弃上清液,沉淀分 别用400 μL 预冷的70%乙醇和冷无水乙醇各洗一 次;室温下风干,溶于30 μL 双蒸水中(用手指轻 弹离心管使沉淀充分悬浮),-20℃保存。
以抽提的蔗汁总DNA 为模版,采用天根生化 科技(北京)有限公司的Taq PCR MasterMix 进行 PCR 扩增。扩增体系20 μL:ddH2O 8.6 μL,2×PCR Taq mix 8 μL,DNA 模板3 μL,上下游引物各0.2 μL (20 ug/uL);扩增程序为:95℃预变性5 min,94℃ 变性30 s,56℃退火30 s,72℃延伸1 min,35 个 循环后72℃延伸5 min。PCR 扩增结果判别:取10 μL PCR 产物经1.0%琼脂糖凝胶电泳检测,扩增到 438 bp 条带的为阳性,未扩出438 bp 条带的为阴 性;根据目的片段条带亮度的强弱进一步判别样品 带菌浓度的相对高低,条带较亮的样品为强阳性、 一般的为中阳性,较弱的为弱阳性。
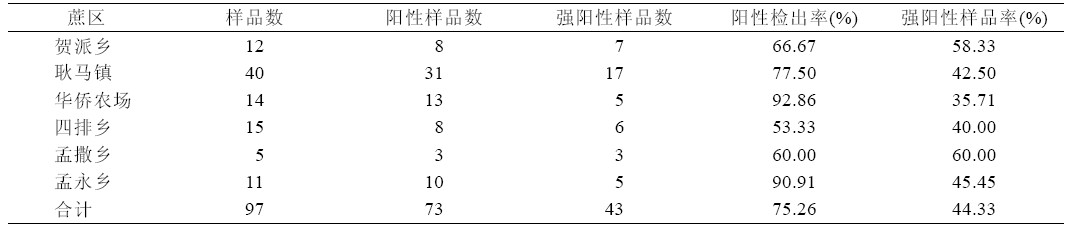
对贺派、耿马、华侨、四排、孟撒、勐永等6 个甘蔗主产乡镇宿根矮化病的调查和检测结果表 明,耿马蔗区RSD 发生普遍。采用RCR 和I-ELISA 法对采集的97 个样本进行RSD 检测,结果一致。 97 个样品中73 个呈阳性,阳性检出率为75.26%; 其中强阳性样品43 个,占44.33%;6 个甘蔗主产 乡镇均检测出RSD, 阳性检出率在53.33 % ~ 92.86% 之间, 检出率最高的是华侨农场,高达 92.86%,其次是孟永乡,检出率为90.91%(表1)。
| 表1 各主产乡镇甘蔗宿根矮化病发生情况 |
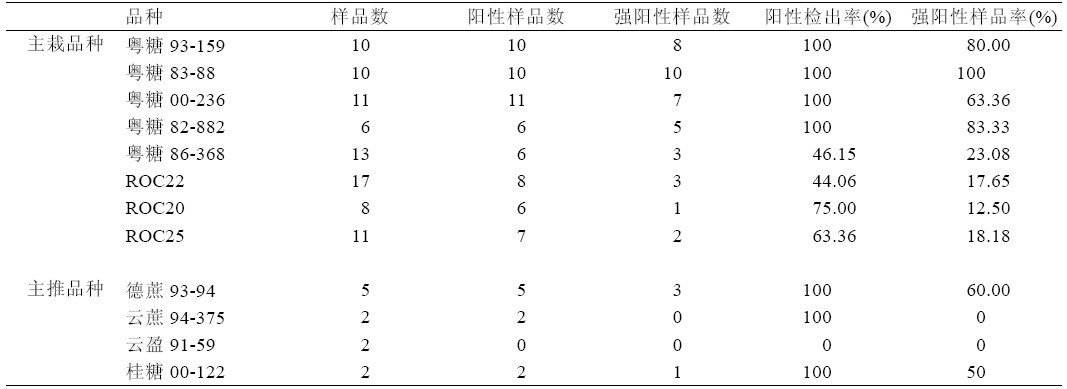
从检测结果看,在12 个主栽或主推品种中, 除云盈91-59 未检测出RSD 外,其余品种粤糖93- 159、粤糖83-88、粤糖00-236、粤糖82-882、粤 糖86-368、ROC20、ROC22、ROC25、ROC26、 德蔗93-94、云蔗94-375、桂糖00-122 等11 个品 种均发病,发病率在44.06%~100%之间;其中尤 以主栽品种粤糖93-159、粤糖83-88、粤糖00-236、 粤糖82-882 等4 个品种发病最重,发病率高达 100%,强阳性率居63.36%~100%之间,其次是 ROC20、ROC25、粤糖86-368 和ROC22;主推品 种德蔗93-94、云蔗94-375 和桂糖00-122 等3 个 品种也发病严重。
| 表2 不同品种甘蔗宿根矮化病发生情况 |
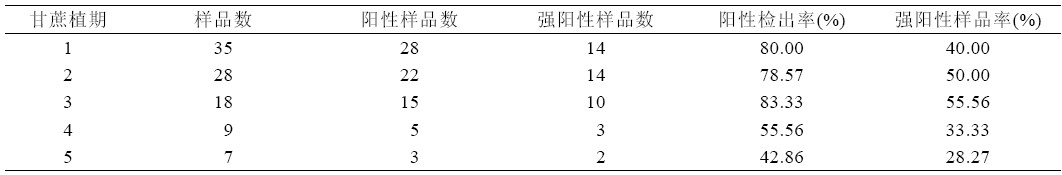
从总的检测结果看,植期上1、2、3、4、5 年 均不同程度发病,但几者之间发病率和发病程度都 没有明显差异(表3)。
| 表3 不同植期甘蔗宿根矮化病发生情况 |
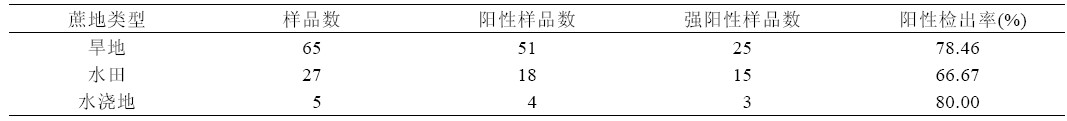
从表4 可看出,水田、水浇地、旱地均发病。 其中,水田蔗样品阳性检出率为66.67%,水浇地 蔗样品阳性检出率达80.00%,旱地蔗样品阳性检 出率为78.46%。
| 表4 不同蔗地甘蔗宿根矮化病发生情况 |
⑴田间随机取样检测结果表明,耿马县所属蔗 区贺派、耿马、华侨、四排、孟撒、勐永等主产乡 镇均检测出RSD,供检测的97 个样品中,有73 个样品为阳性带菌占75.26%,其中有43 个样品为 强阳性带菌量高占58.9%,由此可见,RSD 在耿 马县蔗区发生普遍;田间主栽或主推品种中粤糖 93-159、粤糖83-88、粤糖00-236、粤糖86-368、 ROC20、ROC22、ROC25、ROC26、德蔗93-94、 云蔗94-375、粤糖82-882、桂糖00-122 等多个品 种均发病,其中尤以粤糖93-159、粤糖83-88、粤 糖00-236 发病最重、其次是粤糖86-368、德蔗93- 94、ROC20、ROC22 等主栽品种发病严重;植期 上1、2、3、4、5 年均不同程度发病,但几者之间 无明显差异;水田、旱地均有发病。根据甘蔗宿根 矮化病检测结果,结合我们的多年试验结果以及国 外的研究和生产应用效果,在耿马蔗区生产推广应 用甘蔗脱毒种苗将会获得显著的增产效果:平均单 产可比传统种植提高15 t/hm2 左右,增幅15%~ 30%,可有效地防治甘蔗病害,特别是甘蔗宿根矮 化病(RSD)的传播,是提高甘蔗产量,延长甘蔗 宿根年限最具潜力和效能的重要措施。为此,在耿 马蔗区认真组织做好甘蔗温水脱毒种苗生产、繁 殖、示范工作,建立甘蔗脱毒种苗生产与应用推广 技术体系及相应技术规程,在生产上加快推广,使 之制度化,可大幅度提高甘蔗的产量、延长宿根蔗 年限,从而显著提高甘蔗生产的经济效益,以此解 决甘蔗生产特别是宿根甘蔗长期以来低产、宿根年 限短、生产成本高,效益差的问题。
⑵科学布局温水脱毒种苗示范基地。选择与糖 厂相邻近,交通便利、排灌方便,地势平坦,地块 土质、肥力均较好的良繁基地500/15~1000/15 hm2 作为甘蔗脱毒种苗示范基地一级种苗圃(明确专业 技术人员负责,由管理水平较高的专业种苗大户种 植管理,提供一级脱毒种苗);分别在各甘蔗主产 乡镇规划建立甘蔗脱毒种苗基地二、三级种苗圃 5000/15~10000/15 hm2(由专业种苗户种植管理, 专用于繁殖一级种苗圃提供的一级脱毒种苗),由 二、三级专用种苗圃直接为大面积生产提供无病种 苗。
| [1] | J.P.马丁,E.V.阿伯特,C.G.休慈.世界甘蔗病害(第1卷)[M]. 陈庆龙译.北京:农业出版社,1982:299-319. ( 2) 2)
|
| [2] | Bailey R A,Tough S A.The current distribution of ratoon stunting disease in the South African sugar industry[G]. Procedure 65th Annual Congress South African Sugar Technology Associate,1991:25-29. ( 1) 1)
|
| [3] | James G.A review of ratoon stunting disease[J]. Internationl Sugar Journal,1996,98(1174):532-541. ( 1) 1)
|
| [4] | Hoy J W,Grisham M P,Damann K E.Spread and increase of ratoon stunting disease of sugarcane and comparison of disease detection methods[J]. Plant disease,1999,83:1170-1175. ( 1) 1)
|
| [5] | Duttamajumder-SK.Surreptitious spread of sugarcane ratoon stunting disease pathogen Leifsonia xyli subsp.xyli in subtropical India[J]. India-Phytopathology,2001,54(4):481-483. ( 1) 1)
|
| [6] | Rago A M,Acreche M M,Sopena R A.A survey of ratoon stunting disease(Leifsonia xyli subsp.xyli)in commercial sugarcane fields at Tucuman(Argentina)[J]. Sugar Cane International,2004,22(6):12-14. ( 1) 1)
|
| [7] | James G L,Lukano M P,Ochieng A A.Ratoon stunting disease surveys of the Mumias and South Nyanza mill areas in Kenya[J]. Sugar Cane,1995,5:4-7. ( 1) 1)
|
| [8] | Davis M J,Gillaspie A G,Harris R W,et al.Ratoon stunting disease of sugarcane:isolation of the causal bacterium[J]. Science,1980,210(4476):1365-1367. ( 1) 1)
|
| [9] | 李文凤,黄应昆,卢文洁,等.甘蔗宿根矮化病的I-ELISA快速检测[J]. 中国糖料,2008(1):33-34. ( 1) 1)
|
| [10] | Pao Y B,Grisbam M P,Buroer D M,et al.A polymerase chain reaction protocol for the detection of Clavibacter xyli subsp.xyli,the causal bacterium of sugarcane ratoon stunting disease[J]. Plant Disease,1998,82(3):285-290. ( 1) 1)
|
 2011
2011