甘蔗汁中的多酚类物质是水溶性色素。多酚 类物质不仅本身显色,在生产过程中,大的多酚 类分子会断裂成小的酚类物,形成更多色素[1]; 小分子受氧化酶的作用缩合生成更深色的大分子 化合物,还易与铁反应生成深色物质[2]。在澄清 过程中,酚类物质除去率的高低,影响至产品蔗 糖的含酚量。蔗糖中酚类物质的含量是影响蔗糖 色值及贮存变色的主要因素之一[3]。在生产过程 监测蔗汁中酚含量的变化及其在蔗糖中的含量对 稳定控制产品质量有重要的意义。
目前蔗汁中酚含量的测定方法是在标准没食 子酸溶液中加入对氨基苯磺酸和亚硝酸钠溶液, 待其显色后测定其吸光度。这种方法要求对氨基 苯磺酸溶液 4 h 配一次,亚硝酸钠溶液 2 h 配一 次。笔者多年从事制糖工业分析工作,发现这种 多元酚类的测定方法不仅试剂配制时效性短,且 实验系统误差较大,标准曲线的相关系数不高。 本研究以没食子酸为基准物质,酒石酸亚铁作显 色剂,测定蔗汁中酚含量的方法简便可行,方法 回收率高,重现性和稳定性好。
UV-2802S 型紫外可见分光光度计(尤尼柯上海仪器有限公司) ;
UV-9100 分光光度计(北京瑞利分析仪器公司) ;
AL204 电子天平(上海梅特勒—托利多仪器有限公司) ;
WAY-1S 数字阿贝折光仪(上海物理光学仪器厂) 。
标准溶液:准确称取没食子酸 0.05 g,溶解, 用蒸馏水定容于 100 mL 容量瓶中,配制成 0.5 mg/mL 没食子酸标准溶液。
显色剂:取七水合硫酸亚铁 0.1000 g 和四水 合酒石酸钾钠 0.5000 g,用蒸馏水溶解,定容于 100mL 的容量瓶中,配制成酒石酸亚铁溶液。
pH=7.5 磷酸缓冲液:于 0.5 moL/L 的 NaOH 溶液中加磷酸调至 pH=7.5。
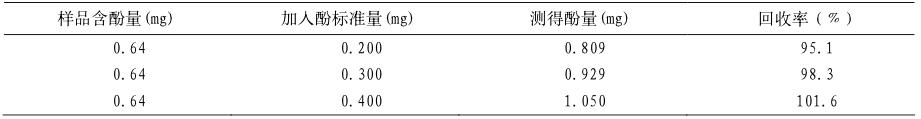
准确吸取标准溶液 2 mL 于 50 mL 容量瓶中, 加酒石酸亚铁溶液 10 mL,加 pH=7.5 磷酸缓冲液 10 mL, 加蒸馏水定容。 另以蒸馏水代替标准溶液, 用同样方法配制空白试剂溶液。于 350~1100nm 波长处扫描,结果如图 1,在 535nm 处有最大吸 光度且吸光度稳定(图 1) 。
|
图 1 测定波长的选择 |
分别移取 2 mL 标准溶液于 5 个 50 mL 容量瓶 中,各加酒石酸亚铁溶液 10 mL,分别加入 5、10、 15、20、25 mL 的磷酸缓冲液(pH=7.5) ,蒸馏水 定容。另以蒸馏水代替标准溶液,用同样方法配 制空白试剂溶液。测定吸光度(表 1) 。
| 表 1 缓冲液用量对测定结果的影响 |
表 1 中,RSD(%)为 0.2345,可认为加入缓 冲液量在 5~25 mL 之间对吸光度没有显著影响。 本实验选择加缓冲液量 10 mL。
取 2 mL 的标准溶液于 50 mL 容量瓶中,加酒 石酸亚铁溶液 10 mL, 加 pH=7.5磷酸缓冲液 10 mL, 加蒸馏水定容。另以蒸馏水代替标准溶液,用同 样方法配制空白试剂溶液。放置不同的时间,在 535nm 处测定其吸光度(表 2) 。
| 表 2 放置时间对测定结果的影响 |
由表 2 计算 RSD(%)为 0.7320,表明在 0~ 10 min 内显色稳定。
取 2 mL 标准溶液于 50 mL 容量瓶中,分别以2、4、6、8、10、12、14 mL 的酒石酸亚铁显色, 分别加 pH=7.5 磷酸缓冲液 10 mL, 加蒸馏水定容。 另以蒸馏水代替标准溶液,用同样方法配制空白 试剂溶液。在 535nm 处测定其吸光度(表 3) 。
| 表 3 显色剂量和吸光度之间的关系 |
由表 3 可知,其中用 8、10、12 mL 酒石酸亚 铁显色稳定性好,本实验选择 10mL 为显色剂用 量。
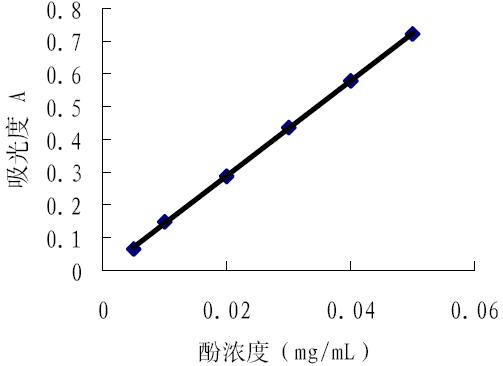
准确吸取标准溶液 0.5、 1.0、 2.0、 3.0、 4.0、 5.0 mL 于 50 mL 容量瓶中,加酒石酸亚铁溶液 10 mL,加 pH=7.5 磷酸缓冲液 10 mL,再加蒸馏水定 容。另以蒸馏水代替标准溶液,用同样方法配制 空白试剂溶液。各容量瓶中相应的没食子酸含量 分别为:0.005、0.01、0.02、0.03、0.04、0.05 mg/mL。在 535nm 处测定吸光度,以没食子酸浓度 对吸光度绘制标准曲线(图 2) 。
|
图 2 酚浓度标准曲线图 |
由图 2 分析, 酚的含量在 0.005~0.05 mg/mL 内符合比尔定律,线性回归方程为:
Y=14.529X-0.0025
相关系数 r=0.9999,线性关系良好。
将 1 mL 标准溶液(0.5 mg/mL)移入 50 mL 的容量瓶中, 加酒石酸亚铁溶液 10 mL, 加 pH=7.5 磷酸缓冲液 10 mL,加蒸馏水定容。另以蒸馏水 代替标准溶液, 用同样方法配制的空白试剂溶液。 测吸光度 10 次,以 3 倍标准差[4]计算,得检出限 为 0.002 mg/mL。
蔗汁的处理:清汁可直接吸取测定;如果是 混合汁则需经 150 目尼龙布过滤,加热至 100℃, 冷却后再测定。
本实验选用的是广西某糖厂的清汁。 移 10 mL 清汁于 50 mL 容量瓶中, 加酒石酸亚铁溶液 10 mL, 加 pH=7.5 磷酸缓冲液 10 mL,再加蒸馏水定容, 测得吸光度为 E 甲。 空白样液取 10 mL 清汁于 50 mL 容量瓶中,加蒸馏水定容,测得吸光度为 E 乙,显 色液吸光度为:
E 清汁=E 甲-E 乙=0.209-0.020=0.189
蔗汁含酚量计算:先由 E 值从上述标准回归2 计 算 得 酚 浓 度 N , 然 后 按 下 式 计 算 :
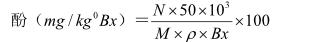
式中: N——在标准曲线上由 E 值查得的含酚 浓度(mg/mL);M——移取的样品量(mL)ρ——样 液视密度;Bx——样液锤度
查 表[5]Bx=10.1°Bx 时 , ρ=1.03750 , 计 算 N=0.0131 mg/mL,M=10 mL 。
代入计算公式:酚= 631.33(mg/kg°Bx) 。
蔗糖的处理:准确称取 20.0 g 蔗糖,用蒸馏 水溶解,移入 50 mL 容量瓶中,加酒石酸亚铁溶 液 10 mL,加 pH=7.5 的磷酸缓冲液 10 mL,再加 蒸馏水定容,测得吸光度为 E 甲。空白样液为准确 称取 20.0 g 蔗糖,用蒸馏水溶解,移入 50 mL 容 量瓶中,加蒸馏水定容,测得吸光度为 E 乙。
显色液吸光度为:
E 蔗糖=E 甲-E 乙=0.06597。
蔗糖含酚量的计算:
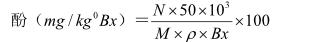
用标准曲线计算得:N=4.71×10-3 mg/mL,称 取蔗糖的重量为 G=20.0g。
代入计算公式:酚= 11.78(mg/kg°Bx) 。
准确称取 20.0 g 蔗糖,用蒸馏水溶解,移入 50 mL 容量瓶中,加酒石酸亚铁溶液 10 mL,加 pH=7.5 的磷酸缓冲液 10 mL,再加蒸馏水定容, 另以蒸馏水代替标准溶液,用同样方法配制空白 试剂溶液,重复测定 6 次,计算酚含量,结果见 表 4,相对标准偏差(RSD)=4.25%,方法精密度符 合分析要求。
| 表 4 精密度实验数据 |
移 10 mL 清汁于 50 mL 容量瓶中,分别加入 标准溶液 1、2、3 mL,加酒石酸亚铁溶液 10 mL, 加 pH=7.5 的磷酸缓冲液 10 mL, 再加蒸馏水定容, 另以蒸馏水代替标准溶液,用同样方法配制空白 试剂溶液,按实验方法进行 3 个加标浓度范围的 实验,表 5 为测定的加标回收率实验数据,回收 率在 100±5%之间,达到分析要求。
| 表 5 加标回收率实验数据 |
实验结果表明:缓冲液用量 5~25mL,显色 剂用量为 10 mL,显色时间 0~10 min,显色稳定, 样品吸光度无明显波动,实验能达到较理想的效 果。
本实验方法是测定糖中酚含量的较好方法, 它具有设备简单、操作快捷、灵敏度高、结果准 确等优点。与目前的测定方法比较,本方法比传 统的实验方法简便、省时且成本低廉,有在制糖 行业推广的意义。
| [1] | 霍汉镇.制糖工艺与装备的新概念与新实践(第一分册)[M]. 南宁:广西大学生物技术与糖业工程学院,1999:601~624. ( 1) 1)
|
| [2] | 霍汉镇.现代制糖工业技术(第一分册)[M]. 北京:中国轻工业出版社,1992:221-239. ( 1) 1)
|
| [3] | S.C.sharma,P.C.Jory,G.3.C.Rao.蔗汁澄清过程中酚的含量[J]. 国际甘蔗糖学会第十七届年会论文选集(下集),1981:27-30. ( 1) 1)
|
| [4] | 中华人民共和国标准.GB/T5009.1-2003食品卫生检测方法-理化部分总则[S]. 北京:中国标准出版社,2003. ( 1) 1)
|
| [5] | 广东省甘蔗糖业食品科学研究所.甘蔗制糖化学管理统一分析方法[M]. 北京:中国轻工业出版社,1976:441. ( 1) 1)
|
 2009
2009