还原糖的测定对于甘蔗茎秆的综合利用研究 具有十分重要的意义。有关总糖和还原糖含量的 测定有多种方法,如旋光法[1]、气相色谱法[2]、液 相色谱法[2]、分光光度法[3,4,5]等。旋光法测量准确 性较差;气相色谱法和液相色谱法测量过程较复 杂;3,5-二硝基水杨酸法(DNS)具有准确性高、 重现性好、特别适用于大批量样品的测定等特点 而被广泛采用;在植物糖的测定中,仍未见到有 同时用DNS 法测定总糖和还原糖的报道。然而DNS 法过程中的诸多因素如吸收光谱、显色剂用量、 显色时间等均对测定结果的准确性有直接影响, 为了能准确的测定甘蔗总糖和还原糖含量,我们 对用3,5-二硝基水杨酸比色法测定甘蔗茎节总糖 和还原糖含量的反应条件进行一系列的试验,试 图摸索出最佳的试验条件以保证试验的最佳精确 度,以期获得可靠的数据为甘蔗品质育种的实践 提供参考。
中国热带农业科学院试验田取生长11 个月 拔地拉果蔗
拔地拉果蔗从生长点依次向下数取23 节,榨 汁,放4℃备用。
分别取0.2 mL 的甘蔗汁加6 mo1/mL HCl 0.4mL,沸水浴30 min[6]。取出溶液1~2 滴于白 瓷板上,加1 滴I-KI 溶液检查水解是否完全,若 水解完全则不呈现黄色。冷却后加入1 滴10%酚 酞指示剂,用6 mol/mL NaOH 溶液中和到微红色, 定容至2 mL 后备用。
美国Bechkman Coulter DU800 分光光度计。
1 mg/mL 葡萄糖标准液:准确称取0.1 g 的 无水葡萄糖,待完全溶解后定容至100 mL。
DNS 显色液:分别取6.3 g DNS 和262 mL 2M NaOH 溶液,加至500 mL 含有185 g 酒石酸钾钠 的热水溶液中,再加入5 g 结晶酚和5 g 亚硫酸 钠,搅拌溶解冷却后加水定容至1000 mL。贮存 于棕色瓶中备用。
酚酞指示剂:称取0.1 g 酚酞,溶解于250 mL 70%乙醇中。
6 M HCl 和6 M NaOH 各100 mL
以上试剂均为分析纯。水为去离子水。
取0.75 mL 配制好的DNS 溶液于10 mL 的试 管中,加入0.4mL 葡萄糖标准液,补加纯水至3 mL, 摇匀糖溶液;置于沸腾的水浴锅中加热5 min 取 出,迅速用自来水冷却至室温;用蒸馏水定容至 10 mL。以DNS 试剂调零,在420~700 nm 波长范 围内测其吸光度。
在11 支比色管内分别加入1 mg/mL 葡萄糖标 准溶液0.00、0.10、0.20、0.30、0.40、0.50、 0.60、0.70、0.80、0.90、1.00 mL,加入DNS 试 剂0.75 mL,步骤同1.2.1 测定,读出各管溶液 的吸光度值。以葡萄糖含量为横坐标,各管吸光 度值为纵坐标绘制标准曲线。
准确吸取0.15 mL 葡萄糖标准液分别加入到 13 个10 mL 的比色管中,各加0.75 mLDNS,并在 沸水浴中煮2、3、4、5、6、7、8、10、12、14、 16、18、20 min,步骤同1.2.1,测定吸光值。
准确吸取甘蔗提取液0.4 mL 分别加入7 支比 色管,步骤1.2.3。显色后分别放置10 min、20 min、30 min、40 min、50 min、1 h、2 h,步骤 同1.2.1,然后测定吸光值。
为了保证显色完全,我们采用较高浓度葡萄 糖的标准液来进行DNS 用量的选择。准确吸取 1.0mL 的葡萄糖标准液分别加入8 支10 mL 比色 管中,分别加入0.2、0.4、0.6、0.8、1.0、1.2、 1.4、1.6 mL DNS 于试管中,步骤同1.2.1,测定 吸光值。
样品按照1.2.5 确定的条件处理后,测定吸 光度,在葡萄糖标准曲线上分别查出相应的还原 糖毫克数。按下式计算样品中总糖在每毫升蔗汁 中所占的质量数,还原糖即为曲线所对应的葡萄 糖量。每个样品设3 个重复。
总糖=查曲线所得水解后还原糖毫克数×稀 释倍数×0.9×100[6]
按照1.2.6 中样品的测定方法,同时取同一 样品6 份溶液,测定吸光度,计算标准偏差。
试验数据用EXCEL2000 进行处理和作图,并 采RSD 法进行差异显著性分析。
我们用DU800 紫外可见分光光度计对反应生 成的氨基化合物以及DNS 溶液调零后进行吸收光 谱扫描,结果见图1。入射光的波长应根据吸收 光谱,以选择溶液具有最大吸收时的波长为宜[7], 由图1 可知选λmax =510 nm 为合适,这一点与 朱海霞等[8]的报道相一致。我们在此波长下确定 显色时间以及由绘制出的葡萄糖含量与吸光度的 曲线关系最终确定测量还原糖的合适范围。
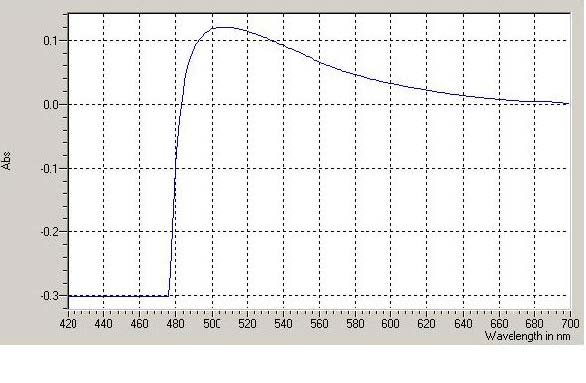
|
图1 葡萄糖与DNS 试剂反应液的紫外一可见吸收光谱 |
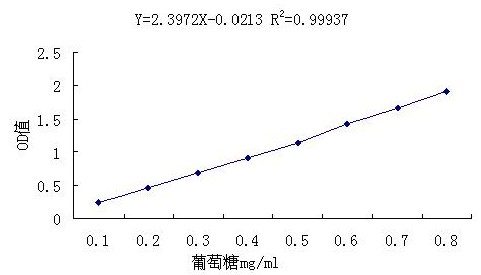
|
图2 葡萄糖标准曲线 |
从图2 我们可以发现,葡萄糖含量(mg/mL) 与相应的吸光度(A)有一定的线性关系。
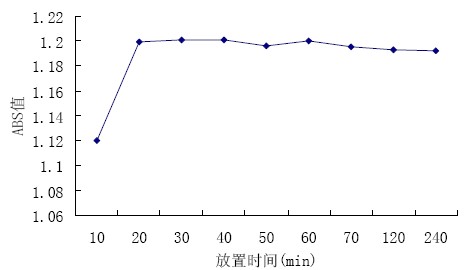
|
图3 显色液放置时间对测定结果的影响 |
图3 可见,显色液在显色之后的4 h 内,其 吸光度逐渐减小,可根据对还原糖含量精确度的 要求选择测定时间,即精确度要求高应及早测定, 若进行大批量样品的还原糖筛选,则可将显色液 样品集中测定以提高工作效率。
图4 可见,前6.0 min 内3,5-二硝基水杨酸 由于被迅速还原而吸光度急剧增大,在显色7 min 之后吸光度的变化趋于平缓,即显色时间在7 min 即可。
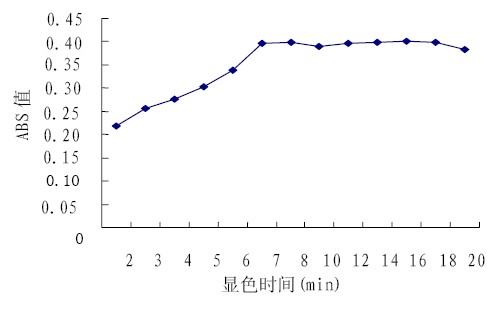
|
图4 显色时间对测定结果的影响 |
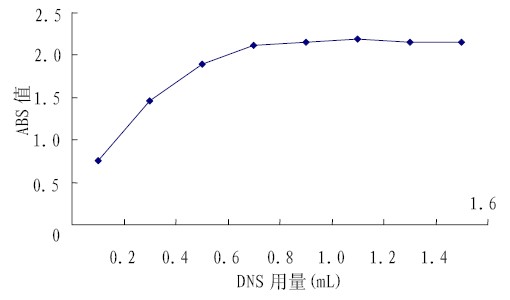
DNS 试剂用量与待测液中还原糖的含量息息 相关。图5 可见, 当 DNS 试剂用量小于 0.8 mL 时, 溶液吸光度随 DNS 剂用量的增加而增大, 当 DNS 试剂用量大于 0.8 mL, 吸光度则基本保持不变。 因此, DNS 试剂的最佳用量为0.8 mL。
|
图5 显色剂用量对测定结果的影响 |
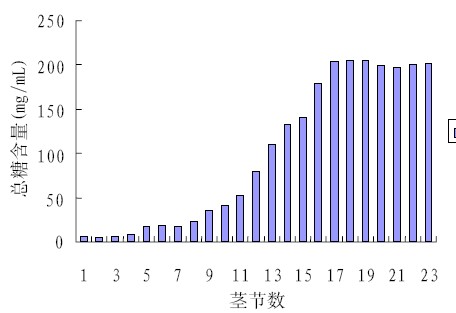
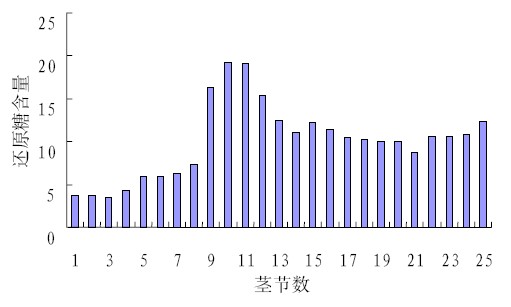
样品的测定结果见图6 和图7,能够正确反 映总糖和还原糖在甘蔗茎中的积累规律并与 McCormick 等[9]结果一致。
|
图6 总糖含量与不同甘蔗茎节数的关系 |
|
图7 还原糖含量与不同甘蔗茎节数的关系 |
| 表1 精密度实验结果 |
在国内首次将DNS 法应用于同时测定甘蔗茎 节总糖与还原糖,然而应用3,5-二硝基水杨酸比 色法测定还原糖含量对最佳吸收光谱的确定,不 同的作物需要采用不同的检测条件[10,11,12]。这些均 与常规方法[13]中的λmax=540 nm 有所不同。这可 能由于最佳波长的确定受到仪器性能、灵敏度、 试验对象中还原糖含量、可溶性物质种类及DNS 用量等因素的影响。因此应根据自己的试验对象 和仪器设备来确定试验所需的最佳条件。通过对 应用3,5-二硝基水杨酸比色法测定甘蔗总糖和还 原糖含量的影响因素,如吸收光谱、显色剂用量 及显色时间等条件进行试验筛选,最终确定甘蔗 茎还原糖和总糖含量测定的最佳波长为510 nm, DNS 用量为0.8 mL,显色时间7 min,显色液放 置时间超过20 min 较好。该法具有方便快捷、安 全、准确、低成本等特点,可用于甘蔗茎总糖和 还原糖含量的批量测定。
| [1] | 仝殿荣.用工作曲线法测定甜菜作物中的蔗糖含量[J]. 江西医学检验,2000,18(4):221. ( 1) 1)
|
| [2] | 沈小婉.色谱法在食品分析中的应用[M].北京:北京大学出版社,1992. ( 1) 1)
|
| [3] | 韩常佳,闰巧娟,刘向阳,等.国农作物秸秆资源及其利用现状[J]. 农业工程学报,2002,18 (3):87-91. ( 1) 1)
|
| [4] | 曹干,谭中文,梁计南,等.甘蔗蔗汁锤度和还原糖分傅立叶变换近红外定量分析数学模型[J]. 华南农业大学学报:自然科学版,2004,25(4):1-4. ( 1) 1)
|
| [5] | 申素红,李文红,戴有荔.用分光光度计测定食品中蔗糖的分析方法[J]. 食品研究与开发,1995,16(3):45. ( 1) 1)
|
| [6] | 孙伟伟,曹维强,王静.DNS法测定玉米秸秆中总糖[J]. 食品研究与开发,2006,127(6):120-123. ( 2) 2)
|
| [7] | 华东理工大学分析化学教研室,成都科学技术大学分析化学教研组.分析化学:第四版[M]. 北京:高等教育出版社,1995. ( 1) 1)
|
| [8] | 朱海霞,石瑛,张庆娜,等.3,5-二硝基水杨酸(DNS)比色法测定马铃薯还原糖含量的研究[J]. 中国马铃薯,2005,19(5):266-269. ( 1) 1)
|
| [9] | McCormick AJ,Cramer MD,Watt DA.Sink Strength regulates photOsynthesis in sugarcane[J]. New Phytologist.2006,171:759-770. ( 1) 1)
|
| [10] | 罗志刚,曾满枝,凌晨,等.3,5-二硝基水杨酸比色法测定烟草中水溶性总糖[J]. 中国烟草科学,2000(2):34-36. ( 1) 1)
|
| [11] | 齐香君,苟金霞,韩戌,等.3,5-二硝基水杨酸比色法测定溶液中还原糖的研究[J]. 纤维素科学与技术,2004(3):17-20. ( 1) 1)
|
| [12] | 范玲,闫建庆,郑春霞.3,5-二硝基水杨酸(DNS)比色法在分析棉花纤维还原糖含量中的应用研究[J]. 棉花学报,1996(3):51-154. ( 1) 1)
|
| [13] | 宇正祥.食品分析手册[M]. 北京:中国轻工业出版社,1998. ( 1) 1)
|
 2008
2008

 , 杨本鹏, 陈萍, 吴转娣, 胡军喻
, 杨本鹏, 陈萍, 吴转娣, 胡军喻 