阿尔茨海默病(Alzheimer’s disease,AD)是一种不可逆的神经退行性疾病,常见于老年人,其主要特征为记忆力和思维能力的逐渐下降。该疾病的病理特征主要包括β淀粉样蛋白在细胞外形成斑块及tau蛋白在神经元内形成神经元纤维缠结,这些变化导致神经元受损和死亡,最终引发大脑萎缩和功能丧失。AD的病因尚未完全明确,年龄、基因遗传、炎症及环境因素等都被认为与该疾病的发生有关。脂质作为能量储存源和代谢底物,在信号通路调节中具有重要作用。大脑富含脂质,在所有人体组织中,大脑的脂质含量仅次于脂肪组织,占其干重的50%[1]。脂质在大脑功能的正常运行和人体健康中具有重要作用[2]。炎症反应与脂质代谢在疼痛的产生和维持中具有密切关联,脂类物质如脂肪酸和脂类信号分子在炎症反应中起着重要作用[3]。脂质代谢稳态的破坏与包括AD等神经退行性疾病在内的神经系统疾病有关[2],了解脂质代谢及其变化在很大程度上有助于理解神经退行性疾病背后的机制。本文回顾梳理了脂质通过调控炎症影响AD的研究进展。
1 AD中的神经炎症神经炎症是指中枢神经系统内的炎症性过程,主要由活化的内皮细胞和神经胶质细胞释放的促炎介质推动。这些介质包括细胞因子、前列腺素、活性氧和活性氮等。神经炎症可能导致水肿、组织损伤和神经元功能障碍,并引发和加速认知障碍和神经退行性疾病。在各种神经系统疾病中,神经炎症起着重要作用。值得注意的是,神经炎症在不同情况下表现出不同特征,例如神经退行性疾病和慢性疼痛后的中枢神经炎症具有显著差异。慢性疼痛中的神经炎症相对较轻,主要源于外周损伤和初级感觉神经元过度活跃;而神经退行性疾病和脊髓损伤中的神经炎症较为严重,由中枢神经系统直接损伤引发,将导致进一步的神经元损伤和细胞死亡,即继发性损伤[3]。
中枢神经系统对炎症反应高度敏感,深入了解神经炎症的机制并揭示其与AD之间的联系,有助于寻找预防和治疗AD的创新方法。小胶质细胞、星形胶质细胞、少突胶质细胞和髓样细胞等多种细胞参与了神经炎症过程,多种细胞因子、趋化因子和一氧化氮也在神经炎症反应中发挥关键作用。炎症调节因子TGF-β在AD中表现出双重作用:一方面,它可以诱导淀粉样斑块在脑血管中形成;另一方面,它可以增加淀粉样斑块的吞噬能力,但同时也会减少小胶质细胞的增生[4]。同时,TGF-β还与神经元纤维缠结有关[4]。神经炎症会影响突触可塑性和突触修剪等过程,从而对神经元的正常功能造成影响,并可能导致认知功能下降[4]。
2 脂质代谢对神经炎症的调控 2.1 肥胖和胰岛素抵抗对神经炎症的调节长期的高脂饮食容易引起脂质代谢异常,导致肥胖。肥胖被认为是一种慢性促炎疾病,脂肪细胞可以模拟免疫细胞产生许多促炎脂肪因子,如IL-6、IL-1β、TNF-α和趋化因子[5]。神经退行性疾病和肥胖之间有复杂的联系,肥胖可能影响中枢神经炎症,并与AD的潜在神经病理机制有关。神经炎症激活小胶质细胞和星形胶质细胞后,可诱导活性氧和活性氮的过量产生;同时,活化胶质细胞通过上调促炎因子(如IL-1β、TNF-α)及异常激活吞噬功能,最终导致神经元损伤和死亡。
胰岛素抵抗是2型糖尿病的病因,同时也参与AD的发展进程。当外周发生胰岛素抵抗时,外周血中高浓度的胰岛素可穿过血脑屏障,促进IL-1β、IL-6和TNF-α等炎症因子的表达;炎症和β淀粉样蛋白互相促进,形成恶性循环,最终导致不可逆的神经损伤[6]。
2.2 脑肠轴对神经炎症的调节脑肠轴是指大脑与肠道之间存在的相互作用和通信机制。其基础在于大脑与肠道之间存在复杂的双向信息交流网络,这种交流依赖于神经系统、内分泌系统和免疫系统的相互作用。肠道菌群通过脑肠轴对AD的发展过程施加影响。目前已有文献指出,炎症进程、AD的发展与肠道菌群有着密切的关联[7]。健康肠道菌群的存在能减少β淀粉样蛋白的沉积,从而延缓AD的发展[8]。
研究表明,肠道菌群组成的改变导致肠道屏障通透性增加甚至全身性炎症,从而损害血脑屏障,加剧神经炎症,最终导致AD。在老年AD患者的粪便微生物群中,能够合成丁酸盐的细菌比例降低,而促炎细菌的比例却增高;与来自没有痴呆的老年人的粪便样本相比,来自老年AD患者的粪便样本在体外诱导下肠上皮细胞P-糖蛋白(肠道稳态的关键介质)表达水平降低,而P-糖蛋白失调将直接导致肠道炎症紊乱[9]。肠道菌群分泌的促炎毒素也可能进入大脑,影响神经元功能,引起神经炎症。肠道菌群、黏膜免疫系统和肠神经系统组成网络的改变可能是驱动神经退行性疾病发病的共同途径[10]。此外,有证据表明肠道菌群会通过影响内源性激素的分泌对AD造成影响,包括YY肽(一种厌食性神经肽,通过抑制胃运动来抑制饥饿感)、肠促胰酶肽、胃饥饿素、瘦素、5-羟色胺、肾上腺酮等;肠道微生物失衡导致肠道微生物代谢产物变化,例如短链脂肪酸减少,这些变化通过下丘脑-垂体-肾上腺轴影响激素的释放;此外,短链脂肪酸也可通过脑肠轴,穿越血脑屏障直接影响大脑[11]。
肠道微生物、脑肠轴与神经炎症之间的联系密切且复杂,进一步探究肠道菌群在AD发生机制和发展过程中的作用,可能为该疾病的诊断、防治等提供新的视角和策略选择。
2.3 脂肪酸在炎症中的重要作用脂肪酸是脂类的基本组成部分,主要有饱和脂肪酸、反式脂肪酸、单不饱和脂肪酸和多不饱和脂肪酸(polyunsaturated fatty acid,PUFA)。在大脑中,PUFA多与神经膜磷脂结合,通过改变膜流动性、信号转导、基因转录影响神经元凋亡和死亡[12]。PUFA是主导炎症反应的脂质介质生物合成的前体。饮食中的n-3/n-6 PUFA比例可以影响膜质磷脂的脂肪酸组成,这些磷脂被代谢为脂质介质,可能具有有害的促炎作用,有益的抗炎、神经保护、抗氧化作用,以及神经调节作用[13]。与新皮质β淀粉样蛋白负荷较低的个体相比,β淀粉样蛋白负荷较高的个体血浆花生四烯酸(arachidonic acid,AA)升高,二十二碳五烯酸(docosapentaenoic acid,DPA)降低[14]。体外实验表明,高水平的游离脂肪酸特别是皮质游离脂肪酸诱导淀粉样蛋白和tau蛋白细丝的组装[15]。对亚油酸、AA、α-亚麻酸、二十二碳六烯酸(docosahexaenoic acid,DHA)、二十碳五烯酸(eicosapentaenoic acid,EPA)和油酸等6种不饱和脂肪酸的研究表明,这些不饱和脂肪酸与神经斑块和认知能力相关;在易受AD影响的大脑区域(额叶中回和颞下回),亚油酸、α-亚麻酸和AA均下降,而DHA上升[16]。这6种不饱和脂肪酸均可直接与β淀粉样蛋白40和β淀粉样蛋白42相互作用,并通过阻止淀粉样蛋白纤维的形成而表现出优异的抗聚集特性,尤其是油酸和DHA[17]。
PUFA和饱和脂肪酸已被证实直接参与驱动小胶质细胞的炎症反应,并改变其相关的免疫功能。其中,n-3 PUFA能够直接调控小胶质细胞向抗炎表型的转化,并促进其吞噬作用;EPA和DHA不仅能增加小胶质细胞中抗炎基因(如CD206、精氨酸酶1和过氧化物酶体增殖物激活受体γ)的表达,还会下调促炎相关基因的表达,从而减轻多发性硬化过程中的脱髓鞘病理改变,并改善相关神经退行性病变[18]。DHA是所有脑区中含量最多的PUFA[19]。在出生前,脂肪酸的浓度达到一个平台,但DHA是一个例外,在突触发生之前,它继续快速积累并增加[20]。随着年龄的增长,DHA水平逐渐下降。正常的衰老会导致整体脑萎缩,而DHA水平的降低与海马萎缩有关[21-22]。有研究表明,AD患者脑内DHA水平降低,并与认知功能缺陷有关[23]。DHA主要从饮食中摄取或在肝脏中合成,AD患者的肝脏中DHA水平较低但短链n-3脂肪酸前体(包括四碳六烯酸)水平较高,这表明DHA的合成过程受损[24]。然而,也有一些研究表明,AD患者红细胞或脑组织中DHA含量与对照组无显著差异[25-26]。有研究发现,用同位素增强(氘化)PUFA替代氢化PUFA可以抑制脂质过氧化,与喂食氢化PUFA的AD模型小鼠相比,喂食氘化PUFA的AD模型小鼠海马中的脂质过氧化产物和β淀粉样蛋白的产生减少[27]。
油酸和AA与AD之间存在一定的关系,但这种关系非常复杂,仍在不断研究中。在AD的细胞和动物模型中,补充油酸可减少β淀粉样蛋白的形成[28]。AD患者脯氨酰内肽酶活性增高,它可能与该病特有的淀粉样蛋白的生成有关,在不饱和脂肪酸中油酸对脯氨酰内肽酶抑制活性最高[29]。另有研究表明,油酸导致转染细胞中γ-分泌酶活性升高,使早老蛋白1和β淀粉样蛋白升高[30]。需要指出的是,关于油酸、AA和AD之间的关系仍然存在争议,研究结果不一致。有些研究表明,高摄入油酸和AA的饮食可能增加AD风险[31],而其他研究则没有发现这种关联[32]。总之,油酸和AA与AD之间的关系复杂,仍需要更多的研究来明确它们之间的确切联系。
2.4 载脂蛋白E(apolipoprotein E,ApoE)对神经炎症的调控ApoE是一种分子量约为34 000的糖蛋白,人体的许多细胞如肝实质细胞、巨噬细胞、脂肪细胞和肌细胞等都分泌ApoE,在中枢神经系统中星形胶质细胞、脉络丛、小胶质细胞是ApoE的主要来源[33]。人类ApoE基因具有多态性的特点,在单基因位点ε2、ε3和ε4上存在3个等位基因变异,分别编码ApoE的3种不同的异构体E2、E3和E4[34]。ApoE4是AD的主要遗传危险因素,大约60%~80%的AD患者携带ε4等位基因。ApoE4引起AD的风险是剂量依赖性的,携带1个ε4等位基因的个体患AD的风险增加2~3倍,而携带2个ε4等位基因的个体患AD的风险增加10~15倍[35]。在AD中,ApoE与β淀粉样蛋白的代谢、tau蛋白介导的神经变性、神经炎症反应、突触完整性、脂质运输、葡萄糖代谢等过程密切相关[36]。
ApoE4对炎症的影响是复杂的,在不同的种族和生存环境中不尽相同[37]。最近有研究证明ApoE4能够激活钙依赖性胞质磷脂酶A2(cytosolic phospholipase A2,cPLA2)信号系统,cPLA2参与炎症信号转导并在AD脑斑块中升高,且ApoE4对cPLA2的激活作用高于ApoE3[38],这可能为减轻ApoE4和AD导致的神经炎症提供了潜在药物靶点。此外,ApoE4也与外周炎症有关,ApoE4携带者的外周慢性低度炎症可能增加AD风险[39]。
3 小胶质细胞在神经炎症中的作用小胶质细胞在中枢神经系统免疫反应中起着关键作用,其主要功能之一是检测和清除有毒蛋白聚集体。在正常生理条件下,小胶质细胞在毒性蛋白的刺激下被激活[40-41],并通过胞饮作用、吞噬作用或受体介导的内吞作用将这些致病物质内化,同时激活趋化因子受体和干扰素等相关基因的表达,发挥抗炎作用[42-43]。一旦消除刺激,这个过程通常就会消失。然而随着年龄的增长,小胶质细胞检测清除功能减弱,并且易于持续激活,成为促炎表型小胶质细胞,产生促炎细胞因子,这可能与神经退行性疾病的发病机制有关[44-45]。小胶质细胞通过不同的调节网络与中枢神经系统的发育、成熟和衰老同步,并在发育突触修剪、神经元凋亡、突触可塑性维持和免疫监视中发挥重要作用[46]。有缺陷的突触修剪被认为与自闭症谱系障碍有关,免疫监视功能受损似乎也与神经退行性疾病密切相关[47]。
3.1 小胶质细胞表型改变由于具有不同的表型和多种激活途径,小胶质细胞在AD的发展进程中有着复杂的作用。小胶质细胞可以在病理刺激下由分支状转变为变形虫状[48-49]。衰老大脑中的小胶质细胞分支减少,导致其免疫监视区域变小,这可能损害体内稳态平衡[50-52]。有趣的是,患病大脑中的小胶质细胞形态也因疾病的空间位置和时间阶段而异,例如,淀粉样斑块相关的小胶质细胞经历了剧烈的形态和电生理变化,而斑块远处的小胶质细胞随着时间的推移只表现出微小的变化[53]。这可能归因于病理环境的强度和持续时间,也可能与小胶质细胞对不同刺激(如β淀粉样蛋白或tau蛋白聚集)的差异反应有关[54]。具体来说,营养不良小胶质细胞(也被称为“暗小胶质细胞”)的出现先于tau聚集的发展[55-56]。可溶性高磷酸化的tau蛋白能够驱动小胶质细胞的表型变化,导致其免疫监视功能丧失,并通过形成神经原纤维缠结促进AD进展[57]。这些研究结果表明,小胶质细胞的表型改变,包括形态学、蛋白质组学特征和行为的改变,与AD疾病进展有关[58-59]。
既往研究中通常把激活的小胶质细胞分为M1、M2两种表型,其中M1为促炎表型,M2为抗炎表型(图 1),在小胶质细胞的个体发育和功能意义尚未明确的时候,这种简化分类模型有助于解释小胶质细胞的研究数据[60]。然而,越来越多的证据表明小胶质细胞不符合M1、M2二分法[61]。此外,小胶质细胞和巨噬细胞表型的典型免疫化学标志物,如人类白细胞DR抗原和CD68,在识别促炎和抗炎表型方面缺乏特异性[62]。尽管如此,这种分类方法仍然被广泛使用,以证明小胶质细胞在不同情况下可能具有保护作用(M2)或有害作用(M1)的观点。
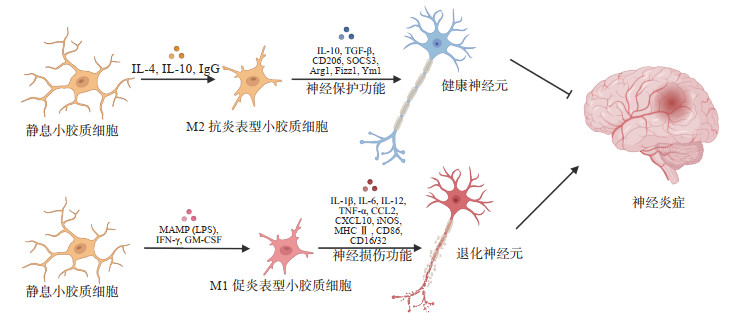
|
图 1 小胶质细胞表型改变与神经炎症(使用Biorender软件绘制) IL:白细胞介素;IgG:免疫球蛋白G;TGF-β:转化生长因子β;SOCS3:细胞因子信号转导抑制因子3;Arg1:精氨酸酶1;Fizz1:抵抗素样分子α;Ym1:壳多糖酶3样蛋白3;MAMP:微生物相关分子模式;LPS:脂多糖;IFN-γ:干扰素γ;GM-CSF:粒细胞巨噬细胞集落刺激因子;TNF-α:肿瘤坏死因子α;CCL2:C-C基序趋化因子配体2;CXCL10:C-X-C基序趋化因子配体10;iNOS:诱导型一氧化氮合酶;MHCⅡ:主要组织相容性复合体Ⅱ. |
脂蛋白脂肪酶(lipoprotein lipase,LPL)是甘油三酯运输、传递和利用的关键酶之一。高碳水化合物和高脂肪饮食会增加小胶质细胞中LPL的表达,而特异性下调小胶质细胞中的LPL则会导致其对脂质的摄取和利用效率降低。这种变化进而引发小胶质细胞线粒体形态异常、ATP供应不足,以及吞噬功能的负向调控[63]。在AD中,上调小胶质细胞LPL的表达能够促进脂肪酸代谢,减轻小胶质细胞的炎症反应,并增强其吞噬β淀粉样蛋白的能力,从而减轻神经炎症,延缓AD的发展进程[64]。
3.2 小胶质细胞和神经元之间的串扰关于神经炎症的研究表明,小胶质细胞、星形胶质细胞和神经元同步促进神经系统病变。β淀粉样蛋白激活星形胶质细胞的NFκB通路,导致补体C3释放增加;补体C3反过来作用于神经元和小胶质细胞上的C3a受体,导致神经元功能障碍和小胶质细胞激活[65-66];激活的小胶质细胞通过释放IL-1α、C1q和TNF诱导神经毒性星形胶质细胞的激活[67]。在神经炎症环境下,小胶质细胞和星形胶质细胞之间的细胞串扰可以形成正反馈回路,导致炎症反应失调和自我放大。值得注意的是,在AD中也观察到神经元-神经胶质细胞串扰失调。CD200-CD200受体(CD200 receptor,CD200R)和C-X3-C基序趋化因子配体1(C-X3-C motif chemokine ligand 1,CX3CL1)- C-X3-C基序趋化因子受体1(C-X3-C motif chemokine receptor 1,CX3CR1)是介导神经元-小胶质细胞串扰的关键通路,对于维持小胶质细胞的稳态特征具重要意义[68]。然而,在AD患者的大脑中,CD200、CD200R和CX3CR1的表达减少,削弱了神经元-小胶质细胞之间的串扰,加剧了神经炎症反应[69-70]。
4 小结脂质代谢调控炎症反应在AD中的机制复杂多样,仍有待深入研究。揭示脂质代谢和炎症反应之间的相互关系对于理解AD的发病机制具有重要意义,也有助于为AD的预防和治疗提供潜在的策略。
| [1] |
HORNEMANN T. Mini review: lipids in peripheral nerve disorders[J]. Neurosci Lett, 2021, 740: 135455. DOI:10.1016/j.neulet.2020.135455 |
| [2] |
YOON J H, SEO Y, JO Y S, et al. Brain lipidomics: From functional landscape to clinical significance[J]. Sci Adv, 2022, 8(37): eadc9317. DOI:10.1126/sciadv.adc9317 |
| [3] |
JI R R, XU Z Z, GAO Y J. Emerging targets in neuroinflammation-driven chronic pain[J]. Nat Rev Drug Discov, 2014, 13(7): 533-548. DOI:10.1038/nrd4334 |
| [4] |
ARDURA-FABREGAT A, BODDEKE E M, BOZA-SERRANO A, et al. Targeting neuroinflammation to treat Alzheimer's disease[J]. CNS Drugs, 2017, 31(12): 1057-1082. DOI:10.1007/s40263-017-0483-3 |
| [5] |
FENG T, ZHAO X, GU P, et al. Adipocyte-derived lactate is a signalling metabolite that potentiates adipose macrophage inflammation via targeting PHD2[J]. Nat Commun, 2022, 13(1): 5208. DOI:10.1038/s41467-022-32871-3 |
| [6] |
ZHU T B, ZHANG Z, LUO P, et al. Lipid metabolism in Alzheimer's disease[J]. Brain Res Bull, 2019, 144: 68-74. DOI:10.1016/j.brainresbull.2018.11.012 |
| [7] |
MOU Y, DU Y, ZHOU L, et al. Gut microbiota interact with the brain through systemic chronic inflammation: implications on neuroinflammation, neurodegeneration, and aging[J]. Front Immunol, 2022, 13: 796288. DOI:10.3389/fimmu.2022.796288 |
| [8] |
ZHA X, LIU X, WEI M, et al. Microbiota-derived lysophosphatidylcholine alleviates Alzheimer's disease pathology via suppressing ferroptosis[J]. Cell Metab, 2025, 37(1): 169-186.e9. DOI:10.1016/j.cmet.2024.10.006 |
| [9] |
HARAN J P, BHATTARAI S K, FOLEY S E, et al. Alzheimer's disease microbiome is associated with dysregulation of the anti-inflammatory P-glycoprotein pathway[J]. mBio, 2019, 10(3): e00632-19. DOI:10.1128/mBio.00632-19 |
| [10] |
DONALDSON A I C, FYFE C L, MARTIN J C, et al. Aging gut-brain interactions: pro-inflammatory gut bacteria are elevated in fecal samples from individuals living with Alzheimer's dementia[J]. Geriatrics (Basel), 2025, 10(2): 37. DOI:10.3390/geriatrics10020037 |
| [11] |
WU Y, HANG Z, LEI T, et al. Intestinal flora affect Alzheimer's disease by regulating endogenous hormones[J]. Neurochem Res, 2022, 47(12): 3565-3582. DOI:10.1007/s11064-022-03784-w |
| [12] |
KIM H Y, AKBAR M, LAU A, et al. Inhibition of neuronal apoptosis by docosahexaenoic acid (22: 6n-3). Role of phosphatidylserine in antiapoptotic effect[J]. J Biol Chem, 2000, 275(45): 35215-35223. DOI:10.1074/jbc.M004446200 |
| [13] |
SCHÖNFELD P, REISER G. Brain energy metabolism spurns fatty acids as fuel due to their inherent mitotoxicity and potential capacity to unleash neurodegeneration[J]. Neurochem Int, 2017, 109: 68-77. DOI:10.1016/j.neuint.2017.03.018 |
| [14] |
GOOZEE K, CHATTERJEE P, JAMES I, et al. Alterations in erythrocyte fatty acid composition in preclinical Alzheimer's disease[J]. Sci Rep, 2017, 7(1): 676. DOI:10.1038/s41598-017-00751-2 |
| [15] |
WILSON D M, BINDER L I. Free fatty acids stimulate the polymerization of tau and amyloid beta peptides. In vitro evidence for a common effector of pathogenesis in Alzheimer's disease[J]. Am J Pathol, 1997, 150(6): 2181-2195. |
| [16] |
SNOWDEN S G, EBSHIANA A A, HYE A, et al. Association between fatty acid metabolism in the brain and Alzheimer disease neuropathology and cognitive performance: a nontargeted metabolomic study[J]. PLoS Med, 2017, 14(3): e1002266. DOI:10.1371/journal.pmed.1002266 |
| [17] |
EL SHATSHAT A, PHAM A T, RAO P P N. Interactions of polyunsaturated fatty acids with amyloid peptides Aβ40 and Aβ42[J]. Arch Biochem Biophys, 2019, 663: 34-43. DOI:10.1016/j.abb.2018.12.027 |
| [18] |
CHEN S, ZHANG H, PU H, et al. N-3 PUFA supplementation benefits microglial responses to myelin pathology[J]. Sci Rep, 2014, 4: 7458. DOI:10.1038/srep07458 |
| [19] |
NAUDÍ A, CABRÉ R, DOMINGUEZ-GONZALEZ M, et al. Region-specific vulnerability to lipid peroxidation and evidence of neuronal mechanisms for polyunsaturated fatty acid biosynthesis in the healthy adult human central nervous system[J]. Biochim Biophys Acta Mol Cell Biol Lipids, 2017, 1862(5): 485-495. DOI:10.1016/j.bbalip.2017.02.001 |
| [20] |
GREEN P, GLOZMAN S, KAMENSKY B, et al. Developmental changes in rat brain membrane lipids and fatty acids: the preferential prenatal accumulation of docosahexaenoic acid[J]. J Lipid Res, 1999, 40(5): 960-966. DOI:10.1016/S0022-2275(20)32132-5 |
| [21] |
UMHAU J C, ZHOU W, CARSON R E, et al. Imaging incorporation of circulating docosahexaenoic acid into the human brain using positron emission tomography[J]. J Lipid Res, 2009, 50(7): 1259-1268. DOI:10.1194/jlr.M800530-JLR200 |
| [22] |
POTTALA J V, YAFFE K, ROBINSON J G, et al. Higher RBC EPA + DHA corresponds with larger total brain and hippocampal volumes: WHIMS-MRI study[J]. Neurology, 2014, 82(5): 435-442. DOI:10.1212/WNL.0000000000000080 |
| [23] |
ASTARITA G, JUNG K M, BERCHTOLD N C, et al. Deficient liver biosynthesis of docosahexaenoic acid correlates with cognitive impairment in Alzheimer's disease[J]. PLoS One, 2010, 5(9): e12538. DOI:10.1371/journal.pone.0012538 |
| [24] |
ASTARITA G, PIOMELLI D. Towards a whole-body systems[J]. Prostaglandins Leukot Essent Fatty Acids, 2011, 85(5): 197-203. DOI:10.1016/j.plefa.2011.04.021 |
| [25] |
KRÖGER E, VERREAULT R, CARMICHAEL P H, et al. Omega-3 fatty acids and risk of dementia: the Canadian Study of Health and Aging[J]. Am J Clin Nutr, 2009, 90(1): 184-192. DOI:10.3945/ajcn.2008.26987 |
| [26] |
FRASER T, TAYLER H, LOVE S. Fatty acid composition of frontal, temporal and parietal neocortex in the normal human brain and in Alzheimer's disease[J]. Neurochem Res, 2010, 35(3): 503-513. DOI:10.1007/s11064-009-0087-5 |
| [27] |
RAEFSKY S M, FURMAN R, MILNE G, et al. Deuterated polyunsaturated fatty acids reduce brain lipid peroxidation and hippocampal amyloid β-peptide levels, without discernable behavioral effects in an APP/PS1 mutant transgenic mouse model of Alzheimer's disease[J]. Neurobiol Aging, 2018, 66: 165-176. DOI:10.1016/j.neurobiolaging.2018.02.024 |
| [28] |
AMTUL Z, WESTAWAY D, CECHETTO D F, et al. Oleic acid ameliorates amyloidosis in cellular and mouse models of Alzheimer's disease[J]. Brain Pathol, 2011, 21(3): 321-329. DOI:10.1111/j.1750-3639.2010.00449.x |
| [29] |
PARK Y S, JANG H J, LEE K H, et al. Prolyl endopeptidase inhibitory activity of unsaturated fatty acids[J]. J Agric Food Chem, 2006, 54(4): 1238-1242. DOI:10.1021/jf052521h |
| [30] |
LIU Y, YANG L, CONDE-KNAPE K, et al. Fatty acids increase presenilin-1 levels and γ-secretase activity in PSwt-1 cells[J]. J Lipid Res, 2004, 45(12): 2368-2376. DOI:10.1194/jlr.M400317-JLR200 |
| [31] |
YIN F. Lipid metabolism and Alzheimer's disease: clinical evidence, mechanistic link and therapeutic promise[J]. FEBS J, 2023, 290(6): 1420-1453. DOI:10.1111/febs.16344 |
| [32] |
NAGHSHI S, AUNE D, BEYENE J, et al. Dietary intake and biomarkers of alpha linolenic acid and risk of all cause, cardiovascular, and cancer mortality: systematic review and dose-response meta-analysis of cohort studies[J]. BMJ, 2021, 375: n2213. DOI:10.1136/bmj.n2213 |
| [33] |
郭翠鸳, 王万海, 万延民. 载脂蛋白E在免疫调节及病毒感染过程中的作用[J]. 微生物学免疫学进展, 2023, 51(1): 82-88. DOI:10.13309/j.cnki.pmi.2023.01.013 |
| [34] |
KACPERCZYK M, KMIECIAK A, KRATZ E M. The role of ApoE expression and variability of its glycosylation in human reproductive health in the light of current information[J]. Int J Mol Sci, 2021, 22(13): 7197. DOI:10.3390/ijms22137197 |
| [35] |
TROUTWINE B R, HAMID L, LYSAKER C R, et al. Apolipoprotein E and Alzheimer's disease[J]. Acta Pharm Sin B, 2022, 12(2): 496-510. DOI:10.1016/j.apsb.2021.10.002 |
| [36] |
付莎, 袁忠明. 阿尔茨海默病与载脂蛋白E的联系研究[J]. 现代医药卫生, 2021, 37(4): 609-612. DOI:10.3969/j.issn.1009-5519.2021.04.019 |
| [37] |
ASANTE I, LOUIE S, YASSINE H N. Uncovering mechanisms of brain inflammation in Alzheimer's disease with APOE4: application of single cell-type lipidomics[J]. Ann N Y Acad Sci, 2022, 1518(1): 84-105. DOI:10.1111/nyas.14907 |
| [38] |
WANG S, LI B, SOLOMON V, et al. Calcium-dependent cytosolic phospholipase A2 activation is implicated in neuroinflammation and oxidative stress associated with ApoE4[J]. Mol Neurodegener, 2022, 17(1): 42. DOI:10.1186/s13024-022-00549-5 |
| [39] |
PARHIZKAR S, HOLTZMAN D M. APOE mediated neuroinflammation and neurodegeneration in Alzheimer's disease[J]. Semin Immunol, 2022, 59: 101594. DOI:10.1016/j.smim.2022.101594 |
| [40] |
DOENS D, FERNÁNDEZ P L. Microglia receptors and their implications in the response to amyloid β for Alzheimer's disease pathogenesis[J]. J Neuroinflammation, 2014, 11: 48. DOI:10.1186/1742-2094-11-48 |
| [41] |
GARCÍA-REVILLA J, ALONSO-BELLIDO I M, BURGUILLOS M A, et al. Reformulating pro-oxidant microglia in neurodegeneration[J]. J Clin Med, 2019, 8(10): E1719. DOI:10.3390/jcm8101719 |
| [42] |
SOLÉ-DOMÈNECH S, CRUZ D L, CAPETILLO-ZARATE E, et al. The endocytic pathway in microglia during health, aging and Alzheimer's disease[J]. Ageing Res Rev, 2016, 32: 89-103. DOI:10.1016/j.arr.2016.07.002 |
| [43] |
OWENS T, KHOROOSHI R, WLODARCZYK A, et al. Interferons in the central nervous system: a few instruments play many tunes[J]. Glia, 2014, 62(3): 339-355. DOI:10.1002/glia.22608 |
| [44] |
NORDEN D M, GODBOUT J P. Review: microglia of the aged brain: primed to be activated and resistant to regulation[J]. Neuropathol Appl Neurobiol, 2013, 39(1): 19-34. DOI:10.1111/j.1365-2990.2012.01306.x |
| [45] |
SPITTAU B. Aging microglia-phenotypes, functions and implications for age-related neurodegenerative diseases[J]. Front Aging Neurosci, 2017, 9: 194. DOI:10.3389/fnagi.2017.00194 |
| [46] |
ALSHAEBI F, SCIORTINO A, KAYED R. The role of glial cell senescence in Alzheimer's disease[J]. J Neurochem, 2025, 169(3): e70051. DOI:10.1111/jnc.70051 |
| [47] |
PAOLICELLI R C, BOLASCO G, PAGANI F, et al. Synaptic pruning by microglia is necessary for normal brain development[J]. Science, 2011, 333(6048): 1456-1458. DOI:10.1126/science.1202529 |
| [48] |
NIMMERJAHN A, KIRCHHOFF F, HELMCHEN F. Resting microglial cells are highly dynamic surveillants of brain parenchyma in vivo[J]. Science, 2005, 308(5726): 1314-1318. DOI:10.1126/science.1110647 |
| [49] |
STENCE N, WAITE M, DAILEY M E. Dynamics of microglial activation: a confocal time-lapse analysis in hippocampal slices[J]. Glia, 2001, 33(3): 256-266. DOI:10.1002/1098-1136(200103)33:3<256::AID-GLIA1024>3.0.CO;2-J |
| [50] |
DAVIES D S, MA J, JEGATHEES T, et al. Microglia show altered morphology and reduced arborization in human brain during aging and Alzheimer's disease[J]. Brain Pathol, 2017, 27(6): 795-808. DOI:10.1111/bpa.12456 |
| [51] |
RAWJI K S, MISHRA M K, MICHAELS N J, et al. Immunosenescence of microglia and macrophages: impact on the ageing central nervous system[J]. Brain, 2016, 139(Pt 3): 653-661. DOI:10.1093/brain/awv395 |
| [52] |
BISHT K, SHARMA K P, LECOURS C, et al. Dark microglia: a new phenotype predominantly associated with pathological states[J]. Glia, 2016, 64(5): 826-839. DOI:10.1002/glia.22966 |
| [53] |
PLESCHER M, SEIFERT G, HANSEN J N, et al. Plaque-dependent morphological and electrophysiological heterogeneity of microglia in an Alzheimer's disease mouse model[J]. Glia, 2018, 66(7): 1464-1480. DOI:10.1002/glia.23318 |
| [54] |
DOORN K J, GOUDRIAAN A, BLITS-HUIZINGA C, et al. Increased amoeboid microglial density in the olfactory bulb of Parkinson's and Alzheimer's patients[J]. Brain Pathol, 2014, 24(2): 152-165. DOI:10.1111/bpa.12088 |
| [55] |
TISCHER J, KRUEGER M, MUELLER W, et al. Inhomogeneous distribution of Iba-1 characterizes microglial pathology in Alzheimer's disease[J]. Glia, 2016, 64(9): 1562-1572. DOI:10.1002/glia.23024 |
| [56] |
STREIT W J, BRAAK H, XUE Q S, et al. Dystrophic (senescent) rather than activated microglial cells are associated with tau pathology and likely precede neurodegeneration in Alzheimer's disease[J]. Acta Neuropathol, 2009, 118(4): 475-485. DOI:10.1007/s00401-009-0556-6 |
| [57] |
SANCHEZ-MEJIAS E, NAVARRO V, JIMENEZ S, et al. Soluble phospho-tau from Alzheimer's disease hippocampus drives microglial degeneration[J]. Acta Neuropathol, 2016, 132(6): 897-916. DOI:10.1007/s00401-016-1630-5 |
| [58] |
YIN Z, RAJ D, SAIEPOUR N, et al. Immune hyperreactivity of Aβ plaque-associated microglia in Alzheimer's disease[J]. Neurobiol Aging, 2017, 55: 115-122. DOI:10.1016/j.neurobiolaging.2017.03.021 |
| [59] |
NGUYEN H M, GRÖSSINGER E M, HORIUCHI M, et al. Differential Kv1.3, KCa3.1, and Kir2.1 expression in "classically" and "alternatively" activated microglia[J]. Glia, 2017, 65(1): 106-121. DOI:10.1002/glia.23078 |
| [60] |
YANG X, WANG J, JIA X, et al. Microglial polarization in Alzheimer's disease: mechanisms, implications, and therapeutic opportunities[J]. J Alzheimers Dis, 2025, 104(1): 3-13. DOI:10.1177/13872877241313223 |
| [61] |
RANSOHOFF R M. A polarizing question: do M1 and M2 microglia exist?[J]. Nat Neurosci, 2016, 19(8): 987-991. DOI:10.1038/nn.4338 |
| [62] |
KIM C C, NAKAMURA M C, HSIEH C L. Brain trauma elicits non-canonical macrophage activation states[J]. J Neuroinflammation, 2016, 13(1): 117. DOI:10.1186/s12974-016-0581-z |
| [63] |
KRASEMANN S, MADORE C, CIALIC R, et al. The TREM2-APOE pathway drives the transcriptional phenotype of dysfunctional microglia in neurodegenerative diseases[J]. Immunity, 2017, 47(3): 566-581.e9. DOI:10.1016/j.immuni.2017.08.008 |
| [64] |
GAO Y, VIDAL-ITRIAGO A, KALSBEEK M J, et al. Lipoprotein lipase maintains microglial innate immunity in obesity[J]. Cell Rep, 2017, 20(13): 3034-3042. DOI:10.1016/j.celrep.2017.09.008 |
| [65] |
LIAN H, YANG L, COLE A, et al. NFκB-activated astroglial release of complement C3 compromises neuronal morphology and function associated with Alzheimer's disease[J]. Neuron, 2015, 85(1): 101-115. DOI:10.1016/j.neuron.2014.11.018 |
| [66] |
LIAN H, LITVINCHUK A, CHIANG A C, et al. Astrocyte-microglia cross talk through complement activation modulates amyloid pathology in mouse models of Alzheimer's disease[J]. J Neurosci, 2016, 36(2): 577-589. DOI:10.1523/JNEUROSCI.2117-15.2016 |
| [67] |
LIDDELOW S A, GUTTENPLAN K A, CLARKE L E, et al. Neurotoxic reactive astrocytes are induced by activated microglia[J]. Nature, 2017, 541(7638): 481-487. DOI:10.1038/nature21029 |
| [68] |
SIMON E, OBST J, GOMEZ-NICOLA D. The evolving dialogue of microglia and neurons in Alzheimer's disease: microglia as necessary transducers of pathology[J]. Neuroscience, 2019, 405: 24-34. DOI:10.1016/j.neuroscience.2018.01.059 |
| [69] |
WALKER D G, DALSING-HERNANDEZ J E, CAMPBELL N A, et al. Decreased expression of CD200 and CD200 receptor in Alzheimer's disease: a potential mechanism leading to chronic inflammation[J]. Exp Neurol, 2009, 215(1): 5-19. DOI:10.1016/j.expneurol.2008.09.003 |
| [70] |
HOLTMAN I R, RAJ D D, MILLER J A, et al. Induction of a common microglia gene expression signature by aging and neurodegenerative conditions: a co-expression meta-analysis[J]. Acta Neuropathol Commun, 2015, 3: 31. DOI:10.1186/s40478-015-0203-5 |
 2025, Vol. 46
2025, Vol. 46


