卵巢癌是一种恶性程度极高的妇科肿瘤,目前一线治疗方案是手术和以铂类药物为主的化疗,约80%的患者初始化疗有反应,但是大多数会复发并最终发展为铂类药物耐药[1]。同源重组缺陷(homologous recombination deficiency,HRD)是指细胞在DNA损伤修复过程中同源重组修复通路出现功能异常。HRD在卵巢癌中具有较高的发生率,尤其是在高级别浆液性卵巢癌中发生率约为50%[2]。HRD阳性的卵巢癌患者对铂类药物和聚腺苷二磷酸核糖聚合酶[poly(ADP-ribose) polymerase,PARP]抑制剂更为敏感,预后较好,而HRD阴性卵巢癌患者则需要考虑其他治疗策略[3]。因此,卵巢癌患者的HRD状态对于治疗方案选择具有重要意义。
调动自身免疫系统对抗肿瘤是预防肿瘤复发、转移的最佳方法。因此,近年来免疫治疗在晚期肿瘤诊治中的价值开始崭露头角,但是其在卵巢癌中的治疗效果欠佳,仅10%~15%的患者能从免疫药物治疗中获得明显客观缓解[4]。研究表明,HRD阳性的卵巢癌组织有更丰富的淋巴细胞浸润,免疫反应更活跃,更容易被免疫系统识别攻击[5-6]。CD4和CD8是T细胞表面标志物,其中CD4+ T细胞的功能是辅助其他免疫细胞发挥作用、参与免疫调节和炎症反应,而CD8+ T细胞则主要发挥细胞毒性作用,能够直接杀死癌细胞。肿瘤微环境中的CD4+ T细胞和CD8+ T细胞可能存在功能缺陷,从而促进了肿瘤免疫逃逸。CD25与调节性T细胞(regulatory T cell,Treg细胞)活性相关,而Treg细胞在肿瘤免疫逃逸中扮演重要角色。另外免疫细胞还可以通过分泌细胞因子,如IL-2、IL-6、IL-10、干扰素γ等影响肿瘤的发生、发展[7]。这些免疫细胞及细胞因子的变化可能与肿瘤的免疫逃逸、对免疫治疗的反应及疾病预后密切相关。
本研究通过分析不同HRD状态的晚期卵巢癌患者肿瘤组织及血液中免疫细胞和细胞因子的表达差异,探讨HRD状态对肿瘤微环境及患者预后的影响,旨在为卵巢癌的治疗提供新的思路和方法。
1 资料和方法 1.1 一般资料选取上海交通大学医学院附属瑞金医院妇产科2018年1月至2023年1月收治的68例国际妇产科联盟(International Federation of Gynecology and Obstetrics,FIGO)分期为Ⅲ~Ⅳ期的上皮来源卵巢癌患者作为研究对象,依据基因检测结果分为HRD阳性组(n=30)和HRD阴性组(n=38)。所有患者均对本研究知情并签署了知情同意书。本研究经上海交通大学医学院附属瑞金医院伦理委员会审核批准。纳入标准:(1)符合卵巢癌诊断标准,病理组织学类型为高级别浆液性癌,且根据FIGO 2014年标准分期为Ⅲ~Ⅳ期;(2)卡氏功能状态评分>80分;(3)接受初始肿瘤细胞减灭术(primary debulking surgery,PDS)或新辅助化疗联合间歇性肿瘤细胞减灭术(interval debulking surgery,IDS)治疗,且治疗后均接受一线铂类药物化疗[化疗方案为紫杉醇175 mg/m2、卡铂AUC=5 mg·mL-1·min-1,每3周1个疗程,化疗6个疗程],并且经上述治疗结束后疗效评价为完全缓解(complete response,CR)或部分缓解(partial response,PR);(4)未接受任何PARP抑制剂和抗血管生成药物治疗(2020年前PARP抑制剂及2023年前抗血管生成药物未进入本院医保系统,故入组卵巢癌患者未接受PARP抑制剂和抗血管生成药物治疗);(5)肝肾功能、血常规指标基本正常;(6)自愿接受基因检测。排除标准:(1)存在肝、肺等多处转移;(2)化疗前评估不能耐受化疗;(3)合并其他恶性肿瘤;(4)预计生存期<3个月(由医生依据年龄、性别、临床分期、肿瘤部位、生活环境等因素和经验判断);(5)合并免疫功能障碍类疾病;(6)存在其他重大器官疾病。
1.2 病情评价方法详细询问并记录所有研究对象的家族史(一级或二级亲属中有无卵巢癌或乳腺癌病史)、临床信息、病理报告、手术记录。从临床确诊之日起,追踪患者的疾病进展情况,通过血清糖类抗原125水平、影像学资料、临床症状及电话随访,评价疾病进展状况。患者治疗后出现新病灶或肿瘤体积增大,判定为病情进展(disease progression,PD);治疗后肿瘤体积减小<50%,判定为病情稳定(stable disease,SD);治疗后肿瘤体积减小>50%且时间超过1个月,判定为PR;治疗后肿瘤完全消失且未出现新病灶,判定为CR。客观缓解率(objective response rate,ORR)(%)=(CR例数+PR例数)/总例数×100%,疾病控制率(disease control rate,DCR)(%)=(SD例数+PR例数+CR例数)/总例数×100%。
1.3 HRD基因检测入组卵巢癌患者均自愿接受HRD基因检测,并签署书面知情同意书。PDS或IDS手术时取卵巢癌组织样本,术后第1天抽取血液样本,送至我院病理科进行二代测序,并根据检测结果将患者分为HRD阳性组和HRD阴性组。
1.4 观察指标(1)免疫组织化学染色检测:对两组患者的卵巢癌组织样本进行CD4、CD8、CD25免疫组织化学染色,CD4抗体(货号MA5-14524)、CD8抗体(货号MA5-14548)、CD25抗体(货号MA5-14553)均购自美国ThermoFisher公司。PDS或IDS手术时取组织学样本,使用4%甲醛溶液固定12~24 h,之后经过石蜡包埋制成蜡块,再使用切片机切成薄片(厚4~5 μm)。将组织切片放入装有抗原修复液的容器中,在微波炉或高压锅中加热进行抗原修复,然后依次进行一抗和二抗孵育。染色完成后在光学显微镜下观察。采用积分光密度(integrated optical density,IOD)衡量目标蛋白的表达水平,IOD分析使用ImageJ软件完成。(2)血液免疫细胞检测:抽取患者空腹外周静脉血5 mL,通过流式细胞术检测血液样本中CD4+ T细胞、CD8+ T细胞、CD4+CD25+ Treg细胞比例,并计算CD4+/CD8+比值。CD4-FITC(货号CYT-4F2)、CD8-藻红蛋白(phycoerythrin,PE)(货号CYT-8PE4)购自深圳市科润达生物工程有限公司,CD4+CD25+叉头框蛋白P3(forkhead box protein P3,FoxP3)+ Treg细胞试剂盒(货号ED7417)购自武汉艾美捷科技有限公司。(3)血清细胞因子检测:抽取患者空腹外周静脉血5 mL,用ELISA试剂盒检测血清中干扰素γ、IL-2、IL-6、IL-10的表达水平。干扰素γ、IL-2、IL-6、IL-10检测试剂盒(货号分别为432105、431805、430501、430601)均购自美国BioLegend公司。
1.5 统计学处理采用SPSS 27.0软件对所得数据进行统计分析。计数资料以例数和百分数表示,组间比较采用χ2检验;符合正态分布的计量资料用 x±s表示,组间比较采用独立样本t检验。检验水准(α)为0.05。
2 结果 2.1 两组患者一般资料和临床疗效比较HRD阳性组和HRD阴性组卵巢癌患者年龄、病程、家族史、初始治疗方式、肿瘤分期、肿瘤分化程度等方面差异均无统计学意义(均P>0.05,表 1)。HRD阳性组患者的ORR与DCR高于HRD阴性组,差异均有统计学意义(均P<0.05,表 2)。
|
|
表 1 HRD阳性和HRD阴性卵巢癌患者一般资料比较 Tab 1 Comparison of general information between HRD-positive and HRD-negative ovarian cancer patients |
|
|
表 2 HRD阳性和HRD阴性卵巢癌患者临床疗效比较 Tab 2 Comparison of clinical efficacy between HRD-positive and HRD-negative ovarian cancer patients |
2.2 两组患者卵巢癌组织中免疫细胞标志物表达比较
免疫组织化学染色结果(图 1)显示,与HRD阴性组相比,HRD阳性组患者卵巢癌组织中CD4、CD8、CD25的表达量均增加,差异均有统计学意义(均P<0.05),提示HRD阳性晚期卵巢癌患者肿瘤组织中有更多的淋巴细胞浸润,可能会对免疫治疗的反应更好。
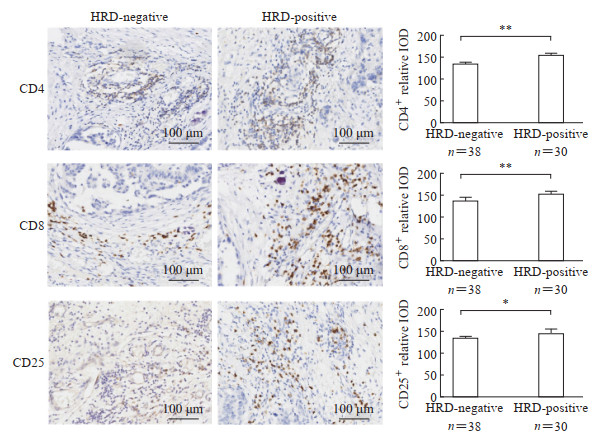
|
图 1 HRD阳性和HRD阴性卵巢癌患者癌组织中CD4、CD8、CD25的免疫组织化学染色结果 Fig 1 Immunohistochemical staining results for CD4, CD8, and CD25 in cancer tissues of HRD-positive and HRD-negative ovarian cancer patients *P<0.05, **P<0.01. x±s. HRD: Homologous recombination deficiency; IOD: Integrated optical density. |
2.3 两组患者血液中免疫细胞表达比较
流式细胞术检测结果(图 2)显示,与HRD阴性组相比,HRD阳性组卵巢癌患者血液样本中CD4+ T细胞、CD8+ T细胞、CD4+CD25+ Treg细胞的比例均增加,CD4+/CD8+比值升高,差异均有统计学意义(均P<0.05)。结果表明HRD阳性晚期卵巢癌患者循环系统中也有较多的淋巴细胞,这类患者可能对免疫治疗更敏感,预后较好。
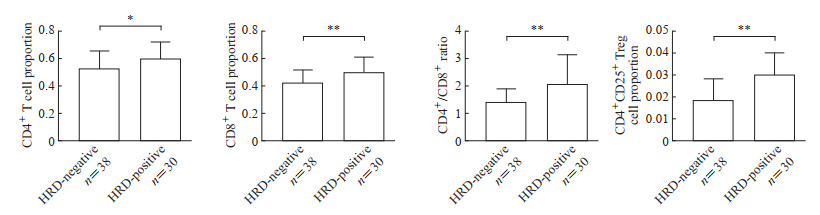
|
图 2 流式细胞术检测HRD阳性和HRD阴性卵巢癌患者血液中免疫细胞水平 Fig 2 Flow cytometry analysis of immune cell levels in blood of HRD-positive and HRD-negative ovarian cancer patients *P<0.05, **P<0.01. x±s. HRD: Homologous recombination deficiency; Treg cell: Regulatory T cell. |
2.4 两组患者血清中细胞因子水平比较
ELISA检测结果(图 3)显示,与HRD阴性组相比,HRD阳性组卵巢癌患者血清中IL-2、IL-6、IL-10水平均升高(均P<0.05),而干扰素γ水平差异无统计学意义(P>0.05)。结果表明HRD阳性晚期卵巢癌患者体内有更丰富的细胞因子分泌,从而有可能更好地调节肿瘤微环境中的免疫平衡,增强抗肿瘤免疫反应。
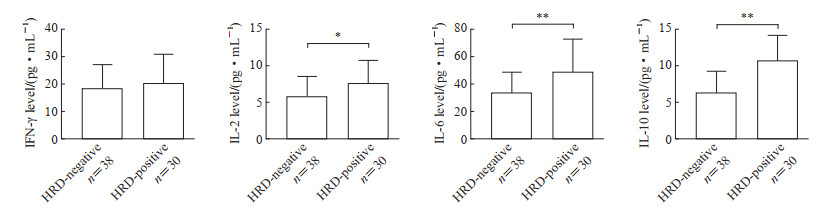
|
图 3 ELISA检测HRD阳性和HRD阴性卵巢癌患者血清中细胞因子水平 Fig 3 Cytokine levels in serum of HRD-positive and HRD-negative ovarian cancer patients detected by ELISA *P<0.05, **P<0.01. x±s. ELISA: Enzyme-linked immunosorbent assay; HRD: Homologous recombination deficiency; IL: Interleukin; IFN-γ: Interferon-γ. |
3 讨论
HRD阳性卵巢癌患者使用PARP抑制剂治疗可以取得较好的治疗效果[8-9]。对卵巢癌患者尤其是有肿瘤家族史的患者进行HRD基因检测极其重要,有助于发现潜在的基因缺陷从而进行早期干预,也有助于制定更精准的治疗方案。一项对日本701例晚期卵巢癌患者的研究发现,晚期卵巢癌患者HRD阳性率为45.2%,且与HRD阴性患者比较,HRD阳性患者的无进展生存期和总生存期更好[2]。另一项研究也指出,高级别卵巢癌中HRD阳性患者的无进展生存期和总生存期均优于HRD阴性患者,且在接受铂类药物为主的化疗后,其ORR和无进展生存率较HRD阴性患者更高[10]。在一些临床试验中,HRD阳性卵巢癌患者的ORR可达到70%~80%,而HRD阴性患者仅为30%~40%[11]。本研究也发现,HRD阳性卵巢癌患者ORR为60.00%(18/30)、DCR为83.33%(25/30),而HRD阴性患者ORR为26.32%(10/38)、DCR为60.53%(23/38),提示HRD阳性卵巢癌患者的预后较好,这与上述研究结果[2, 8-11]相似。
HRD阳性卵巢癌具有更活跃的免疫反应,尤其是肿瘤浸润淋巴细胞的富集,这对提升肿瘤免疫反应具有积极作用。研究表明,卵巢癌肿瘤组织中CD4+ T细胞水平显著高于卵巢良性肿瘤组织和健康对照组织[12]。本研究发现,在卵巢癌组织中,与HRD阴性组相比,HRD阳性组患者CD4的表达量增加。另有研究表明,卵巢癌患者组织中CD8+ T细胞中细胞毒性T淋巴细胞相关抗原4(cytotoxic T-lymphocyte associated protein 4,GTLA-4)、FoxP3表达水平均高于卵巢良性肿瘤患者及健康体检者,提示在卵巢癌患者中FoxP3表达升高可能导致Treg细胞的抑制功能增强,从而抑制CD8+ T细胞的活性[13]。本研究观察到在卵巢癌组织中,与HRD阴性组相比,HRD阳性组患者中CD8的表达量增加。CD25通常与CD4一起表达在Treg细胞中,CD4+CD25+ Treg细胞在卵巢癌的肿瘤免疫中起着重要作用。目前关于HRD阳性卵巢癌中CD25+ Treg细胞的研究相对较少。一项前瞻性、多中心Ⅱ期临床试验纳入HRD阳性的晚期高级别浆液性卵巢癌患者,HRD阳性卵巢癌肿瘤微环境中CD25+ Treg细胞的显著富集与其免疫抑制状态直接相关,靶向CD25可以清除效应性Treg细胞,从而显著增强尼拉帕利的抑瘤效果[14]。本研究也发现,与HRD阴性组相比,HRD阳性组卵巢癌患者肿瘤组织中CD25的表达量增加。众多研究并没有区分卵巢癌患者的HRD状态,本研究通过基因检测将卵巢癌患者分为HRD阳性和HRD阴性2组,并证实HRD阳性晚期卵巢癌肿瘤微环境中有更丰富的淋巴细胞,这提示HRD阳性患者可能对药物更敏感,预后也较好。
研究表明,HRD阳性卵巢癌患者外周血中的CD4+ T细胞减少还是增多取决于疾病的进展阶段和患者的个体差异,外周血中CD4+ T细胞的减少或功能的抑制可能提示预后不良[15]。HRD阳性卵巢癌中关于外周血CD4+ T细胞数量的具体变化目前研究相对较少。本研究发现,与HRD阴性组相比,HRD阳性组卵巢癌患者血液中CD4+ T细胞比例增加。外周血中CD8+ T细胞的数量和功能变化可能与HRD阳性卵巢癌患者的预后相关。研究发现,晚期卵巢癌的免疫抑制微环境通过多种机制削弱CD8+ T细胞的抗肿瘤功能,其中部分CD8+ T细胞在TGF-β和IL-2信号诱导下获得FoxP3表达,转化为具有免疫抑制功能的T细胞亚群,这类细胞通过分泌某些细胞因子杀伤效应T细胞,与患者预后不良有关[16];卵巢癌组织中FoxP3+ Treg细胞的阳性率与淋巴结转移、TNM分期显著相关[17]。在129例上皮性卵巢癌患者中,FoxP3+ Treg细胞与TNM分期(Ⅲ/Ⅳ期)和淋巴结转移密切相关,尽管该研究未直接针对外周血CD8+ T细胞,但提示肿瘤进展阶段伴随更强的免疫抑制特征,可能间接影响外周血免疫细胞表型[18]。本研究发现,与HRD阴性组相比,HRD阳性组卵巢癌患者血液中CD8+ T细胞比例增加。CD4+/CD8+比值是衡量机体免疫功能状态的指标,正常人群中该比值相对稳定,但在卵巢癌患者中CD4+/CD8+比值呈下降趋势,这导致免疫系统无法有效地发挥抗肿瘤作用,因此,这类患者的预后可能较差;相反CD4+/CD8+比值增加的患者有更活跃的免疫功能,预后可能更好。有研究发现,HRD阳性卵巢癌患者中,CD4+/CD8+比值较高者在接受免疫检查点抑制剂治疗后,其无进展生存期和总生存期明显延长[19]。本研究发现,与HRD阴性组相比,HRD阳性组卵巢癌患者血液中CD4+/CD8+比值增加。CD4+CD25+ Treg细胞可以通过多种途径抑制效应细胞的抗肿瘤免疫。HRD阳性卵巢癌患者的肿瘤微环境中CD4+CD25+ Treg细胞的比例往往较高,这可能与肿瘤的进展和不良预后相关。研究也表明,卵巢癌患者外周血CD4+CD25+ Treg细胞比例显著增加,且其与肿瘤的分期、组织学类型、分化程度、淋巴结转移有关[20]。本研究发现,与HRD阴性组相比,HRD阳性组卵巢癌患者血液中CD4+CD25+ Treg细胞比例增加。总之,本研究通过分析不同HRD状态的晚期卵巢癌患者血液中免疫细胞的差异,结果提示HRD阳性晚期卵巢癌患者循环系统中有较多的淋巴细胞,这类患者可能对免疫治疗更敏感,预后也较好。
在卵巢癌中,激活的CD4+ T细胞、CD8+ T细胞、CD4+CD25+ Treg细胞可以分泌多种细胞因子,如干扰素γ、IL-6、IL-10、IL-2等,这些细胞因子参与调节免疫细胞的功能[7]。IL-2可以促进淋巴细胞的增殖与活化,提高机体对肿瘤细胞的免疫杀伤能力,其在卵巢癌中的表达情况较为复杂。有研究发现,不同分期卵巢癌中IL-2的表达均增多,也有研究认为IL-2在卵巢癌中表达降低,这可能是因为卵巢癌中IL-2表达的变化可能涉及多种机制,包括肿瘤微环境的改变、表观遗传调控及肿瘤细胞与免疫细胞的相互作用等[21-22]。目前关于HRD阳性卵巢癌中IL-2表达的研究较少。本研究发现,与HRD阴性组相比,HRD阳性组卵巢癌患者血清中IL-2水平增高。卵巢癌患者IL-6及其受体表达也增加,且IL-6升高与临床预后不良密切相关[23]。本研究发现,与HRD阴性组相比,HRD阳性组卵巢癌患者血清中IL-6水平升高。IL-10在卵巢癌中的免疫调节具有多样性,既具有免疫抑制作用,促进肿瘤的生长和免疫逃逸,也具有免疫活化作用,参与肿瘤免疫监视。一项研究分析了117例晚期卵巢癌患者和30例卵巢良性疾病患者(对照组)血清中IL-10的浓度,结果显示卵巢癌患者IL-10水平中位数为9.87 pg/mL,对照组为7.80 pg/mL[24],说明卵巢癌患者血清中IL-10高表达。本研究发现,与HRD阴性组相比,HRD阳性组卵巢癌患者血清中IL-10水平升高。卵巢癌中干扰素γ的表达与肿瘤的进展和预后相关。研究发现,早期卵巢癌组织切片和血清中干扰素γ可能有一定程度的表达,但随着肿瘤分期的增加其表达水平可能会受到抑制。本研究发现,与HRD阴性组相比,HRD阳性组卵巢癌患者血清中干扰素γ水平差异无统计学意义。卵巢癌患者血液中干扰素γ的水平可能受到多种因素的影响,包括肿瘤负荷、机体免疫状态等[25]。本研究对不同HRD状态的晚期卵巢癌患者血清中细胞因子表达差异的分析结果提示,HRD阳性晚期卵巢癌患者中的免疫细胞不仅可以发挥抗肿瘤免疫作用,而且还可以通过分泌细胞因子(如干扰素γ、IL-2、IL-6、IL-10)调节肿瘤微环境中的免疫平衡,增强抗肿瘤免疫反应,这也可能是HRD阳性卵巢癌患者对药物反应更敏感的原因之一。
本研究在分析不同HRD状态的晚期卵巢癌患者免疫微环境时未对接受PDS与IDS治疗的患者进行分层比较。这一局限性主要源于样本量的限制:HRD阳性组PDS 23例、IDS 7例,HRD阴性组PDS 32例、IDS 6例,进一步细分各组病例数不足以满足统计学要求。新辅助化疗可能通过改变肿瘤微环境间接影响免疫细胞,一方面化疗可通过减少肿瘤负荷和免疫抑制性细胞来改善免疫微环境,另一方面化疗也可能诱导T细胞耗竭或自然杀伤细胞数量波动。临床实践中需结合免疫监测CD8+ T细胞的功能、免疫抑制性细胞的比例等来优化治疗时机和方案。因此,接受IDS的患者免疫细胞的表达可能同时受化疗干预和HRD状态的双重影响。未来需要开展更大样本量的前瞻性研究或通过多中心合作积累数据,以进一步验证HRD状态与化疗干预在调节肿瘤微环境中的交互作用。
综上所述,本研究通过分析不同HRD状态的晚期卵巢癌中免疫细胞和细胞因子的表达差异,发现HRD阳性卵巢癌患者肿瘤组织中有更多的免疫细胞浸润,并且能分泌更多有免疫调节作用的细胞因子,提示HRD阳性卵巢癌患者可能有更活跃的肿瘤免疫微环境,也许会对免疫治疗产生较好的反应。因此,免疫微环境相对活跃的HRD阳性卵巢癌患者可能成为免疫治疗的获益者。卵巢癌具有高度异质性,不同患者的肿瘤细胞可能具有不同的抗原表达谱,这给细胞免疫治疗带来了挑战。肿瘤微环境中的免疫抑制因素可能会影响细胞免疫治疗的疗效,如何克服这些免疫抑制因素,增强免疫细胞的抗肿瘤活性将会是未来研究的重点和热点。
| [1] |
BUECHEL M, HERZOG T J, WESTIN S N, et al. Treatment of patients with recurrent epithelial ovarian cancer for whom platinum is still an option[J]. Ann Oncol, 2019, 30(5): 721-732. DOI:10.1093/annonc/mdz104 |
| [2] |
YOSHIHARA K, BABA T, TOKUNAGA H, et al. Homologous recombination inquiry through ovarian malignancy investigations: JGOG3025 Study[J]. Cancer Sci, 2023, 114(6): 2515-2523. DOI:10.1111/cas.15747 |
| [3] |
KEKEEVA T, ANDREEVA Y, TANAS A, et al. HRD testing of ovarian cancer in routine practice: what are we dealing with?[J]. Int J Mol Sci, 2023, 24(13): 10497. DOI:10.3390/ijms241310497 |
| [4] |
GHISONI E, IMBIMBO M, ZIMMERMANN S, et al. Ovarian cancer immunotherapy: turning up the heat[J]. Int J Mol Sci, 2019, 20(12): E2927. DOI:10.3390/ijms20122927 |
| [5] |
LEE J J, KANG H J, KIM S S, et al. Unraveling the transcriptomic signatures of homologous recombination deficiency in ovarian cancers[J]. Adv Biol (Weinh), 2022, 6(12): e2200060. DOI:10.1002/adbi.202200060 |
| [6] |
CRESPO J, SUN H, WELLING T H, et al. T cell anergy, exhaustion, senescence, and stemness in the tumor microenvironment[J]. Curr Opin Immunol, 2013, 25(2): 214-221. DOI:10.1016/j.coi.2012.12.003 |
| [7] |
BONADIO R C, DEL PILAR ESTEVEZ-DIZ M. Perspectives on PARP inhibitor combinations for ovarian cancer[J]. Front Oncol, 2021, 11: 754524. DOI:10.3389/fonc.2021.754524 |
| [8] |
SHAHZAD M, NACI H, ESSELEN K M, et al. Regulatory histories of recently withdrawn ovarian cancer treatment indications of 3 PARP inhibitors in the US and Europe: lessons for the accelerated approval pathway[J]. J Pharm Policy Pract, 2024, 17(1): 2351003. DOI:10.1080/20523211.2024.2351003 |
| [9] |
GUO Y, HE X, TAN Y, et al. ShallowHRD status acts as an effective prognostic predictor in ovarian cancer patients treated by poly (ADP-ribose) polymerase inhibitors (PARPis)[J]. J Cancer Res Clin Oncol, 2023, 149(17): 15839-15844. DOI:10.1007/s00432-023-05341-6 |
| [10] |
FENG Z, SHAO D, CAI Y, et al. Homologous recombination deficiency status predicts response to platinum-based chemotherapy in Chinese patients with high-grade serous ovarian carcinoma[J]. J Ovarian Res, 2023, 16(1): 53. DOI:10.1186/s13048-023-01129-x |
| [11] |
WETHINGTON S L, SHAH P D, MARTIN L, et al. Combination ATR (ceralasertib) and PARP (olaparib) inhibitor (CAPRI) trial in acquired PARP inhibitor-resistant homologous recombination-deficient ovarian cancer[J]. Clin Cancer Res, 2023, 29(15): 2800-2807. DOI:10.1158/1078-0432.CCR-22-2444 |
| [12] |
GONG W, KUANG M, CHEN H, et al. Single-sample gene set enrichment analysis reveals the clinical implications of immune-related genes in ovarian cancer[J]. Front Mol Biosci, 2024, 11: 1426274. DOI:10.3389/fmolb.2024.1426274 |
| [13] |
MCCAW T R, GOEL N, BROOKE D J, et al. Class Ⅰ histone deacetylase inhibition promotes CD8 T cell activation in ovarian cancer[J]. Cancer Med, 2021, 10(2): 709-717. DOI:10.1002/cam4.3337 |
| [14] |
LUO Y, XIA Y, LIU D, et al. Neoadjuvant PARPi or chemotherapy in ovarian cancer informs targeting effector Treg cells for homologous-recombination-deficient tumors[J]. Cell, 2024, 187(18): 4905-4925.e24. DOI:10.1016/j.cell.2024.06.013 |
| [15] |
王丽华, 王亮亮, 张競, 等. 卵巢癌患者外周血Th1/Th2及Treg/Th17细胞平衡关系[J]. 南方医科大学学报, 2017, 37(8): 1066-1070. DOI:10.3969/j.issn.1673-4254.2017.08.11 |
| [16] |
PRESTON C C, MAURER M J, OBERG A L, et al. The ratios of CD8+ T cells to CD4+CD25+ FOXP3+ and FOXP3- T cells correlate with poor clinical outcome in human serous ovarian cancer[J]. PLoS One, 2013, 8(11): e80063. DOI:10.1371/journal.pone.0080063 |
| [17] |
SHANG B, LIU Y, JIANG S J, et al. Prognostic value of tumor-infiltrating FoxP3+ regulatory T cells in cancers: a systematic review and meta-analysis[J]. Sci Rep, 2015, 5: 15179. DOI:10.1038/srep15179 |
| [18] |
刘小丽, 杨志明, 王黎黎, 等. Foxp3+调节性T细胞及程序性死亡受体1在上皮性卵巢癌组织中的表达及临床病理意义[J]. 中国医师进修杂志, 2018, 41(6): 532-536. DOI:10.3760/cma.j.issn.1673-4904.2018.06.013 |
| [19] |
DI J, MASSUGER L F A G, DUIVEMAN-DE BOER T, et al. Functional OCT4-specific CD4+ and CD8+ T cells in healthy controls and ovarian cancer patients[J]. Oncoimmunology, 2013, 2(5): e24271. DOI:10.4161/onci.24271 |
| [20] |
THEDREZ A, LAVOUÉ V, DESSARTHE B, et al. A quantitative deficiency in peripheral blood Vγ9Vδ2 cells is a negative prognostic biomarker in ovarian cancer patients[J]. PLoS One, 2013, 8(5): e63322. DOI:10.1371/journal.pone.0063322 |
| [21] |
TAKAYA H, NAKAI H, TAKAMATSU S, et al. Homologous recombination deficiency status-based classification of high-grade serous ovarian carcinoma[J]. Sci Rep, 2020, 10: 2757. DOI:10.1038/s41598-020-59671-3 |
| [22] |
SINGER C F, HUDELIST G, WALTER I, et al. Tissue array-based expression of transglutaminase-2 in human breast and ovarian cancer[J]. Clin Exp Metastasis, 2006, 23(1): 33-39. DOI:10.1007/s10585-006-9015-0 |
| [23] |
SZULC-KIELBIK I, KIELBIK M, NOWAK M, et al. The implication of IL-6 in the invasiveness and chemoresistance of ovarian cancer cells. Systematic review of its potential role as a biomarker in ovarian cancer patients[J]. Biochim Biophys Acta Rev Cancer, 2021, 1876(2): 188639. DOI:10.1016/j.bbcan.2021.188639 |
| [24] |
MUSTEA A, KÖNSGEN D, BRAICU E I, et al. Expression of IL-10 in patients with ovarian carcinoma[J]. Anticancer Res, 2006, 26(2C): 1715-1718. |
| [25] |
ZHU X L, WANG H J, WANG X R, et al. IL-6 secretion of CD4+ T cells stimulated by LC3-positive extracellular vesicles in human epithelial ovarian cancer[J]. Clin Transl Oncol, 2022, 24(11): 2222-2230. DOI:10.1007/s12094-022-02883-y |
 2025, Vol. 46
2025, Vol. 46


