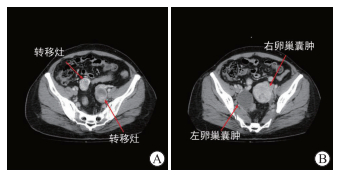
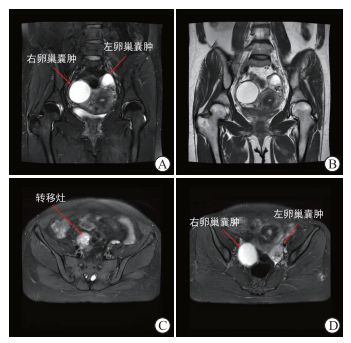
患者女,44岁,因“体检发现盆腔肿物1个月”于2023年8月1日入上海交通大学医学院附属瑞金医院妇科住院治疗。患者已婚育,月经规律,我院门诊妇科超声检查提示左侧卵巢囊实性占位,大小约34 mm×26 mm×26 mm,内见大小约21 mm×14 mm×18 mm的附壁高回声区,伴少许血流信号;右侧附件区实性占位,大小约45 mm×39 mm×38 mm,以等回声为主,内见丰富血流信号,肠道来源待排;右侧卵巢囊性占位,大小约54 mm×40 mm×49 mm。体格检查示双侧附件区均扪及活动性包块。患者2014年于外院行卵巢囊肿剥除术(术后病理提示卵巢甲状腺肿,伴局灶滤泡上皮非典型增生),否认家族遗传病史。入院查血生物化学指标示肿瘤标志物糖类抗原(carbohydrate antigen,CA)19-9、CA125、癌胚抗原、鳞状细胞癌抗原、人附睾蛋白4均未见异常,甲胎蛋白为8.01 ng/mL(正常参考值为≤7 ng/mL);甲状腺功能指标三碘甲腺原氨酸(triiodothyronine,T3)、甲状腺素(thyroxine,T4)均未见异常,促甲状腺激素(thyroid-stimulatinghormone,TSH)为0.146 6 μIU/mL(正常参考值为0.35~4.94 μIU/mL),甲状腺过氧化物酶抗体(thyroidperoxidase antibody,TPOAb)未见异常,促甲状腺激素受体抗体为9.98 IU/L(正常参考值为<1.75 IU/L)。胃肠镜检查未见异常。腹盆部增强CT检查示右侧附件区上方富血供占位,盆腔内数枚实性结节(部分为增大的淋巴结),双侧附件区囊性为主占位(图 1)。盆部增强MRI检查示右侧附件区上方实性占位,肠道或附件来源?双侧附件区囊性为主占位(图 2)。PET-MRI检查示:(1)双侧附件囊实性占位伴出血(右侧以囊性为主),实性成分强化,代谢不高;盆腔多发异常信号灶,较大者不均匀强化伴代谢略增高。倾向良性病变可能,建议结合病理学检查除外其他性质病变,考虑子宫多发肌瘤。(2)甲状腺左叶及峡部异常信号灶伴强化,代谢不高,建议结合甲状腺超声检查明确诊断。
|
图 1 腹盆部增强计算机断层扫描图像 A:盆腔内数枚实性病灶;B:双侧附件区囊性为主占位. |
|
图 2 盆部增强磁共振成像结果 A:T2加权脂肪抑制序列冠状面图像;B:T2加权冠状面图像;C、D:T2加权脂肪抑制序列轴位图像. |
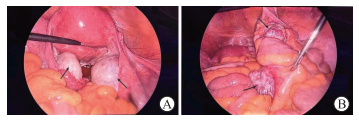
2023年8月4日行腹腔镜探查术,术中未见明显腹水,右侧子宫角表面见1枚直径约1 cm的肿物,双侧卵巢呈囊性增大,左侧大小约5 cm×6 cm×6 cm,右侧大小约7 cm×8 cm×6 cm,输卵管外观正常,膀胱腹膜反折表面见1枚直径约0.8 cm的肿物,右侧回盲部见2枚较大实性肿物,直径分别约4 cm、5 cm;进一步全面探查见肠系膜及大网膜表面见数十枚肿物,直肠子宫陷凹见结节,膈肌、胃、肝脏、脾脏均未见肿瘤累及(图 3)。因肠系膜病灶广泛,请普外科医师会诊,建议中转开腹手术。切除肠系膜结节送冰冻病理,提示为甲状腺来源的转移癌。切除左侧附件送冰冻病理,结果提示甲状腺来源的肿瘤,部分细胞伴有非典型改变。剥除右侧卵巢囊肿,送冰冻病理,考虑甲状腺来源的病变,局部细胞非典型增生。综合术中冰冻病理、病史考虑卵巢肿瘤合并腹腔转移可能性大。与家属谈话后行经腹卵巢癌肿瘤细胞减灭术(全子宫切除+双侧卵巢输卵管切除+大网膜、阑尾切除+肠系膜多发肿物切除术),术中达到肿瘤R0切除。普外科医师建议同时行甲状腺切除术,但患者家属要求待妇科手术恢复后再考虑。
|
图 3 术中卵巢肿物及肠系膜肿物图像 A:双侧卵巢肿物;B:肠系膜肿物.箭头所示为肿瘤. |
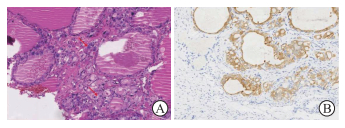
术后病理报告:左侧卵巢占位考虑为起源于卵巢甲状腺肿的癌(滤泡亚型乳头状癌,图 4A),免疫组织化学染色示CD56(弱+)、细胞角蛋白19(+)、甲状腺过氧化物酶(thyroid peroxidase,TPO)(+,图 4B)、人骨髓内皮细胞标志物1(灶+)、Ki67(5%+)。右侧卵巢囊肿考虑卵巢单胚层畸胎瘤(卵巢甲状腺肿)。肠系膜肿物、大网膜结节、子宫表面肿物、盆底腹膜结节均为肿瘤累及,阑尾浆膜层亦见肿瘤累及。术后分子检测示神经母细胞瘤Ras癌基因(neuroblastoma Ras gene,NRAS)c.181C>A(p.Q61K)错义突变。
|
图 4 左侧卵巢占位术后病理结果(400×) A:苏木精-伊红染色提示起源于卵巢甲状腺肿的癌(滤泡亚型乳头状癌,箭头所示为肿瘤细胞);B:免疫组织化学染色提示甲状腺过氧化物酶阳性. |
术后与普外科、内分泌科、病理科、影像科等进行多学科诊疗(multi-disciplinary treatment,MDT)讨论,建议患者完善甲状腺超声检查,结果提示甲状腺左叶中部背侧低回声灶,根据中国甲状腺影像报告和数据系统(Chinese thyroid imaging reporting and data system,C-TIRADS)判定为4A类,炎症病灶待排;余甲状腺结节,拟C-TIRADS 3类。普外科医师建议进一步行甲状腺穿刺或甲状腺切除术,患者拒绝,故予左甲状腺素钠片(商品名为优甲乐)每天1粒口服。术后1年随访患者无不适,2024年7月甲状腺功能检查示T3为1.54 nmol/L,T4为103.25 nmol/L,TSH<0.008 3 μIU/mL,甲状腺球蛋白抗体为16.1 IU/mL,TPOAb为14.6 IU/mL;腹盆部增强CT检查未见肿瘤复发表现。至截稿,患者继续口服优甲乐(每天1粒)维持治疗。
2 讨论恶性卵巢甲状腺肿(malignant struma ovarii,MSO)是一种来源于卵巢畸胎瘤的罕见甲状腺癌。MSO在临床上主要表现为盆腔肿物,多数患者因超声、CT、MRI等影像学检查发现盆腔肿物而就诊,可能伴随下腹疼痛、可触及肿块或异常出血,偶有腹水、甲状腺功能亢进及神经系统症状[1],极少数患者有肿瘤指标如CA125等升高[2]。MSO合并甲状腺功能亢进者约占5%,少数患者同时合并颈部甲状腺癌,平均发病年龄为42岁;大约94%的MSO是单侧病变,且更常见于左侧卵巢[3]。本例患者44岁,无不适症状,因体检发现盆腔肿物就诊,CA125正常,无甲状腺功能亢进症状,仅存在TSH明显降低,既往有畸胎瘤剥除术病史,因此临床上对于甲状腺功能检查异常的卵巢畸胎瘤患者应考虑到MSO的可能。
卵巢甲状腺肿在CT或MRI检查时通常显示为复杂的囊性外观,由于其罕见,在没有转移的情况下很难通过超声、CT或MRI等影像学检查区分良恶性。本例患者术前CT、MRI、PET-MRI检查虽都提示卵巢肿物,但都无明显典型的恶性肿瘤表现,但都检出盆腔多发实性结节。本例患者由于术前检查均未提示恶性肿瘤,且有既往卵巢良性囊肿剥除史,故术前未考虑到MSO的诊断。由此可见,当影像学检查提示卵巢良性肿瘤同时又伴有盆腔多发结节时,要考虑到罕见恶性肿瘤或低度恶性肿瘤伴盆腹腔转移的可能,不能完全依赖于辅助检查结果。
MSO的组织学外观与正常甲状腺组织相似,病理类型以乳头状癌和滤泡状癌较为常见。在分子遗传学上,MSO与原发性甲状腺癌相似。MSO存在NRAS、鼠类肉瘤病毒癌基因(Kirsten rat sarcoma viral oncogene,KRAS)、鼠类肉瘤滤过性毒菌致癌基因同源体B1和KIT原癌基因受体酪氨酸激酶等基因突变,与甲状腺癌的基因突变相似。与其他恶性肿瘤相比,甲状腺癌患者NRAS突变的概率高于HRas原癌基因鸟苷三磷酸酶和KRAS突变(分别为8%、3%和3%)。99%的RAS突变发生在密码子12、13和61处[4]。本例患者疾病发现时已有肿瘤盆腹腔转移,术后完善基因检测发现的NRAS密码子61处发生突变。据文献报道,甲状腺癌中NRAS密码子61处突变是最常见的点突变,且与滤泡样甲状腺癌的远处转移有关[5]。因此,NRAS密码子61处的突变状态可能是MSO的潜在预后因素,建议MSO患者术后完善相关基因检测,以便预测疾病的发展及预后。
MSO的手术治疗方法包括卵巢囊肿剥除术、患侧附件切除术、双侧附件切除术、全子宫+双侧附件切除术、肿瘤细胞减灭术等[6]。对于希望保留生育功能的年轻女性,患侧附件切除术是首选。对于绝经患者或无保留生育功能意愿的患者,建议行全子宫+双侧附件切除术。因相关文献报道较少,目前暂无统一的后续诊疗规范。许多MSO患者初次手术未行肿瘤分期术,术后需接受辅助治疗,但对于术后辅助治疗目前也没有共识。文献报道,肿瘤>2 cm、伴有卵巢外播散且组织学特征具有侵袭性的患者,应接受放射性碘治疗[7-8]。由于甲状腺细胞优先摄取131I,因此应在放射性碘治疗前行甲状腺全切术,以优化残留肿瘤细胞对131I的摄取。根据甲状腺癌诊治指南,TSH抑制治疗在这些患者中必不可少,并且应维持至少5年[9]。因为甲状腺癌细胞表面有TSH受体表达,TSH会促进肿瘤细胞生长。通过补充外源性甲状腺素(如左甲状腺素钠片)来反馈性抑制脑垂体分泌TSH,可以实现TSH抑制治疗。TSH抑制水平与甲状腺癌的复发、转移密切相关,TSH>2 mU/L时癌症相关死亡和复发率会增加[9]。对于高危患者,术后TSH抑制到<0.1 mU/L时肿瘤复发和转移率显著降低[8]。TSH抑制治疗的不良反应包括超生理剂量的甲状腺激素可能导致亚临床甲状腺功能亢进,长期TSH抑制可能影响患者的生活质量、加重心脏负担和心肌缺血,以及增加绝经后妇女的骨质疏松发生风险。TSH抑制治疗目前没有统一的药物剂量标准,应评估患者肿瘤复发和不良反应危险度,采取个体化治疗。本例患者经医院MDT会诊,普外科医师建议行甲状腺穿刺以排除恶性肿瘤,或行甲状腺切除术,但患者无法接受甲状腺全切除术,在这种情况下MDT团队建议予优甲乐每天1粒维持TSH抑制治疗。患者耐受良好,定期进行甲状腺功能复查,目前无甲状腺功能亢进表现,且疾病无复发迹象。后续内分泌科医师建议患者密切随访甲状腺功能,及时调整药量,避免因药物过量而发生不良反应。因此,MSO的治疗需要妇科、普外科、内分泌科、影像科、病理科等多科室共同参与并制定个体化诊治方案,如果患者拒绝甲状腺切除及放射性碘治疗,左甲状腺素钠片是不错的治疗选择,但需要密切随访甲状腺功能,个体化调整药量,以达到既能降低MSO的复发和转移风险又能避免亚临床甲状腺功能亢进发生的目的。
甲状腺球蛋白水平测定是MSO的重要随访指标[10]。据文献报道,MSO患者5年和10年复发率分别为27.1%和35.2%,5、10和20年的总生存率分别为95.3%、88.7%和88.7%[6]。MSO的总体预后较好,但近年来已有MSO远处复发、转移的报道,因此所有MSO患者在手术和辅助治疗后都应定期随访至少10年[11]。
由于疾病罕见,MSO的诊治面临诸多挑战,术前评估需要结合病史、生物化学指标及影像学检查结果。MDT团队的协作至关重要,需要妇科、普外科、内分泌科、影像科、病理科医师共同参与。目前较公认的治疗方案是手术,合并转移者建议行甲状腺切除术联合放射性碘治疗。根据本例患者的诊治经验,对于拒绝行甲状腺切除术的MSO患者,抑制TSH治疗是一个较好的选择,但患者需要长期随访。虽然目前MSO诊治的经验大多来自个案报道,但也应努力规范MSO患者的管理,以改善患者预后。
| [1] |
谢毅, 赵莉, 吴海波, 等. 畸胎瘤相关抗N-甲基-D-天冬氨酸受体脑炎1例报告[J]. 海军军医大学学报, 2024, 45(6): 784-786. XIE Y, ZHAO L, WU H, et al. Teratoma-related anti-N-methyl-D-aspartate receptor encephalitis: a case report[J]. Acad J Naval Med Univ, 2024, 45(6): 784-786. DOI:10.16781/j.CN31-2187/R.20230187 |
| [2] |
RYU H J, LEEM D E, YOO J H, et al. Clinical manifestations of malignant struma ovarii: a retrospective case series in a tertiary hospital in Korea[J]. Endocrinol Metab (Seoul), 2024, 39(3): 461-467. DOI:10.3803/EnM.2023.1863 |
| [3] |
ZHANG X, AXIOTIS C. Thyroid-type carcinoma of struma ovarii[J]. Arch Pathol Lab Med, 2010, 134(5): 786-791. DOI:10.5858/134.5.786 |
| [4] |
PRIOR I A, LEWIS P D, MATTOS C. A comprehensive survey of Ras mutations in cancer[J]. Cancer Res, 2012, 72(10): 2457-2467. DOI:10.1158/0008-5472.CAN-11-2612 |
| [5] |
JANG E K, SONG D E, SIM S Y, et al. NRAS codon 61 mutation is associated with distant metastasis in patients with follicular thyroid carcinoma[J]. Thyroid, 2014, 24(8): 1275-1281. DOI:10.1089/thy.2014.0053 |
| [6] |
LI S, YANG T, XIANG Y, et al. Clinical characteristics and survival outcomes of malignant struma ovarii confined to the ovary[J]. BMC Cancer, 2021, 21(1): 383. DOI:10.1186/s12885-021-08118-7 |
| [7] |
RAHIMI Y, RABIZADEH S, SEIFOURI S, et al. A case report of malignant struma ovarii with papillary thyroid carcinoma[J]. Clin Case Rep, 2024, 12(4): e8610. DOI:10.1002/ccr3.8610 |
| [8] |
GILD M L, HEATH L, PAIK J Y, et al. Malignant struma ovarii with a robust response to radioactive iodine[J]. Endocrinol Diabetes Metab Case Rep, 2020, 2020: 19-0130. DOI:10.1530/EDM-19-0130 |
| [9] |
李玉姝, 单忠艳, 滕卫平. 《甲状腺结节和分化型甲状腺癌诊治指南(第二版)》解读[J]. 中国实用内科杂志, 2023, 43(11): 884-889. DOI:10.19538/j.nk2023110102 |
| [10] |
KANTREVA K, PASCHOU S A, STEFANAKI K, et al. Two rare cases of benign struma ovarii with malignant recurrence[J]. Endocrinol Diabetes Metab Case Rep, 2024, 2024(2): 23-0122. DOI:10.1530/EDM-23-0122 |
| [11] |
YANG B, ZHONG L, PENG L, et al. Malignant struma ovarii (papillary carcinoma) with hyperthyroidism: a case report and literature review[J]. Case Rep Oncol, 2023, 16(1): 385-390. DOI:10.1159/000530066 |
 2025, Vol. 46
2025, Vol. 46


