糖尿病心脏自主神经病变(diabetic cardiovascular autonomic neuropathy,DCAN)是糖尿病重要的临床并发症之一,有较高的心血管疾病发生率和死亡率;临床症状多表现为静息状态下心动过速、直立性低血压、晕厥、运动不耐受等,可引起无症状心肌缺血和梗死、心源性猝死、脑卒中、肾功能不全等的发生[1]。DCAN多起病隐匿,患者可数十年无明显症状,不易被察觉[2],因此研究其预测因素尤为重要。心血管自主神经反射试验(cardiovascular autonomic reflex test,CART)多用于DCAN的检测与诊断[2],本研究利用卡尔思R6000心血管自主神经检测系统对2型糖尿病(type 2 diabetes mellitus,T2DM)患者进行DCAN筛查,并探讨T2DM继发DCAN的影响因素,为DCAN的诊治提供临床依据。
1 资料和方法 1.1 病例资料分析海军军医大学第一附属医院于2022年11月1日至2023年11月30日病房连续接诊的T2DM患者的临床资料。本研究通过海军军医大学第一附属医院伦理委员会审批,所有患者均知情同意。纳入标准:(1)符合1998年WHO T2DM诊断标准[3];(2)临床资料完整。排除标准:(1)高血压2~3级或严重增殖性视网膜病变患者;(2)恶性肿瘤患者;(3)急性心力衰竭、心肌梗死、脑梗死、脑出血等严重循环、中枢神经系统疾病患者;(4)合并糖尿病酮症酸中毒、高渗高血糖昏迷、糖尿病足等严重糖尿病急慢性并发症患者;(5)合并严重肝功能不全(转氨酶≥正常参考值上限3倍)、肾功能不全(慢性肾脏病4~5期)患者;(6)合并感染性休克或脓毒血症等严重感染性疾病患者;(7)有甲状腺功能亢进症或甲状腺功能减退症病史的患者;(8)近期有新型冠状病毒感染病史者。
1.2 研究方法收集所有患者一般资料和实验室指标,一般资料包括性别、年龄、糖尿病病程、既往病史(高血压、糖尿病大血管病变、糖尿病周围神经病变)、BMI等,实验室指标包括空腹血糖、空腹C肽、估计的肾小球滤过率、糖化血红蛋白、总胆固醇、甘油三酯、高密度脂蛋白胆固醇、低密度脂蛋白胆固醇、尿微量白蛋白/肌酐比值和血尿酸等。
利用卡尔思R6000心血管自主神经检测系统[中国锐盟(深圳)医疗科技有限公司],参考CART标准(包括4项试验)[4-5],判断患者是否有DCAN及其严重程度。
(1)深呼吸心率反应试验:以6个呼吸循环/分钟匀速深呼吸,同时监测心电图心率变化,测量每个呼吸循环中最快心率和最慢心率的差值。正常值≥15次/min,临界值11~14次/min,异常为≤10次/min。每例患者取3个连续呼吸周期心率差值的平均值。
(2)卧立位心率反应试验:持续心电图监测,测量受试者从仰卧位到直立后第30次心搏附近R-R间期与第15次心搏附近R-R间期的比值。正常值≥1.04,临界值1.01~1.03,异常为≤1。重复3次试验取平均值。
(3)Valsalva动作心率反应试验:受试者用力向吹嘴吹气,直至气压计显示40 mmHg(1 mmHg=0.133 kPa)并维持15 s,同时监测心电图变化,计算最长R-R间期与最短R-R间期的比值。正常值≥1.21,临界值为1.11~1.20,异常为≤1.10。重复3次试验取平均值。
(4)卧立位收缩压变化试验:仰卧位测量受试者收缩压,站立2 min后再次测量收缩压,计算收缩压下降值。正常情况下≤10 mmHg,临界值11~29 mmHg,异常为≥30 mmHg。重复3次试验取平均值。
非DCAN组患者为上述4项试验结果均正常或仅有1项为临界值。DCAN组患者存在以下任一病变:(1)早期病变(有1项试验结果异常或2项为临界值;(2)明确病变(≥2项试验结果异常);(3)严重病变(明确病变基础上,卧立位收缩压变化试验异常)。
患者在试验前24 h避免吸烟、饮酒和剧烈运动,试验前至少3 h避免进食,试验前12 h暂停使用β受体阻滞剂、抗组胺药、抗抑郁药等影响试验结果的药物。
1.3 统计学处理采用SPSS 26.0软件进行统计分析。计量资料先经过正态性检验,符合正态分布的计量资料以x±s表示,比较采用独立样本t检验;非正态分布的计量资料以中位数(下四分位数,上四分位数)表示,比较采用非参数Mann-Whitney U检验;计数资料以例数和百分数表示,比较采用χ2检验;采用logistic回归方程分析DCAN的影响因素,并绘制ROC曲线分析相关指标预测DCAN的价值。检验水准(α)为0.05。
2 结果 2.1 患者基本特征和4项CART试验阳性率最终纳入63例患者,男45例、女18例,年龄34~75岁,平均年龄(57.94±10.41)岁。在4项CART试验中,深呼吸心率反应试验阳性患者18例(28.57%),卧立位心率反应试验阳性患者2例(3.17%),Valsalva动作心率反应试验阳性患者14例(22.22%),卧立位血压变化试验阳性患者6例(9.52%)。
2.2 两组基线资料和试验室指标比较63例T2DM患者中非DCAN组患者31例(49.21%),DCAN组患者32例(50.79%)。非DCAN组患者平均年龄为(53.97±10.84)岁,DCAN组患者平均年龄为(61.78±8.50)岁,两组患者的年龄差异有统计学意义(P=0.002);其余指标在两组间差异均无统计学意义(均P>0.05)。见表 1。
|
|
表 1 两组T2DM患者的一般资料和实验室指标比较 |
2.3 DCAN影响因素分析
将是否患有DCAN作为因变量(非DCAN=0,DCAN=1),年龄作为自变量,建立logistic回归模型,结果显示年龄是T2DM继发DCAN的危险因素(OR=1.095,95% CI1.029~1.166,P=0.04)。
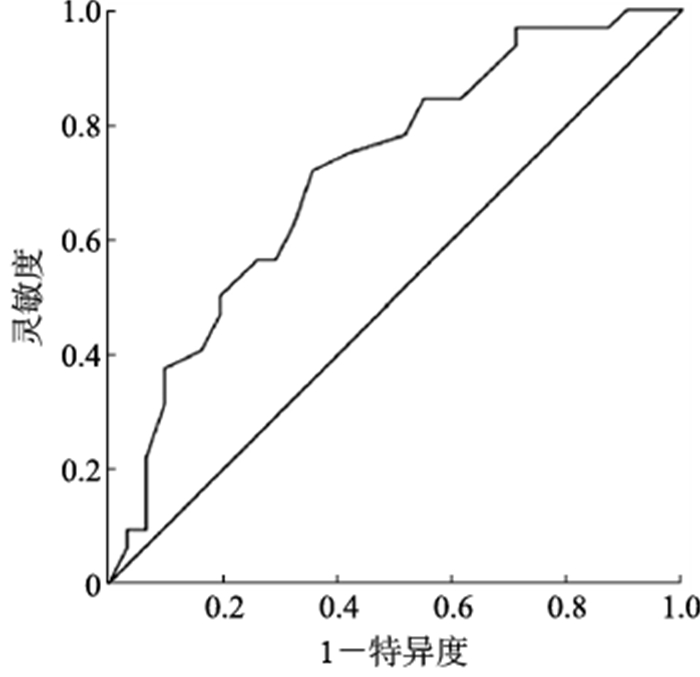
2.4 年龄对DCAN的诊断价值分析以年龄为检验变量,是否患有DCAN为状态变量,绘制ROC曲线,计算约登指数,最大值为最佳截断值。结果显示,年龄预测T2DM继发DCAN的AUC值为0.718(95% CI 0.592~0.845),约登指数为0.364,最佳截断值为58.5岁,灵敏度为0.719,特异度为0.645。见图 1。
|
图 1 年龄预测T2DM患者继发DCAN的ROC曲线分析 T2DM:2型糖尿病;DCAN:糖尿病心脏自主神经病变;ROC:受试者操作特征. |
3 讨论
DCAN是糖尿病常见的并发症之一,是排除其他原因后由糖尿病引起的心血管自主神经系统功能紊乱,可出现心率增快、心输出量减少、血压异常等[2]。多伦多糖尿病神经病变共识委员会建议,T2DM患者在确诊时或1型糖尿病患者在确诊后5年应进行DCAN筛查,尤其是血糖控制不良、吸烟或有高血压、血脂异常的患者,之后应每年复查[6]。CART是DCAN诊断的金标准,由Ewing等[5]在20世纪70年代提出。Ewing等推荐了4项试验:深呼吸心率反应、卧立位心率反应、Valsalva动作心率反应、卧立位收缩压变化试验,前3项试验主要用于评估副交感神经功能,最后1项用于评估交感神经功能[7]。本研究使用上述4项测试方法,通过卡尔思R6000心血管自主神经检测系统进行检测,较传统检测方法更加简单、高效,能够更加真实和客观地检测受试者阳性率。
因为检查方式、诊断标准、检测人群和年龄的不同,DCAN的患病率变化很大,患病率为17%~90%[8]。Pan等[9]等研究发现年龄是T2DM继发DCAN的独立危险因素。本研究结果亦提示,DCAN阳性检测率为50.79%,年龄是T2DM继发DCAN的危险因素,表明随着年龄增长DCAN检出率逐年增加,与既往研究相符。Ge等[10]研究发现年龄可作为心脏自主神经病变的一项危险评分指标:年龄<50岁评分0分,50~60岁评分2分,>60岁评分4分;评分越高心脏自主神经病变可能性越大。本研究结果显示,年龄预测T2DM继发DCAN的AUC值为0.718,最佳截断值为58.5岁,灵敏度和特异度分别为0.719、0.645,这为T2DM继发DCAN的早期筛查提供了一定理论基础。糖尿病患者易合并心脏器质性病变,继发DCAN后患者死亡风险会显著增加。合并DCAN的糖尿病患者存在无症状心肌缺血的比例高于无DCAN的糖尿病者,DCAN可引起头晕、视物模糊、不明原因的肩颈部疼痛等不典型症状[7],但是因为临床对该病认识不足,常常会忽略这些症状,最后造成DCAN加重甚至导致患者死亡。因此,早期对糖尿病患者进行DCAN筛查与诊断至关重要。
DCAN受很多因素影响,刘雨桐等[11]通过meta分析发现DCAN与年龄、性别、糖尿病病程、血压、血脂、糖化血红蛋白、尿酸、空腹血糖、估计的肾小球滤过率等有关。本研究结果显示,糖尿病病程、空腹血糖、糖化血红蛋白、空腹C肽、血脂等与DCAN并不相关,可能与本研究纳入病例的糖尿病病程较长(平均病程>10年),以及空腹血糖、糖化血红蛋白、空腹C肽、低密度脂蛋白总胆固醇等控制较为理想有关。Pan等[9]对1 975例T2DM患者的研究结果提示DCAN与性别、糖化血红蛋白、血压、血脂等无相关性。Astrup等[12]进行的一项大型前瞻性研究结果也提示DCAN与估计的肾小球滤过率无相关性。这表明DCAN的病因非常复杂且具有异质性,不同试验方法得到的结论差别较大,而本研究使用卡尔思R6000心血管自主神经检测系统进行检测,相比传统方法稳定性更强,准确性也更高。
DCAN还与多种疾病有关,孙彩霞等[13]研究发现,T2DM合并冠心病患者的心脏自主神经受损程度更严重,糖尿病作为冠心病的一个高危因素,参与了冠心病的发生和发展过程。β受体阻滞剂可以改善心脏自主神经功能,其通过增加心脏迷走神经活动使24 h心率变异性上升[14]。本研究纳入患者均在试验前12 h暂停使用β受体阻滞剂,减少了药物对心率的影响。Falcone等[15]研究发现,甲状腺激素可直接作用于心肌并通过调节自主神经功能维持心血管稳定,患有亚临床甲状腺功能减退症或亚临床甲状腺功能亢进症的冠心病患者心率变异性均明显低于甲状腺功能正常的冠心病患者,即使已经接受了治疗,患者心率变异性也无法完全恢复正常。赵蕾等[16]研究发现在T2DM患者中促甲状腺激素水平与DCAN相关,亚临床甲状腺功能减退症是DCAN的独立影响因素。在本研究中排除了既往有甲状腺功能亢进症和甲状腺功能减退症病史的患者,避免了甲状腺疾病对CART结果的影响。有研究发现,新型冠状病毒感染后患者存在感染后综合征[17-18],可表现为异常窦性心动过速、低血压等心血管自主神经病变症状。在本研究中也排除了有近期新型冠状病毒感染的患者,入选患者均无明显胸闷、心悸等不适,尽可能避免新型冠状病毒感染后综合征对CART结果的影响。
本研究尚存在一些局限性,如样本量较小,研究结果仅提示年龄是T2DM继发DCAN的危险因素,今后需扩大样本量进一步明确研究结果。此外,本研究获得的结果无法推广到一般糖尿病人群,后续研究需涉及更广泛的范围,以进一步探究影响DCAN的因素。
综上所述,本研究结果表明T2DM患者中DCAN的阳性检测率为50.79%,年龄是T2DM患者DCAN发生与发展的危险因素,并且年龄作为DCAN的筛查指标有一定价值,提示临床开展DCAN的筛查十分重要,尤其是在年龄>58岁的T2DM患者中更应进行DCAN筛查。
| [1] |
YUN J S, PARK Y M, CHA S A, et al. Progression of cardiovascular autonomic neuropathy and cardiovascular disease in type 2 diabetes[J]. Cardiovasc Diabetol, 2018, 17(1): 109. DOI:10.1186/s12933-018-0752-6 |
| [2] |
POP-BUSUI R, BOULTON A J M, FELDMAN E L, et al. Diabetic neuropathy: a position statement by the American Diabetes Association[J]. Diabetes Care, 2017, 40(1): 136-154. DOI:10.2337/dc16-2042 |
| [3] |
ALBERTI K G, ZIMMET P Z. Definition, diagnosis and classification of diabetes mellitus and its complications.Part 1:diagnosis and classification of diabetes mellitus provisional report of a WHO consultation[J]. Diabet Med, 1998, 15(7): 539-553. DOI:10.1002/(SICI)1096-9136(199807)15:7<539::AID-DIA668>3.0.CO;2-S |
| [4] |
EWING D J, MARTYN C N, YOUNG R J, et al. The value of cardiovascular autonomic function tests: 10 years experience in diabetes[J]. Diabetes Care, 1985, 8(5): 491-498. DOI:10.2337/diacare.8.5.491 |
| [5] |
EWING D J, CAMPBELL I W, BURT A A, et al. Vascular reflexes in diabetic autonomic neuropathy[J]. Lancet, 1973, 2(7842): 1354-1356. DOI:10.1016/s0140-6736(73)93323-0 |
| [6] |
SPALLONE V, ZIEGLER D, FREEMAN R, et al. Cardiovascular autonomic neuropathy in diabetes: clinical impact, assessment, diagnosis, and management[J]. Diabetes Metab Res Rev, 2011, 27(7): 639-653. DOI:10.1002/dmrr.1239 |
| [7] |
VINIK A I, MASER R E, MITCHELL B D, et al. Diabetic autonomic neuropathy[J]. Diabetes Care, 2003, 26(5): 1553-1579. DOI:10.2337/diacare.26.5.1553 |
| [8] |
BISSINGER A. Cardiac autonomic neuropathy: why should cardiologists care about that?[J]. J Diabetes Res, 2017, 2017: 5374176. DOI:10.1155/2017/5374176 |
| [9] |
PAN Q, LI Q, DENG W, et al. Prevalence and diagnosis of diabetic cardiovascular autonomic neuropathy in Beijing, China: a retrospective multicenter clinical study[J]. Front Neurosci, 2019, 13: 1144. DOI:10.3389/fnins.2019.01144 |
| [10] |
GE X, PAN S M, ZENG F, et al. A simple Chinese risk score model for screening cardiovascular autonomic neuropathy[J]. PLoS One, 2014, 9(3): e89623. DOI:10.1371/journal.pone.0089623 |
| [11] |
刘雨桐, 柳洪宙, 张雪莲. 2型糖尿病患者心脏自主神经病变影响因素的Meta分析[J]. 医学信息, 2023, 36(11): 50-59, 66. DOI:10.3969/j.issn.1006-1959.2023.11.009 |
| [12] |
ASTRUP A S, TARNOW L, ROSSING P, et al. Cardiac autonomic neuropathy predicts cardiovascular morbidity and mortality in type 1 diabetic patients with diabetic nephropathy[J]. Diabetes Care, 2006, 29(2): 334-339. DOI:10.2337/diacare.29.02.06.dc05-1242 |
| [13] |
孙彩霞, 张颖, 沈俊飞, 等. 老年冠心病合并2型糖尿病患者心率变异性分析研究[J]. 临床和实验医学杂志, 2011, 10(24): 1896-1897. DOI:10.3969/j.issn.1671-4695.2011.24.004 |
| [14] |
VAILE J C, FLETCHER J, AL-ANI M, et al. Use of opposing reflex stimuli and heart rate variability to examine the effects of lipophilic and hydrophilic β-blockers on human cardiac vagal control[J]. Clin Sci (Lond), 1999, 97(5): 585-593. |
| [15] |
FALCONE C, MATRONE B, BOZZINI S, et al. Time-domain heart rate variability in coronary artery disease patients affected by thyroid dysfunction[J]. Int Heart J, 2014, 55(1): 33-38. DOI:10.1536/ihj.13-198 |
| [16] |
赵蕾, 李如强, 袁明霞. 亚临床甲状腺功能减退症对糖尿病心脏自主神经病变的影响研究[J]. 中国全科医学, 2022, 25(9): 1113-1118. DOI:10.12114/j.issn.1007-9572.2021.02.128 |
| [17] |
RAMAN B, BLUEMKE D A, LÜSCHER T F, et al. Long COVID: post-acute sequelae of COVID-19 with a cardiovascular focus[J]. Eur Heart J, 2022, 43(11): 1157-1172. DOI:10.1093/eurheartj/ehac031 |
| [18] |
FEDOROWSKI A, FANCIULLI A, RAJ S R, et al. Cardiovascular autonomic dysfunction in post-COVID-19 syndrome: a major health-care burden[J]. Nat Rev Cardiol, 2024, 21(6): 379-395. DOI:10.1038/s41569-023-00962-3 |
 2025, Vol. 46
2025, Vol. 46


