2. 海军军医大学(第二军医大学)第一附属医院脑血管病中心, 上海 200433;
3. 上海中冶医院神经内科, 上海 200941
2. Neurovascular Center, The First Affiliated Hospital of Naval Medical University (Second Military Medical University), Shanghai 200433, China;
3. Department of Neurology, Shanghai Zhongye Hospital, Shanghai 200941, China
脑卒中是全球范围内导致死亡和长期残疾的主要疾病之一,给社会、家庭带来沉重的经济负担,已成为重要的公共卫生问题[1]。其中缺血性脑卒中占80%以上,且以大血管闭塞急性缺血性脑卒中(acute ischemic stroke with large vessel occlusion,AIS-LVO)的并发症最为严重,而血管内取栓(endovascular thrombectomy,EVT)可使闭塞的血管快速再通、恢复再灌注,是AIS-LVO最主要的治疗方式[2]。胰岛素抵抗在急性缺血性脑卒中(acute ischemic stroke,AIS)的发生、发展中被证实起着关键作用[3-4]。而根据甘油三酯和空腹血糖计算得出的甘油三酯-葡萄糖指数(triglyceride-glucose index,TyG)作为一种新兴的胰岛素抵抗的可靠替代标志物,因简便、经济、高效备受关注[5-6]。然而,目前有关TyG与前循环AIS-LVO相关性的研究较少。本研究通过回顾性分析前循环AIS-LVO患者的临床资料、实验室检查结果,初步探讨TyG与前循环AIS-LVO之间的关系,以期为AIS的临床预防、早期评估和干预提供新的思路和方法。
1 资料和方法 1.1 研究对象连续纳入2018年1月至2019年12月在海军军医大学第一附属医院脑血管病中心行急诊EVT的前循环AIS-LVO患者。纳入标准:(1)符合《中国急性缺血性脑卒中诊治指南2014》诊断标准[7],并经头颅CT或MRI检查证实为AIS;(2)年龄≥18岁;(3)发病至穿刺时间(time from onset to puncture,OTP)<6 h;(4)CT血管成像及CT灌注成像检查证实为急性前循环大血管闭塞,且为责任血管。排除标准:(1)患有精神分裂症或精神发育迟滞等;(2)合并严重心、肝、肺、肾功能衰竭;(3)发病前改良Rankin量表(modified Rankin scale,mRS)评分>2分;(4)临床资料不完整、术后90 d失访。本研究通过海军军医大学第一附属医院伦理委员会审批,所有患者均签署知情同意书。
1.2 研究方法 1.2.1 临床资料收集收集患者的人口学资料(年龄、性别、BMI)、血管危险因素(高血压病史、糖尿病史、高脂血症病史、冠心病史、心房颤动病史、既往脑卒中病史、吸烟史、饮酒史)、入院时收缩压和舒张压、入院时美国国立卫生研究院卒中量表(National Institutes of Health stroke scale,NIHSS)评分[8-9]、Org 10172急性脑卒中治疗试验(Trial of Org 10172 in Acute Stroke Treatment,TOAST)病因分型[10]、术前是否接受静脉溶栓、OTP、穿刺至再通时间(time from puncture to recanalization,PTR)等。
1.2.2 实验室检查资料收集及TyG计算于入院次日采集患者空腹外周静脉血,检测总胆固醇、甘油三酯、高密度脂蛋白胆固醇(high density lipoprotein-cholesterol,HDL-C)、低密度脂蛋白胆固醇(low density lipoprotein-cholesterol,LDL-C)、空腹血糖等实验室指标,并计算TyG:TyG=ln[甘油三酯(mg/dL)×空腹血糖(mg/dL)/2],其中甘油三酯1 mmol/L=88.6 mg/dL,空腹血糖1 mmol/L=18 mg/dL。
1.2.3 影像学检查资料收集根据治疗前头颅CT平扫检查结果进行Alberta脑卒中计划早期CT评分(Alberta Stroke Program early CT score,ASPECTS)。利用CT血管成像技术,通过图像后处理和三维重建分析血管闭塞部位,包括颈内动脉、大脑中动脉M1段、大脑中动脉M2段。使用RAPID软件利用CT灌注成像数据自动计算出核心梗死体积,即脑血流量<30%的脑组织区域的体积。
1.2.4 评价指标评价患者EVT后的血管成功再通率和症状性颅内出血(symptomatic intracranial hemorrhage,sICH)发生率。采用扩展脑梗死溶栓(extended thrombolysis in cerebral infarction,eTICI)分级评价治疗后血管再通情况,并将成功再通定义为eTICI分级≥2b。sICH根据海德堡标准[11],定义为治疗后48 h内影像学检查提示出血转化,且NIHSS评分较治疗前增加≥4分。
1.2.5 结局评价采用术后90 d mRS评分评估患者的预后,并将患者分为预后良好组(mRS评分为0~2分)和预后不良组(mRS评分为3~6分),其中mRS评分6分为死亡。
1.3 统计学处理使用SPSS 26.0软件进行统计学分析。呈正态分布的计量资料以x±s表示,组间比较采用独立样本t检验;呈偏态分布的计量资料以中位数(下四分位数,上四分位数)表示,组间比较采用Mann-Whitney U检验;计数资料以例数和百分数表示,组间比较采用χ2检验。采用ROC曲线分析TyG对前循环AIS-LVO患者预后不良的预测价值。所有检验均为双侧检验,检验水准(α)为0.05。
2 结果 2.1 预后不良组与预后良好组前循环AIS-LVO患者的临床资料比较共纳入135例前循环AIS-LVO患者,其中预后良好组72例、预后不良组63例。与预后良好组相比,预后不良组患者的年龄更大(P=0.012),有高脂血症病史的患者比例更高(P=0.016),入院时收缩压更高(P=0.034),入院时NIHSS评分更高(P=0.002),术前ASPECTS更低(P=0.003),核心梗死体积更大(P<0.001),sICH发生率更高(P=0.003)。两组患者的性别、BMI、高血压病史、糖尿病史、冠心病史、心房颤动病史、既往脑卒中病史、吸烟史、饮酒史、入院时舒张压、TOAST病因分型、血管闭塞部位、术前静脉溶栓比例、OTP、PTR、血管成功再通率等差异均无统计学意义(均P>0.05)。见表 1。
|
|
表 1 预后良好组与预后不良组前循环AIS-LVO患者的临床资料比较 Tab 1 Comparison of clinical data of anterior circulation AIS-LVO patients between favorable and unfavorable outcome groups |
2.2 预后良好组与预后不良组前循环AIS-LVO患者的实验室检查结果比较
与预后良好组相比,预后不良组患者的空腹血糖水平更高(P<0.001)、LDL-C水平更低(P=0.022)、TyG更高(P<0.001)。而两组患者的总胆固醇、甘油三酯、HDL-C水平差异均无统计学意义(均P>0.05)。见表 2。
|
|
表 2 预后良好组与预后不良组前循环AIS-LVO患者的实验室指标比较 Tab 2 Comparison of laboratory indexes of anterior circulation AIS-LVO patients between favorable and unfavorable outcome groups |
2.3 高TyG组与低TyG组前循环AIS-LVO患者的临床资料比较
根据TyG的中位数8.57将患者分为低TyG组(<8.57,n=67)和高TyG组(≥8.57,n=68)。与低TyG组相比,高TyG组有高脂血症病史的患者比例更高(P=0.003),入院时收缩压更高(P=0.018),核心梗死体积更大(P=0.025),且两组患者的TOAST病因分型差异有统计学意义(P=0.005)。此外,高TyG组患者术后90 d的mRS评分高于低TyG组(P=0.049)。两组患者的年龄、性别、BMI、高血压病史、糖尿病史、冠心病史、心房颤动病史、既往脑卒中病史、吸烟史、饮酒史、入院时舒张压、入院时NIHSS评分、术前ASPECTS、血管闭塞部位、术前静脉溶栓比例、OTP、PTR、血管成功再通率、sICH差异均无统计学意义(均P>0.05)。见表 3。
|
|
表 3 高TyG组与低TyG组前循环AIS-LVO患者临床资料比较 Tab 3 Comparison of clinical data of anterior circulation AIS-LVO patients between high- and low-TyG groups |
2.4 高TyG组与低TyG组前循环AIS-LVO患者的实验室检查结果比较
与低TyG组相比,高TyG组的空腹血糖和甘油三酯水平更高(均P<0.001)、HDL-C水平更低(P=0.013)。而两组患者的总胆固醇、LDL-C水平差异均无统计学意义(均P>0.05)。见表 4。
|
|
表 4 高TyG组与低TyG组前循环AIS-LVO患者的实验室指标比较 Tab 4 Comparison of laboratory data of anterior circulation AIS-LVO patients between high- and low-TyG groups |
2.5 TyG对前循环AIS-LVO患者预后不良的预测价值
ROC曲线分析结果显示,TyG对前循环AIS-LVO患者行EVT治疗后预后不良具有一定的预测价值(AUC值为0.662,95% CI 0.571~0.753)。见图 1。
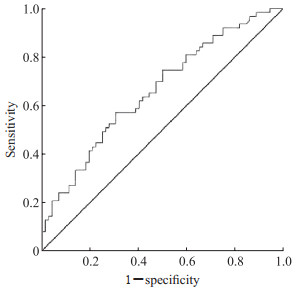
|
图 1 TyG预测前循环AIS-LVO患者EVT后预后不良的ROC曲线 Fig 1 ROC curve of TyG predicting poor prognosis after EVT in anterior circulation AIS-LVO patients TyG: Triglyceride-glucose index; AIS-LVO: Acute ischemic stroke with large vessel occlusion; EVT: Endovascular treatment; ROC: Receiver operating characteristic. |
3 讨论
本研究结果揭示了TyG作为糖脂代谢异常标志物在前循环AIS-LVO患者预后评估中的潜在价值。结果显示,预后不良组患者TyG高于预后良好组,进一步分析发现TyG升高对前循环AIS-LVO患者预后不良具有一定的预测能力(AUC值为0.662)。脑卒中预后受多种因素的影响,包括患者的基本特征、卒中的类型和严重程度、是否有并发症等。本研究表明,年龄、高脂血症、高血压、严重的神经功能缺损、较大的梗死体积及sICH的发生都是影响前循环AIS-LVO患者预后的重要因素。该结果提示在AIS治疗和管理中应综合评估这些高风险因素,并采取相应的预防和治疗措施以改善患者的预后。
研究表明,胰岛素抵抗患者的缺血性脑卒中发生风险显著增高[12-13],这些研究结果支持胰岛素抵抗通过糖脂代谢紊乱加速动脉粥样硬化进程进而影响脑卒中预后的病理生理假说。胰岛素具有抑制血小板聚集的作用,并以此发挥抗凝功效。然而,当出现胰岛素抵抗时,机体常伴随慢性炎症状态并出现高血糖和高脂血症。高血糖促使糖基化终产物生成,损害血管内皮细胞功能;而高脂血症显著增加了脂质在血管壁沉积的风险,从而加速动脉粥样硬化进程,增加了脑卒中复发的风险。这一系列因胰岛素抵抗引发的高血糖、高脂血症及其后续血管病变等机制,极大地增加了脑卒中复发、神经功能恶化及不良预后的可能性[14-16]。由此可见,胰岛素抵抗在缺血性脑卒中的发生、发展过程中发挥重要作用[17-18]。TyG被认为是一种反映胰岛素抵抗的简单、可靠的糖脂代谢指标[5-6, 19]。多项研究显示,TyG与缺血性脑卒中的发生、发展和不良预后密切相关[20-22],NHANES和MIMIC-Ⅳ队列研究对其与脑卒中相关死亡风险的关系进行了评估,结果证实TyG与脑卒中风险相关,进一步的单向双样本孟德尔随机化分析结果也表明TyG升高与脑卒中风险增加有关[23]。此外,一项针对396例老年大动脉粥样硬化型AIS患者的回顾性研究发现,预后不良组的TyG明显增高,Spearman秩相关分析结果也显示TyG与mRS评分呈正相关[24]。
本研究结果显示,TyG在预后不良的前循环AIS-LVO患者中升高,对AIS-LVO患者的预后有潜在预测价值。然而,本研究存在一定局限性:第一,本研究结果来源于单中心数据;第二,本研究是一项回顾性研究,可能存在选择偏倚;第三,本研究样本量较小。未来需开展多中心、大样本的前瞻性队列研究验证本研究结果,并进一步探索TyG在前循环AIS-LVO患者中的临床应用价值,为AIS-LVO的临床预防、早期评估和干预提供新的策略。
| [1] |
GBD 2016 Lifetime Risk of Stroke Collaborators, FEIGIN V L, NGUYEN G, et al. Global, regional, and country-specific lifetime risks of stroke, 1990 and 2016[J]. N Engl J Med, 2018, 379(25): 2429-2437. DOI:10.1056/nejmoa1804492 |
| [2] |
POWERS W J, RABINSTEIN A A, ACKERSON T, et al. Guidelines for the early management of patients with acute ischemic stroke: 2019 update to the 2018 guidelines for the early management of acute ischemic stroke: a guideline for healthcare professionals from the American Heart Association/American Stroke Association[J]. Stroke, 2019, 50(12): e344-e418. DOI:10.1161/STR.0000000000000211 |
| [3] |
DING X, WANG X, WU J, et al. Triglyceride-glucose index and the incidence of atherosclerotic cardiovascular diseases: a meta-analysis of cohort studies[J]. Cardiovasc Diabetol, 2021, 20(1): 76. DOI:10.1186/s12933-021-01268-9 |
| [4] |
ALIZARGAR J, BAI C H, HSIEH N C, et al. Use of the triglyceride-glucose index (TyG) in cardiovascular disease patients[J]. Cardiovasc Diabetol, 2020, 19(1): 8. DOI:10.1186/s12933-019-0982-2 |
| [5] |
KHAN S H, SOBIA F, NIAZI N K, et al. Metabolic clustering of risk factors: evaluation of triglyceride-glucose index (TyG index) for evaluation of insulin resistance[J]. Diabetol Metab Syndr, 2018, 10: 74. DOI:10.1186/s13098-018-0376-8 |
| [6] |
TAO L C, XU J N, WANG T T, et al. Triglyceride-glucose index as a marker in cardiovascular diseases: landscape and limitations[J]. Cardiovasc Diabetol, 2022, 21(1): 68. DOI:10.1186/s12933-022-01511-x |
| [7] |
中华医学会神经病学分会, 中华医学会神经病学分会脑血管病学组. 中国急性缺血性脑卒中诊治指南2014[J]. 中华神经科杂志, 2015, 48(4): 246-257. DOI:10.3760/cma.j.issn.1006-7876.2015.04.002 |
| [8] |
ANDREW JOSEPHSON S, HILLS N K, CLAIBORNE JOHNSTON S. NIH stroke scale reliability in ratings from a large sample of clinicians[J]. Cerebrovasc Dis, 2006, 22(5/6): 389-395. DOI:10.1159/000094857 |
| [9] |
GOLDSTEIN L B, SAMSA G P. Reliability of the National Institutes of Health stroke scale. Extension to non-neurologists in the context of a clinical trial[J]. Stroke, 1997, 28(2): 307-310. DOI:10.1161/01.str.28.2.307 |
| [10] |
ADAMS H P Jr, BENDIXEN B H, KAPPELLE L J, et al. Classification of subtype of acute ischemic stroke. Definitions for use in a multicenter clinical trial. TOAST. Trial of Org 10172 in Acute Stroke Treatment[J]. Stroke, 1993, 24(1): 35-41. DOI:10.1161/01.str.24.1.35 |
| [11] |
VON KUMMER R, BRODERICK J P, CAMPBELL B C V, et al. The Heidelberg bleeding classification: classification of bleeding events after ischemic stroke and reperfusion therapy[J]. Stroke, 2015, 46(10): 2981-2986. DOI:10.1161/STROKEAHA.115.010049 |
| [12] |
PYÖRÄLÄ M, MIETTINEN H, HALONEN P, et al. Insulin resistance syndrome predicts the risk of coronary heart disease and stroke in healthy middle-aged men: the 22-year follow-up results of the Helsinki Policemen Study[J]. Arterioscler Thromb Vasc Biol, 2000, 20(2): 538-544. DOI:10.1161/01.atv.20.2.538 |
| [13] |
THACKER E L, PSATY B M, MCKNIGHT B, et al. Fasting and post-glucose load measures of insulin resistance and risk of ischemic stroke in older adults[J]. Stroke, 2011, 42(12): 3347-3351. DOI:10.1161/STROKEAHA.111.620773 |
| [14] |
中华医学会糖尿病学分会. 胰岛素抵抗相关临床问题专家共识(2022版)[J]. 中华糖尿病杂志, 2022, 14(12): 1368-1379. DOI:10.3760/cma.j.cn115791-20220905-00446 |
| [15] |
LOVE K M, LIU Z. DPP4 activity, hyperinsulinemia, and atherosclerosis[J]. J Clin Endocrinol Metab, 2021, 106(6): 1553-1565. DOI:10.1210/clinem/dgab078 |
| [16] |
周旭游, 朱向阳, 周永, 等. 胰岛素抵抗与缺血性卒中[J]. 国际脑血管病杂志, 2018, 26(5): 373-378. DOI:10.3760/cma.j.issn.1673-4165.2018.05.009 |
| [17] |
DING P F, ZHANG H S, WANG J, et al. Insulin resistance in ischemic stroke: mechanisms and therapeutic approaches[J]. Front Endocrinol (Lausanne), 2022, 13: 1092431. DOI:10.3389/fendo.2022.1092431 |
| [18] |
AGO T, MATSUO R, JUN H, et al. Insulin resistance and clinical outcomes after acute ischemic stroke[J]. Neurology, 2018, 90(17): e1470-e1477. DOI:10.1212/WNL.0000000000005358 |
| [19] |
GUERRERO-ROMERO F, SIMENTAL-MENDIA L E, GONZALEZ-ORTIZ M, et al. The product of triglycerides and glucose, a simple measure of insulin sensitivity. Comparison with the euglycemic-hyperinsulinemic clamp[J]. J Clin Endocrinol Metab, 2010, 95(7): 3347-3351. DOI:10.1210/jc.2010-0288 |
| [20] |
MIAO M, BI Y, HAO L, et al. Triglyceride-glucose index and short-term functional outcome and in-hospital mortality in patients with ischemic stroke[J]. Nutr Metab Cardiovasc Dis, 2023, 33(2): 399-407. DOI:10.1016/j.numecd.2022.11.004 |
| [21] |
WANG X, FENG B, HUANG Z, et al. Relationship of cumulative exposure to the triglyceride-glucose index with ischemic stroke: a 9-year prospective study in the Kailuan cohort[J]. Cardiovasc Diabetol, 2022, 21(1): 66. DOI:10.1186/s12933-022-01510-y |
| [22] |
YANG Y, HUANG X, WANG Y, et al. The impact of triglyceride-glucose index on ischemic stroke: a systematic review and meta-analysis[J]. Cardiovasc Diabetol, 2023, 22(1): 2. DOI:10.1186/s12933-022-01732-0 |
| [23] |
JIANG Y A, SHEN J, CHEN P, et al. Association of triglyceride glucose index with stroke: from two large cohort studies and Mendelian randomization analysis[J]. Int J Surg, 2024, 110(9): 5409-5416. DOI:10.1097/JS9.0000000000001795 |
| [24] |
谢翼, 高修银, 李雷, 等. TyG指数对老年大动脉粥样硬化型脑卒中患者预后的预测价值[J]. 医学研究杂志, 2021, 50(12): 141-144, 93. DOI:10.11969/j.issn.1673-548X.2021.12.031 |
 2025, Vol. 46
2025, Vol. 46


