2. 陕西中医药大学药学院, 西安 712046;
3. 北京中医药大学, 北京 100105;
4. 清华德人西安幸福制药有限公司, 西安 710043
2. College of Pharmacy, Shaanxi University of Chinese Medicine, Xi'an 712046, Shaanxi, China;
3. Beijing University of Chinese Medicine, Beijing 100105, China;
4. Tsinghua Deren Xi'an Happiness Pharmaceutical Co., Ltd., Xi'an 710043, Shaanxi, China
自身免疫性肝炎(autoimmune hepatitis,AIH)是一种由免疫系统介导的肝细胞疾病,主要病理改变是肝组织中大量炎症细胞浸润[1]。若不进行及时有效治疗,AIH可进一步发展为肝纤维化、肝硬化、肝癌等。目前对于AIH的防治尚缺乏有效药物,临床主要用硫唑嘌呤、糖皮质激素等药物缓解患者肝脏炎症,但长期使用存在严重不良反应[2]。中药有多功能、多靶点的作用特点,对AIH的防治具有显著优势。五灵胶囊是药理作用明确的保肝药物,由丹参、柴胡、五味子、灵芝四味药材组成,被收录入2020版《中华人民共和国药典》,具有疏肝、健脾、活血之功效,用于慢性乙型肝炎肝郁脾虚挟瘀证[3]。研究表明,五灵胶囊可降低脂多糖诱导肝损伤小鼠的IL-6、IL-8、TNF-α水平及TNF-α、CD14表达强度;五灵胶囊抑制各种诱因导致肝实质与非实质细胞释放大量细胞因子是其治疗肝损伤的机制之一[4]。本研究以刀豆蛋白A(concanavalin A, Con A)诱导AIH模型,探究五灵胶囊对AIH小鼠的保护作用,为其临床应用提供实验依据。
1 材料和方法 1.1 动物、药品和试剂雄性BALB/c小鼠,体重(18±2)g,6~8周龄,由成都达硕实验动物中心提供,动物生产许可证号为SCXK(川)2020-030。自由摄食及饮水,饲养环境温度(21±3)℃、相对湿度(50±5)%,照明时间为12 h,小鼠适应性饲养1周后使用。
五灵胶囊(批号210304)由清华德人西安幸福制药有限公司提供,Con A(货号C2010)购于美国Sigma公司。
丙氨酸转氨酶(alanine transaminase,ALT)测定试剂盒和天冬氨酸转氨酶(aspartate transaminase,AST)测定试剂盒购于深圳迈瑞生物医疗电子股份有限公司;小鼠IL-6、IL-4和TNF-α ELISA检测试剂盒购于深圳欣博盛生物科技有限公司;TRIzol试剂(货号T9424)购于美国Sigma公司,PrimeScriptTM RT Master Mix反转录试剂盒(货号RR036A)和SYBR® Premix Ex TaqTM Ⅱ试剂盒(货号RR820A)购于日本TaKaRa公司。
1.2 实验仪器BS-330E全自动生化分析仪(深圳迈瑞生物医疗电子股份有限公司),Synergy H1全功能酶标仪(美国BioTek公司),Sorvall LegendTM Micro 17R高速冷冻离心机(美国Thermo Scientific公司),NanoDrop One分光光度计(AZY1810928,美国Themo Scientific公司),qTOWER2.2实时荧光定量PCR仪(德国Analytik Jena公司)。
1.3 Con A注射剂量和注射时间探索参照既往报道的方法,采用Con A尾静脉注射诱导AIH小鼠模型[5-6]。实验方案如下:(1)小鼠随机分为不同剂量Con A组(分别尾静脉注射Con A 15、20和30 mg/kg)和正常对照组(尾静脉注射等体积生理盐水),每组5只。注射8 h后采样。(2)小鼠随机分为Con A注射后不同时间组(均尾静脉注Con A 20 mg/kg,分别于尾静脉注射Con A后4、6、8和12 h采样)和正常对照组(尾静脉注射等体积生理盐水),每组5只。以上2组实验方案均观察肝脏外观变化,称全肝、全脾湿重,计算脏器指数[脏器指数(%)=脏器重量/小鼠体重×100%],检测血清ALT、AST水平。
1.4 五灵胶囊给药小鼠随机分为对照组、AIH模型组、五灵胶囊低剂量组(0.5 g·kg-1·d-1)、五灵胶囊中剂量组(1.0 g·kg-1·d-1)、五灵胶囊高剂量组(2.0 g·kg-1·d-1),每组10只。五灵胶囊的剂量设置参照既往报道[4]及临床使用剂量:5(粒)×0.35(g/粒)×3(次/d)/60(kg,人平均体重)=0.087 5 g·kg-1·d-1。换算为小鼠用药剂量[7]:0.087 5 g·kg-1·d-1×9.01=0.788 g·kg-1·d-1,因此在本实验中,选择0.5、1.0和2.0 g·kg-1·d-1作为五灵胶囊的低、中、高剂量。
取五灵胶囊粉末适量,加水配成50、100、200 mg/mL混悬液,分别用作五灵胶囊低、中、高剂量组的灌胃药物,按10 mL/kg的体积灌胃给药,每天1次,连续14 d。对照组和AIH模型组灌胃给予等体积生理盐水。预防性给药14 d后,采用尾静脉注射Con A制作AIH模型。AIH模型组和五灵胶囊各剂量组小鼠按20 mg/kg剂量尾静脉注射Con A,正常对照组小鼠尾静脉注射等体积的生理盐水。注射8 h后采用摘除眼球法收集血液,以1.5 mL无菌试管采血约1 mL,静置30 min后,1 200×g离心10 min,分离血清。之后脱颈处死小鼠,摘取肝脏和脾脏,计算脏器指数。部分肝脏于4%多聚甲醛溶液内固定,其余部分于-80 ℃保存备用。
1.5 血清肝功能指标的检测应用全自动生化分析仪通过国际临床化学和实验室医学联合会推荐的方法检测小鼠血清ALT和AST水平。
1.6 肝组织病理结构的观察剪取小鼠肝左叶,以4%多聚甲醛溶液固定,石蜡包埋,连续切片(厚5 μm),进行H-E染色,于光学显微镜下观察肝组织病理变化。
1.7 肝组织IL-6、IL-4和TNF-α含量的测定称取肝组织100 mg,加入纯化水900 μL,匀浆、17 000×g离心10 min,取上清液,采用ELISA方法,依照试剂盒说明书操作,测定肝组织匀浆中IL-6、IL-4和TNF-α的含量。
1.8 qPCR分析采用TRIzol法提取小鼠肝组织总RNA,用NanoDrop One分光光度计检测总RNA的浓度和纯度。采用PrimeScriptTM RT Master Mix反转录试剂盒将总RNA反转录为cDNA,采用实时荧光定量PCR仪和SYBR® Premix Ex TaqTMⅡ试剂盒进行qPCR扩增。反应体系为20 μL,内参为β-肌动蛋白,根据2-ΔΔCt法计算IL-6、IL-4、TNF-α、Toll样受体4(Toll-like receptor 4,TLR4)和NF-κBmRNA的相对表达量。IL-6正向引物序列为5'-CTCCCAACAGACCT-GTCTATAC-3',反向引物序列为5'-CCATTGCAC-AACTCTTTTCTCA-3';IL-4正向引物序列为5'-G-GTCTCAACCCCCAGCTAGT-3',反向引物序列为5'-GCCGATGATCTCTCTCAAGTGAT-3';TNF-α正向引物序列为5'-CATCTTCTCTCAAAATTCG-AGTGACAA-3',反向引物序列为5'-TGGGAGTA-GACAAGGTACAACCC-3';TLR4正向引物序列为5'-GCCATCATTATGAGTGCCAATT-3',反向引物序列为5'-AGGGATAAGAACGCTGAGAATT-3';NF-κB正向引物序列为5'-TCCAGGCTCCTGTTCG-AGTCTC-3',反向引物序列为5'-CGGTGGCGATC-ATCTGTGTCTG-3';β-肌动蛋白正向引物序列为5'-AGGGAAATCGTGCGTGACATCAAA-3',反向引物序列为5'-ACTCATCGTACTCCTGCTT-GCTGA-3'。
1.9 免疫荧光法检测NF-κB p65入核激活对小鼠肝组织石蜡切片进行脱腊、水化,加入枸橼酸缓冲液煮沸,冷却到室温后,加入NF-κB p65抗体孵育过夜,然后滴加荧光二抗,室温孵育1~2 h。使用Image-Pro Plus 6.0软件对染色结果进行半定量分析。
1.10 统计学处理采用SPSS 19.0和GraphPad Prism 8.0.1软件进行统计学分析。计量资料用x±s表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析。检验水准(α)为0.05。
2 结果 2.1 Con A注射剂量浓度和注射后时间对小鼠肝损伤的影响与正常对照组比较,Con A各剂量组小鼠的肝脏指数、脾脏指数、血清ALT和AST水平均升高(P<0.05或P<0.01),并随Con A注射剂量增加而增高(表 1)。与正常对照组比较,Con A(20 mg/kg)注射后各时间点小鼠的肝脏指数、脾脏指数、血清ALT和AST水平均升高(P<0.05或P<0.01),肝脏指数随Con A注射后时间延长而减小,脾脏指数在Con A注射后6 h时最大,血清ALT和AST水平随Con A注射后时间延长而增高(表 2)。
|
|
表 1 Con A注射剂量对小鼠脏器指数和肝功能指标的影响 Tab 1 Effects of Con A injection dose on viscera indexes and liver function indexes of mice |
|
|
表 2 Con A(20 mg/kg)注射后不同时间点小鼠脏器指数和肝功能指标的变化 Tab 2 Changes of viscera indexes and liver function indexes at different time points after Con A (20 mg/kg) injection in mice |
Con A注射剂量为30 mg/kg时各指标数值最高,但此时小鼠的状态较差;12 h时肝功能数值最高,但出现小鼠在采集血液前死亡的现象。综合考虑小鼠状态和死亡率,选择Con A的注射剂量为20 mg/kg、注射后8 h制作AIH小鼠模型。
2.2 五灵胶囊对AIH小鼠肝组织病理学形态的影响H-E染色结果(图 1)显示,对照组小鼠肝小叶结构完整,肝细胞形态正常;AIH模型组小鼠可见肝小叶结构紊乱,炎症细胞浸润,大面积片状肝细胞死亡;五灵胶囊各剂量组小鼠肝脏病理结构皆有改善,损伤区域面积减小,肝细胞形态较为完好。
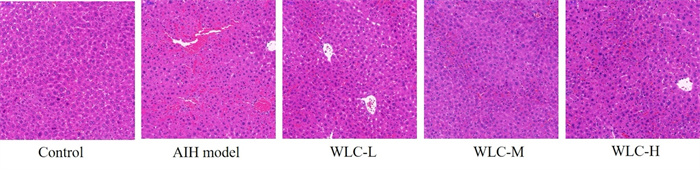
|
图 1 各组小鼠肝组织病理学变化(H-E染色,200×) Fig 1 Pathology of liver tissue of mice in each group (H-E staining, 200×) WLC-L, WLC-M, and WLC-H indicate low-dose (0.5 g·kg-1·d-1), middle-dose (1.0 g·kg-1·d-1) and high-dose (2.0 g·kg-1·d-1) Wuling capsule groups, respectively. H-E: Hematoxylin-eosin; AIH: Autoimmune hepatitis. |
2.3 五灵胶囊对AIH小鼠血清ALT和AST水平的影响
与对照组相比,AIH模型组小鼠血清ALT和AST水平均升高(均P<0.01)。与AIH模型组相比,五灵胶囊低、中、高剂量组小鼠血清ALT水平均降低(均P<0.01),中剂量组的AST水平降低(P<0.01)。五灵胶囊高剂量组的ALT水平高于中剂量组(P<0.05),五灵胶囊低、高剂量组的AST水平高于中剂量组(均P<0.05)。见表 3。
|
|
表 3 五灵胶囊对AIH小鼠血清ALT和AST水平的影响 Tab 3 Effects of Wuling capsule on serum ALT and AST levels in AIH mice |
2.4 五灵胶囊对AIH小鼠肝组织IL-4、IL-6和TNF-α含量的影响
与对照组相比,AIH模型组小鼠肝组织IL-4、IL-6和TNF-α含量均升高(均P<0.01);与AIH模型组相比,五灵胶囊中、高剂量组小鼠肝组织IL-4、IL-6和TNF-α含量均降低(P<0.05或P<0.01),且随着剂量增加降低程度愈明显。见表 4。
|
|
表 4 五灵胶囊对AIH小鼠肝组织IL-4、IL-6和TNF-α含量的影响 Tab 4 Effects of Wuling capsule on IL-4, IL-6 and TNF-α contents in the liver of AIH mice |
2.5 五灵胶囊对AIH小鼠肝脏炎症相关基因mRNA表达的影响
与对照组相比,AIH模型组小鼠肝组织TLR4、NF-κB、IL-4、IL-6和TNF-α mRNA表达均上调(均P<0.05);与AIH模型组相比,五灵胶囊低、中、高剂量组小鼠肝组织的TLR4、NF-κB、IL-4和IL-6 mRNA表达均下调(P<0.05或P<0.01),五灵胶囊中剂量组的TNF-α mRNA表达下调(P<0.05)。见表 5。
|
|
表 5 五灵胶囊对AIH小鼠肝脏炎症相关基因mRNA表达的影响 Tab 5 Effect of Wuling capsule on mRNA expression of liver inflammation genes in AIH mice |
2.6 五灵胶囊对AIH小鼠肝组织NF-κB p65入核激活的影响
如图 2所示,与对照组相比,AIH模型组小鼠肝组织绿色荧光明显增强,细胞核呈明显的蓝绿色荧光,说明模型组NF-κB p65在细胞核内有较高的表达。与AIH模型组相比,五灵胶囊给药组视野中的绿色荧光明显减少,且绿色荧光主要附着在细胞核附近,核内较少。
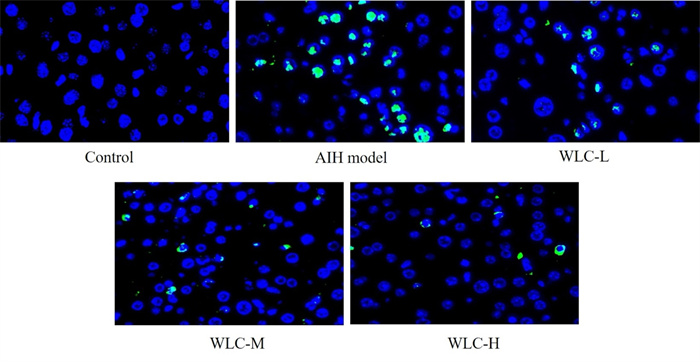
|
图 2 五灵胶囊对AIH小鼠肝组织NF-κB p65入核激活的影响(免疫荧光法,200×) Fig 2 Effect of Wuling capsule on liver NF-κB p65 nucleation activation in AIH mice (immunofluorescence, 200×) WLC-L, WLC-M, and WLC-H indicate low-dose (0.5 g·kg-1·d-1), middle-dose (1.0 g·kg-1·d-1) and high-dose (2.0 g·kg-1·d-1) Wuling capsule groups, respectively. AIH: Autoimmune hepatitis; NF-κB: Nuclear factor κB. |
3 讨论
AIH是以细胞免疫为主、多种免疫应答参与的肝细胞损伤坏死,主要特征是大量炎症因子释放并浸润细胞质,引起肝脏急性出血性坏死,主要表现为周身无力、睡眠不足、上消化道出血等。目前AIH的病理病机尚不明确。Con A诱导的免疫肝损伤模型是国内外较为认可的AIH动物模型,可模拟人类AIH发病过程中的病理变化特征[5-6]。通过注射Con A可在短时间内使小鼠肝脏部位浸润大量的炎症细胞,诱导小鼠肝脏出现肝细胞变性、坏死[5-6]。本实验考察了尾静脉注射不同剂量Con A和注射后不同时间小鼠的肝损伤情况,根据小鼠脏器指数、肝功能指标和小鼠状态,选取了Con A 20 mg/kg注射后8 h的小鼠作为AIH小鼠模型,用于五灵胶囊预防性给药对Con A诱导的AIH小鼠保护作用研究。
本实验中,H-E染色发现AIH模型组小鼠肝脏内肝小叶中央静脉及门管区可见大量炎症细胞浸润,并可见肝小叶内部分肝细胞变性、坏死,血清AST及ALT水平升高,表明该小鼠模型符合AIH早期肝脏组织学和血清免疫学的变化特征,提示AIH模型构建成功。五灵胶囊可明显改善AIH小鼠的肝脏病理结构,降低AIH小鼠血清ALT和AST水平,表明五灵胶囊对Con A诱导的AIH小鼠具有保护作用。
TNF-α是一种重要的炎症细胞因子,在Con A致肝损伤的发病机制中发挥关键作用[8]。TNF-α由肝巨噬细胞(Kupffer细胞)和活化的T细胞分泌,其表达过多可诱导肝细胞凋亡引起肝损伤[9]。经TNF-α抑制剂和TNF-α抗体预处理均对Con A诱导的AIH小鼠有保护作用[9-11]。除了TNF-α,其他炎症因子如IL-4和IL-6也被认为在Con A诱导的免疫肝损伤中起重要作用,其中IL-6为促炎因子,IL-4为抗炎因子,但注射Con A后,IL-4和IL-6含量均显著升高[6]。本实验中Con A诱导的AIH小鼠肝组织中IL-6和TNF-α含量均较对照组升高,IL-4含量变化呈相同趋势,说明当促炎因子增加时机体也会调动抗炎因子表达,以维持平衡。与AIH模型组相比,五灵胶囊给药组的IL-6、TNF-α和IL-4含量均降低,说明五灵胶囊可通过调节炎症因子水平减轻免疫肝损伤。这些炎症因子上调与TLR4/NF-κB信号通路密切相关[12-14]。在本研究中,五灵胶囊可下调Con A诱导的AIH小鼠肝脏中的TLR4和NF-κB mRNA表达,并可抑制NF-κB p65入核激活,说明抑制TLR4/NF-κB信号通路可能是五灵胶囊抗肝纤维化的作用机制,但该结论还需要通过五灵胶囊和TLR4诱导剂/抑制剂在动物实验中一同给药或在细胞实验中共孵育等进一步验证。
| [1] |
王海峰. 自身免疫性肝炎临床、免疫学及病理学特征分析[J]. 世界最新医学信息文摘, 2017, 17(85): 27-28. DOI:10.19613/j.cnki.1671-3141.2017.85.014 |
| [2] |
王翔鹏, 武璐璐, 李丽丽, 等. 枫杨醇提物对刀豆蛋白A诱导的免疫性肝损伤的保护作用[J]. 西安交通大学学报(医学版), 2020, 41(1): 157-160. DOI:10.7652/jdyxb202001030 |
| [3] |
国家药典委员会. 中华人民共和国药典[S]. 一部. 北京: 中国医药科技出版社, 2020: 644-645.
|
| [4] |
王胜春, 赵辉平, 皇甫孟娟, 等. 五灵胶囊对脂多糖诱导肝细胞因子所致肝损伤的作用机制[J]. 中国现代应用药学, 2007, 24(6): 442-445. DOI:10.13748/j.cnki.issn1007-7693.2007.06.003 |
| [5] |
WANG H X, LIU M, WENG S Y, et al. Immune mechanisms of concanavalin A model of autoimmune hepatitis[J]. World J Gastroenterol, 2012, 18(2): 119-125. DOI:10.3748/wjg.v18.i2.119 |
| [6] |
HEYMANN F, HAMESCH K, WEISKIRCHEN R, et al. The concanavalin A model of acute hepatitis in mice[J]. Lab Anim, 2015, 49. DOI:10.1177/0023677215572841 |
| [7] |
刘涛, 季光. 科研思路与方法[M]. 2版. 北京: 中国中医药出版社, 2016: 222.
|
| [8] |
GANTNER F, LEIST M, LOHSE A W, et al. Concanavalin A-induced T-cell-mediated hepatic injury in mice: the role of tumor necrosis factor[J]. Hepatology, 1995, 21(1): 190-198. DOI:10.1016/0270-9139(95)90428-x |
| [9] |
MIZUHARA H, O'NEILL E, SEKI N, et al. T cell activation-associated hepatic injury: mediation by tumor necrosis factors and protection by interleukin 6[J]. J Exp Med, 1994, 179(5): 1529-1537. DOI:10.1084/jem.179.5.1529 |
| [10] |
KSONTINI R, COLAGIOVANNI D B, JOSEPHS M D, et al. Disparate roles for TNF-alpha and Fas ligand in concanavalin A-induced hepatitis[J]. J Immunol, 1998, 160(8): 4082-4089. |
| [11] |
KÜSTERS S, TIEGS G, ALEXOPOULOU L, et al. In vivo evidence for a functional role of both tumor necrosis factor (TNF) receptors and transmembrane TNF in experimental hepatitis[J]. Eur J Immunol, 1997, 27(11): 2870-2875. DOI:10.1002/eji.1830271119 |
| [12] |
SERRYA M S, ZAGHLOUL M S. Mycophenolate mofetil attenuates concanavalin A-induced acute liver injury through modulation of TLR4/NF-κB and Nrf2/HO-1 pathways[J]. Pharmacol Rep, 2020, 72(4): 945-955. DOI:10.1007/s43440-019-00055-4 |
| [13] |
SANG R, YU Y, GE B, et al. Taraxasterol from Taraxacum prevents concanavalin A-induced acute hepatic injury in mice via modulating TLRs/NF-κB and Bax/Bc1-2 signalling pathways[J]. Artif Cells Nanomed Biotechnol, 2019, 47(1): 3929-3937. DOI:10.1080/21691401.2019.1671433 |
| [14] |
FENG D, MEI Y, WANG Y, et al. Tetrandrine protects mice from concanavalin A-induced hepatitis through inhibiting NF-kappaB activation[J]. Immunol Lett, 2008, 121(2): 127-133. DOI:10.1016/j.imlet.2008.10.001 |
 2025, Vol. 46
2025, Vol. 46


