扩展功能
文章信息
- 张璇, 韦恒叶
- ZHANG Xuan, WEI HengYe.
- 湖北秭归吴家坪组—长兴组界线氧化还原条件及其意义
- Redox Conditions and their Implications at the Wujiaping-Changxing Formation Boundary in Zigui, Hubei Province
- 沉积学报, 2020, 38(3): 476-484
- ACTA SEDIMENTOLOGICA SINCA, 2020, 38(3): 476-484
- 10.14027/j.issn.1000-0550.2020.008
-
文章历史
- 收稿日期:2019-11-26
- 收修改稿日期: 2020-03-02
在显生宙,二叠纪末生物大灭绝事件是五次生物大灭绝事件中最为严重的一次[1] 。二叠纪存在两次相对独立的生物灭绝事件,一次发生在瓜德鲁普世末期,即瓜德鲁普生物灭绝事件[2-4],而另一次则发生于长兴末期,即晚二叠世末生物灭绝事件[5-7]。目前,在这两个生物灭绝事件之间大约八百万年间,其环境变化的研究相对较少[8]。大部分的研究主要集中在二叠纪—三叠纪过渡期以及早三叠世的古环境变化特征及其与生物灭绝、复苏的关系[9-11],以及瓜德鲁普—乐平世过渡期古环境变化与生物灭绝事件方面[12-14]。距离二叠纪末大规模灭绝之前几百万年有可能已经发生过海洋缺氧事件[15]。部分学者研究表明在二叠末生物大灭绝之前的长兴早中期就已经发生了剧烈的环境变化[8, 16-17]。Isozaki[18]甚至认为二叠纪末期古海洋超级缺氧事件实际上从晚二叠世初期就已经开始孕育了。然而,中二叠世末期至晚二叠世末期大约八百万年期间古海洋的氧化还原条件尚未清楚,吴家坪晚期海洋缺氧事件[19]的区域性或全球性属性判断还需要更多的证据。本文研究以湖北秭归县杨林剖面为研究对象,通过分析吴家坪组至长兴组硅质石灰岩的黄铁矿形态及粒径特征,重建了吴家坪晚期至长兴早期古海洋的氧化还原条件演变历史,并讨论了古海洋条件变化对晚二叠世生物大灭绝的潜在影响。
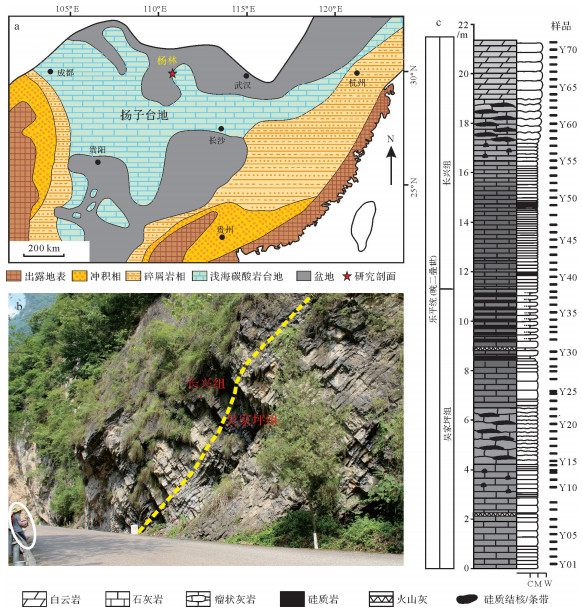
1 地质背景研究区杨林剖面(30°7′60″ N,110°78′2″ E)位于湖北省西部宜昌市秭归县杨林镇鱼泉洞S255省道旁。在古地理位置上,研究区属于扬子台地北缘,位于赤道附近(图 1a)。在二叠纪,扬子台地在稳定的持续沉降构造背景下沉积了大套碳酸盐岩[20-21]。晩二叠世时期,华南板块形成了位于古特提斯大洋中的一个巨型台地。杨林地区在晚二叠世位于鄂西盆地的斜坡上,属于半深水沉积环境。
|
| 图 1 研究剖面地质背景 (a)研究区古地理图及研究区位置(据文献[21]);(b)研究剖面野外露头;(c)研究区地层岩性特征。C.硅质岩;M.泥晶灰岩;W.粒泥灰岩 Fig.1 Geological setting of study section (a) Late Permian paleogeography of South China and location of the studied section (after reference [21]); (b) outcrop section at Yanglin; (c) lithological log of the studied strata. C = chert; M = lime mudstone; W= wackestone |
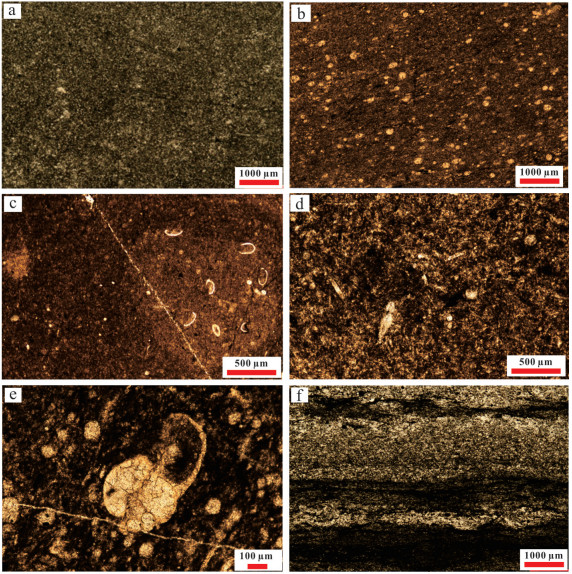
杨林剖面完整出露上二叠统吴家坪组和长兴组(图 1b)。吴家坪组主要发育灰至深灰色石灰岩,而长兴组为灰色石灰岩。本次研究目的层为吴家坪组上部以及长兴组下部地层。吴家坪组从下至上由中—厚层状硅质泥晶灰岩、颗粒质泥晶灰岩逐渐变为薄层状石灰岩与硅质岩互层(图 1c),并且水平层理发育。长兴组从下至上由薄层泥晶灰岩逐渐变为厚层状生物碎屑石灰岩、瘤状灰岩。显微镜下研究地层中泥晶灰岩未见生物碎屑(图 2a),而硅质泥晶灰岩含放射虫(图 2b),偶尔见到生物扰动(图 2c)。硅质含量较高时,硅质灰岩富含硅质海绵骨针、菊石、放射虫(图 2d,e)。吴家坪与长兴组界线处的泥晶灰岩普遍发育水平纹层(图 2f)。吴家坪组与长兴组的界线出现在薄层硅质岩与石灰岩互层向纯石灰岩过渡地层,也即含硅质岩层向石灰岩层过渡的界线。与研究剖面距离约150 km的恩施甘溪剖面吴家坪阶与长兴阶界线也出现在黑色硅质岩向灰色石灰岩过渡阶段[22],可能说明本次研究剖面吴家坪—长兴组界线距离吴家坪阶—长兴阶界线较近。
|
| 图 2 杨林剖面吴家坪组—长兴组石灰岩显微镜下岩相特征 (a)泥晶石灰岩;(b)含放射虫的颗粒质泥晶石灰岩;(c)含生物扰动泥晶石灰岩;(d)含硅质海绵骨针的硅质石灰岩;(e)硅质灰岩中的菊石与放射虫;(f)富含水平纹层的泥晶灰岩 Fig.2 Lithofacies characteristics of Wujiaping and Changxing Formations at Yanglin section |
野外系统采集样品,避开风化、重结晶和矿脉发育的岩石,采集新鲜且质地均匀的样品,共采集样品71件。将样品制成岩石薄片,表面喷碳后在东华理工大学核资源与环境国家重点实验室使用扫描电子显微镜对薄片中黄铁矿形态进行观察,并测量草莓状黄铁矿粒径大小。实验使用的扫描电子显微镜为捷克有限公司(FEI)生产的Nova NanoSEM 450型场发射扫描电子显微镜,加速电压为50 V~30 kV,连续可调,电子束流可达200 nA。草莓状黄铁矿粒径直接在屏幕上测量,每个样品至少测量100个以上。充填草莓状黄铁矿的平均粒径仅比未充填的正常草莓状黄铁矿粒径略大,但是这个差别基本上可以忽略不计[23]。因此,充填草莓状黄铁矿的粒径大小可以较为真实的反映草莓状黄铁矿粒径变化,在进行粒径统计时也测量充填草莓状黄铁矿粒径大小。
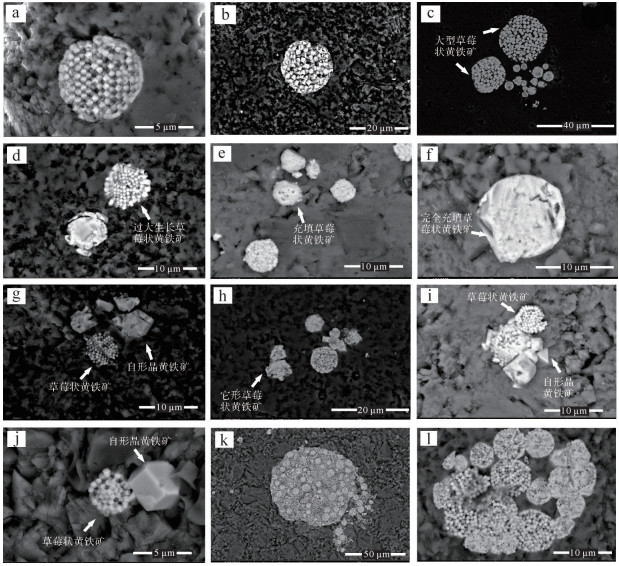
3 实验结果扫描电子显微镜下的黄铁矿形态丰富多样,主要为正常(标准)草莓状黄铁矿(图 3a~c)、过大生长草莓状黄铁矿(图 3d)、充填草莓状黄铁矿(图 3e,f)、自形晶黄铁矿(图 3g~j)以及复合草莓状黄铁矿(图 3k,l)。完全充填草莓状黄铁矿(图 3f)、部分自形晶黄铁矿(图 3g)和它形晶黄铁矿(图 3h)内部存在残余孔洞。这些内部残余的小孔洞可能说明草莓状黄铁矿可以演化成为部分充填草莓状黄铁矿、完全充填草莓状黄铁矿、它形晶草莓状黄铁矿,甚至自形晶黄铁矿。大型草莓状黄铁矿(大于10 μm)与小型草莓状黄铁矿相伴而生。复合草莓状黄铁矿一般由多个正常草莓状黄铁矿聚合在一起而形成(图 3l)。一些复合草莓状黄铁矿内部还存在松散的黄铁矿微晶(图 3k)。样品中黄铁矿的形态主要以正常草莓状黄铁矿以及充填草莓状黄铁矿为主。杨林剖面草莓状黄铁矿粒径最小值分布范围是1~5 μm,平均为2 μm,样品间变化不大(表 1);粒径平均值分布范围是5~9 μm,平均为6.6 μm,样品间变化较大。草莓状黄铁矿粒径最大值分布范围是10~40 μm,平均为20 μm。在垂向上,吴家坪组中下部石灰岩的草莓状黄铁矿粒径比较大,而在吴家坪组上部和长兴组下部的薄层硅质岩和硅质石灰岩中草莓状黄铁矿粒径较小(图 4)。在长兴组中部的瘤状石灰岩基本上不含草莓状黄铁矿。
|
| 图 3 秭归杨林剖面吴家坪组和长兴组黄铁矿扫描电子显微相片 (a)正常草莓状黄铁矿,微晶之间孔隙明显;(b)沉积碎屑被草莓状黄铁矿包裹;(c)黄铁矿;(d)过大生长草莓状黄铁矿,在最外层的结构中显示为较大的微晶;(e)充填草莓状黄铁矿;(f)充填草莓状黄铁矿显示有残余孔隙,能反映草莓状黄铁矿的生长起源;(g)草莓状黄铁矿与自形晶黄铁矿;(h)它形晶草莓状黄铁矿与正常黄铁矿并存;(i)草莓状黄铁矿与自形晶黄铁矿;(j)草莓状黄铁矿与自行晶黄铁矿;(k)复合草莓状黄铁矿;(l)复合草莓状黄铁矿 Fig.3 Pyrite SEM images (backscatter mode) in the Wujiaping and Changxing Formations at Yanglin section, South China |
| 地层组 | 样品 | 均值/μm | 标准偏差/μm | 偏度 | 最大值/μm | 数量/个 | 解释 |
| 长兴组 | Y54 | 6.3 | 2.0 | 1.1 | 12.5 | 76 | 贫氧—氧化 |
| 长兴组 | Y52 | 6.4 | 2.3 | 1.0 | 14.7 | 129 | 贫氧—氧化 |
| 长兴组 | Y51 | 5.4 | 2.2 | 1.5 | 14.0 | 116 | 硫化 |
| 长兴组 | Y50 | 5.4 | 2.3 | 1.9 | 17.2 | 126 | 贫氧—氧化 |
| 长兴组 | Y49 | 5.7 | 2.2 | 1.1 | 13.4 | 122 | 贫氧—氧化 |
| 长兴组 | Y48 | 4.2 | 1.7 | 1.4 | 10.4 | 154 | 硫化 |
| 长兴组 | Y47 | 5.0 | 2.6 | 1.6 | 16.1 | 135 | 贫氧—氧化 |
| 长兴组 | Y46 | 6.5 | 2.5 | 1.3 | 16.7 | 130 | 贫氧—氧化 |
| 长兴组 | Y45 | 5.0 | 1.9 | 1.1 | 12.8 | 122 | 硫化 |
| 长兴组 | Y44 | 7.2 | 2.4 | 0.7 | 13.8 | 79 | 贫氧—氧化 |
| 长兴组 | Y43 | 6.5 | 3.4 | 1.2 | 19.1 | 125 | 贫氧—氧化 |
| 长兴组 | Y42 | 4.4 | 2.4 | 2.8 | 18.2 | 173 | 硫化 |
| 长兴组 | Y41 | 5.5 | 3.2 | 2.0 | 19.8 | 151 | 贫氧—氧化 |
| 长兴组 | Y40 | 5.4 | 2.5 | 1.5 | 17.2 | 118 | 贫氧—氧化 |
| 长兴组 | Y39 | 5.2 | 2.2 | 2.0 | 17.9 | 143 | 硫化 |
| 吴家坪组 | Y38 | 6.1 | 2.8 | 1.0 | 15.6 | 149 | 贫氧—氧化 |
| 吴家坪组 | Y37 | 6.4 | 2.5 | 1.5 | 18.6 | 124 | 贫氧—氧化 |
| 吴家坪组 | Y36 | 5.4 | 2.2 | 1.9 | 17.5 | 118 | 贫氧—氧化 |
| 吴家坪组 | Y35 | 5.3 | 2.1 | 0.9 | 12.5 | 106 | 硫化 |
| 吴家坪组 | Y34 | 4.4 | 2.4 | 2.2 | 15.2 | 149 | 硫化 |
| 吴家坪组 | Y33 | 6.4 | 2.6 | 1.1 | 17.3 | 143 | 贫氧—氧化 |
| 吴家坪组 | Y32 | 9.0 | 3.3 | 0.9 | 18.5 | 99 | 贫氧—氧化 |
| 吴家坪组 | Y31 | 6.6 | 3.0 | 2.4 | 26.3 | 148 | 贫氧—氧化 |
| 吴家坪组 | Y30 | 6.7 | 3.0 | 1.3 | 19.5 | 286 | 贫氧—氧化 |
| 吴家坪组 | Y29 | 5.8 | 2.4 | 1.1 | 13.4 | 149 | 贫氧—氧化 |
| 吴家坪组 | Y28 | 6.0 | 2.0 | 1.1 | 13.4 | 109 | 贫氧—氧化 |
| 吴家坪组 | Y27 | 6.6 | 2.3 | 1.3 | 16.2 | 127 | 贫氧—氧化 |
| 吴家坪组 | Y26 | 6.3 | 3.2 | 1.6 | 18.0 | 167 | 贫氧—氧化 |
| 吴家坪组 | Y25 | 6.7 | 3.6 | 2.5 | 27.1 | 231 | 贫氧—氧化 |
| 吴家坪组 | Y24 | 6.8 | 3.9 | 2.0 | 23.8 | 169 | 贫氧—氧化 |
| 吴家坪组 | Y23 | 6.0 | 2.8 | 1.8 | 19.8 | 138 | 贫氧—氧化 |
| 吴家坪组 | Y22 | 5.8 | 2.2 | 2.5 | 19.6 | 125 | 贫氧—氧化 |
| 吴家坪组 | Y21 | 6.4 | 2.6 | 2.3 | 20.8 | 131 | 贫氧—氧化 |
| 吴家坪组 | Y20 | 7.1 | 4.5 | 4.0 | 39.3 | 123 | 贫氧—氧化 |
| 吴家坪组 | Y19 | 7.4 | 3.4 | 1.5 | 21.8 | 146 | 贫氧—氧化 |
| 吴家坪组 | Y18 | 7.4 | 4.0 | 2.0 | 28.9 | 158 | 贫氧—氧化 |
| 吴家坪组 | Y17 | 7.8 | 3.1 | 1.4 | 23.2 | 119 | 贫氧—氧化 |
| 吴家坪组 | Y16 | 7.8 | 3.3 | 2.1 | 21.6 | 68 | 贫氧—氧化 |
| 吴家坪组 | Y15 | 8.7 | 3.9 | 1.6 | 23.8 | 94 | 贫氧—氧化 |
| 吴家坪组 | Y14 | 6.5 | 2.4 | 1.1 | 14.9 | 122 | 贫氧—氧化 |
| 吴家坪组 | Y13 | 7.0 | 2.8 | 0.8 | 15.4 | 164 | 贫氧—氧化 |
| 吴家坪组 | Y12 | 8.1 | 3.9 | 1.9 | 27.3 | 132 | 贫氧—氧化 |
| 吴家坪组 | Y11 | 6.9 | 3.1 | 1.6 | 18.8 | 106 | 贫氧—氧化 |
| 吴家坪组 | Y10 | 7.5 | 3.3 | 2.3 | 25.1 | 114 | 贫氧—氧化 |
| 吴家坪组 | Y09 | 7.2 | 2.7 | 1.1 | 18.8 | 140 | 贫氧—氧化 |
| 吴家坪组 | Y08 | 7.8 | 4.4 | 3.0 | 36.0 | 179 | 贫氧—氧化 |
| 吴家坪组 | Y07 | 6.7 | 2.8 | 1.9 | 20.6 | 132 | 贫氧—氧化 |
| 吴家坪组 | Y06 | 8.1 | 4.3 | 1.8 | 27.7 | 199 | 贫氧—氧化 |
| 吴家坪组 | Y05 | 7.3 | 3.9 | 1.8 | 21.5 | 92 | 贫氧—氧化 |
| 吴家坪组 | Y04 | 7.6 | 4.0 | 2.0 | 22.2 | 117 | 贫氧—氧化 |
| 吴家坪组 | Y03 | 7.9 | 4.5 | 1.9 | 32.4 | 132 | 贫氧—氧化 |
| 吴家坪组 | Y02 | 8.2 | 4.4 | 2.3 | 29.1 | 155 | 贫氧—氧化 |
| 吴家坪组 | Y01 | 8.2 | 3.0 | 1.0 | 17.8 | 144 | 贫氧—氧化 |
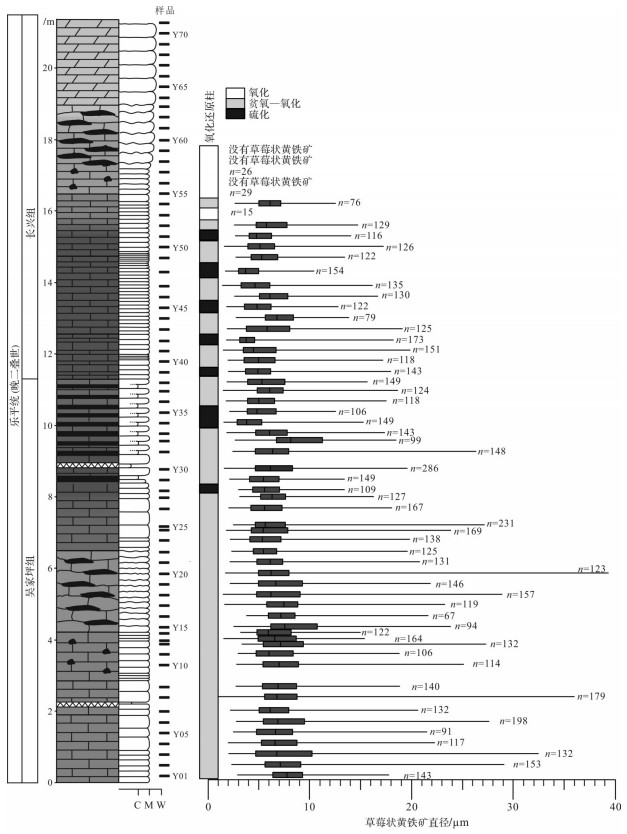
|
| 图 4 杨林剖面吴家坪—长兴组草莓状黄铁矿粒径分布盒须图 盒须图中的盒子范围为25%到75%,两侧的须分别为最小值和最大值,氧化还原柱是根据图 5的结果划分 Fig.4 Pyrite framboid size distribution in the Wujiaping and the Changxing Formations at Yanglin section, South China In the box-and-whisker plots, the boxes range from 25% to 75% and contain 50% of the data. The two ends of the horizontal lines represent minimum and maximum values, the redox column is according to Fig. 5 |
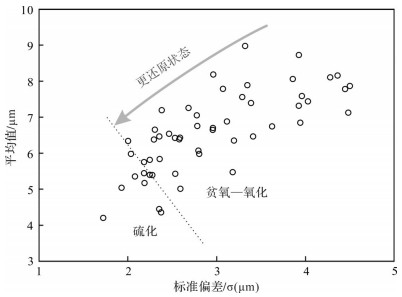
草莓状黄铁矿形成后,在埋藏过程中并没有继续生长变大,其直径大小在地质埋藏与后期风化过程中可以得到很好的保存[24]。草莓状黄铁矿粒径被广泛用于约束古沉积水体的氧化还原条件[25-31]。其基本原理为:草莓状黄铁矿的粒径(直径)与其在氧化还原界面附近生长时间的长短和生长速率有关[24]。在硫化环境中草莓状黄铁矿生长于水体中,达到一定重量会下沉而脱离适合其生长的环境,生长时间短且生长速率快。而在非硫化环境中草莓状黄铁矿形成于沉积物中,生长时间较长。因此,硫化环境中形成的草莓状黄铁矿粒径均匀且直径小(5.0±1.7 μm);而非硫化环境中粒径变化大且直径大(7.7±4.1 μm)[24, 32]。其中,大于10 μm的草莓状黄铁矿一般形成于早期成岩的沉积物中[24, 33]。通过大量统计每个样品的草莓状黄铁矿直径分布特征,分析平均值及标准偏差,进而判断古沉积水体是氧化—贫氧还是硫化环境[24]。
研究层段长兴组上部地层中不含草莓状黄铁矿,说明其古沉积水体可能是氧化环境。大型草莓状黄铁矿以及复合草莓状黄铁矿在研究地层某个层段的出现表明其为成岩黄铁矿成因,也即古沉积水体为非硫化环境。同生草莓状黄铁矿粒径一般具有较小的平均值以及较小的标准偏差,以此与成岩草莓状黄铁矿相区分[30]。因此,利用草莓状黄铁矿粒径标准偏差交汇图可以评估古沉积水体的氧化还原状态。草莓状黄铁矿粒径标准偏差与平均值的交汇图(图 5)表明大部分样品分布在贫氧—氧化的范围中,部分样品落在指示硫化区域范围内,说明研究层位沉积时期主要为氧化—贫氧环境,间歇性发育硫化环境。水平层理、微纹层沉积构造的出现(图 2f)也证实了这种强还原环境的存在,因为微纹层一般指示缺少生物扰动的沉积特征。
将黄铁矿粒径与标准偏差交汇图以及草莓状黄铁矿粒径图结合起来进行综合解释(表 1)。数据分布规律表明,吴家坪组中下部草莓状黄铁矿指示为贫氧—氧化环境,而自吴家坪组上部至长兴组下部地层,开始间歇性出现硫化环境,至长兴组中部则又恢复为贫氧—氧化环境。这说明在吴家坪组—长兴组过渡时期,古海水中发育了极端还原环境,底部水体中富含硫化氢,构成古海水水柱硫化事件。从总体上讲,由吴家坪至长兴组底部,草莓状黄铁矿粒径逐渐减小,说明在吴家坪晚期至长兴早期转变时期古海水水体逐渐趋向还原。
4.2 吴家坪—长兴阶过渡时期古海洋缺氧的全球性及意义秭归地区吴家坪—长兴组过渡时期出现的古海水水柱硫化事件是否全球性还需要对比分析其他地区同时期海水氧化还原条件。通过对比全球其他研究剖面发现,同在鄂西盆地的甘溪剖面铁组数据表明吴家坪晚期存在硫化缺氧事件[34]。同时恩施赵家坝剖面铁组份和分子标志物数据同样表明吴家坪组晚期存在缺氧事件[35]。在扬子台地南部的南盘江盆地来宾铁桥剖面的遗迹化石数据也指示在吴家坪—长兴期过渡时期存在缺氧事件[19]。阿拉伯地台研究剖面的吴家坪—长兴期过渡时期也出现了缺氧事件[36]。与此同时,东格林兰盆地草莓状黄铁矿粒径也证实了吴家坪晚期至长兴早期浅海陆棚环境上发生间歇性缺氧或硫化事件[37]。这些研究表明,吴家坪组—长兴组过渡时期的硫化缺氧事件可能不仅仅是一次区域性的缺氧事件,有可能是一次全球性的海洋缺氧事件。该事件可能与之后的二叠纪末事件有一定的关联。Burgess et al.[38]认为西伯利亚火山在二叠纪末之前的数百万年前就已经开始活跃,可能已经引发了一些古环境条件的异常。随着西伯利亚火山主幕喷发在二叠纪—三叠纪之交的发生,这些异常事件持续性地积累或者间歇性的恶化,是导致生物大灭绝事件发生的可能机制。
5 结论吴家坪组与长兴组石灰岩沉积时期古海水主要为贫氧至氧化环境。吴家坪组上部与长兴组下部地层沉积时期古水体出现间歇性硫化现象。该间歇性硫化缺氧事件不仅在秭归地区出现,还广泛分布于鄂西盆地、扬子台地南缘南盘江盆地、阿拉伯地台以及东格陵兰盆地地区。这些说明吴家坪—长兴组界线沉积时期的间歇性硫化缺氧事件可能是一个全球性事件。该事件可能与之后的二叠纪末事件有一定的关联。
| [1] |
Raup D M. Size of the Permo-Triassic bottleneck and its evolutionary implications[J]. Science, 1979, 206(4415): 217-218. doi: 10.1126/science.206.4415.217 |
| [2] |
Jin Y G, Shen S Z, Henderson C M, et al. The Global Stratotype Section and Point (GSSP) for the boundary between the Capitanian and Wuchiapingian Stage (Permian)[J]. Episodes, 2006, 29(4): 253-262. doi: 10.18814/epiiugs/2006/v29i4/003 |
| [3] |
Clapham M E, Shen S Z, Bottjer D J. The double mass extinction revisited: Reassessing the severity, selectivity, and causes of the end-Guadalupian biotic crisis (Late Permian)[J]. Paleobiology, 2009, 35(1): 32-50. doi: 10.1666/08033.1 |
| [4] |
Shen S Z, Shi G R. Latest Guadalupian brachiopods from the Guadalupian/Lopingian boundary GSSP section at Penglaitan in Laibin, Guangxi, South China and implications for the timing of the pre-Lopingian crisis[J]. Palaeoworld, 2009, 18(2/3): 152-161. |
| [5] |
Jin Y G, Wang Y, Wang W, et al. Pattern of marine mass extinction near the Permian-Triassic boundary in South China[J]. Science, 2000, 289(5478): 432-436. doi: 10.1126/science.289.5478.432 |
| [6] |
Yin H F, Zhang K X, Tong J N, et al. The Global Stratotype Section and Point (GSSP) of the Permian-Triassic boundary[J]. Episodes, 2001, 24(2): 102-114. doi: 10.18814/epiiugs/2001/v24i2/004 |
| [7] |
Shen S Z, Crowley J L, Wan Y, et al. Calibrating the end-Permian mass extinction[J]. Science, 2011, 334(6061): 1367-1372. doi: 10.1126/science.1213454 |
| [8] |
Stebbins A, Williams J, Brookfield M, et al. Frequent euxinia in southern Neo-Tethys Ocean prior to the end-Permian biocrisis: Evidence from the Spiti region, India[J]. Palaeogeography, Palaeoclimatology, Palaeoecology, 2019(516): 1-10. |
| [9] |
Korte C, Kozur H W. Carbon-isotope stratigraphy across the Permian–Triassic boundary: A review[J]. Journal of Asian Earth Sciences, 2010, 39(4): 215-235. |
| [10] |
Yin H F, Xie S C, Luo G M, et al. Two episodes of environmental change at the Permian–Triassic boundary of the GSSP section Meishan[J]. Earth-Science Reviews, 2012, 115(3): 163-172. doi: 10.1016/j.earscirev.2012.08.006 |
| [11] |
Shen S Z, Bowring S A. The end-Permian mass extinction: A still unexplained catastrophe[J]. National Science Review, 2014, 1(4): 492-495. doi: 10.1093/nsr/nwu047 |
| [12] |
Wignall P B, Sun Y D, Bond D P G, et al. Volcanism, mass extinction, and carbon isotope fluctuations in the Middle Permian of China[J]. Science, 2009, 324(5931): 1179-1182. doi: 10.1126/science.1171956 |
| [13] |
Bond D P G, Hilton J, Wignall P B, et al. The Middle Permian (Capitanian) mass extinction on land and in the oceans[J]. Earth-Science Reviews, 2010, 102(1/2): 100-116. |
| [14] |
Wei H Y, Wei X M, Qiu Z, et al. Redox conditions across the G-L boundary in South China: Evidence from pyrite morphology and sulfur isotopic compositions[J]. Chemical Geology, 2016(440): 1-14. |
| [15] |
Brennecka G A, Herrmann A D, Algeo T J, et al. Rapid expansion of oceanic anoxia immediately before the end-Permian mass extinction[J]. Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(43): 17631-17634. doi: 10.1073/pnas.1106039108 |
| [16] |
Cao C Q, Love G D, Hays L E, et al. Biogeochemical evidence for euxinic oceans and ecological disturbance presaging the end-Permian Mass Extinction Event[J]. Earth and Planetary Science Letters, 2009, 281(3/4): 188-201. |
| [17] |
Wei H Y, Algeo T J, Yu H, et al. Episodic euxinia in the Changhsingian (Late Permian) of South China: Evidence from framboidal pyrite and geochemical data[J]. Sedimentary Geology, 2015(319): 78-97. |
| [18] |
Isozaki Y. Permo-Triassic boundary superanoxia and stratified superocean: Records from lost deep sea[J]. Science, 1997, 276(5310): 235-238. doi: 10.1126/science.276.5310.235 |
| [19] |
Ding Y, Cao C Q, Zheng Q F. Lopingian (Upper Permian) trace fossils from the northern Penglaitan Section, Laibin, Guangxi, South China and their environmental implications[J]. Palaeoworld, 2016, 25(3): 377-387. doi: 10.1016/j.palwor.2015.11.012 |
| [20] |
万秋, 李双应, 丁宁, 等. 湖北秭归兴滩二叠系沉积及演化特征[J]. 安徽地质, 2011, 21(1): 14-18. [Wan Qiu, Li Shuang-ying, Ding Ning, et al. Permian deposits and their evolutional features in Xingtan, Zigui, Hubei[J]. Geology of Anhui, 2011, 21(1): 14-18. doi: 10.3969/j.issn.1005-6157.2011.01.003] |
| [21] |
Yin H F, Jiang H S, Xia W C, et al. The end-Permian regression in South China and its implication on mass extinction[J]. Earth-Science Reviews, 2014(137): 19-33. |
| [22] |
Nafi M, Xia W C, Zhang N. Late Permian (Changhsingian) conodont biozonation and the basal boundary, Ganxi section, western Hubei province, South China[J]. Canadian Journal of Earth Sciences, 2006, 43(2): 121-133. |
| [23] |
Wang L, Shi X Y, Jiang G Q. Pyrite morphology and redox fluctuations recorded in the Ediacaran Doushantuo Formation[J]. Palaeogeography, Palaeoclimatology, Palaeoecology, 2012, 333-334: 218-227. doi: 10.1016/j.palaeo.2012.03.033 |
| [24] |
Wilkin R T, Barnes H L, Brantley S L. The size distribution of framboidal pyrite in modern sediments: An indicator of redox conditions[J]. Geochimica et Cosmochimica Acta, 1996, 60(20): 3897-3912. doi: 10.1016/0016-7037(96)00209-8 |
| [25] |
Wilkin R T, Barnes H L. Formation processes of framboidal pyrite[J]. Geochimica et Cosmochimica Acta, 1997, 61(2): 323-339. doi: 10.1016/S0016-7037(96)00320-1 |
| [26] |
Wilkin R T, Arthur M A. Variations in pyrite texture, sulfur isotope composition, and iron systematics in the Black Sea: Evidence for Late Pleistocene to Holocene excursions of the O2-H2S redox transition[J]. Geochimica et Cosmochimica Acta, 2001, 65(9): 1399-1416. doi: 10.1016/S0016-7037(01)00552-X |
| [27] |
Bond D, Wignall P B, Racki G. Extent and duration of marine anoxia during the Frasnian-Famennian (Late Devonian) mass extinction in Poland, Germany, Austria and France[J]. Geological Magazine, 2004, 141(2): 173-193. doi: 10.1017/S0016756804008866 |
| [28] |
Wei H Y, Chen D Z, Wang J G, et al. Organic accumulation in the Lower Chihsia Formation (Middle Permian) of South China: Constraints from pyrite morphology and multiple geochemical proxies[J]. Palaeogeography, Palaeoclimatology, Palaeoecology, 2012, 353-355: 73-86. doi: 10.1016/j.palaeo.2012.07.005 |
| [29] |
Wei H Y, Tang Z W, Yan D T, et al. Guadalupian (Middle Permian) ocean redox evolution in South China and its implications for mass extinction[J]. Chemical Geology, 2019, 530: 119318. doi: 10.1016/j.chemgeo.2019.119318 |
| [30] |
Wignall P B, Bond D P G, Sun Y D, et al. Ultra-shallow-marine anoxia in an Early Triassic shallow-marine clastic ramp (Spitsbergen) and the suppression of benthic radiation[J]. Geological Magazine, 2016, 153(2): 316-331. doi: 10.1017/S0016756815000588 |
| [31] |
Huang Y G, Chen Z Q, Wignall P B, et al. Latest Permian to Middle Triassic redox condition variations in ramp settings, South China: Pyrite framboid evidence[J]. Geological Society of America Bulletin, 2017, 129(1/2): 229-243. |
| [32] |
Wignall P B, Newton R. Pyrite framboid diameter as a measure of oxygen deficiency in ancient mudrocks[J]. American Journal of Science, 1998, 298(7): 537-552. doi: 10.2475/ajs.298.7.537 |
| [33] |
Lash G G, Blood D R. Organic matter accumulation, redox, and diagenetic history of the Marcellus Formation, southwestern Pennsylvania, Appalachian basin[J]. Marine and Petroleum Geology, 2014(57): 244-263. |
| [34] |
Lei L D, Shen J, Li C, et al. Controls on regional marine redox evolution during Permian-Triassic transition in South China[J]. Palaeogeography, Palaeoclimatology, Palaeoecology, 2017(486): 17-32. |
| [35] |
Wei H Y, Yu H, Wang J G, et al. Carbon isotopic shift and its cause at the Wuchiapingian-Changhsingian boundary in the Upper Permian at the Zhaojiaba section, South China: Evidences from multiple geochemical proxies[J]. Journal of Asian Earth Sciences, 2015(105): 270-285. |
| [36] |
Clarkson M O, Wood R A, Poulton S W, et al. Dynamic anoxic ferruginous conditions during the end-Permian mass extinction and recovery[J]. Nature Communications, 2016(7): 12236. |
| [37] |
Nielsen J K, Shen Y N. Evidence for sulfidic deep water during the Late Permian in the East Greenland Basin[J]. Geology, 2004, 32(12): 1037-1040. doi: 10.1130/G20987.1 |
| [38] |
Burgess S D, Muirhead J D, Bowring S A. Initial pulse of Siberian Traps sills as the trigger of the end-Permian mass extinction[J]. Nature Communications, 2017(8): 164. |
 2020, Vol. 38
2020, Vol. 38