扩展功能
文章信息
- 惠荣耀, 丁安娜
- HUI RongYao, DING AnNa
- 微生物在石油生成中的作用(二)——氢代谢及多源输入
- Role of Microorganisms in Oil Generation(Ⅱ): Hydrogen metabolism and organic matter input from many origins
- 沉积学报, 2018, 36(5): 1023-1031
- ACTA SEDIMENTOLOGICA SINCA, 2018, 36(5): 1023-1031
- 10.14027/j.issn.1000-0550.2018.071
-
文章历史
- 收稿日期:2017-02-28
- 收修改稿日期: 2018-04-20
在厌氧环境中,各种不同的微生物群体将来源于动、植物的有机质水解为蛋白质、脂肪、纤维素、半纤维素、果胶等大分子物质,并进一步降解成中、低分子量的化合物。在除去含氧官能团、产氢、耗氢、有机物重新组合后,形成了大量的石油烃类[1]。酶是一种具有催化活性的蛋白质,具有高度的专一性。温度压力增加,有机组份的更替,影响着厌氧微生物的生长和消亡。新的微生物群及其酶系统生成,原来的微生物及酶组分可作为母源输入,使石油的生成具有多种途径,多元生成的特征。
产氢菌的发现是近代微生物学的一大重要进展,地质环境中的氢代谢(H2的生成和利用)是微生物降解有机质形成各种低分子烃类的中心环节。氢是石油生成中不可缺少的中间体,是厌氧环境中生化活性的调节者,氢代谢快,石油生成也快,氢代谢使石油生成过程可以活跃地进行,氢循环与碳循环紧密相关,有机物的氧化还原反应都需要氢的参与,在有机质厌氧降解过程中,氢是重要的主产物及中间产物,没有氢代谢便没有大量石油饱和烃的生成[2]。
1 厌氧环境中氢的生成有机物向石油转化的许多中间产物是缺氢的,如大分子化合物分解为小分子化合物便缺氢,脱去含氧基团也缺氢,烯烃成为饱和烃需要补充氢等。各种有机物中的碳水化合物、脂肪酸、氨基酸等在降解中都有H2的生成,这些氢将由其他非产氢微生物通过氢酶系统消耗,这两类反应之间的氢转移是厌氧降解有机质区别于有氧降解有机质的最重要特征。
厌氧环境中存在多种类型的产氢菌,它们能通过发酵作用,在逐步分解有机物的过程中产生分子氢,表 1[3-4]所列出的产氢发酵细菌是具有代表性的菌属。氢细菌是一些革兰式阴性的自养菌,能利用有机物生长,氢细菌的细胞膜上有泛醌、维生素K2及细胞色素等呼吸链组分。有机物厌氧发酵产氢具有高产率、可利用多种底物的能力。
| 微生物名称 | 微生物名称 |
| Rhodopseudomonas sphaeroides | E.cloacae |
| H2-producing acidogens | Clostridiumbutyricum |
| R.palustris | C.pasteurianum |
| R.capsulata | Desulfovibrio vulgaris |
| Rhodospirillum rubnum | Magashaera elsdenii |
| Chromatium sp. Miami PSB 1071 | Citrobacter intermedius |
| Chlorobium limicola | Escherichia coli |
| Chloroexu aurantiacus | Methylotrophs |
| Thiocapsa roseopersicina | Methanogenic bacteria |
| Halobacterium halobium | Archaea |
| Enterobacteraerogenes | Pyrococcus fusiosus |
| Syntrophomonas wolfei | Syntrophobacter wolinii |
微生物产氢存在多种途径,其共同特点在于利用体内氢酶进行有机物还原分解,同时产生氢气,以维持体内氧化还原代谢的平衡。
根据微生物的种属不同,存在多种不同的产氢机制,如短链脂肪酸,通过形成丙酮酸和乙酸的发酵作用而形成氢,厌氧微生物产氢菌大致可以分成以下几种类型:
(1) 产氢产乙酸细菌(H2-producing acidogens)能将发酵中产生的丙酸、丁酸、戊酸、乳酸、乙醇等进一步转化为乙酸,同时产生氢气。这类细菌为严格厌氧菌,目前仅有少数被分离,相关菌株及其产氢反应列于表 2[5-7]。
(2) 梭菌(Clostridia),通过葡萄糖的酵解产氢,其反应式为:
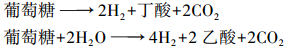
发酵过程中产生的丁酸和乙酸的比例决定了从葡萄糖发酵产H2的量。
(3) 甲基营养型细菌(Methylotrophs),可以从甲烷产生H2。
(4) 产甲烷细菌(Methanogenic bacteria),有的产甲烷菌能降解甲酸形成CO2和H2。
(5) 纤维素厌氧菌,它通过分解碳水化合物生成乙酸、乙醇、甲酸、H2和CO2。
(6) 古细菌(Archaea),嗜热古细菌中的激烈热球菌(Pyrococcus fusiasus)含有一种可溶性的含镍氢酶,能利用碳水化合物和蛋白质生成H2。
各种H2的生成和利用都是在氢酶的催化下进行的,有机物结构上的含氢量能活跃地进行循环。厌氧细菌的氢酶可在细胞质中,也可在膜上或周质中,从酶蛋白的活性中心金属出发,氢酶有镍氢酶、镍铁氢酶、铁氢酶和无金属氢酶。
大多数氢酶对一定范围的高温能保持其稳定性,如深红红螺菌(Rhodospirillum rubrum)的氢酶在实验条件下55 ℃时可持续放H2在1小时以上,79 ℃时仍可持续放H2,显示高温条件下具有相当大的稳定性。
2 厌氧环境中的氢代谢形成饱和烃类厌氧环境中的H2代谢是降解各种有机物生成低碳有机物和烃类的重要步骤,是微生物的特殊功能。若环境中羟基、羧基、羰基等含氧基团存在时,将利用氢形成低碳化合物,这些反应是耗氢反应,使环境中的H2保持在某一水平之下,从而促进生氢反应的进行。
厌氧微生物对有机质降解过程中的氢化反应十分活跃,它可以形成向石油转化的中间产物,对石油的形成具有重要意义。例如长链脂肪酸、脱羧基加氢而成为正构烷烃,氨基酸氢化脱氨,一碳酸、醛、醇氢化为烷烃。其他以氢为能源推动的反应有脱硫孤菌等硫酸盐还原菌,以氢还原硫酸盐为硫化氢,产甲烷菌以H2还原CO2形成甲烷,弯曲杆菌等以H2还原元素硫为硫化氢,硝酸盐还原菌以H2还原硝酸盐为亚硝酸盐。微生物利用H2作为还原剂,并在氢的氧化中获取能源。绝大多数氢化反应是放能的,因此氢化反应在热动力学上是易于进行的,氢化反应在生油过程中也易于发生。
厌氧环境中,一部分微生物在降解有机物的过程中大量地形成H2,另一部分微生物利用这些H2进行生命活动,使沉积环境中的氢难以积聚和检测到。前者称为产氢微生物,后者称耗氢微生物,产氢耗氢一直处于一种稳定的动态平衡。这种不同种之间氢的生成和利用的偶联现象称为种间氢转移。产氢微生物只有在耗氢微生物存在下才能生长,耗氢微生物的耗氢作用将促进产氢反应的连续进行,产氢微生物与耗氢微生物之间的生长联合称为微生物的互营联合,这种种间氢转移不仅发生在对有机质大分子的降解阶段,也发生在短链酸、醇的产氢用氢油气形成的各个阶段。
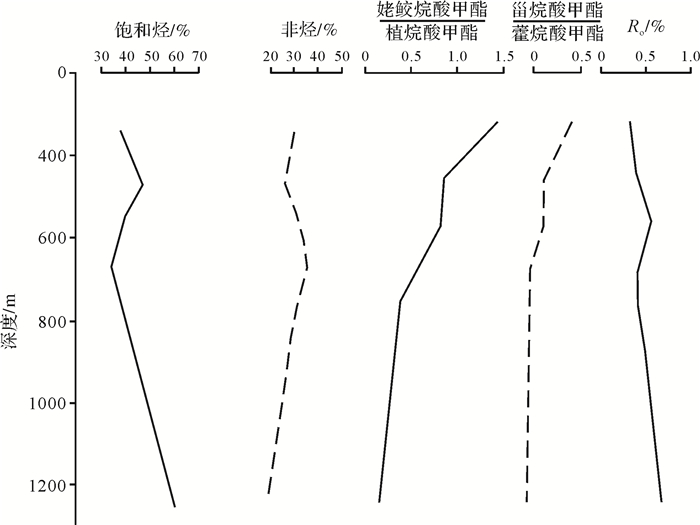
从松辽盆地滨北地区西部斜坡带源岩中的含氧化合物变化来看,随深度增加,样品抽提物中饱和烃含量增加,非烃含量减小(图 1)[8],说明样品中不断发生去含氧官能团和产氢用氢反应,从而形成了大量的饱和烃。
微生物生长繁殖受温度、营养及沉积环境的影响,每一种微生物种群只能在一定温度范围内存活,一般最大为40 ℃,有的菌种生存温度范围不到十度,大于最高温度便会死亡。微生物也会相互竞争,营养的改变也影响着菌体的发育,因此从浅层至深层,微生物菌种是不断更替的,原有的菌种因环境改变而死亡,新的菌种又会得到大量繁殖,死亡的微生物输入至沉积层便成为烃类[9]。
不少学者如彼得斯K E等[10]、盛国英等[11]、王铁冠[12]等研究了生物标志物的生源输入,认为油、岩中许多藿烷类化合物、重排甾烷、β胡萝卜烷、角鲨烷、异戊二烯类化合物等均来自细菌,其余为经过细菌改造的生物标志物(表 3)[10]。
| 类别 | 化合物 | 生物来源 | 沉积环境 |
| 2-甲基二十二烷 | 细菌? | 超盐环境 | |
| 姥/植比(低) | 自养光合古细菌 | 还原至缺氧,高盐度 | |
| 2,6,10,15,19-五甲基二十烷 | 古细菌 | 超盐环境 | |
| 微 生 物 生 源 |
β胡萝卜烷 | 细菌 | 干旱环境,超盐环境 |
| 4-甲基甾烷 | 沟鞭藻/一些细菌 | 湖相或海相 | |
| 重排甾烷 | 细菌 | 还原环境 | |
| 25,28,30-三降藿烷 | 细菌? | 缺氧的海相环境,上升海流? | |
| 28,30-二降藿烷 | 细菌? | 缺氧的海相环境,上升海流 | |
| C3517α,21β(H)-藿烷 | 细菌 | 还原到缺氧 | |
| 2-甲基藿烷 | 细菌 | 碳酸盐岩 | |
| 伽马蜡烷(Gammacerane) | 原生动物门?细菌 | 超盐环境 | |
| 六氢苯并藿烷 | 细菌 | 缺氧的碳酸盐—石膏沉积环境 | |
| 角鲨烷 | 古细菌 | 超盐环境 | |
| C31~C40头对头类异戊二烯烷烃 | 甲烷菌 | 非专属沉积环境 | |
| 芳基:类异戊二烯烷烃(1-烷基,2,3,6,三甲基苯) | 绿硫菌 | 超盐沉积环境 | |
| nC15, nC17, nC19 | 藻类 | 湖相,海相 | |
| nC15, nC17, nC19 | 粘球藻Gloeocapsamorpha prisca(?) | ~奥陶纪 | |
| nC27, nC29, nC31 | 高等植物 | 陆相 | |
| 微生物改造的生源 | nC23~nC31(奇数) | 非海相藻类 | 湖相 |
| 2,6,10-三甲基-7-(3-甲基-丁基)十二烷 | 绿藻 | 超盐环境 | |
| 丛粒藻烷 | 丛粒藻(Botryococcus branuii) | 湖相/微咸水 | |
| 16-去甲基-丛粒藻烷 | 丛粒藻(Botryococcus branuii) | 湖相/微咸水 | |
| 中等链长单甲基烷烃 | 蓝菌 | 温泉,海相 | |
| 饱和烃:C15~C23(奇数)环己基烷 | 粘球藻Gloeocapsamorpha prisca(?) | ||
| 扁枝烷 | 针叶树 | 陆相 | |
| C27~C29甾烷 | 藻(C27)藻和高等植物(C29) | 各种沉积环境 | |
| 微 生物 改 造 的 生 源 |
C3024-正丙基甾烷(4-去甲基甾烷) | 金藻 (Chrysophy- ealgae) |
海相 |
| 重排甾烯 | 藻类或高等植物 | 富含黏土矿物岩石 | |
| 甲藻甾烷(Dinosterane) | 沟鞭藻 | 海相,三叠纪或比三叠纪年轻的地质时代 | |
| 23,28-二降羽扇烷 | 高等植物? | 陆相 | |
| 4β(H)-桉叶油烷(eudesmane) | 高等植物 | 陆相 | |
| 18α(H)-奥利烷(Oleanane) | 高等植物(被子植物) | 白垩纪或比白垩纪更年轻的地质时代 | |
| 孕甾烷,升孕甾烷 | 未知 | 超盐环境 | |
| C24四环萜烷 | 未知 | 超盐环境 | |
| 降藿烷(C29藿烷) | 多种生物来源 | 碳酸盐/蒸发盐 | |
| C19~C30三环萜烷 | 塔斯玛尼亚(Tasman- nites)藻? | 非专属沉积环境 | |
| 芳烃:苯并噻吩,烷基二苯并噻吩 | 未知 | 碳酸盐/蒸发盐沉积环境 | |
| Trimethylated2-methyl-2-trimethyldecylchromans三甲基化的2-甲基-2-三甲基癸基色满 | 未知 | 咸水环境 |
根据目前的研究成果,应用分析手段,在原油中,已经区分出细菌生源和高温菌生源:
(1) 细菌生源,膜脂是由甘油和脂肪酸通过酯链结合而成的脂肪酸甘油酯,非极性链,一般是C14~C28(C15~C18占优势)的脂肪酸,常见的有以下类型:
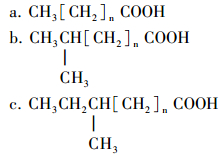
在高温菌中,发现了一些常温菌未曾有的特殊脂肪酸

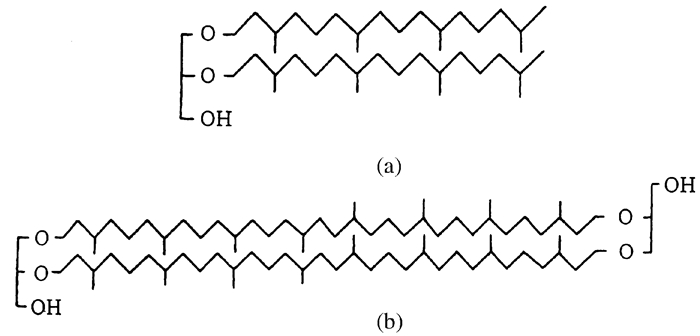
(2) 醚酯是古细菌的特有标志。C20和C40植烷醇与甘油通过醚键结合衍生出两类基本的醚,即植烷醇甘油和植烷醇甘油四醚(图 2)。
|
| 图 2 植烷醇甘油三醚(a)和二植烷醇二甘油四醚(b) Figure 2 Structures of phytanol glycerin triether(a) and diphytanol diglycerin four-ether(b) |
酶是一种具有催化活性的高分子化合物,微生物的一切生命活动都离不开酶。一种酶只能催化一种反应或一类反应的完成。微生物降解有机质形成烃类有多个途径、多个阶段,每个途径、阶段都有独特的微生物菌群,各类细菌群的有效代谢相互连贯、相互促进。成油和成气[13]都有自己的酶系统,酶在完成专属代谢途径后,可转化成石油组分。
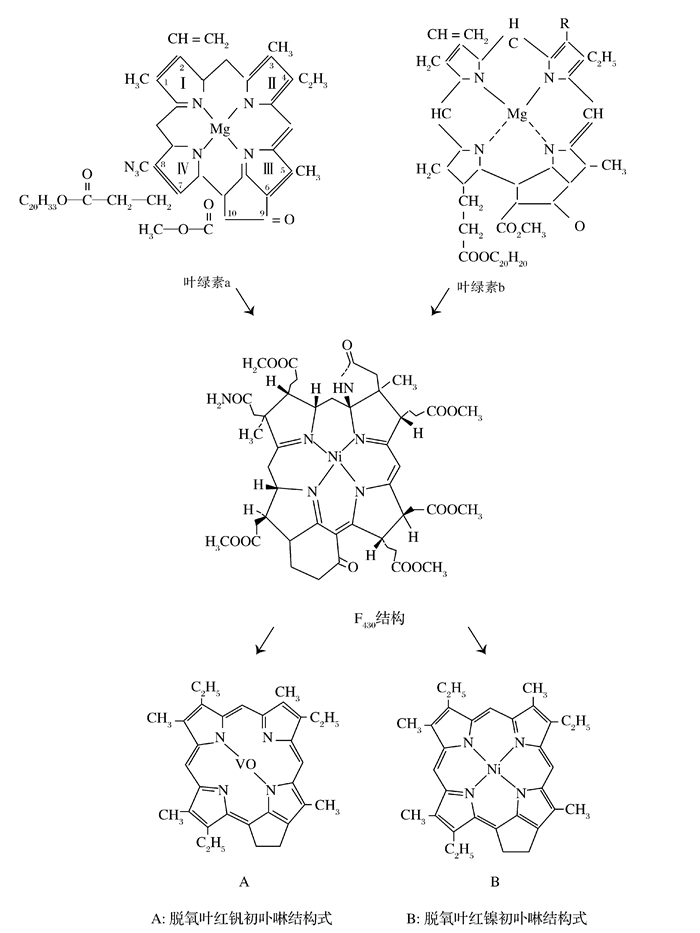
例如,叶绿素是植物的基本组成,是含有镁原子的族衍生物,在沉积物中,由厌氧微生物转化成辅酶F430,为产甲烷菌进行代谢和传递能量,辅酶F430是一种包含有大量Ni的相对低分子量的生物物质,镍是F430的必要成分,F430作为甲基还原系统的一部分,为甲烷气的形成起着关键作用。在这一转变过程中,Ni原子置换Mg可形成F430辅酶,后来与V、Ni重新络合,形成卟啉(图 3)。
产甲烷菌所具有的辅酶F430可能是叶绿素向卟啉转化的中间产物,从结构上看,F430同叶绿素和卟啉结构极其相似:
(1) 都是四吡咯结构,再加上各种取代基构成;
(2) 在四个吡咯环之间络合的金属是镍和钒;
(3) 取代基中有甲基和氢原子;
(4) 9位取代基为氧,同叶绿素一致。
辅酶是指与酶蛋白不是以共价键连接,彼此结合松驰,容易将它们分开的一种成分。在沉积物中,只要具备还原条件,产甲烷菌便能从植物中迅速获取营养,合成辅酶。辅酶F430直接参与催化反应,起到传递电子、氢原子、羧基等化学基团的作用,它的存在有利于天然气的形成。
钒、镍是构成F430辅酶最重要的金属,也是卟啉化合物中最常见的成分。镍、钒金属元素在微生物机体中的生理作用主要是参与了酶的组成,构成酶的最大活性,维持细胞结构的稳定性,提高机体的代谢能力。产甲烷菌在生长过程中,如果缺乏这些元素,会导致机体生理活性的降低。
F430在产甲烷古菌中含量丰富,约为0.23~0.80 μmol/g细胞干重,大部分F430紧密结合于产甲烷菌的蛋白质部分,产甲烷菌体内的Ni含量高时,F430含量也高,均大于227 μmol/L,非产甲烷菌体内的Ni含量低,F430含量也低,均 < 10 μmol/L。当产甲烷菌在有Ni存在的条件下生长时,Ni中的50%~70%被吸收用于合成F430。
F430辅酶脱羧后的产物是卟啉。卟啉化合物广泛分布于各时代的沉积物及石油中,大部分卟啉是以金属络合物的形式存在于地质体中,与卟啉络合的最常见的金属除镍和钒外,极少数还有铁、钴、锌等。卟啉的金属络合物相当稳定,在漫长的地质年代中能够保存下来(表 4)。
| 地层时代 | 样品数 /个 |
砂质沉积物 | 样品数 /个 |
泥质沉积物 | 样品数 /个 |
碳酸盐岩 | 样品数 /个 |
其他沉积物(土壤例外) | ||||
| Nip | Vop | Nip | Vop | Nip | Vop | Nip | Vop | |||||
| 现代沉积物 | 1 | — | — | 7 | — | — | 3 | — | — | 12 | — | — |
| 第三纪 | 6 | 17 | 17 | 31 | 61 | 55 | 2 | — | — | 40 | 50 | 45 |
| 中生代 | 11 | 9 | 27 | 32 | 28 | 38 | 17 | 35 | 35 | 62 | 26 | 34 |
| 古生代 | 9 | — | 11 | 27 | 18 | 15 | 39 | 5 | 18 | 81 | 10 | 17 |
| 前寒武纪 | 5 | — | 60 | 7 | 14 | — | 5 | — | 40 | 18 | 6 | 28 |
| 注:Nip.镍卟啉;VoP.钒卟啉 | ||||||||||||
由表 4可以看出:
(1) 叶绿素是有机质的重要组成部分,泥质沉积物中镍卟啉和钒卟啉含量均高于砂质沉积物和碳酸盐岩,这同泥质沉积物中有机质丰度高有关。
(2) 卟啉在古生代、中生代、第三纪地层中普遍存在,说明产甲烷菌存在的普遍性,产甲烷菌的生理活动不仅形成了天然气,而且参与了石油的形成。
(3) 镍卟啉、钒卟啉在前寒武纪地层中大量存在,说明产甲烷菌是地球形成过程中存在时间最长、年代最早的古菌。
(4) 卟啉的形成有一个过程。在进入厌氧条件后,产甲烷菌等微生物群体可迅速将叶绿素转化成F430辅酶。这是产甲烷过程最活跃的阶段,进入成岩阶段后,F430便转化为石油中的卟啉。
根据微生物学家Thauer et al.[16]的发现,在热自养甲烷菌中鉴定出了具有卟吩骨架的天然镍络合物,也说明了卟啉的微生物成因。
5 地层温度促进了有机质热裂解随着沉积物埋藏深度的增加,地层温度增加,温度促进了有机质的热裂解,它同微生物作用相互促进,加速了石油的生成[17]。
从石油聚集的区域分布来看,同地温特征有一定关联。如我国西部盆地(如新疆)的地温梯度仅2.0 ℃/100m,而东部诸盆地高达3.5~4.5 ℃/100m。同一时代相比,西部成油门限的深度大而东部小。泌阳凹陷下第三系生油门限值仅1 800 m,86 ℃;松辽盆地白垩系青一段为1 250 m,60 ℃~65 ℃。这一现象又同源岩母质有关,东部以Ⅰ~Ⅱ型为主,西部Ⅱ~Ⅲ型居多。
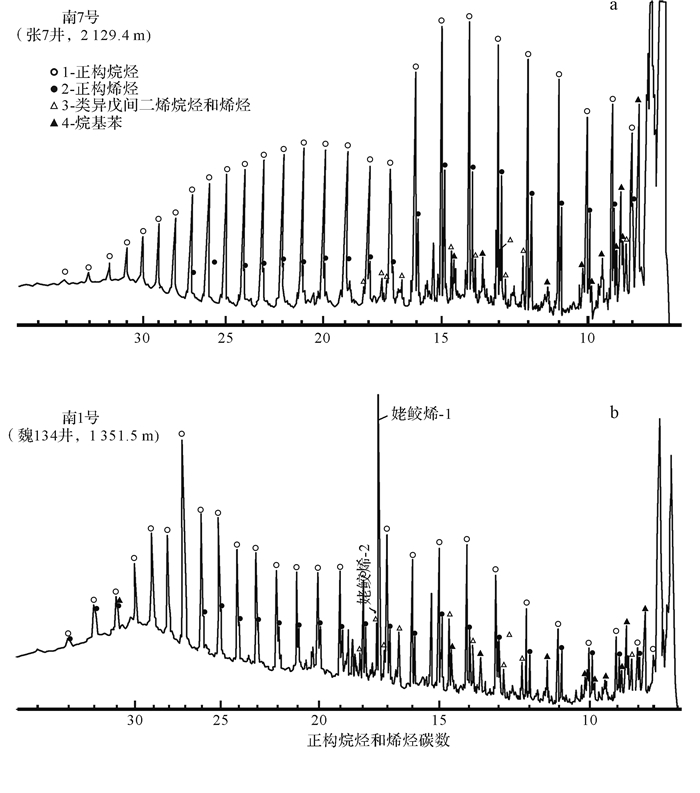
将干酪根加热,可产生各种烃类及可溶性沥青,这就是干酪根热降解成油说。在干酪根裂解产物的主要系列化合物中,除含有大量的正构烷烃外,还含有大量的正构烯烃、类异戊间二烯烃和烯烃(图 4)[18]。而一般原油中烯烃含量很低,其模拟实验的温度为300 ℃~500 ℃,远远高于地质体中的实际温度。虽然高温可以弥补时间的不足,但过高温度未必能全面反映地层中生油的实际情况。
从江汉盆地源岩及甘南泥炭样品28 ℃~38 ℃时进行富集培养本源菌类发酵的模拟实验来看,发酵样品链烷烃分布呈明显变化[19]。正构烷烃碳数范围拓宽,均为饱和烃,无烯烃。低碳数和偶数正烷烃含量增加,CPI和OEP值接近1(0.93~1.01),奇偶均势。类异戊二烯烃系列被检出,植烷具有很强的优势(图 5)[19],更近似于石油的生成。
温度的作用使有机质中C-C键断裂发生得更加频繁。厌氧微生物的降解作用也使有机质发生降解(使大分子有机质变成小分子有机质),二者方向相同,互为融合,使有机质的裂解加速。微生物对有机质改造形成烃类的作用还有去氧作用,脱去含氧官能团,产氢菌产氢、用氢形成饱和烃,因而作用更为全面、重要。
厌氧微生物多途径、多种方式参与了石油的形成。微生物细胞体积极小,而所面临的环境多变,每个细胞要在这样复杂的环境条件下求得生存和发展,就必须具备一套发达的代谢调节系统,以保证上千种酶能有条不紊地进行极其复杂的新陈代谢反应。在生理上具有一定特点,能适应高温、高压、高盐等极端环境,保持膜的功能。氢代谢是厌氧微生物最重要的地质特征,沉积物中的氢化反应十分丰富,对地质体中的物质循环、石油的形成和演化具有重要意义。沉积物中厌氧微生物发育着许许多多群体,不同演化阶段有不同的微生物,各有不同的作用,新老交替,不断更新。石油的生成是一个多元化、长期的过程。
致谢: 感谢恩师叶连俊先生、黄弟藩教授、黄汝昌教授、王大珍教授;感谢中石油廊坊分院、东北石油大学、农业部成都沼科所以及准噶尔盆地、柴达木盆地、松辽盆地等各盆地各石油勘探开发研究院、研究所的同事、朋友们,谢谢你们对我们工作的指导、帮助与支持,尤其是我们在开展《石油天然气形成过程中微生物地质作用》研究时给予的鼎力协作,再次表示衷心的感谢。| [1] |
惠荣耀, 丁安娜. 微生物在石油生成中的作用(一):降解和去含氧基团[J]. 沉积学报, 2017, 35(6): 1274-1283. [ Hui Rongyao, Ding Anna. The role of microorganisms in the oil generation (Ⅰ):the degradation of macromolecular organic matter and the elimination of oxygen-containing groups[J]. Acta Sedimentologica Sinica, 2017, 35(6): 1274-1283.] |
| [2] |
王大珍. 有机沉积区中由微生物导致的物质与能量转化[J]. 沉积学报, 1983, 1(1): 75-85. [ Wang Dazhen. Microbiological conversion of substances and energy in organic sedimentary regions[J]. Acta Sedimentologica Sinica, 1983, 1(1): 75-84.] |
| [3] |
袁权. 能源化学进展[M]. 北京: 化学工业出版社, 2005: 2004-2006. [ Yuan Quan. Advances in energy chemistry[M]. Beijing: Chemical Industry Press, 2005: 2004-2006.]
|
| [4] |
Nazeeruddin M K, Kay I, Rodicio R, et al. Conversion of light to electricity by cis-X2Bis(2, 2'-bipyridyl-4, 4'-dicarboxylate) ruthenium(Ⅱ) charge-transfer sensitizers (X=Cl-, Br-, I-, CN-and SCN-) on nanocrystalline TiO2 electordes[J]. Journal of the American Chemical Society, 1993, 115(14): 6382-6390. DOI:10.1021/ja00067a063 |
| [5] |
Reddy C A, Bryant M P, Wolin M J. Characteristics of S organism isolated from Methanobacillus omelianskii[J]. Journal of Bacteriology, 1972, 109(2): 539-545. |
| [6] |
McInerney M J, Bryant M P. Anaerobic degradation of lactate by syntrophic associations of Methanosarcina barkeri and Desulfovibrio species and effect of H2 on acetate degradation[J]. Applied and Environmental Microbiology, 1981, 41(2): 346-354. |
| [7] |
Boone D R, Bryant M P. Propionate-degrading bacterium, Syntrophobacter Wolinii sp. nov. gen. nov., from methanogenic ecosystems[J]. Applied and Environment Microbiology, 1980, 40(3): 626-632. |
| [8] |
丁安娜, 宋桂侠, 惠荣耀, 等. 松辽盆地滨北地区生物气源岩酸性含氧化合物的分布及其地球化学意义[J]. 天然气地球科学, 2004, 15(1): 51-57. [ Ding Anna, Song Guixia, Hui Rongyao, et al. Distribution of acid bearing-oxygen compounds and its geochemical significance in source rocks of biogas, Binbei area, Songliao Basin[J]. Natural Gas Geoscience, 2004, 15(1): 51-57. DOI:10.3969/j.issn.1672-1926.2004.01.010] |
| [9] |
丁安娜, 卢双舫, 冯子辉, 等. 生物气源岩中原核生物改性指标与评价新方法[J]. 石油勘探与开发, 2008, 35(1): 59-66. [ Ding Anna, Lu Shuangfang, Feng Zihui, et al. Activity of bacteria and archaea in immature or lower-mature organic matter and new appraisal methods for biogas source rocks[J]. Petroleum Exploration and Development, 2008, 35(1): 59-66. DOI:10.3321/j.issn:1000-0747.2008.01.011] |
| [10] |
彼得斯K E, 莫尔多万J M.生物标记化合物指南: 古代沉积物和石油中分子化石的解释[M].姜乃煌, 张水昌, 林永汉, 等译.北京: 石油工业出版社, 1995: 102-136. [Peters K E, Moldowan J M. The biomarker guide: interpreting molecular fossils in petroleum and ancient sediments[M]. Jiang Naihuang, Zhang Shuichang, Lin Yonghan, et al, trans. Beijing: Petroleum Industry Press, 1995: 102-136.]
|
| [11] |
盛国英, 张千, 付家谟, 等.生物标志物及其古生物与古环境意义[M]//杨群.分子生物学原理与方法.北京: 科学出版社, 2003: 96-148. [Sheng Guoying, Zhang Qian, Fu Jiamo, et al. Biomarkers and theirs fingerprint significance in palaeobiology and palaeo-environment[M]//Yang Qun. Principle and method of molecular biology. Beijing: Science Press, 2003: 96-148.]
|
| [12] |
王铁冠. 生物标志物地球化学研究[M]. 武汉: 中国地质大学出版社, 1990. [ Wang Tieguan. Approach to biomarker geochemistry[M]. Wuhan: China University of Geosciences Press, 1990.]
|
| [13] |
丁安娜, 王明明, 李本亮, 等. 生物气的形成机理及源岩的地球化学特征:以柴达木盆地生物气为例[J]. 天然气地球科学, 2003, 14(5): 402-407. [ Ding Anna, Wang Mingming, Li Benliang, et al. Biogas forming mechanism and geochemical characteristics of its source rock[J]. Natural Gas Geoscience, 2003, 14(5): 402-407. DOI:10.3969/j.issn.1672-1926.2003.05.015] |
| [14] |
中国科学院地球化学研究所有机地球化学与沉积学研究室. 有机地球化学[M]. 北京: 科学出版社, 1982: 121-134. [ Laboratory of Organic Geochemistry, Institute of Geochemistry. Organic geochemistry[M]. Beijing: Science Press, 1982: 121-134.]
|
| [15] |
Hodgson G W, Hitchon B, Taguchi K, et al. Geochemistry of porphyrins, chlorins and polycyclic aromatics in soils, sediments and sedimentary rocks[J]. Geochimica et Cosmochimica Acta, 1968, 32(7): 737-772. DOI:10.1016/0016-7037(68)90010-0 |
| [16] |
Thauer R K, Shima S. Methane as fuel for anaerobic microorganisms[J]. Annals of the New York Academy of Sciences, 2010, 1125(1): 158-170. |
| [17] |
丁安娜, 夏燕青, 妥进才, 等. D型菌解无定形体和B型微粒体的热模拟实验研究[J]. 石油实验地质, 1999, 21(2): 175-179, 183. [ Ding Anna, Xia Yanqing, Tuo Jincai, et al. Study on the thermal simulation experiment of D-bacteriodecomposed amorphous solid and B-micrinite[J]. Experimental Petroleum Geology, 1999, 21(2): 175-179, 183. DOI:10.3969/j.issn.1001-6112.1999.02.016] |
| [18] |
黄第藩, 李晋超, 周翥虹, 等. 陆相有机质演化和成烃机理[M]. 北京: 石油工业出版社, 1984: 154-159. [ Huang Difan, Li Jinchao, Zhou Zhuhong, et al. The evolutional and hydrocarbon-generating mechanism of terrestrial organic matter[M]. Beijing: Petroleum Industry Press, 1984: 154-159.]
|
| [19] |
丁安娜, 黄第藩, 惠荣耀, 等. 未熟有机质发酵后饱和烃中主要生物标志化合物的变化[J]. 地球化学, 2001, 30(5): 407-415. [ Ding Anna, Huang Difan, Hui Rongyao, et al. Changes of main biomarkers in saturated hydrocarbon fractions after fermentation of immature organic matter[J]. Geochimica, 2001, 30(5): 407-415. DOI:10.3321/j.issn:0379-1726.2001.05.001] |
 2018, Vol. 36
2018, Vol. 36


 CH3COOH+2H2
CH3COOH+2H2