扩展功能
文章信息
- 惠荣耀, 丁安娜
- HUI RongYao, DING AnNa
- 微生物在石油生成中的作用(一)——降解和去含氧基团
- The Role of Microorganisms in the Oil Generation (Ⅰ): The degradation of macromolecular organic matter and the elimination of oxygen-containing groups
- 沉积学报, 2017, 35(6): 1274-1283
- ACTA SEDIMENTOLOGICA SINCA, 2017, 35(6): 1274-1283
- 10.14027/j.cnki.cjxb.2017.06.018
-
文章历史
- 收稿日期:2016-10-02
- 收修改稿日期: 2016-10-20
微生物学已成为当今世界上研究最活跃、取得成果最辉煌、应用前景最广阔的生命科学之一,厌氧微生物学和有机地球化学随着各种现代技术的出现而得到迅猛发展,这些研究成果对我们讨论石油天然气的成因机理有重大裨益。
沉积物中的有机质转化成石油烃类是由大分子有机物分解成中、低分子有机化合物的过程,由富含含氧基团、杂原子逐步变为基本不含含氧基团化合物的过程。在沉积物的浅层至深层,从低温到高温都广泛分布着厌氧微生物群体,包括各种分解菌、产氢菌、产甲烷菌等。厌氧微生物多途径、多步骤地将沉积岩中的有机质转化成石油烃类。
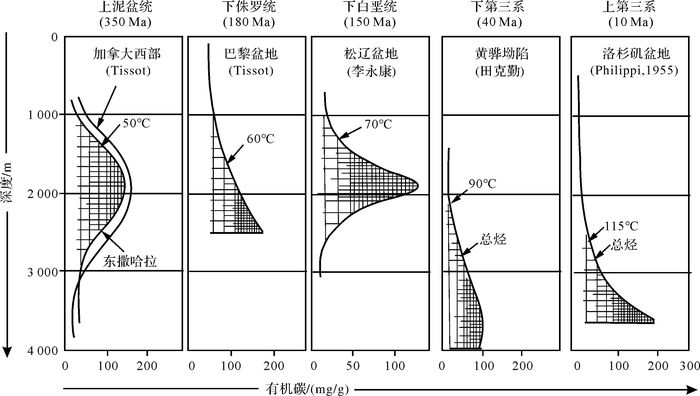
1 高温微生物的大量发现是认识油气生成的基础近20~30年来,随着高温菌(大于50℃~60℃)培养、分离、鉴定技术的发展,对高温菌的研究取得了一批重要成果[1-30](表 1)。目前已经发现了约70个属140种高温菌,最高温度普遍在60℃以上,有的在80℃以上,甚至可达110℃~113℃[29],这其中包括各种类型的分解菌(蛋白质分解菌、纤维素分解菌……)、高温脱硫孤菌、脱硫短杆菌、产氢杆菌、炽热球菌、高温神袍菌、产甲烷菌等。高温菌生态有球状、杆状、螺旋状,还有多形态的。所有高温菌都是厌氧菌。这些菌种同石油生成的主要温度段(60℃~100℃)大体相当(图 1)。
| 菌种名 | Topt/℃ | Tmax/℃ | 菌种名 | Topt/℃ | Tmax/℃ |
| C.thermosulfurogenes | 60 | 75 | T.thermarum | 70 | 84 |
| C.stercorarium | 65 | 70 | Thermosipho africanus | 75 | 77 |
| C.thermohydrosulfuricum | 69 | 78 | Acetomicrobium faecalis | 72 | 77 |
| C.fervidus | 58 | 80 | Methanopyrus Kandleri | 98 | 110 |
| T.filiformis | 73 | 80 | Sulfolobus acidocaldarius | 75 | 90 |
| Thermothrix azorensis | 76~78 | 87 | Sulfolobus shibatae | 81 | 85 |
| Thermoanaerobacter Brockii | 65~70 | 85 | Desulfurolobus ambivalens | 80 | 87 |
| Thermobacteroides acetoethylicus | 65 | 80 | Acidianus infernus | 90 | 96 |
| Rhodothermus obamensis | 80 | 85 | Stygiolobus azoricus | 80 | 89 |
| Fervidobacterium islandicum | 65 | 80 | Pyrococcus furiosus | 100 | 103 |
| Methanococcus igneus | 88 | 91 | Pyrococcus woesei | 100~103 | 104.8 |
| Metallosphaera sedula | 75 | 80 | Staphylothermus marinus | 92 | 98 |
| Sulfosphaerellus thermoacidophilum | 70 | 80 | Caldococcus Litoralis | 88 | 100 |
| Thermococcus stetteri | 75~88 | 98 | Archaeoglobus fulgidus | 83 | 95 |
| T.flavus | 70~75 | 81 | Archaeoglobus strain Z | 75~80 | 90 |
| Desulfovibrio thermophilus | 65 | 85 | Archaeoglobus profundus | 82 | 90 |
| Thermoanaerobium brockii | 67 | 76 | Hypertermus butylicus | 95~107 | 108 |
| Thermoanaerobacter ethanolicus | 69 | 78 | Rhodothermus obamensis | 80 | 85 |
| Thermodesulfobacterium commune | 70 | 85 | Thermotoga neapolitana | 80 | 90 |
| Acetogenium Kuvui | 66 | 72 | Thermotoga thermoarum | 70 | 84 |
| Thermobacteroides acetoethylicus | 65 | 75 | Fervidobacterium nodosum | 70 | 79 |
| T.leptospartum | 60 | 71 | Aquifex pyrophilus | 85 | 95 |
| Dyctioglomus thermophilum | 78 | 80 | Bacillus schegelii | 70 | 80 |
| Thermoanaerobacterium lactoethylicum | 65 | 75 | Clostridium fervidus | 68 | 80 |
| Fervidobacterium modosum | 67 | 80 | Desulfurella multipotens | 58~60 | 77 |
| F.islandicum | 65 | 80 | T.thermophilus | 65~72 | 85 |
| Thermotoga maritima | 80 | 90 | Thermomicrobium roseum | 70~75 | 85 |
| T.neapolitana | 80 | 90 | Dictyoglomus thermophilum | 73~78 | 80 |
| 注:据Pley, 1991;Davey, 1993;Sako, 1996;Stetter, 1983;Steitz, 1998;Baumann, 1988;和致中等2001;Blöch1, et al., 1997 | |||||
高温菌样品主要采自陆地或海底活火山区附近的沉积层或淤泥层。火山活动区发育热泉和间歇喷泉,地下500~3 000 m处水温可达150~300℃,周围为高地热区。研究样品主要分布在意大利、冰岛、多米尼加、萨尔瓦多、墨西哥、新西兰、日本、苏门答腊、美国、阿根廷、亚速尔群岛、俄罗斯、印度洋等地区。
科学家也对深部油藏的微生物活动进行了研究。Davey et al. [30]研究了美国俄克拉何马州(Oklahoma)和得克萨斯州(Texas)的油田,从钻井不同深度到2 000多米分离出厌氧嗜热杆菌等菌属,地层温度为50℃~80℃和35℃~77℃,属高盐环境。在北海油田500~2 000m发现了硫酸盐还原菌[31-32]、硝酸盐还原菌[33]及产甲烷菌及各种厌氧菌[32]。从油田深层获得的微生物同海底深部火山喷泉附近获得的微生物具有极大的相似性,说明厌氧微生物普遍具有在特殊环境下生存的能力。
丁安娜等[35]对准噶尔盆地马庄气藏侏罗系气源岩进行了产甲烷菌的富集培养,样品埋深1 854~2 608 m,结果发现样品中发酵性细菌数量分布在(5×102个/g~2.3×104)个/g,35℃~65℃普遍富集培养出产甲烷球菌(Methanococus),55℃从个别样品中富集培养出产甲烷杆菌(Methonobacterium)。
王修垣等[36]研究了玉门油田不同含油构造油田水中微生物的分布,Ⅰ、Ⅱ号油藏为背斜构造,Ⅲ号油藏为单斜断层遮挡油藏,油层为第三系,CaCl2型水为主。样品取自三个油田不同深度地层:349~581 m,1 138~1 178 m,1 962~2 720 m,分别对应低、中、高地层温度(表 2)。不仅有腐生分解菌、脂肪分解菌,还有脱硫菌、反硝化菌等厌氧微生物的活体分布,厌氧分解菌数量在349.2~592.7 m为(6.0×10~8.0×102)个/mL,1 138.8~1 178.7 m为(1.0×10~1.5×103)个/mL,1 962~2 720 m为(1.0×102~5.4×104)个/mL。从浅部向深部厌氧分解菌有增加的趋势。
| 油田类型 | 采样深度 /m |
原油含水量 /% |
水的矿化度 /(mg/L) |
分解菌/(个/mL) | 脱硫菌 | 液体石蜡 分解菌 |
反硝化菌 | pH值 | 相应温度 /℃ |
||
| 好氧 | 厌氧 | 乳酸钙为碳源 | 原油为碳源 | ||||||||
| Ⅱ号油田 (封闭型) |
581.9 | 74.0 | 63 756 | 2.2×102 | 2.2×102 | + | - | + | - | 33~41 | |
| 501.1 | 84.0 | 64 527 | 3.0×102 | 8.0×102 | + | + | + | + | |||
| 592.7 | 86.0 | 54 405 | 6.1×10 | 6.0×10 | + | - | + | + | 6.75 | ||
| 488.0 | 80.1 | 48 554 | + | + | + | + | + | - | 6.8 | ||
| 585.0 | 15.0 | - | - | + | - | - | - | ||||
| 349.2 | 3.8 | ||||||||||
| 428.0 | 8.0×10 | 6.0×10 | + | + | + | + | |||||
| Ⅲ号油田 (开启型) |
地表 | 1.5×10 | 1.1×10 | - | - | - | - | 7.0 | 63~65 | ||
| 1178.7 | 54.9 | 12 094 | 2.2×103 | 1.1×103 | + | + | + | + | |||
| 1154.0 | 59.1 | 12 942 | 5.0×102 | 1.5×103 | + | - | + | + | 7.2 | ||
| 1171.0 | 22.9 | 22 226 | - | - | + | - | - | - | 7.0 | ||
| 1138.8 | 0.3 | - | - | - | - | - | - | ||||
| 1140.8 | 6.7 | 14 976 | 3.2×102 | 3.0×102 | + | + | - | + | |||
| Ⅰ号油田 (封闭型) |
2334.0 | 30.2 | 35 890 | 6.0×102 | 1.0×102 | + | + | + | + | 84.5~98.5 | |
| 1962.32 | 0.1 | 0 | - | - | - | - | - | + | 6~7 | ||
| 2038.0 | 81.0 | 44 983 | 5.0×104 | 5.4×104 | + | + | + | + | |||
| 2198.0 | 35.2 | 37 723 | 2.2×103 | 1.5×103 | + | + | + | - | |||
| 2219.8 | 12.4 | 0 | - | - | - | - | - | - | |||
| 2720.0 | 65.1 | 54 297 | 3.0×103 | 5.0×103 | + | + | + | + | |||
| 注:+有菌发育;-无菌发育;0无资料 | |||||||||||
细菌包括中温菌均有细胞壁,细胞壁含肽聚糖,细胞膜特征为酯链、直链脂。嗜热菌没有细胞壁仅有细胞质膜,无肽聚糖,为醚链相连接的类异戊二烯酯,只有这种酯才能在高温下保持细胞膜的完整性。细胞质膜具有半渗透作用,是酶和核糖体活动的部位。细胞膜内的酶和蛋白质也具有较高的热稳定性,核糖体抗热性高,能较好的生存。也有研究者认为,嗜热菌的细胞质膜可以作为绝缘体,阻止热从外部向细胞内传递,以便保护细胞内的酶。
微生物对极端环境的适应,是40亿年来生物进化过程的结果。嗜热性是在细菌进化的早期出现的,祖先菌就是高温菌,最原始最古老的细胞生物是没有细胞壁的。目前已从极端嗜热环境中分离出少量热原体菌株。热原体是一种无细胞壁的原核生物,细胞更小,生长温度更高。研究发现,极端嗜热古菌存在着地球最原始的生命代谢形式,基因组测序表明,它们为古老生命的后代,是靠近生命源头的祖先。生命的起源可能就是从小分子形成生物单体,再由生物单体形成生物高分子,生物高分子形成多分子体系,再组合成生命形式。随着技术的进步,人类将会发现大量生长温度大于100℃超嗜热类似热原体一类的单细胞生物。
2 厌氧微生物降解有机质转化成简单化合物生物分子都是碳的化合物,碳构成了生物的骨架,碳源是细胞的组成部分。厌氧微生物需要不断地从它的外部环境中吸收所需要的各种营养,合成本身的细胞物质和提供机体进行各种生理活动所需要的能量,使机体进行正常的生长与繁殖。地层中厌氧微生物的营养物质,主要来自沉积物中的有机质。
碳是构成生命的核心原子,能与氧、氢、氮和硫形成共用电子对,其它重要元素的循环都与碳循环相关联。碳源等各种营养物质可直接通过细胞外酶分解后被微生物吸收,组成细胞壁、细胞膜、细胞质、细胞核等细胞物质。厌氧微生物获取碳的过程便是使有机质从复杂化合物变成简单化合物的过程。
对于复杂的有机物,先分解成最简单化合物予以吸收,例如蛋白质是组成细胞原生质的基本物质。分子量在一万以上,大者可达数千万。蛋白质被酶分解,最后生成氨基酸的混合物,在分解成二肽后,可被微生物吸收。

碳水化合物又称为糖类,是一种重要的碳源和能源,沉积物中存在的糖类主要是多糖。微生物降解碳水化合物的第一步是水解,在水解酶参与下把复杂的有机物分子分解为较简单的化合物(图 2),通过水解,多糖转化为二糖可进入细胞膜内,二糖可再水解成单糖,在细胞内部,单糖作为能源而被利用。
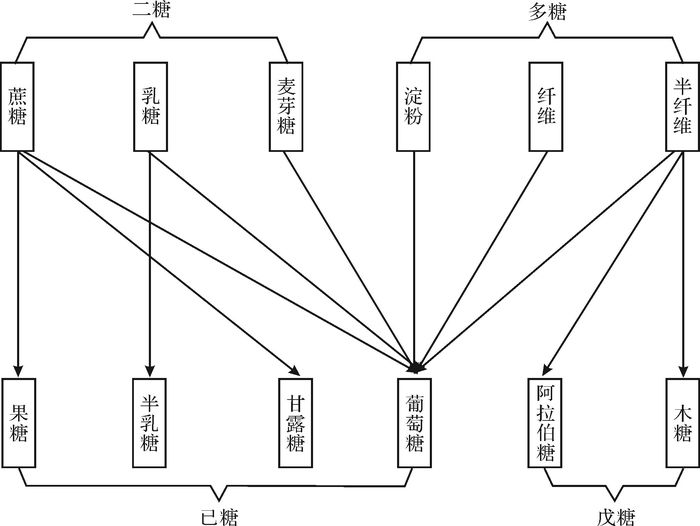
|
| 图 2 碳水化合物的水解 Figure 2 Hydrolysis of carbohydrate |
进一步的变化是在无氧条件下,单糖首先转化为丙酮酸:

丙酮酸本身作为受氢体,反应的最终产物是酸、醇、酮等。这是石油烃类的前身。
脂肪是由高级脂肪酸(>C10)与甘油组成的甘油三酯的混合物,植物的种子、孢子、果实及藻类低等生物均含有大量的类脂化合物。脂类具有重要的生物功能,是构成生物膜的重要物质,几乎细胞所含有的磷脂都集中在生物膜中。对于长链有机质微生物将它们分解成小分子化合物,再加以利用。在厌氧降解短链脂肪酸时,有一些专门的产氢产乙酸细菌与产甲烷菌一起组成降解微生物群体,将脂肪酸分解,其反应为:

脂肪降解首先在细胞外发生水解,生成甘油和相应的各种脂肪酸。

式中,R1、R2、R3是有机基团,R是C4、C6、C8、C10、C12、C14、C16、C18的烷基,其中C16、C18也可以是烯基,它们也可能是很长的碳链。脂肪酸脱羧基便形成了一系列正构烷烃和植烷、姥鲛烷等异构烷烃。
3 厌氧呼吸使含氧基团逐步消失并产生烃类参与成油的有机质,如高等植物、草本植物、水生生物、底栖生物等最初都是生长在有氧环境中,其组成中不同程度地都具有含氧基团,除去有机质中的含氧基团是有机质向石油转化的重要环节之一。这一过程是由微生物来完成的[1]。
沉积物的成岩过程就是还原性增强、氧化还原电位(Eh值)不断降低的过程。沉积初期,喜氧微生物在Eh值为+0.3~+0.4 V的条件下进行新陈代谢,消耗了水体中的溶解氧。厌氧菌则要求Eh值为-0.2~ -0.25 V以下。因为厌氧微生物缺乏超氧化物歧化酶、过氧化氢酶和过氧化物酶,容易受到氧的毒害,厌氧微生物的正常生长和代谢只能在一定限度的氧化还原电位(Eh)之间进行,环境水体或有机质中有任何形态氧的存在,都不能达到或维持进一步生长代谢所需的低Eh值。
但是,不同菌种之间对环境的要求并不相同。有的菌种需要更强的还原环境,因为这些厌氧微生物只有在更低的氧化还原电位时才能生长,它们往往是细胞中无高电位的细胞色素和细胞色素氧化酶等,不能发生和完成那些只有在高电位下才能发生的生物化学反应。另一方面是这些厌氧微生物生长所必需的酶只有环境被进一步还原后,这些酶才能活化并活跃地起到酶的功能,细胞内活跃的代谢便开始,还原性物质便产生,微生物生长也呈现正常的速率,所以盆地的沉积环境只是具有还原环境还是不够的,必须持续沉降、快速沉积,不断造成更强的还原环境对生油才是最有利的。
微生物进行生命活动过程中,无论在有氧情况下的呼吸或无氧情况下的发酵都是一个物质被氧化,另一个物质被还原[31]。不同的是,有氧呼吸一定要有分子氧才能进行,使有机质中的含氧基团增多,并释放出CO2。厌氧呼吸使含氧化合物减少,并伴随有机质的分解,形成一些较原来基质简单更还原的化合物。在厌氧呼吸中,作为最终电子受体的物质不是分子氧,而是有机物结构上的含氧基团和NO3-、NO2-、SO42-等。脱硫孤菌将SO42-还原成H2S,硝酸盐还原菌将硝酸盐还原成N2,产甲烷菌使CO2还原成甲烷等。
厌氧微生物在进行厌氧呼吸的同时,也在不断除去有机质中的含氧化合物。沉积物有机质中的含氧化合物,主要包括醇、酮和酸类带有羟基、羧基和羰基官能团的化合物,除了常见的脂肪酸、脂肪醇和脂肪酮系列化合物外,甾类、萜类的前身物亦具有相应的含氧基团,厌氧微生物在还原含氧基团的同时,形成了石油烃类。如植醇脱羟基、羧基而形成植烷、姥鲛烷,脂肪酸脱羧基成烃类,羊毛甾醇脱羟基成单毛甾烷,多角甾醇脱羟基成为多角甾烷,胆甾醇脱羟基而成重排甾烷,生物藿烷脱去含氧基团而成为藿烷系列,其它含羧基化合物脱羧基而形成萜烷、松香烷等(图 3)。
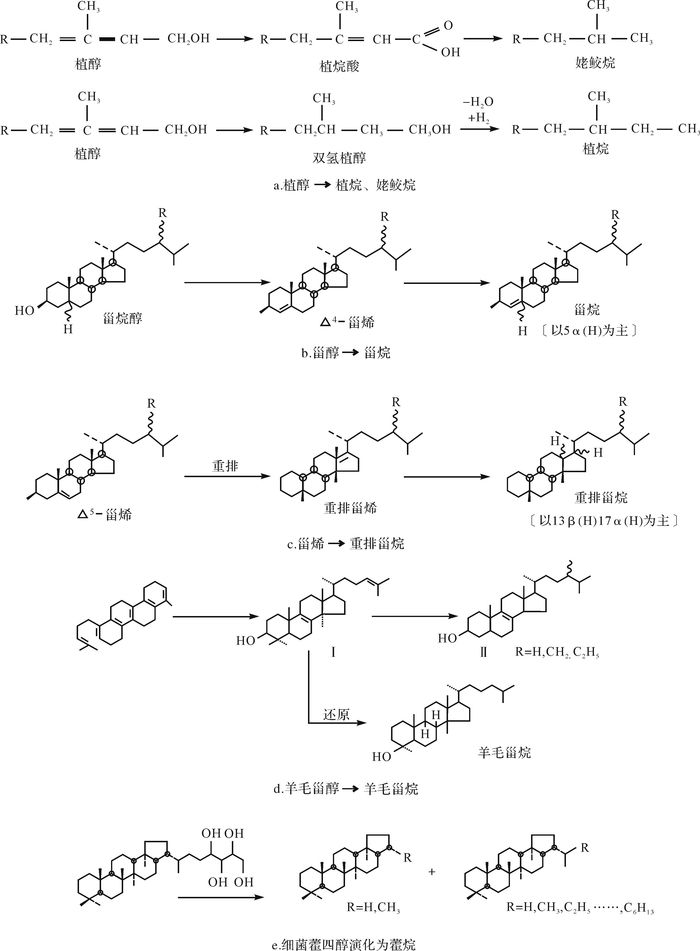
|
| 图 3 除去含氧基团形成烃类图解 Figure 3 Diagrams of removing oxygen groups to form hydrocarbon |
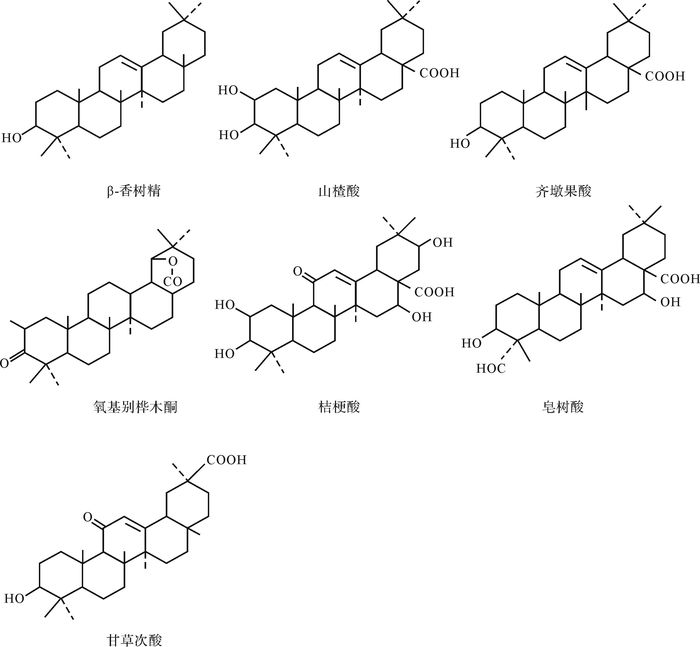
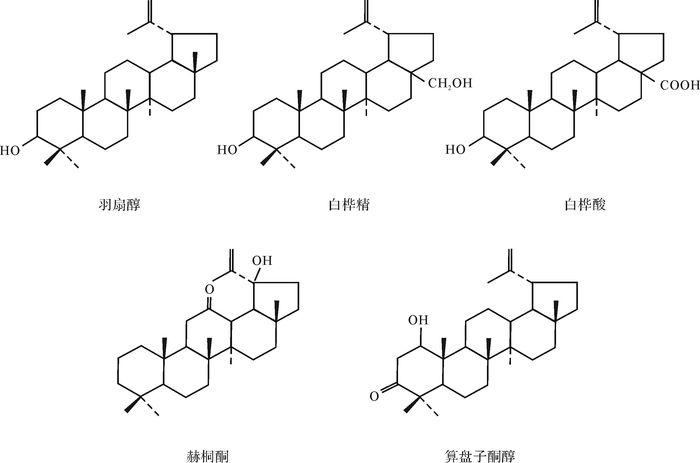
植物成分中有很多奥利烷型前身物,如山楂酸、皂树酸、甘草次酸等,在还原条件下,经脱羧形成奥利烯,去羟基加氢成为奥利烷(图 4)。羽扇醇及相应的酮和酸的衍生物如白桦精、白桦酸等,经厌氧微生物脱去含氧基团而成为羽扇烷(图 5)。
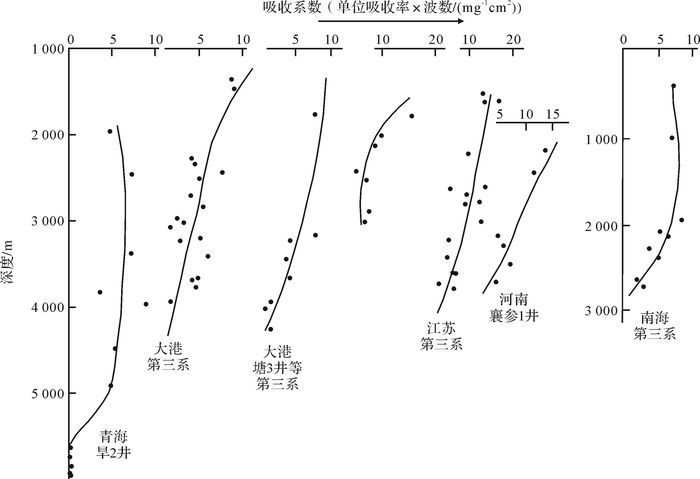
微生物进行厌氧呼吸还原含氧基团是一种自然规律,无论那个盆地,无论什么时代,岩石有机质中1 700 cm-1均随埋深而减小(图 6),显示微生物的成烃活动是一直进行着的。
我们生活在细菌广泛分布的时代,细菌是地球上最早出现的生命有机体,许多以前被认为是生命禁区的地域,如今发现了新的生命形式,是近代科学的一大贡献。微生物结构简单,当环境变化时,每个细胞能直接感受到环境的刺激,对环境变化更敏感,更易发生适应作用,发生遗传上的变异。高温、高压、高盐环境成为嗜热菌生存的良好环境。高温嗜热菌的大量发现为认识生命起源、油气藏的形成提供了坚实的理论基础。
微生物是单细胞生物,个体小,靠细胞分裂而繁殖,繁殖速率极快。每一个细菌都能独立生活,能充分地同沉积岩中的有机质广泛接触,降解有机质,吸取营养,除去含氧基团。沉积物中厌氧微生物对有机质的分解、改造胜过一般的化学作用,反应速度和深度超过强的化学氧化剂,在石油形成过程中,生物作用、化学作用和物理作用,相互交织,相互推动[33, 36]。随着埋藏深度加大,温度压力增加,微生物可以从高温水体中吸取难溶于水的有机组分和有用元素,使有机组分重新组合。压实使泥岩中水体带动烃类排出,又促进了石油的形成。从浅层至深层,从低温至高温,油气生成过程一直贯彻始终,连续进行。石油天然气是生物地质作用的产物,主要是由微生物作用形成的。
| [1] | 丁安娜, 宋桂侠, 惠荣耀, 等. 松辽盆地滨北地区生物气源岩酸性含氧化合物的分布及其地球化学意义[J]. 天然气地球科学, 2014, 15 (1): 51–57. [ Ding Anna, Song Guixia, Hui Rongyao, et al. Distribution of acid bearing-oxygen compounds and its geochemical significance in source rocks of biogas, Binbei area, Songliao Basin[J]. Natural Gas Geoscience, 2014, 15(1): 51–57. ] |
| [2] | 王家生, 王永标, 李清. 海洋极端环境微生物活动与油气资源关系[J]. 地球科学-中国地质大学学报, 2007, 32 (6): 780–788. [ Wang Jiasheng, Wang Yongbiao, Li Qing. Potential relationship between extremophiles and hydrocarbon resources in marine extreme environment[J]. Earth Science-Journal of China University of Geosciences, 2007, 32(6): 780–788. ] |
| [3] | 陈骏, 连宾, 王斌, 等. 极端环境下的微生物及其生物地球化学作用[J]. 地学前缘, 2006, 13 (6): 199–207. [ Chen Jun, Lian Bin, Wang Bin, et al. The occurrence and biogeochemistry of microbes in extreme environments[J]. Earth Science Frontiers, 2006, 13(6): 199–207. ] |
| [4] | 刘金峰, 牟伯中. 油藏极端环境中的微生物[J]. 微生物学杂志, 2004, 24 (4): 31–34. [ Liu Jinfeng, Mou Bozhong. Extreme environment of oil reservoir and associated microorganisms[J]. Journal of Microbiology, 2004, 24(4): 31–34. ] |
| [5] | 王万春, 陶明信. 地质微生物作用与油气资源[J]. 地质通报, 2008, 24 (10/11): 1022–1026. [ Wang Wanchun, Tao Mingxin. Geomicrobial processes and petroleum resources[J]. Geological Bulletin of China, 2008, 24(10/11): 1022–1026. ] |
| [6] | 和致中, 彭谦, 陈俊英. 高温菌生物学[M]. 北京: 科学出版社, 2001. [ He Zhizhong, Peng Qian, Chen Junying. High temperature bacteria biology[M]. Beijing: Science Press, 2001. ] |
| [7] | 闵航, 陈美慈, 赵宇华, 等. 厌氧微生物学[M]. 杭州: 浙江大学出版社, 1993. [ Min Hang, Chen Meici, Zhao Yuhua, et al. Anaerobic microbiology[M]. Hangzhou: Zhejiang University Press, 1993. ] |
| [8] | 武汉大学, 复旦大学生物系微生物学教研室. 微生物学[M]. 2版. 北京: 高等教育出版社, 1987. [ Wuhan University, Department of Microbiology Fudan University. Microbiology[M]. 2nd ed. Beijing: Higher Education Press, 1987. ] |
| [9] | Bryant F O, Adams M W. Characterization of hydrogenase from the hyperthermophilic archaebacterium, Pyrococcus furiosus[J]. The Journal of Biological Chemistry, 1989, 264(9): 5070–5079. |
| [10] | Belkin S, Jannasch H W. A new extremely thermophilic, sulfur-reducing heterotrophic, marine bacterium[J]. Archives of Microbiology, 1985, 141(3): 181–186. DOI: 10.1007/BF00408055 |
| [11] | Bouther de la Tour C, Portemer C, Nadal M, et al. Reverse gyrase, a hallmark of the hyperthermophilic archaebacteria[J]. Journal of Bacteriology, 1990, 172(12): 6803–6808. DOI: 10.1128/jb.172.12.6803-6808.1990 |
| [12] | Chrisostomos S, Patel B K C, DwivedI P P, et al. Caloramator indicus sp. nov., a new thermophilic anaerobic bacterium isolated from the deep-seated nonvolcanically heated waters of an Indian artesian aquifer[J]. International Journal of Systematic Bacteriology, 1996, 46(2): 497–501. DOI: 10.1099/00207713-46-2-497 |
| [13] | Engle M, Li Youhong, Rainey F, et al. Thermobrachium celere gen. nov., sp. nov., a rapidly growing thermophilic, alkalitolerant, and proteolytic obligate anaerobe[J]. International Journal of Systematic Bacteriology, 1996, 46(4): 1025–1033. DOI: 10.1099/00207713-46-4-1025 |
| [14] | Godfroy A, Lesongeur F, Raguénès G, et al. Thermococcus hydrothermalis sp. nov., a new hyperthermophilic archaeon isolated from a deep-sea hydrothermal vent[J]. International Journal of Systematic Bacteriology, 1997, 47(3): 622–626. DOI: 10.1099/00207713-47-3-622 |
| [15] | Huber H, Thomm M, König H, et al. Methanococcus thermolithotrophicus, a novel thermophilic lithotrophic methanogen[J]. Archives of Microbiology, 1982, 132(1): 47–50. DOI: 10.1007/BF00690816 |
| [16] | Huber R, Langworthy T A, König H, et al. Thermotoga maritima sp. nov. Represents a new genus of unique extremely thermophilic eubacteria growing up to 90℃[J]. Archives of Microbiology, 1988, 144(4): 324–333. |
| [17] | Huber R, Kurr M, Jannasch HW, et al. A novel group of abyssal methanogenic archaebacteria (Methanopyrus) growing at 110℃[J]. Nature, 1989, 342(6251): 833–834. DOI: 10.1038/342833a0 |
| [18] | Kobayashi T, Kwak YS, Akiba T, et al. Thermococcus profundus sp. nov., a new hyperthermophilic archaeon isolated from a deep-sea hydrothermal vent[J]. Systematic and Applied Microbiology, 1994, 17(2): 232–236. DOI: 10.1016/S0723-2020(11)80013-5 |
| [19] | Kurr M, Huber R, Köng H, et al. Methanopyrus kandleri, gen. and sp. nov. represents a novel group of hyperthermophilic methanogens, growing at 110℃[J]. Archives of Microbiology, 1991, 156(4): 239–247. DOI: 10.1007/BF00262992 |
| [20] | Lauerer G, Kristjansson J K, Langworthy T A, et al. Methanothermus sociabilis sp. nov., a second species within the Methanothermaceae growing at 97℃[J]. Systematic and Applied Microbiology, 1986, 8(1/2): 100–105. |
| [21] | Miroshnichenko M L, Rainey F A, Hippe H, et al. Desulfurella kamchatkensis sp. nov. and Desulfurella propionica sp. nov., new sulfur-respiring thermophilic bacteria from Kamchatka thermal environments[J]. International Journal of Systematic Bacteriology, 1998, 48(2): 475–479. DOI: 10.1099/00207713-48-2-475 |
| [22] | Mladenovska Z, Mathrani I M, Ahring B K. Isolation and characterization of Caldicellulosiruptor lactoaceticus sp. nov., an extremely thermophilic, cellulolytic, anaerobic bacterium[J]. Archives of Microbiology, 1995, 163(3): 223–230. DOI: 10.1007/BF00305357 |
| [23] | Nilsen R K, Torsvik T, Lien T. Desulfotomaculum thermocisternum sp. nov., a sulfate reducer isolated from a hot north sea oil reservoir[J]. International Journal of Systematic Bacteriology, 1996, 46(2): 397–402. DOI: 10.1099/00207713-46-2-397 |
| [24] | Pley U, Schipka J, Gambacorta A, et al. Pyrodictium abyssi sp. nov. represents a novel heterotrophic marine archaeal hyperthermophile growing at 110℃[J]. Systematic and Applied Microbiology, 1997, 14(3): 245–253. |
| [25] | Sako Y, Nomura N, Uchida A, et al. Aeropyrum pernix gen. nov., sp. nov., a novel aerobic hyperthermophilic archaeon growing at temperatures up to 100℃[J]. International Journal of Systematic Bacteriology, 1996, 46(4): 1070–1077. DOI: 10.1099/00207713-46-4-1070 |
| [26] | Steitz T A. A mechanism for all polymerases[J]. Nature, 1998, 391(6664): 231–232. DOI: 10.1038/34542 |
| [27] | Stetter K O. Ultrathin mycelia-forming organisms from submarine volcanic areas having an optimum growth temperature of 105℃[J]. Nature, 1982, 300(5889): 258–260. DOI: 10.1038/300258a0 |
| [28] | Baumann C, Judex M, Huber H, et al. Estimation of genome sizes of hyperthermophiles[J]. Extremophiles, 1998, 2(2): 101–108. DOI: 10.1007/s007920050048 |
| [29] | Blöchl E, Rachel R, Burggraf S, et al. Pyrolobus fumarii, gen. and sp. nov., represents a novel group of archaea, extending the upper temperature limit for life to 113℃[J]. Extremophiles, 1997, 1(1): 14–21. DOI: 10.1007/s007920050010 |
| [30] | Davey M E, Wood W A, Key R, et al. Isolation of three species of Geotoga and Petrotoga:two new genera, representing a new lineage in the bacterial line of descent distantly related to the "Thermotogales"[J]. Systematic and Applied Microbiology, 1993, 16(2): 191–200. DOI: 10.1016/S0723-2020(11)80467-4 |
| [31] | Rosnes J T, Torsvik T, Lien T. Spore-Forming Thermophilic Sulfate-Reducing Bacteria Isolated from North Sea Oil Field Waters[J]. Applied & Environmental Microbiology, 1991, 57(8): 2302. |
| [32] | Gevertz, Zimmerman, Jenneman, et al. Microbial oxidation of soluble sulfide in produced water from the Bakkeen Sands[J]. 1995. |
| [33] | Pfiffner S M, Palumbo A V, Gibson T, et al. Relating ground water and sediment chemistry to microbial characterization at a BTEX-contaminated site[J]. Applied Biochemistry & Biotechnology Part A Enzyme Engineering & Biotechnology, 1997, 63-65(1): 775. |
| [34] | 黄第藩, 李晋超. 中国陆相油气生成[M]. 北京: 石油工业出版社, 1982: 141-151. [ Huang Difan, Li Jinchao. Chinese continental oil and gas generation[M]. Beijing: Petroleum Industry Press, 1982: 141-151. ] |
| [35] | 丁安娜, 连莉文, 张辉, 等. 1854m~2608m气源岩中产甲烷菌的富集培养和发酵产气实验研究[J]. 沉积学报, 1995, 13 (3): 117–125. [ Ding Anna, Lian Liwen, Zhang Hui, et al. Studies on the enriched cultivation of methanogen and the fermentation experiment by using 1854 to 2608m gas source rocks[J]. Acta Sedimentologica Sinica, 1995, 13(3): 117–125. ] |
| [36] | 王修垣, 毛桂震. 玉門油区油水中微生物区系的分布[J]. 微生物学报, 1965, 11 (4): 554–563. [ Wang Xiuyuan, Mao guizhen. Distribution of microbial flora in oil and water in Yumen oil area[J]. Acta Microbiologica Sinica, 1965, 11(4): 554–563. ] |
| [37] | 曾宪章, 梁狄刚. 中国陆相原油和生油岩中的生物标志物[M]. 兰州: 甘肃科学技术出版社, 1989. [ Zeng Xianzhang, Liang Digang. Biomarkers in Chinese continental oil and petroleum source rocks[M]. Lanzhou: Gansu Science and Technology Press, 1989. ] |
| [38] | 杨志琼, 唐琳仙, 杨一峰, 等. 我国陆相生油岩干酪根的红外光谱特征.有机地球化学和陆相生油[M]. 北京: 石油工业出版社, 1986: 211-223. [ Yang Zhiqiong, Tang Linxian, Yang Yifeng, et al. The infrared spectral characteristics of the root of chinese terrestrial oil source rocks:organic geochemistry and terrestrial oil[M]. Beijing: Petroleum Industry Press, 1986: 211-223. ] |
 2017, Vol. 35
2017, Vol. 35