扩展功能
文章信息
- 张慧芳, 吴欣松, 王斌, 段云江, 屈洋, 陈德飞
- ZHANG HuiFang, WU XinSong, WANG Bin, DUAN YunJiang, QU Yang, CHEN DeFei
- 陆相湖盆沉积有机质富集机理研究进展
- Research Progress of the Enrichment Mechanism of Sedimentary Organics in Lacustrine Basin
- 沉积学报, 2016, 34(3): 463-477
- ACTA SEDIMENTOLOGICA SINCA, 2016, 34(3): 463-477
- 10.14027/j.cnki.cjxb.2016.03.004
-
文章历史
- 收稿日期: 2015-06-30
- 收修改稿日期: 2015-09-30
2. 中国石油大学(北京)地球科学学院 北京 102249;
3. 塔里木油田油气工程研究院 新疆库尔勒 841000
2. College of Geosciences, China University of Petroleum(Beijing), Beijing 102249, China;
3. Oil and Gas Engineering Research Institute, Tarim Oilfield Company, Korla, Xinjiang 841000, China
有机质富集机理的研究对于寻找优质烃源岩、评价一个盆地的油气远景具有极其重要的意义,尤其是针对日益受到人们重视的非常规油气资源(页岩气、致密油)的勘探更是如此。
沉积物中有机质富集控制因素的研究至少已有50年的历史[1],学者们根据各自所用的资料得出不同的认识。Muller et al.[2],Lynne et al.(1982)通过研究均得出沉积速率与现代沉积物中有机质丰度之间存在着必然关系。Calvert[3]研究认为海相沉积物中有机质富集主要受沉积速率以及有机质原始生产率的影响。Meyers et al.[4]研究认为湖泊有机质的丰度是湖盆构造、湖盆形态、有机质沉积过程等相互作用的结果[4]。Talbot(1988)研究非洲热带湖泊时发现暖湿气候有利于沉积物中有机质的富集。拜文华等[5]研究浅湖—半深湖相湖湾环境油页岩成矿富集机理时得出沉积环境对于有机质富集具有控制作用。岩性差异对有机质富集也有影响,沉积物颗粒越细,有机碳含量越高[6, 7],且颗粒表面吸附的有机质对其起到很好的保护作用[8, 9, 10]。此外一些特殊的地质事件也会强烈的改变沉积物中有机质的富集规律,如海侵事件[11]和缺氧事件[12]等。
通过调研发现控制海相、湖相沉积物中有机质丰度的因素多种多样。长久以来学者们大多侧重于研究控制烃源岩有机质丰度的某一个或某几个方面的因素,关于沉积物中有机质丰度的控制因素尚未形成系统的认识。研究发现无论哪种控制因素,都是通过影响有机质生产、分解与保存,以及稀释三方面中的一种或几种来达到控制沉积物中有机质的丰度。
基于海相沉积物中有机质富集机理的研究较早也较多的现状,学者们在研究湖相有机质时大都沿用了海相研究的思想,同时也缺少针对海相、湖相差异性的分析。由于湖泊与海洋相比具有一些独特的性质,湖泊的盐度变化范围大,有淡水、半咸水、咸水和超咸水,湖泊的水深与规模通常比海洋小,湖泊沉积速率比海洋高、湖泊生产力比海洋高,这些因素使得湖泊沉积与海洋沉积存在较大的差异。
针对上述研究的不足,笔者从有机质生产、分解与保存,以及有机质稀释三个方面对沉积物中有机质丰度的控制因素进行系统的分析,并对湖相沉积与海相沉积的异同进行对比。该研究对于寻找优质烃源岩,评价烃源岩具有重要的理论意义。
1 有机质的生产湖泊的高生产力是有机质富集的重要物质基础[13, 14]。对于烃源岩的形成来说,高生产力比水体的缺氧环境更重要。西非Congo盆地下白垩统大套湖相烃源岩中的Marnes Noire段页岩有机质丰度高达6%,明显高于其上下层段的有机质丰度。有机地球化学指标指示它们沉积环境都为不完全的厌氧环境,它们之间最重要的区别在于Marnes Noire页岩沉积时期,有机质的生产力明显高于其他层段[15]。巴西Camamu盆地早白垩世裂谷期沉积上部的富有机质烃源岩,其形成同样也是受生产力的控制[16]。
1.1 光照和营养盐对初级生产力的控制湖泊初级生产力大小取决于光照率和营养盐的供给。光照率取决于湖盆所处的纬度,高纬度地区日照时间短,日光入射角小,生长季节短,故不利于高生产力的形成,而低纬度的热带湖泊正好相反。据Katz[13]统计的不同纬度湖泊生产力(表 1),发现低纬度热带湖泊生产力最高,其次是中纬度,最低的就是极地湖泊生产力(表 1)。
处于同一纬度的湖泊,生产力的大小与湖盆水体的营养供给密切相关,其中又主要以磷元素(磷酸盐)和氮元素(硝酸盐)为主。磷酸盐普遍存在于各类岩石中 ,其输入量取决于湖盆周边岩石的风化作用速率。不同的岩石类型,其化学风化速率由小到大为:砂岩、花岗岩、火山岩、页岩、碳酸盐、蒸发岩,故钙质磷酸盐比硅质磷酸盐的风化速率高。Meybeck[17]通过研究温度对200多个流域不同岩性的风化作用影响时发现,温度与硅质岩、钙质岩、变质岩、岩浆岩的风化速率之间有良好的正相关性,温度越高,风化速率越大(温度主要影响岩石的化学风化)。当岩石处在风化作用的早期,这一观点可能正确,该时期,岩石表面附着的风化土壤薄,下部岩石化学风化相对容易;而当岩石经历了长时间的地质风化,温度对于岩石化学风化速率的影响较弱,此时岩石的化学风化速率主要取决于岩石的物理风化速率,当岩石经历了长时间的风化过后,岩石表面附着的风化土壤相对较厚,除非物理搬运作用大于或等于化学风化作用,才能够将上层的风化土壤搬运走,否则化学风化作用将非常弱[18]。冰岛流域(年平均温度16℃~23.5℃,年均降雨量75~150 cm/y)和夏威夷流域(年平均温度3℃~3.5℃,年均降雨量200~400 cm/y)的基岩都是玄武岩,因冰岛流域基岩表面风化土壤薄,导致其风化速率明显高于夏威夷流域[18]。因此,构造抬升或者裂谷初期构造盆地沉降造成的地形坡度增加增大了土壤的侵蚀作用,因为它增大了物理风化速率,也增大了化学风化速率[15, 18, 19, 20]。可见,磷元素的输入受湖盆周围岩性、湖盆地貌、湖盆构造及湖盆发育时期气候条件等的影响。
氮元素的输入也受湖盆周围岩性、湖盆地貌、湖盆构造及湖盆发育时期气候条件等的影响。但氮元素还可以来源于生物的固氮作用,如蓝藻细菌的固氮作用。对于陆相湖盆而言,氮元素很少成为初级生产力的限制因素,但几乎所有的磷元素都来源于陆上母岩的风化。Schindler[21]的全湖实验证实了磷是刺激藻类爆发式生长的限制性营养元素。
因此,在暖湿气候条件下,尤其是较陡的断陷湖盆,如果湖盆周围有营养物质丰富的母岩存在,如磷灰岩、玄武岩、碳酸盐岩等,则可以大大提高湖盆有机质的生产力。
1.2 湖泊的水介质条件对生物的影响光照和营养盐的供给决定了浮游植物、水生植物的初级生产,而湖泊的水介质条件决定着湖泊的生态系统。酸性湖泊中的生物量非常少,鱼类难以生存,浮游植物通常只有耐酸性的硅藻和甲藻[22]。酸性溶液使碱金属和碱土金属阳离子活性增强,从而有更多的金属阳离子从沉积物中转移到水中,其中的Al3+能形成对水生生物具有毒杀性的Al(OH)2+和Al(OH)+2等羟基形式的化合物[23]。高浓度的H+抑制了许多微生物的生存,其中硝化细菌的减少,使得有机质硝化作用减慢,铵根离子氧化为硝酸根离子的作用逐渐停止,湖水营养水平被破坏,加速了湖泊的贫营养化[22]。因此酸性湖泊的生产力低,但由于其微生物的数量少,降低了有机质降解速率,从而有利于有机质的保存。Kelts[24]指出该环境沉积物可以富集厚层的III型褐煤干酪根。
碱性湖水对于生物的生长是非常有利的。碱性溶液可以增加CO2、磷酸盐和硝酸盐等的溶解度[24]。碱性湖泊可以从大气中吸收更多的CO2,从而增加了湖泊中溶解无机碳(DIC)的含量,并且CO2的增加也可以促使进行光合作用的生物量增加。由于湖泊中无机磷是限制湖泊初级生产力的主要营养元素,碱性湖泊增大了磷酸盐的溶解度,故而可以极大促进湖泊中生物的生长繁殖。
世界上众多的咸水湖泊具有很高的生产力[25],这些湖泊主要为NaCl型咸水湖,咸水湖泊生产力高可能是由于咸水中生活的藻类及细菌为了适应盐度的变化而在细胞内形成有渗透活度的有机物,如甘油、蛋白质及可溶性糖等[26],当这些生物死亡细胞解体后,会释放出大量的有机质。杜氏藻(Dunaliella)是一广盐性光合自养生物,可在1%~35%的浓度范围内生长,当水体盐度升高时,藻体会在细胞内积攒甘油以从高盐环境中获得水分维持生长[27],因此该藻类生物在咸水环境中比在淡水环境中生产的有机质量高。还有一些藻类,如牟氏角毛藻在低盐度下藻细胞生长缓慢,而在高盐度下藻细胞生长较快,这无疑加快了有机质生产速率[28]。犹他州的大盐湖北部含盐量22%,D.saline藻和D.viridis藻的生物量分别可高达24 g/m3,150 g/m3,而其中生活的异养型细菌数量更是巨大,主要为嗜盐杆菌和嗜盐球菌,菌数常年高达300 g/m3,该湖泊具有很高的生产力。
淡水湖泊中的生物量可能不大,但其生物种类多样,其中生活着浮游藻类、底栖藻类、浮游动物、游泳动物、底栖动物、细菌等。当淡水湖泊富营养化后,生物量可以很大,生产力可以很高。印度的Ana Sagar湖是一古老的淡水湖泊,然而由于其位于城市中,生活污水、农业污染以及工业污染的排放导致湖泊N、P含量显著增加,湖水富营养化,使得湖泊生产力大大提高[29]。
1.3 季节性的藻类勃发使有机质快速成层沉积除了营养元素的输入外,营养物质的再循环也至关重要,而湖泊气候季节性变化是影响营养物质再循环的关键因素。生物死亡后,有机遗体下沉,一部分在经过湖水动荡、含氧量高的变温层时被氧化分解了,有机质中的营养元素(N,P,K,Ca,Mg,C等)重新回到水体中,重新被植物和藻类光合作用再利用;另一部分越过了温跃层到达了水体稳定、含氧量低的均温层,被微生物分解后溶解于水中,当湖泊季节性回水时,这些营养元素会被循环再利用,促使藻类勃发。
藻类勃发具有季节性,该现象在海洋和许多现代湖泊中较为常见[30, 31, 32],但不同地区或不同环境,这种“勃发”的时间和次数依湖泊的深度、大小、所处的气候带不同而有很大的差异。Hay[31]曾报道黑海在春季硅藻勃发,秋季颗石藻勃发。非洲坦噶尼喀湖北部,硅藻勃发发生在每年的5—8月,南部则发生在9—11月[33]。
藻类勃发的结果是在沉积岩中出现纹层状构造,这些纹层状构造通常是由暗色有机质纹层和浅色陆源碎屑或碳酸盐矿物纹层互层组成的韵律性沉积。藻类勃发之后分解出的大量有机质,在分层的水体中,经过缓慢的沉降,在水体较稳定的冬季沉积下来,形成单独的有机质纹层[32]。由于藻类勃发,大量藻类光合作用消耗掉表层水体中的CO2,诱导表层水体碳酸盐过饱和而沉淀下来,形成碳酸盐纹层[30]。藻类的生物骨骼,如颗石藻的方解石骨骼、硅藻的硅酸盐骨骼等也可以单独堆积成纹层。如济阳坳陷沙河街组中常见的由于藻类勃发生长而记录下来的纹层就有多种组成形式:颗石藻/富有机质纹层,方解石(白云石)/富有机质纹层(图 1)[34]。
藻类勃发式生长是湖泊系统中十分重要的特征,它不仅为湖泊提供了大量的有机质,极大的提高了湖泊生产力,而且也为沉积岩中有机质的富集创造了良好的条件。济阳坳陷沙河街组沉积时期,由于多次发生藻类勃发式生长而形成的富有机质纹层,形成了有机质丰度高的烃源岩,有机碳含量平均为5.39%,最高可达11.3%。世界上著名的绿河组页岩有机质丰度高的主要原因也是颗石藻的勃发。
1.4 自养型细菌创造高生产力作用细菌对于有机质生产的贡献易被忽视,在一些湖泊中,尤其是半循环湖泊中,自养型细菌通过光能或者化能合成有机质,其生产的有机质的量可能大大超过植物生产的量。世界上一些湖泊的例子可以证明这一现象的存在,包括日本的Suigetsu湖,美国Nevada大苏打湖和瑞士的Cadagno湖[35]。
此外Waldsea湖绿色硫细菌光能合成的有机质年平均产率为32 g C/m2,与浮游植物有机质生产力相等[36]。Solar湖为一超咸水湖,其表层水中植物初级生产力为59 g C/m2/y,然而下层湖水中微生物和光合细菌产生的有机质速率为923 g C/m2/y[37]。这些细菌将无机碳转换为自身生长所需的有机碳,当它们死亡后,其生物遗体将是易于生油,类型非常好的有机质。
2 有机质分解与保存有机质在水体沉降过程中可以被无机矿物,尤其是黏土矿物吸附,有机质因密度小,沉降缓慢,而被吸附的有机质则能够快速的通过水体沉淀下来,减少沉降过程中遭受的分解破坏。同时在沉积埋藏过程中,黏土矿物的吸附作用对有机质起到了非常有效的保护作用,这已成为有机质保存的重要机制之一。尽管存在着一些保护作用,但初级生产的有机质到达湖底或海底的却很少,据测定,到达5 300 m深的海底初级生产的有机质仅为2%[38],到达100 m深的Michigan湖底为6%[39],到达一小型湖泊底部为25%[24]。绝大多数在水体中已被氧化分解,尤其是在温跃层之上的变温层,Michigan湖初级生产的有机质有接近85%在离开变温层前已被氧化[39],而到达水体底部的有机质在有生物扰动的地方又会遭受氧化分解,在缺氧分层的环境中也会遭受多种微生物的分解,因此最后保存在沉积岩中能够成为生油或生气母质的有机质往往较少。但是不同的沉积环境、湖盆规模、水介质条件、水动力条件、沉积速率等还是会决定着保存于沉积岩中有机质丰度的大小。
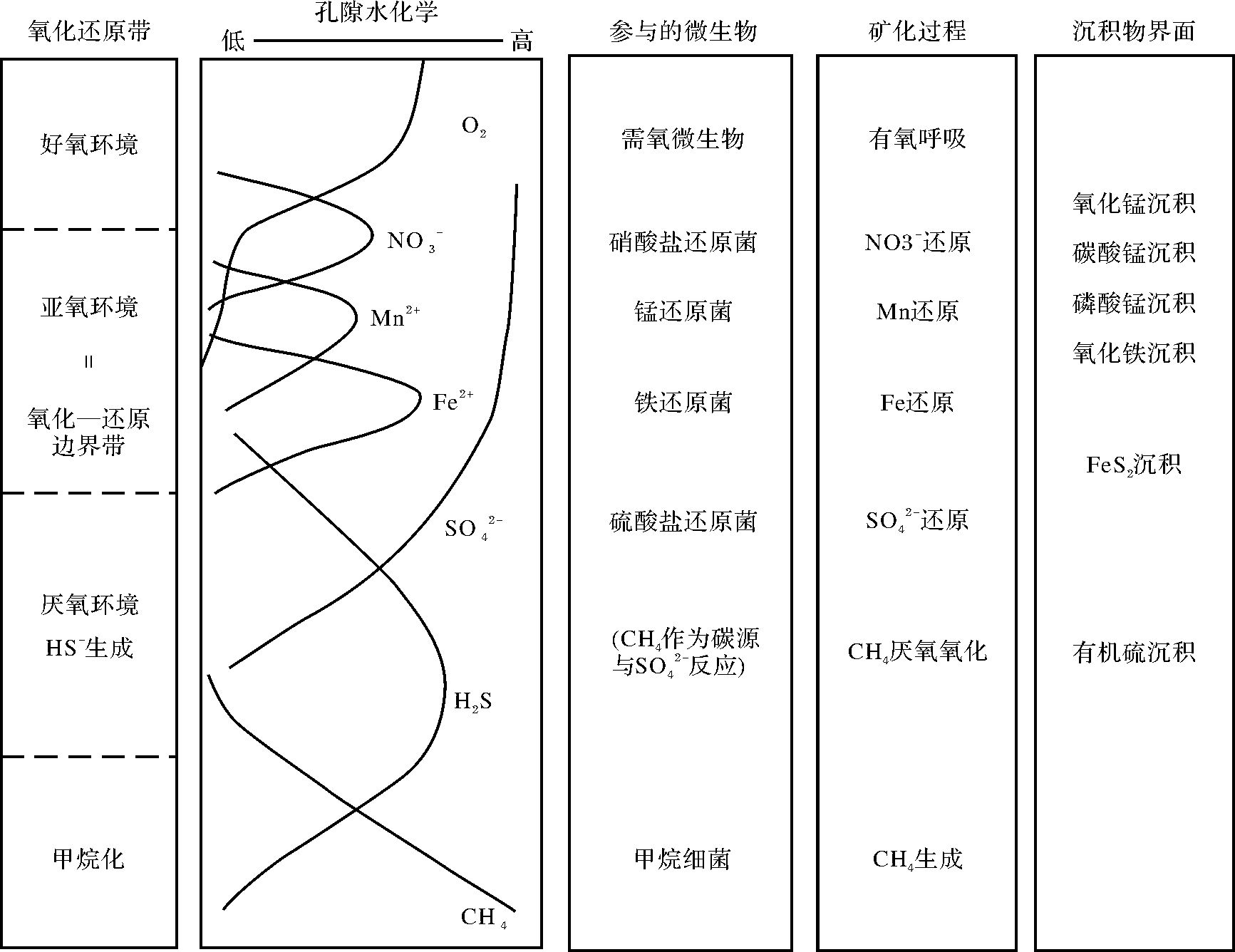
2.1 有机质在沉降和埋藏早期的分解过程有机质的分解是按照一定的顺序进行的(见表 2):主要是有氧呼吸、硝酸盐还原、锰氧化物还原、铁氧化物还原、硫酸盐还原和甲烷化作用,发生这些反应的过程也是有机质氧化的过程,溶解氧、硝酸盐、金属氧化物、硫酸盐都充当的氧化剂,且都是在相应的微生物细菌参与下完成的。这一反应顺序是由吉布斯生成自由能、细菌催化及反应动力学决定的[24, 40, 41]。反应产生自由能最大的先发生,逐次进行直至所有氧化剂或反应的有机质被耗尽为止。
| 作用 | 反应 | G0 |
| 1.有氧呼吸 | (CH2O)106(NH3)16(H3PO4)+138O2→H3PO4+16HNO3+106CO2+122H2O | -3 190 |
| 2.锰还原 | (CH2O)106(NH3)16(H3PO4)+472H++236MnO2→H3PO4+236Mn2++8N2+106CO2+366H2O | |
| 钠水猛矿G0=-3090;六方猛矿G0=-3050;软猛矿G0=-2920; | ||
| 3.硝酸盐还原 | ①:(CH2O)106(NH3)16(H3PO4)+94.4HNO3→H3PO4+55.2N2+106CO2+177.2H2O | -3 030 |
| ②:(CH2O)106(NH3)16(H3PO4)+84.8HNO3→H3PO4+42.4N2+16NH3+106CO2+148.4H2O | -2 750 | |
| 4.铁还原 | ①:(CH2O)106(NH3)16(H3PO4)+848H++212Fe2O3→H3PO4+424Fe2++16NH3+106CO2+530H2O | -1 410 |
| ②:(CH2O)106(NH3)16(H3PO4)+848H++424FeOOH→H3PO4+424Fe2++16NH3+106CO2+742H2O | -1 330 | |
| 5.硫酸盐还原 | (CH2O)106(NH3)16(H3PO4)+53SO2-4→H3PO4+53S2-+16NH3+106CO2+106H2O | -380 |
| 6.甲烷形成 | ①:(CH2O)106(NH3)16(H3PO4)+ 14H2O→HPO2-4+16NH-4+14HCO-3+39CO2+53CH4 | -350 |
| ②:CO2+4H2→CH4+2H2O | ||
| 注:G0为反应产生的自由能,单位为KJ/mol;C6H12O6为葡萄糖。 | ||
有机质在水体和沉积物中的分解分为两步:首先有机质在微生物的作用下水解发酵(该过程有机质 没有被彻底氧化),发酵的速率与产生的能量都很小,然后发酵产物与不同的电子受体(氧化剂)作用被彻底氧化,产生大量能量[41, 42]。有机质通过微生物有氧呼吸被彻底氧化产生水和CO2,而在湖底缺氧的地方,微生物无氧呼吸不是以溶解氧而是以无机物按照氧化还原电位和热力学反应顺序依次作为最终电子受体进行有机质的生物氧化。同时有机质分解的过程伴随着大量营养元素的释放,主要是N和P。因此当湖泊发生季节性回水时,有机质分解释放的营养元素成了浮游生物勃发式生长的触发机制。
有机质分解的反应序列在湖水中发生的位置受控于氧化—还原边界。在季节性分层的湖泊中,氧化—还原边界还会随着季节的变化在沉积物和水体之间发生迁移[41],以处于亚热带贵阳阿哈湖为例,湖水每年在夏季分层,秋、冬、春季循环。夏季湖水分层时,氧化—还原界面位于沉积物—水界面之上的水体中;冬季湖水分层结束,氧化—还原界面位于沉积物中,并随着沉积物孔隙水中所含溶解氧量变化而变化,见图 2。

|
| 图 2 氧化—还原边界随着季节的变化在沉积物和水体之间发生迁移(以处于亚热带的贵阳阿哈湖为例) 1.下部水体缺氧时氧化还原边界的位置;2.水体含氧;3.沉积物中孔隙水含溶解氧并向下延伸一定深度 Fig. 2 Redox boundary changes with season between sediments and water body (take Aha Lake in Guiyang province as an example) |
氧化—还原边界之上的氧化条件下有机质氧化速率非常高,附近的溶解氧通常很快就完全消耗,但由于有上覆溶解氧不断的补充,易分解的有机质在1~2个季节就可以消耗完[24]。而氧化—还原边界带中的缺氧环境及其之下的厌氧环境可以减缓有机质的降解速率,因此缺氧的水体有助于有机质的保存[43, 44]。
早期成岩过程中,湖泊沉积物中硫酸盐浓度高时,硫酸盐还原作用对于有机质的分解与保存具有极其重要的意义。在富含有机质的典型陆棚沉积物中,约有一半的有机质被硫酸盐还原反应所消耗掉[42],可见硫酸盐还原菌(SRB)消耗有机质的速率很大。在微生物参与下的硫酸盐氧化有机质的能力实际上比其他的氧化剂(氧、硝酸盐、金属氧化物)更强[45],但由于水体中硫酸盐的浓度不及溶解氧的高,导致学者普遍认为氧分子氧化有机质的能力最强。因此,湖泊中硫酸盐氧化有机质的能力主要取决于其浓度的大小。部分硫酸盐含量高的湖泊中,硫酸盐氧化有机质的作用是导致其沉积物中有机质丰度低最主要的原因之一。犹他州的大盐湖(Great Salt Lake)中有机质生产力高,然而其中硫酸盐含量高(20 000 ppm),导致其中有机质含量只有不到1%,并且沉积物表面富集黄铁矿[24]。
除位于火山附近以及周围有膏盐岩的湖泊外,通常情况下湖泊中的硫酸盐含量均较低[46, 47]。因此硫酸盐还原反应在湖泊中并不显著,在沉积物表层几厘米内就可以反应完[41]。硫酸盐的浓度低,沉积物表面有机质含量高,沉积物中硫酸盐消耗就快,从而导致了许多湖相沉积物的早期成岩阶段主要为甲烷细菌参与的甲烷化反应。甲烷化作用是有机质矿化的最后一个反应,该反应与硫酸盐还原反应一样,都是在绝对厌氧的环境下进行的(图 3)。甲烷化反应主要是甲烷细菌将甲酸、甲醇和乙酸等发酵生成CH4,由于甲烷细菌通常作用于这些特殊的有机物质,因此该过程消耗有机质的能力有限。当浊流沉积携带着大量陆源有机质快速沉积于湖底时,由于高沉积速率在湖底制造了一个厌氧环境,在甲烷细菌的作用下,可以形成早期的生物成因气。
当有机质沉积到湖底,生物扰动和有机质的再悬浮对有机质的保存都不利。生物扰动延长了有机质暴露于溶解氧的时间,据Cobler et al.[49]的分析,大约有75%抵达沉积物表面的有机质在生物扰动层中被分解破坏。水动力条件(风、波浪等)和生物扰动作用都可以使埋藏在沉积物表层的有机质发生再悬浮,再悬浮作用使有机质再次暴露于水体的溶解氧中。再悬浮作用的大小主要受湖泊动力比(湖泊面积平方千米数的平方根除以平均水深的米数)的控制,湖泊动力比越大,水底沉积物被风浪扰动的可能性越大[50]。对于季节性分层的湖泊,当湖水分层时,湖水底部缺氧,生物扰动减弱或者不存在,并且由于风浪 引起的沉积物再悬浮作用的次数较湖水循环时减少许多[51],故极大地减弱了有机质的破坏,有利于有机质的富集保存。因此较大的、湖水混合较好的湖泊沉积物再悬浮作用比中小型的、具有分层性的湖泊的再悬浮作用强。
2.2.2 水介质条件水介质条件的差异对有机质的分解保存的影响较大。酸性湖泊由于其中微生物细菌数量少,其数量只有非酸性湖泊的1/15[52],因此降低了有机质的降解速率,从而有利于有机质保存。盐碱性湖泊由于其中缺少底栖动物,因此不存在生物扰动作用,可以降低埋藏在沉积物中的有机质再次遭受氧化分解的机率。淡水湖泊盐度低,有机质沉降速率相对咸水较大,但该影响对最终保存在沉积物中有机质含量所起到的作用尚不明确。
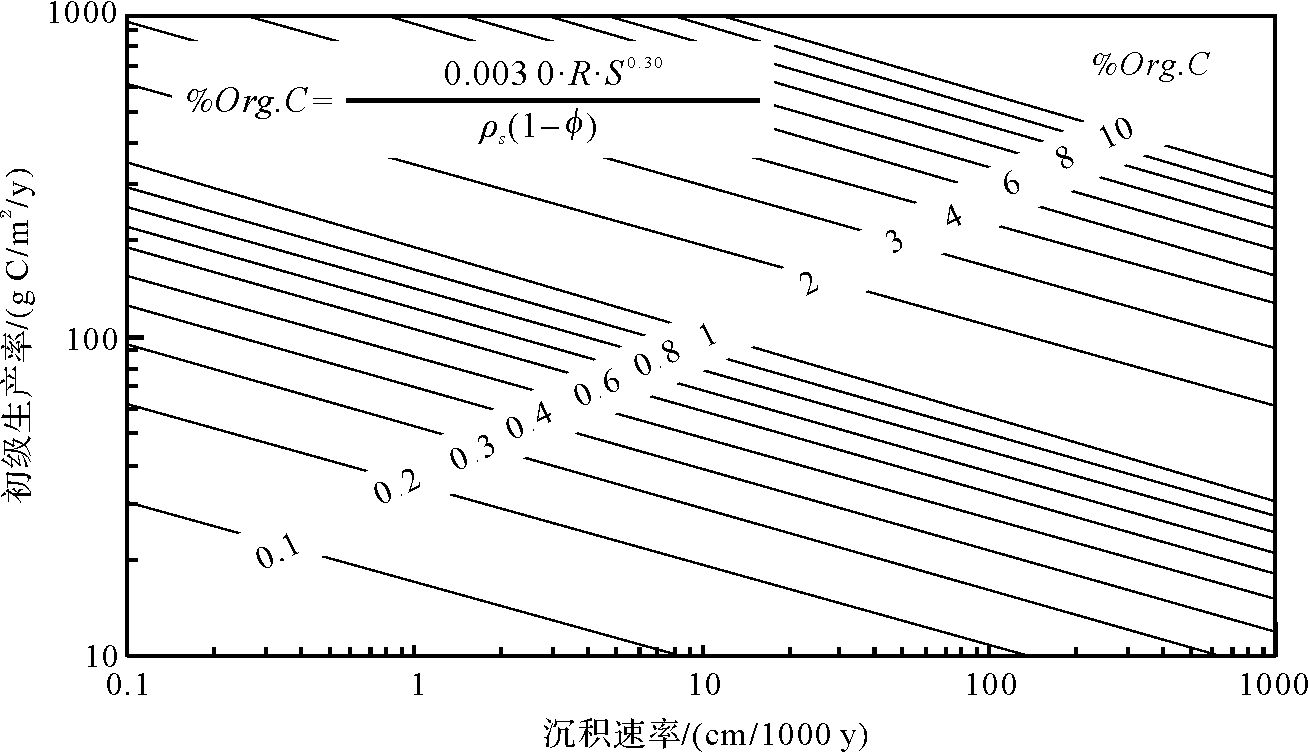
2.2.3 沉积速率Muller et al.[2]最早提出了沉积速率可以在很大程度上决定初级生产的有机质最终保存于沉积物中的含量,他们通过现代海相沉积物的一系列数据推导出了沉积速率、沉积物中有机碳含量和初级生产率三者之间的关系,如公式(1)及图 4所示。据图 4中可看出,沉积速率越高,沉积物中保存的原始生产的有机质含量就越大,这主要是由于沉积速率越大,沉降在水体沉积物表面的有机质埋藏的效率就越高,在氧化还原带中遭受的微生物分解破坏就越少,这些有机质可以快速的度过早成岩期而进入成岩后期,形成干酪根或者生成早期油气。
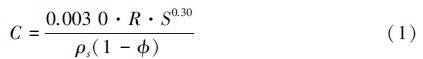
式中:R为初级生产率,g C/m2/y;C为有机碳含量,%;S为沉积速率,cm/1000 y;ρs为干燥的沉积物密度,g /cm3;Φ为孔隙度,%。
在远洋深海环境中,由于沉积速率极低,因而有机质保存率极低。太平洋中部沉积物中,仅0.01%的初级生产的有机质得到保存;而位于Peruvian陆架边缘的沉积物,由于沉积速率快,有10%~20%的初级生产的有机质得到保存。湖泊相比于海洋,其深度和规模大都远小于海洋,湖泊沉积物沉积速率比海洋高[24],因此湖泊具有更高的保存有机质的能力,更容易形成高丰度的烃源岩。某些小型湖泊底部沉积物中有机质含量可达到25%,某些营养水平中等较深的湖泊底部沉积物中有机质含量为10%。
沉积速率并非越大越好,沉积速率对有机质丰度的影响是双向的。Johnson Ibach[53]在探究古代海相沉积岩的沉积速率(SR)与岩石总有机碳含量(TOC)的关系时指出,两者的关系存在一临界值,当沉积速率小于该临界值时,沉积岩中TOC随着SR的增大而增大;当沉积速率大于该临界值时,沉积岩中TOC随着SR的增大而减小(详见本文第三部分关于有机质的稀释作用中的阐述)。
2.3 有机质的保存机制且存在有机质降解再缩聚、有机质自然硫化和有机质选择性保存三大有机质保存机制理论。近年来,学者们又提出矿物吸附保护有机质的新理论。而有机质氧化缩聚现象由于没有受到重视而没有形成理论。
2.3.1 有机质降解再缩聚该理论的提出始于学者们在土壤和沉积物中发现了大量腐殖质的存在,进而研究其成因和意义,该理论发展于20世纪六七十年代,形成于Tissot et al.[54]编纂的Petroleum,Formation and Occurrence一书。早期海洋学的研究者发现,海洋沉积有机质中含有30%~70%不等的腐殖质[55]。土壤中腐殖质也是有机质的主体。湖泊水体中40%~60%的溶解有机质都是水生腐殖质,为自然水体中有机物的最大组分。因此,腐殖质的形成对于高丰度烃源岩的形成具有重要的意义。
湖泊中腐殖质包括异地搬运和原地自生两种。异地搬运而来的腐殖质是陆源上原先已形成的腐殖质随着地表径流、河流流入湖泊;原地自生的腐殖质是湖泊生态系统产生的。无论哪种来源,腐殖质的形成必须经历三步:①微生物将溶解有机质分解成能够产生腐殖质分子的多个组分,如氨基酸、酚和醛等;②由醛、酚和氨基酸缩合成腐殖质单体分子;③由腐殖质单体分子继续缩聚成高级腐殖质分子[56, 57]。陆源和内生的区别在于陆源腐殖质大都是由高等植物的木质素先降解为酚类和醌类化合物,然后这些物质再与氨基酸以及其他分子一道聚合成腐殖质。而内生腐殖质是直接由水体中已存在的碳水化合物、氨基酸及其他简单分子一起直接缩聚成腐殖质[56]。
经缩聚后,原先可被生物直接利用的营养物质现在已变得不能被降解酶所识别,致使这些复杂的有机大分子物质逃离微生物的再分解而得以保存。烃源岩有机显微组分中观察到的一些无定形体有机质(浮游生物、细菌降解再缩聚产物)和无结构镜质体(高等植物木质素、纤维素降解凝胶化产物)往往是有机质降解再缩聚的产物。该理论解释了部分干酪根的形成是由生物物质的降解产物经过一系列随机而连续的再结合反应形成复杂的聚合物最终保存在沉积有机质当中。
2.3.2 有机质选择性保存有机质降解再缩聚理论是最早最传统的有机质保存理论,直到二十世纪七八十年代,越来越多的研究者发现一些沥青、干酪根、煤中存在着一些分子结构未被改变或稍被改变的生物大分子聚合物,通常为脂肪族大分子、纤维素、木质素、胶鞘、孢粉素等[58, 59],九十年代前后学者们提出了有机质选择性保存理论[60],用来解释那些经历了沉积和成岩过程后依旧保存在干酪根中的抗分解生物大分子。
Dubreuil et al.[59]对比研究了来自澳大利亚Darwin River油藏滨岸中的弹性藻沥青与该油藏中勃发的B.braunii藻属种的成分,结果表明70%的弹性藻沥青是由该微藻的细胞外壁物质,即胶鞘组成。胶鞘是一种不溶解且不水解的,高抗细菌分解的脂肪族生物大分子,因此可以在成岩的过程中得到选择性的保存。Hedges et al.[61]在研究不同控制因素对有机质保存的影响时将花粉颗粒在搬运、沉降、沉积和成岩等一系列过程中遭受的物理破坏百分比作为有机质降解的定性指标,主要是因为花粉壁物质(木质素、纤维素)和孢粉素都是非常抗生物分解的物质,甚至在经历了上亿年的厌氧埋藏也能保持完好的分子结构形态[62]。由于这些细胞壁物质的存在,一些包裹在其中的易降解的有机质,如多糖,多肽等可以得到保护而沉积在干酪根当中[60]。通常我们在显微镜中看到的结构完好,内部结构清晰的干酪根显微组分就是有机质选择性保存的结果。
2.3.3 有机质自然硫化20世纪七八十年代,研究者们在腐殖酸、干酪根、煤、沥青中发现了大量的有机硫的存在[56, 63, 64]。对于有机硫的形成有两种观点,一种是生物有机硫,即死亡的生物遗体细胞分解出的含硫有机物,主要是蛋白质、氨基酸和多肽等,然而这些物质很容易被微生物分解破坏[57];另一种是非生物有机硫,早期成岩时期,硫酸盐首先被硫酸盐还原菌还原为H2S或硫单质,随后生成的H2S和硫单质与有机物结合(通常为功能化脂类物质,如脂肪酸、甾类、乙醇类和烯烃类[64])得到高分子量的有机物质,新合成的有机物质由于硫置换了先前有机物中不稳定基团(氢氧化物或卤化物),或者将活性双键加成为饱和单键,随后又可以环状化和芳香化而使之变得更加稳定[54, 65],降低了有机质再次被分解的几率。
研究者根据有机硫的成因,认为后者的形成方式对于有机质的保存、烃源岩的形成非常有利。Nissenbaum et al.[56]通过化学和同位素证据证明了海相腐殖酸中的硫就是早期成岩过程中无机硫与有机物反应生成,并不是含硫有机物选择性保存下来的。Francois[63]研究了一个近滨岩芯中腐殖酸的S/C比,该比值随着沉积物深度的增加而增大,进一步证明了腐殖酸中有机硫为早期成岩的产物。需要注意的是,非生物有机硫的形成需在厌氧的环境下,并且水体或沉积物孔隙水中活性铁含量低,或是硫酸盐含量高,因为硫酸盐的还原是在绝对厌氧环境中进行的,且在动力学上,亚铁离子与硫化氢的反应要先于有机质的硫化[66]。因此,有机硫多出现在海洋沉积物中或者有膏盐来源的湖泊里。
2.3.4 矿物吸附保护有机质早在20世纪60年代已有学者在研究土壤矿物时发现黏土矿物对有机质有吸附作用,两者通过阳离子交换结合成化学性质非常稳定的复合体,从而阻碍了有机质的矿化和微生物的分解[67]。然而这一研究并未受到地质学家的重视,直到20世纪90年代地质学家才开始广泛的注意到黏土矿物吸附有机质的机理与矿物比表面积有关[68, 69]。不同地区现代海岸沉积物中有机碳含量随着沉积物埋深的增加而减小,并且减小到一稳定的背景基值则不再变化,而这一稳定的背景基值与黏土矿物比表面积之间存在着非常良好的正相关性,说明黏土矿物吸附有机质的能力取决于其比表面积[68, 69]。
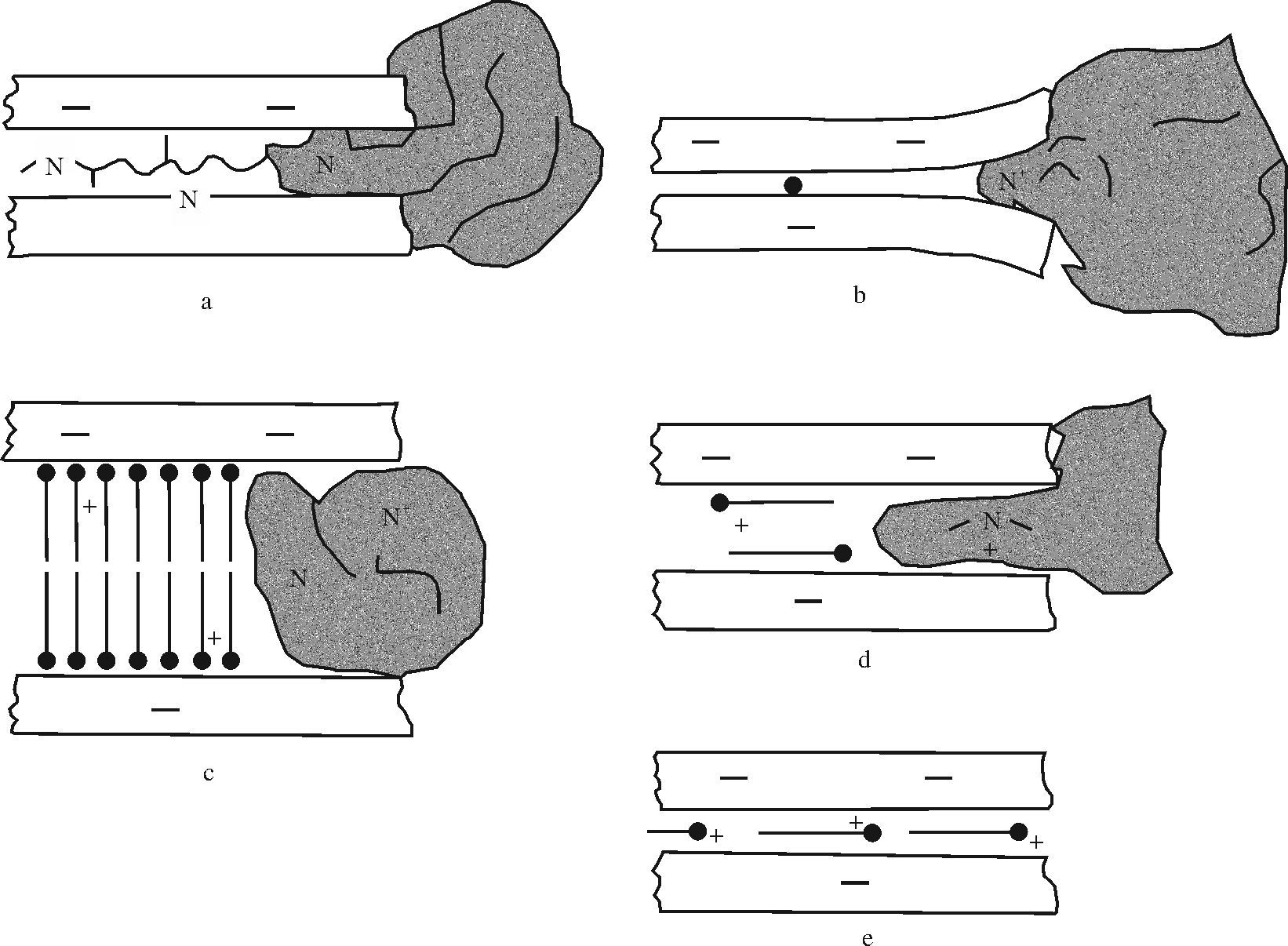
大量实验表明有机质与黏土矿物的结合是一种物理化学作用,它们以氢键、离子偶极力、静电作用和范德华力等方式结合成有机黏土复合体[67, 70]。图 5中显示的是蛋白质(有机质)与钙蒙脱石以阳离子交换的形式结合形成的有机质黏土复合体[71]。有机质可以吸附于黏土矿物外表面,也可以进入黏土矿物晶体结构层间,而后者的化学、生物性质相比于前者更加稳定。它不仅不易被强氧化剂(H2O2)氧化,也不易溶于有机溶剂(CH3Cl)[8, 9, 10]。其化学稳定性的研 究主要集中在2000—2010年间,但仅停留在猜测阶段,直到2012年于炳松等通过微生物降解蒙脱石层间吸附有机质的实验才真正证实了有机质黏土矿物复合体的生物稳定性。实验证明,这种复合体能有效阻碍微生物分泌的有机酸对其中有机质的降解,同时也能较好的抑制微生物对其内部结构的破坏,从而降低因复合体内部结构破坏而释放出黏土矿物层间有机质的量[72]。这样一种复合体在经历了漫长的地质埋藏后同样具有保护有机质的作用,如埋藏2.5 Ma的洛川黄土/古土壤中有机碳含量与黏土矿物含量具有较好的相关性[73],意大利中部Umbria-Marche盆地塞诺曼阶(距今约92 Ma)黑页岩去除未被黏土矿物吸附的有机质后,暴露于氧化环境中,被黏土矿物吸附的有机质依旧能够很好的保存[8]。如果是在埋藏过程中,地温梯度达到有机质热演化的门限温度,吸附于黏土矿物表面的有机质将会演化生烃。
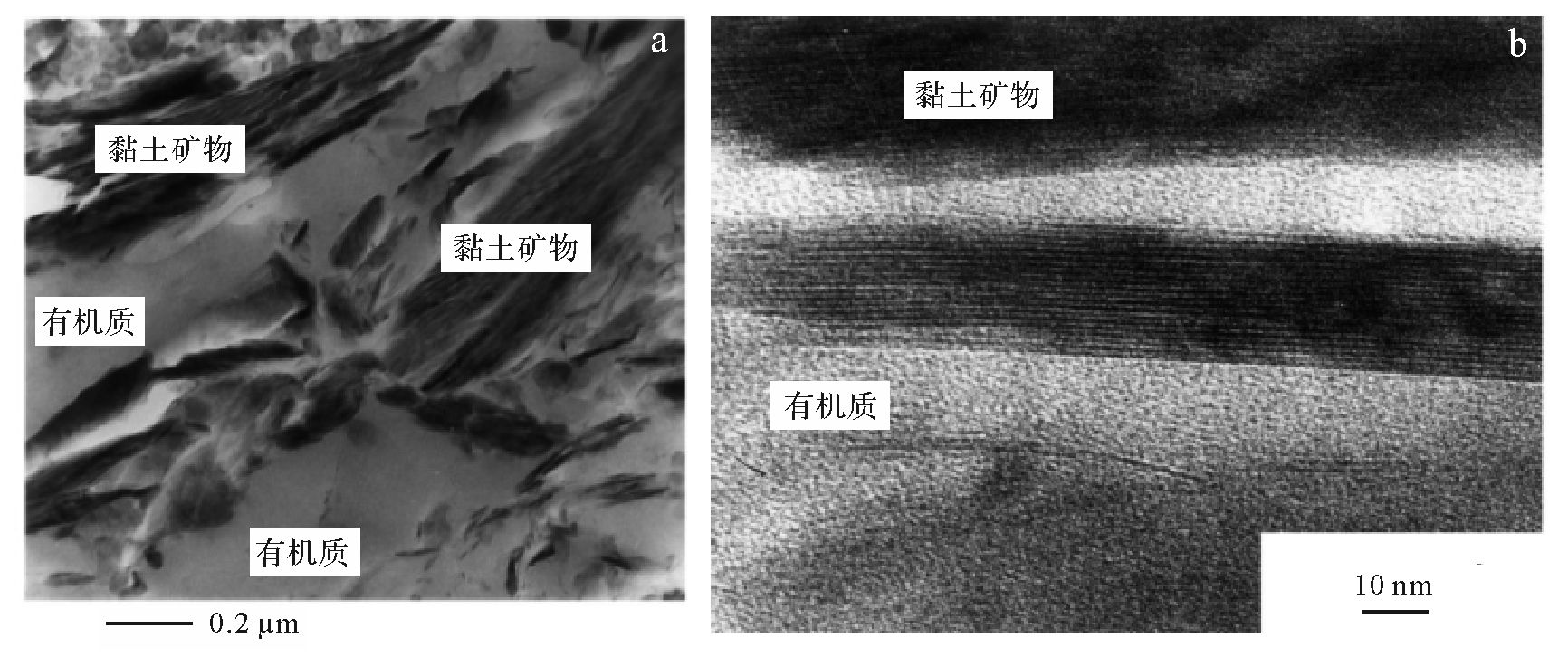
黏土矿物中,吸附有机质能力强的是2∶1型矿物(蒙脱石),晶层间是以较弱的范德华力相连,有机质容易介入,而1∶1型矿物(高岭石),其晶层间是以较强的氢键相连,故有机质不易介入。蒙脱石的外表面积类似于其他黏土矿物和细粒矿物,但其结构层内的表面积可比外表面积高1~2个数量级。蒙脱石的比表面积可高达900 m2/g,而高岭石和石英粉砂通常小于10 m2/g[74]。因此,若沉积物中含有中等含量的蒙脱石时,蒙脱石将是总的矿物比表面积的主要贡献者。图 6 TEM(Transmission Electron Microscopy)和HRTEM(High Resolution Transmission Electron Microscopy)显微照片显示了有机质与黏土矿物(伊利石)紧密接触关系,样品为晚白垩世的泥岩[8]。
富集于黏土矿物中的有机质比富集于粗粒级(φ1~φ3)陆源碎屑中的有机质更稳定。后者以颗粒有机质的形式通过其自身重量,在沉积时逐步下沉,形成与长石、石英等碎屑颗粒共生松散的组合关系,经简单的筛选就可将二者彼此分离。因此粗粒级中的沉积物不易得到保存。
黏土矿物对有机质的保护对于石油地质有着重要的意义。吸附于黏土矿物表面,尤其是吸附于黏土矿物层间(蒙脱石晶体结构层间)的有机质,由于较好的抑制了埋藏早期氧化剂及微生物对其的降解作用,因此能较好的保存在深埋藏环境中。高岭石在埋深的过程中逐渐消失,而蒙脱石随着埋深的增加逐渐转变为伊利石,由于晶体结构的改变,会逐渐排出吸附于其层间的有机质,同时因温度的升高,这些有机质逐渐转变为烃类。因此,蒙脱石对有机质的层间吸附作用是烃源岩中有机质保存的有效机制之一。
2.3.5 有机质氧化缩聚早在1993年Gatellier等就发现了干酪根样品中的某些成分是由原本存在于生物体中的(C27、C29、C31)二烯烃、(C27、C29、C31)三烯烃和醚脂在氧化条件下,早成岩阶段经过氧化缩聚(氧键交联)而形成不溶于酸碱、难降解的大分子物质[75]。而这种保存方式却一直未能引起人们的注意。
直到2000年Stankiewicz等再次发现这种氧化缩聚成因的脂肪族聚合物。现代节肢动物角质层中富含蛋白质和几丁质,而缺少脂肪结构的有机物,然而在一些第三纪、第四纪的节肢动物化石中可以看到其角质层中含有大量脂肪族聚合物。热解实验发现,这些脂肪族大分子聚合物可在实验加热的过程中通过含醚键脂肪类化合物(游离脂肪酸)与易分解的生物大分子(蛋白质、几丁质)氧化缩聚而成[76]。Gupta et al.[77]指出动物化石中脂肪族聚合物中的脂肪结构部分可能是由易分解的脂类先质(游离脂肪酸等)通过醚键原地氧化缩聚而成,而参与反应的蛋白质、几丁质首先必须经过降解,脂类物质才可以与其结合生成聚合物。该反应机制对于动、植物中脂类物质,尤其是易分解脂类的保存有着重要的意义,是构成I型和II型干酪根的重要组成成分。
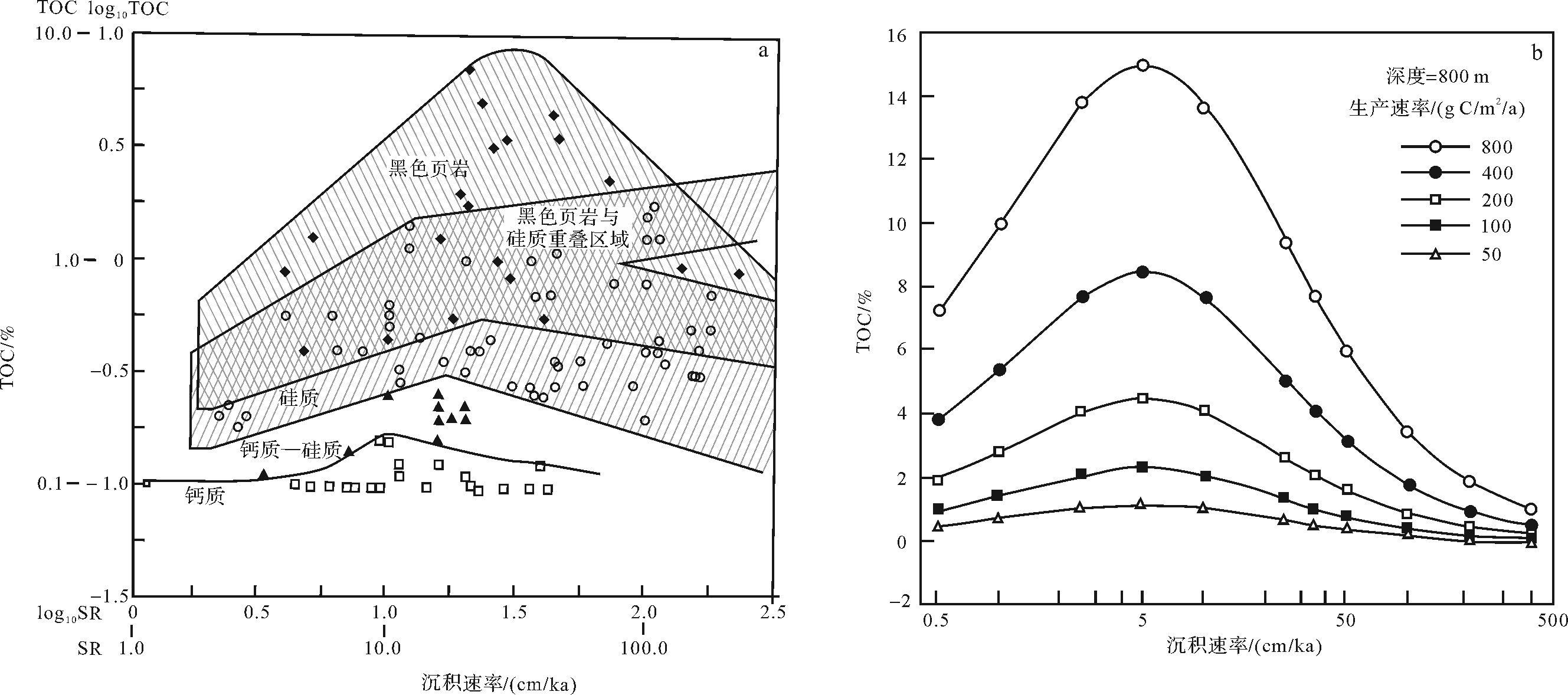
3 有机质的稀释作用有机质稀释指由于碳酸盐矿物或碎屑矿物的输入对有机质的稀释造成单位沉积物中含有的有机质量的减少,而沉积速率对有机质稀释具有重要的影响。Johnson Ibach(1982)研究结果表明,古代海相沉积物不同的岩相沉积速率对有机质起稀释作用的临界值(小于该值,SR与TOC成正相关关系,大于该值,二者成负相关关系)不同,钙质泥岩、硅质泥岩、黑色页岩沉积速率的临界值依次增大,变化范围为1.5~4 cm/ka [53],见图 7(a)。他认为这三类岩性各自所反映的沉积时期有机质所处的氧化还原环境是影响岩石总有机碳含量与沉积速率之间关系的主要原因。钙质岩类渗透性最好,沉积剖面垂向上有机质氧化分解序列中的氧化带和硫酸盐还原带最宽,最不利于有机质的保存,因此其沉积速率对有机质起稀释作用的临界值最小;硅质岩类渗透性次之;黑色页岩渗透性最差,故黑色页岩最有利于有机质的保存,其沉积速率对有机质起稀释作用的临界值最大。
Tyson[78]定量研究了现代海相沉积物有机碳含量与沉积速率之间的关系,见图 7b。当沉积速率小于5 cm/ka时,沉积速率对有机质起保护作用,沉积物中有机质的含量随着沉积速率的增大而增大;当沉积速率大于5 cm/ka时,沉积速率对有机质起稀释作用,沉积物中有机质的含量随着沉积速率的增大而减小。当沉积速率小于10 cm/ka时,缺氧的沉积环境下沉积物中有机质含量是有氧环境的2.5~4倍;而当沉积速率大于35 cm/ka时,沉积速率对沉积物中有机质含量的作用几乎不受含氧或缺氧环境的影响。沉积速率对有机质的稀释效应受水体含氧条件的影响[53, 78, 79]。当底部水体缺氧时,沉积速率对有机质起稀释作用的临界值比水体含氧时高。因缺氧时,相对有更多的有机质得到保存,稀释这些有机质需要更高的沉积速率带来更多的碎屑矿物或者碳酸盐矿物。这是黑色页岩沉积速率的临界值比钙质泥岩和硅质泥岩都高的原因。
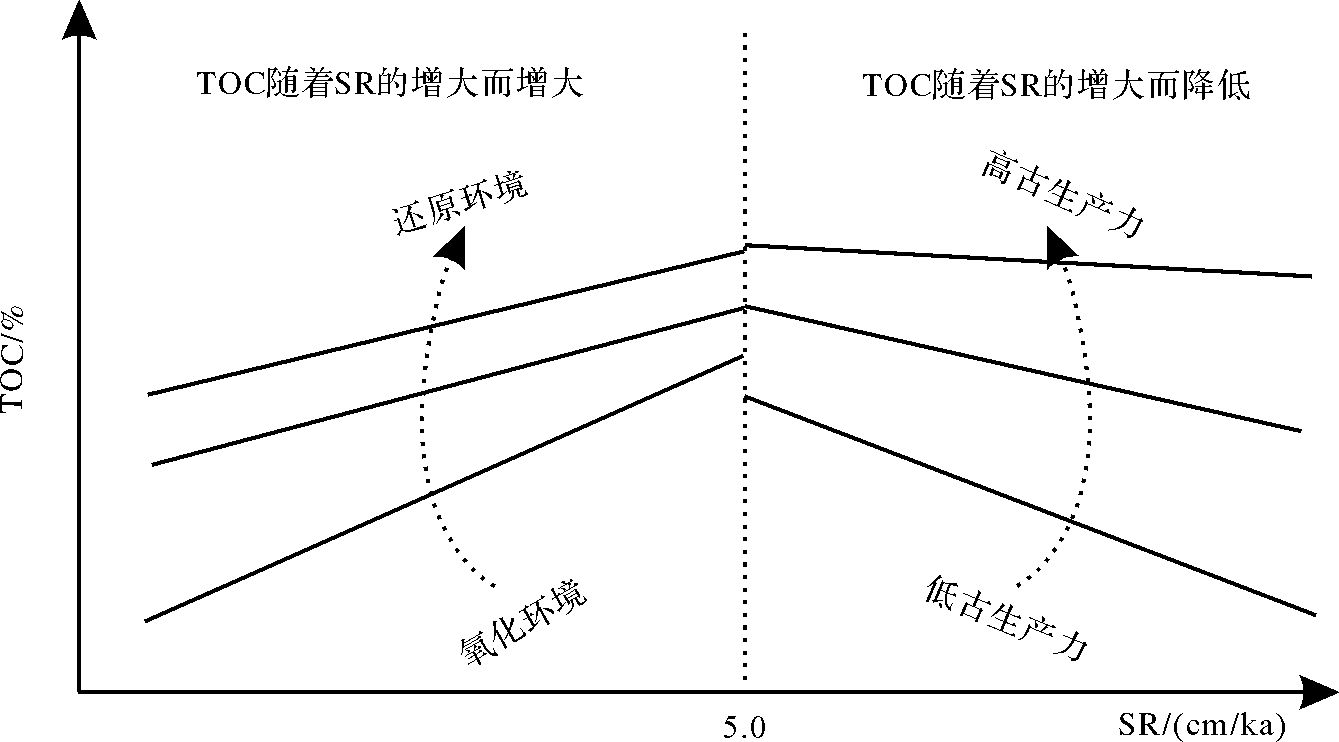
关于海相沉积物沉积速率与有机碳含量关系的研究已有近40年的历史[2, 53, 78, 79],并且初步建立了利用沉积速率求取初级生产率、有机碳含量的关系式,但关于沉积速率对湖相沉积物有机碳含量影响的研究较少,Ding et al.[80]对中国北部二连盆地的8个二级古代陆相湖盆的沉积速率与岩石总有机碳含量之间关系进行了研究,其结果与Tyson[78]的研究结果相似,二者的临界值也为5 cm/ka。但是Ding et al.的研究进一步指出当沉积速率对有机质起保护作用时(即SR<5 cm/ka),沉积速率与有机质的关系受沉积时的氧化还原环境的控制,氧化环境下的TOC随沉积速率增大而增长的幅度较还原环境下的更大;当沉积速率对有机质起稀释作用时(即SR>5 cm/ka),沉积速率与有机质的关系受有机质生产率的控制,低有机质生产率条件下的TOC随沉积速率的增大而降低的幅度较高有机质生产率条件下的更大,见图 8。
沉积速率对沉积物中所含有机质丰度的影响无论在何种沉积体系中均存在。在沉积速率低的沉积体系或沉积环境中,有机质暴露于溶解氧的时间长,经历的早期成岩作用的时间长,有更多的有机质被分解矿化,因而保存下来的比例较低。在沉积速率高的沉积体系或沉积环境中,有机质仅经过短暂的暴露,经历短暂的早期成岩作用期就被埋藏。若沉积速率过高,向盆地中输入的有机质含量跟不上碎屑矿物或碳酸盐矿物含量,则会导致有机质的稀释,降低单位沉积物中有机质的比例。但也有特例,若此时生物繁殖生产的有机质的量也较高,则可以平衡无机矿物的输入量[53],沉积物中有机质的量可以达到一个较高水平。这种情况在湖泊中通常表现为藻类勃发式生长,有机质“脉冲式”沉积。
笔者基于上文中的研究,获得有利于有机质富集的条件及不利于有机质富集的条件,具体见表 3所示。
| 有利于有机质富集的条件 | 不利于有机质富集的条件 | 实例 | |
| 有机质生产 | 光照率高的高纬度地区湖泊 | 光照率低的低纬度地区湖泊 | 表 1:不同纬度湖泊年平均生产力 |
| 营养盐供给充足:湖盆周边岩石类型为不易风化的钙质磷酸盐、硝酸盐类;温度高利于岩石的化学风化;较陡湖盆地貌利于岩石的物理风化 | 营养盐供给不足:湖盆周边岩石类型为不易风化的硅质磷酸盐、硝酸盐等;低温降低岩石的化学风化速率;湖盆地貌平缓使岩石表面附着较厚的风化土壤,降低岩石的物理风化速率,从而阻碍岩石的化学风化速率 | 冰岛流域和夏威夷流域岩石风化速率对比 | |
| 水介质条件:碱性湖水(增加CO2、营养盐的溶解度)、咸水(增加生物体内有机质的合成)、富营养化的淡水(生物量增大) | 酸性水体(抑制生物的生存);过咸的水体(死海) | 犹他州的大盐湖北部(咸水);印度的Ana Sagar湖(富营养化后的淡水) | |
| 藻类季节性勃发(有机质“脉冲式”沉积) | — | 济阳坳陷沙河街组烃源岩;美国绿河组页岩 | |
| 有机质分解与保存 | 分层的水体(垂向上还原带的范围更大) | 循环性好、氧化环境的水体 | — |
| — | 沉积物中硫酸盐浓度高(硫酸盐还原菌消耗有机质的能力非常强) | 犹他州的大盐湖 | |
| — | 生物扰动和再悬浮作用 | — | |
| 黏土矿物(吸附保护有机质) | — | 意大利中部 Umbria-Marche盆地赛诺 曼阶黑页岩 | |
| 适宜的沉积速率(小于5 cm/ka) | — | Johnson Ibach(1982); | |
| 有机质的稀释作用 | — | 较高的沉积速率(大于5 cm/ka) | Tyson(2001) Ding et al.(2015) |
笔者从有机质的生产、分解与保存以及有机质的稀释三方面对湖泊沉积物中有机质丰度的控制因素进行总结,并对各方面如何控制有机质的丰度进行了详细介绍。
湖泊生产力除受最基本的光照和营养盐输入的影响外,还受湖盆的规模、周缘围岩岩性、湖盆的构造形态、湖泊水介质条件以及湖盆当时所处的气候条件等的影响。地形较陡、围岩存在硝酸盐、磷酸盐物质的来源、湖水为碱性半咸水或咸水、处于暖湿气候条件时,湖泊可具有较高的生产力。此外,藻类勃发式生长极大提高了湖泊生产力,该模式非常有利于优质烃源岩的形成,自养型微生物在某些湖泊中也可以创造较高的生产力。
有机质的分解与保存过程中,氧化条件对有机质的消耗最厉害,硫酸盐还原菌消耗有机质的能力不亚于需氧微生物消耗有机质的能力,甲烷细菌消耗有机质的能力有限。生物扰动、沉积物再悬浮、湖泊的水介质、沉积速率等都会影响有机质在早期成岩过程中遭受的分解破坏的时间长短。缺氧、硫酸盐含量低的水体、湖泊规模中等、沉积速率较高时,生物的扰动和沉积物再悬浮作用弱,有机质氧化分解作用小,快速埋藏的能力强。
较高的沉积速率对有机质有稀释作用,盆地中输入的有机质含量跟不上碎屑矿物或碳酸盐矿物的含量,致使单位沉积物中有机质的比例降低,该现象在生产力低的湖盆中表现的更为明显。
湖泊沉积物中有机质的丰度实际是“有机质生产—有机质分解—有机质稀释”三者相互作用的结果。影响着有机质生产的水介质条件又影响着有机质的分解和保存;湖水中生物自身在提供有机质时也会消耗有机质,生物的活动也会影响有机质的保存;气候在影响有机质生产的同时也影响湖水的分层,从而影响有机质的分解与保存;沉积速率既可保护有机质也可稀释有机质。因此,高丰度的烃源岩往往是这三者最佳组合关系的结果。
该论文在研究过程中也存在一些问题:①在有机质生产部分,一些学者发现自养型细菌可以创造较高的生产力,但具体在何种环境下自养型细菌可以创造较高的生产力尚不明确;②在有机质分解与保存部分,没有弄清楚不同的水介质条件(酸性、碱性、淡水、咸水)分别对有机质的分解与保存产生什么样的影响。
希望这些问题在以后的研究中可以得到解决。
| [1] | Bruyevich S U. Rates of mineralization of suspended organic matter in the low latitudes of the Pacific during the predepositional stage[J]. Geochimica et Cosmochimica Acta, 1963, 3: 349-352. |
| [2] | Müller P J, Suess E. Productivity, sedimentation rate, and sedimentary organic matter in the oceans—I. Organic carbon preservation[J]. Deep Sea Research Part A. Oceanographic Research Papers, 1979, 26(12): 1347-1362. |
| [3] | Calvert S E. Oceanographic controls on the accumulation of organic matter in marine sediments[J]. Geological Society, London, Special Publications, 1987, 26(1): 137-151. |
| [4] | Meyers P A, Ishiwatari R. Lacustrine organic geochemistry—an overview of indicators of organic matter sources and diagenesis in lake sediments[J]. Organic Geochemistry, 1993, 20(7): 867-900. |
| [5] | 拜文华,吴彦斌,高智梁,等. 浅湖—半深湖相湖湾环境油页岩成矿富集机理研究[J]. 地质调查与研究,2010,33(3):207-214. [Bai Wenhua, Wu Yanbin, Gao Zhiliang, et al. Study on the mechanism of oil shale minerogenetic enrichment in the arm of shallow to half-deep lake depositional environment[J]. Geological Survey and Research, 2010, 33(3): 207-214.] |
| [6] | Suess E. Interaction of organic compounds with calcium carbonate-II. Organo-carbonate association in recent sediments[J]. Geochimica et Cosmochimica Acta, 1973, 37(11): 2435-2447. |
| [7] | Mayer L M, Rahaim P T, Guerin W, et al. Biological and granulometric controls on sedimentary organic matter of an intertidal mudflat[J]. Estuarine, Coastal and Shelf Science, 1985, 20(4): 491-503. |
| [8] | Salmon V, Derenne S, Lallier-Vergès E, et al. Protection of organic matter by mineral matrix in a Cenomanian black shale[J]. Organic Geochemistry, 2000, 31(5): 463-474. |
| [9] | 蔡进功,徐金鲤,扬守业,等. 泥质沉积物颗粒分级及其有机质富集的差异性[J]. 高校地质学报,2006,12(2):234-241. [Cai Jingong, Xu Jinli, Yang Shouye, et al. The fractionation of an argillaceous sediment and difference in organic matter enrichment in different fractions[J]. Geological Journal of China Universities, 2006, 12(2): 234-241.] |
| [10] | 蔡进功,包于进,杨守业,等. 泥质沉积物和泥岩中有机质的赋存形式与富集机制[J]. 中国科学(D辑):地球科学,2007,37(2):234-243. [Cai Jingong, Bao Yujin, Yang Shouye, et al. Research on preservation and enrichment mechanisms of organic matter in muddy sediment and mudstone[J]. Science China (Seri.D): Earth Sciences, 2007, 37(2): 234-243.] |
| [11] | 陈笑夜,曹剑,施春华,等. 陆相湖盆海侵地质事件识别及其对烃源岩形成影响[J]. 地质论评,2012,58(5):901-910. [Chen Xiaoye, Cao Jian, Shi Chunhua, et al. A review on the distinguishing of marine transgression in continental basins and its impacts on the formation of hydrocarbon source rocks[J]. Geological Review, 2012, 58(5): 901-910.] |
| [12] | 侯读杰,冯子辉,黄清华. 松辽盆地白垩纪缺氧地质事件的地质地球化学特征[J]. 现代地质,2003,17(3):311-317. [Hou Dujie, Feng Zihui, Huang Qinghua. Geological and geochemical evidence of anoxic event in the Songliao Basin, China[J]. Geoscience, 2003, 17(3): 311-317.] |
| [13] | Katz B J. Factors controlling the development of lacustrine petroleum source rock-an update[J]. AAPG Studies in Geology, 1995, 40: 61-79. |
| [14] | Parrish J T. Paleogeography of Corg-rich rocks and the preservation versus production controversy[J]. AAPG Studies in Geology, 1995, 40: 1-20. |
| [15] | Harris N B, Freeman K H, Pancost R D, et al. The character and origin of lacustrine source rocks in the Lower Cretaceous synrift section, Congo Basin, west Africa[J]. AAPG Bulletin, 2004, 88(8): 1163-1184. |
| [16] | Gonçalves F T T. Organic and isotope geochemistry of the Early Cretaceous rift sequence in the Camamu Basin, Brazil: paleolimnological inferences and source rock models[J]. Organic Geochemistry, 2002, 33(1): 67-80. |
| [17] | Meybeck M. Composition chimique des ruisseaux non pollués de France[J]. Sci. Geol. Bull., 1986, 39: 3-77. |
| [18] | Bluth G J S, Kump L R. Lithologic and climatologic controls of river chemistry[J]. Geochimica et Cosmochimica Acta, 1994, 58(10): 2341-2359. |
| [19] | Riebe C S, Kirchner J W, Granger D E, et al. Strong tectonic and weak climatic control of long-term chemical weathering rates[J]. Geology, 2001, 29(6): 511-514. |
| [20] | Jacobson A D, Blum J D. Relationship between mechanical erosion and atmospheric CO2 consumption in the New Zealand Southern Alps[J]. Geology, 2003, 31(10): 865-868. |
| [21] | Schindler D W. Biogeochemical evolution of phosphorus limitation in nutrient-enriched lakes of the Precambrian shield[C]//Nriagu J O. Environmental Biogeochemistry, Metals Transfer and Ecological Mass Balances. Ann Arbor, Mich: Ann Arbor Science Publishers, 1976, 2: 647-664. |
| [22] | 王云飞,朱育新,潘红玺,等. 云南腾冲青海——酸性湖泊的环境特征[J]. 湖泊科学,2002,14(2):117-124. [Wang Yunfei, Zhu Yuxin, Pan Hongxi, et al. Environmental characteristics of an acid Qinghai Lake in Tengchong, Yunnan province[J]. Journal of Lake Sciences, 2002, 14(2): 117-124.] |
| [23] | Driscoll Jr C T, Baker J P, Bisogni J J, et al. Effect of aluminium speciation on fish in dilute acidified waters[J]. Nature, 1980, 284(5752): 164-164. |
| [24] | Kelts K. Environments of deposition of lacustrine petroleum source rocks: an introduction[J]. Geological Society, London, Special Publications, 1988, 40(1): 3-26. |
| [25] | Eugster H P. Oil shales, evaporites and ore deposits[J]. Geochimica et Cosmochimica Acta, 1985, 49(3): 619-635. |
| [26] | 张亚丽,席北斗,许秋瑾. 盐度作为咸水湖富营养化基准指标的可能性初探[J]. 环境工程技术学报,2011,1(3):260-263. [Zhang Yali, Xi Beidou, Xu Qiujin. Research on the possibility of using salinity as entrophication criteria indicator of Saline Lakes[J]. Journal of Environmental Engineering Technology, 2011, 1(3): 260-263.] |
| [27] | 陈峰,姜悦. 微藻生物技术[M]. 北京:中国轻工业出版社,1999:151-153. [Chen Feng, Jiang Yue. Biotechnology of Microalgae[M]. Beijing: China Light Industry Press, 1999: 151-153.] |
| [28] | 张平,柯爱英,黄振华,等. 盐度对牟氏角毛藻生产性培养的影响[J]. 现代农业科技,2008(12):245-247. [Zhang Ping, Ke Aiying, Huang Zhenhua, et al. Effects of salinity on Chaetoceros muelleri productive culture[J]. Modern Agricultural Science and Technology, 2008(12): 245-247.] |
| [29] | Koli V K, Ranga M M. Physicochemical status and primary productivity of Ana Sagar Lake, Ajmer (Rajasthan), India[J]. Universal Journal of Environmental Research & Technology, 2011, 1(3): 286-292. |
| [30] | Kelts K, Hsü K J. Freshwater carbonate sedimentation[M]//Lerman A. Lakes: Chemistry, Geology, Physics. New York: Springer, 1978: 295-323. |
| [31] | Hay B J, Honjo S, Kempe S, et al. Interannual variability in particle flux in the southwestern Black Sea[J]. Deep Sea Research Part A. Oceanographic Research Papers, 1990, 37(6): 911-928. |
| [32] | 王冠民. 古气候变化对湖相高频旋回泥岩和页岩的沉积控制—以济阳坳陷古近系为例[D]. 北京:中国科学院研究生院,2005. [Wang Guanmin. The sedimentary control to mudstone and shale in lacustrine high-frequency cycle by paleoclimate change-taking the Eogene in Jiyang depression as an example[D]. Beijing: University of Chinese Academy of Sciences, 2005.] |
| [33] | Hecky R E, Kling H J. The phytoplankton and protozooplankton of the euphotic zone of Lake Tanganyika: species composition, biomass, chlorophyll content, and spatio-temporal distribution[J]. Limnology and Oceanography, 1981, 26(3): 548-564. |
| [34] | 宿晶. 陆相烃源岩有机质微观赋存方式的认识——以济阳坳陷下第三系为例[D]. 长沙:中南大学,2007. [Su Jing. On the microscopic patterns of the continental hydrocarbon source rock organic matter—Take the Lower Tertiary of Jiyang depression as an example[D]. Changsha: Central South University, 2007.] |
| [35] | Hanselmann K W. Microbially mediated processes in environmental chemistry: lake sediments as model systems[J]. Chimia, 1986, 40: 146-159. |
| [36] | Hammer U T. Saline Lake Ecosystems of the World[M]. Netherlands: Springer Science & Business Media, 1986. |
| [37] | Cohen Y, Krumbein W E, Shilo M. Solar Lake (Sinai). 3. Bacterial distribution and production[J]. Limnology and Oceanography, 1977, 22(4): 621-634. |
| [38] | 陈文新. 土壤和环境微生物学[M]. 北京:北京农业大学出版社,1990. [Chen Wenxin. Soil and Environmental Microbiology[M]. Beijing: Beijing Agricultural University Press, 1990.] |
| [39] | Keast A, Eadie J. Growth in the first summer of life: a comparison of nine co-occurring fish species[J]. Canadian Journal of Zoology, 1984, 62(7): 1242-1250. |
| [40] | Froelich P N, Klinkhammer G P, Bender M L, et al. Early oxidation of organic matter in pelagic sediments of the eastern equatorial Atlantic: suboxic diagenesis[J]. Geochimica et Cosmochimica Acta, 1979, 43(7): 1075-1090. |
| [41] | 罗莎莎. 云贵高原湖泊近代沉积作用的Fe、Mn、S指示[D]. 贵阳:中国科学院地球化学研究所,2001. [Luo Shasha. The geochemical indication of Fe, Mn and S in recent lacustrine sediments on Yun-Gui plateau[D]. Guiyang: Institute of Geochemistry Chinese Academy of Sciences, 2001.] |
| [42] | 施春华,颜佳新,韩欣. 早期成岩作用过程中硫酸盐还原反应研究进展[J]. 广西地质,2001,14(1):21-26. [Shi Chunhua, Yan Jiaxin, Han Xin. Development of sulfate reduction during early diagenesis[J]. Guangxi Geology, 2001, 14(1): 21-26.] |
| [43] | Glenn C R, Arthur M A. Sedimentary and geochemical indicators of productivity and oxygen contents in modern and ancient basins: the Holocene Black Sea as the “type” anoxic basin[J]. Chemical Geology, 1985, 48(1/2/3/4): 325-354. |
| [44] | Simon A, Poulicek M, Velimirov B, et al. Comparison of anaerobic and aerobic biodegradation of mineralized skeletal structures in marine and estuarine conditions[J]. Biogeochemistry, 1994, 25(3): 167-195. |
| [45] | Reeburgh W S. Anaerobic methane oxidation: rate depth distributions in Skan Bay sediments[J]. Earth and Planetary Science Letters, 1980, 47(3): 345-352. |
| [46] | Livingstone D A. Chemical composition of rivers and lakes[R]. Professional Paper, PP-440-G, US Government Printing Office, 1963. |
| [47] | Davison W. Interactions of iron, carbon and sulphur in marine and lacustrine sediments[M]//Fleet A J. Lacustrine Petroleum Source Rocks. London: Geological Society Special Publication, 1988. |
| [48] | Jørgensen B B, Kasten S. Sulfur cycling and methane oxidation[M]//Schulz H D, Zabel M. Marine Geochemistry. Berlin: Springer-Verlag, 2006: 271-309. |
| [49] | Cobler R, Dymond J. Sediment trap experiment on the Galápagos spreading center, Equatorial Pacific[J]. Science, 1980, 209(4458): 801-803. |
| [50] | Bachmann R W, Hoyer M V, Canfield D E. The potential for wave disturbance in shallow Florida lakes[J]. Lake and Reservoir Management, 2000, 16(4): 281-291. |
| [51] | 蒋增杰. 浅海贝藻养殖水域沉积物再悬浮的发生机制及生态效应[D]. 青岛:中国科学院研究生院(海洋研究所),2008. [Jiang Zengjie. Dynamic mechanism of sediment resuspension and its ecological effects on polyculture of shellfish & macroalgae in shallow sea[D]. Qingdao: University of Chinese Academy of Sciences, 2008.] |
| [52] | 晓闻. 酸性和非酸性湖泊的沉积物中微生物的活动与贡献[J]. 环境科学研究,1988(3):28. [Xiao Wen. Microbial activity and contribution in acidic and non-acidic lake sediments[J]. Environmental Science Research, 1988(3): 28.] |
| [53] | Ibach L E J. Relationship between sedimentation rate and total organic carbon content in ancient marine sediments[J]. AAPG Bulletin, 1982, 66(2): 170-188. |
| [54] | Tissot B P, Welte D H. Petroleum Formation and Occurrence[M]. Berlin: Springer, 1984. |
| [55] | Degens E T, Reuter J H, Shaw K N F. Biochemical compounds in offshore California sediments and sea waters[J]. Geochimica et Cosmochimica Acta, 1964, 28(1): 45-66. |
| [56] | Nissenbaum A, Kaplan I R. Chemical and isotopic evidence for the in situ origin of marine humic substances[J]. Limnology and Oceanography, 1972, 17(4): 570-582. |
| [57] | 窦森,王帅. 不同微生物对形成不同腐殖质组分的差异性研究进展[J]. 吉林农业大学学报,2011,33(2):119-125. [Dou Sen, Wang Shuai. Review of different microorganisms effect on humus formation[J]. Journal of Jilin Agricultural University, 2011, 33(2): 119-125.] |
| [58] | Largeau C, Derenne S, Casadevall E, et al. Pyrolysis of immature Torbanite and of the resistant biopolymer (PRB A) isolated from extant alga Botryococcus braunii. Mechanism of formation and structure of torbanite[J]. Organic Geochemistry, 1986, 10(4/5/6): 1023-1032. |
| [59] | Dubreuil C, Derenne S, Largeau C, et al. Mechanism of formation and chemical structure of Coorongite-I. Role of the resistant biopolymer and of the hydrocarbons of Botryococcus braunii. Ultrastructure of Coorongite and its relationship with torbanite[J]. Organic Geochemistry, 1989, 14(5): 543-553. |
| [60] | Tegelaar E W, De Leeuw J W, Derenne S, et al. A reappraisal of kerogen formation[J]. Geochimica et Cosmochimica Acta, 1989, 53(11): 3103-3106. |
| [61] | Hedges J I, Keil R G. Organic geochemical perspectives on estuarine processes: sorption reactions and consequences[J]. Marine Chemistry, 1999, 65(1/2): 55-65. |
| [62] | Pehlivan E, Yildiz S. Modified sporopollenin as a novel anion, cation and ligand exchange medium[J]. Analytical Letters, 1988, 21(2): 297-309. |
| [63] | Francois R. A study of sulphur enrichment in the humic fraction of marine sediments during early diagenesis[J]. Geochimica et Cosmochimica Acta, 1987, 51(1): 17-27. |
| [64] | Damsté J S S, Eglinton T I, De Leeuw J W, et al. Organic sulphur in macromolecular sedimentary organic matter: I. structure and origin of sulphur-containing moieties in kerogen, asphaltenes and coal as revealed by flash pyrolysis[J]. Geochimica et Cosmochimica Acta, 1989, 53(4): 873-889. |
| [65] | 郝晓晨. 东海陆架泥质沉积物黄铁矿硫、有机硫及其硫同位素地球化学[D]. 青岛:中国海洋大学,2012. [Hao Xiaochen. Geochemistry and isotope systematics of pyritic and organic sulfur in mud sediments of the East China Sea shelf[D]. Qingdao: Ocean University of China, 2012.] |
| [66] | Gransch J A, Posthuma J. On the origin of sulphur in crudes[M]//Tissot B P, Bienner F. Advances in Organic Geochemistry. Paris: Editions Technip, 1974: 727-739. |
| [67] | Armstrong D E, Chesters G. Properties of protein-bentonite complexes as influenced by equilibration conditions[J]. Soil Science, 1964, 98(1): 39-52. |
| [68] | Mayer L M. Surface area control of organic carbon accumulation in continental shelf sediments[J]. Geochimica et Cosmochimica Acta, 1994, 58(4): 1271-1284. |
| [69] | Mayer L M. Relationships between mineral surfaces and organic carbon concentrations in soils and sediments[J]. Chemical Geology, 1994, 114(3/4): 347-363. |
| [70] | Yariv S, Cross H. Organic-Clay Complexes and Interaction[M]. New Nork: Marcel Dekker, 2002. |
| [71] | Rodriguez J L P, Weiss A, Lagaly G. A natural clay organic complex from Andalusian black earth[J]. Clays and Clay Minerals, 1977, 25(3): 243-251. |
| [72] | 于炳松,董海良,韩彭彦. 微生物降解蒙脱石层间吸附有机质的实验研究[J]. 岩石学报,2012,28(3):949-960. [Yu Bingsong, Dong Hailiang, Han Pengyan. Experimental research on microbial degradation of organic matter adsorbed in smectite internal surface area in the interlayer of the structure[J]. Acta Petrologica Sinica, 2012, 28(3): 949-960.] |
| [73] | 师焕芝,李福春,孙旭辉,等. 洛川黄土/古土壤中有机碳的分布特征及其与粘土矿物的相关性[J]. 中国地质,2011,38(5):1355-1362. [Shi Huanzhi, Li Fuchun, Sun Xuhui, et al. Distribution of organic carbon in the Luochuan loess/paleosol and its relationship with clay minerals[J]. Geology in China, 2011, 38(5): 1355-1362.] |
| [74] | Kennedy M J, Pevear D R, Hill R H. Mineral surface control of organic carbon in black shale[J]. Science, 2002, 295(5555): 657-660. |
| [75] | Gatellier J P L A, De Leeuw J W, Damsté J S S, et al. A comparative study of macromolecular substances of a Coorongite and cell walls of the extant alga Botryococcus braunii[J]. Geochimica et Cosmochimica Acta, 1993, 57(9): 2053-2068. |
| [76] | Stankiewicz B A, Briggs D E G, Michels R, et al. Alternative origin of aliphatic polymer in kerogen[J]. Geology, 2000, 28(6): 559-562. |
| [77] | Gupta N S, Cody G D, Tetlie O E, et al. Rapid incorporation of lipids into macromolecules during experimental decay of invertebrates: initiation of geopolymer formation[J]. Organic Geochemistry, 2009, 40(5): 589-594. |
| [78] | Tyson R V. Sedimentation rate, dilution, preservation and total organic carbon: some results of a modelling study[J]. Organic Geochemistry, 2001, 32(2): 333-339. |
| [79] | Betts J N, Holland H D. The oxygen content of ocean bottom waters, the burial efficiency of organic carbon, and the regulation of atmospheric oxygen[J]. Global and Planetary Change, 1991, 5(1/2): 5-18. |
| [80] | Ding X J, Liu G D, Zha M, et al. Relationship between total organic carbon content and sedimentation rate in ancient lacustrine sediments, a case study of Erlian basin, northern China[J]. Journal of Geochemical Exploration, 2015, 149: 22-29. |
 2016, Vol. 34
2016, Vol. 34