扩展功能
文章信息
- 钱宇, 王作栋, 贾冬, 雷艳, 王有孝, 贺永红, 妥进才, 张婷
- QIAN Yu, WANG ZuoDong, JIA Dong, LEI Yan, WANG YouXiao, HE YongHong, TUO JinCai, ZHANG Ting
- 烃源岩中单甲基烷烃化合物分析与鉴定
- Analysis and Identification of Monomethylalkanes in Source Rocks
- 沉积学报, 2015, 33(5): 1033-1042
- ACTA SEDIMENTOLOGICA SINCA, 2015, 33(5): 1033-1042
- 10.14027/j.cnki.cjxb.2015.05.019
-
文章历史
- 收稿日期: 2014-07-10
- 收修改稿日期: 2014-11-11
2. 中国科学院大学 北京 100049;
3. 陕西延长石油(集团)有限责任公司研究院 西安 710075;
4. 中国科学院广州地球化学研究所有机地球化学国家重点实验室 广州 510640
2. University of Chinese Academy of Sciences, Beijing 100049;
3. Research Institute of Shaanxi Yanchang Petroleum
4. State Key Laboratory of Organic Geochemistry, Guangzhou Institute of Geochemistry, Chinese Academy of Sciences, Guangzhou 510640
单甲基烷烃广泛存在于生物体[1, 2, 3, 4, 5]、沉积物和原油样品[6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20],并且在各种环境(淡水湖相、海相、热泉极端环境)和各个时代(前寒武系—三叠纪—现代)均被检出。Han等[1]在蓝细菌抽提物中检出单甲基烷烃,并认为是鉴定蓝细菌席的一种潜在的生物标志化合物,Shiea等[4]和Kenig等[7, 8]也支持了上述观点。其中,Shiea等[4]总结了26种蓝细菌席中有18种存在中链单甲基烷烃;Kenig等[6]在现代蓝细菌席检测出了单甲基烷烃(C16~C21),但在海侵沉积的含有微生物席的沉积物中检出C24~C34的单甲基烷烃,后者与Jackson等[9]、Klomp等[10]、Fowler等[11]、Lu等[12]和吉利民等[13]在沉积物和石油样品中检出的单甲基烷烃(C15~C35)分布一致。Kenig等[7, 8]在阿布扎比全新统微生物群可抽提组分中识别出长链单甲基烷烃(C24~C45),他通过同位素示踪方法证明此类长链单甲基烷烃来自于以微生物为食的昆虫,并且指出甲基取代位置均位于奇数碳原子,而Jackson等[9]和Klomp等[10]在沉积物和原油中检出的单甲基烷烃,甲基位于奇数碳和偶数碳原子上。Kenig等[14]对全新统微生物席的开放热解实验残留物中检出了C16~C29的单甲基烷烃,这与沉积物和石油样品中检出的单甲基烷烃分布一致,并且他在未经热模拟实验的微生物席中未发现单甲基烷烃,因此他认为除蓝细菌以外的生物体(真核生物或者异养细菌)也可能合成单甲基烷烃。吉利民等[13]在鄂尔多斯盆地延长组原油样品中检出碳数分布在C15~C34的一系列短链—长链的单甲基烷烃,以3-和4-甲基取代为主,并指出A种属的葡萄藻最有可能是这部分单甲基烷烃的母质来源。Audino等[18]在富含葡萄藻的藻煤饼样品中也检出碳数分布在C23~C31+的系列单甲基烷烃,并通过稳定碳同位素证明了单甲基烷烃来自于A种属的葡萄藻。Thiel等[15]和Summons等[16, 17]认为单甲基烷烃可能是烷基酸在成岩作用下的产物,直链烷基酸常常在现代真核生物中被检出。此外,Kissin等[19]指出单甲基烷烃是烯烃的催化裂解产物。综合前人研究可以看出,单甲基烷烃最可能的成因是生物自身合成或者成岩作用时前驱物的转化,它作为一种重要的无环饱和烃,被认为是一种判断沉积物或原油有机质来源和沉积环境的潜在“生物标志化合物”,因此准确鉴定沉积物和原油中单甲基烷烃对于石油勘探而言是一项有意义的工作。
然而,由于相同碳数的正构烷烃和单甲基烷烃具有相似的离子碎片系列,这为相同碳数的单甲基烷烃系列中各甲基取代基位置的鉴定增加了难度。目前有机化合物的鉴定方法主要是气相色谱—质谱法,使用该方法对复杂化合物进行鉴定时,质量碎片的相对丰度和保留时间是判识未知化合物的重要依据。碳数相同的正构烷烃和单甲基烷烃的定性对于样品分析至关重要,在前人的研究中,质谱碎片的相对丰度和特征离子已经被应用于判识相同碳数的单甲基烷烃和正构烷烃[10, 17, 20],然而很多因素可能导致质谱定性分析复杂化,如:①相同碳数的单甲基烷烃与正构烷烃具有相似的质谱碎片;②部分化合物在标准谱库中没有与其对应的谱图;③多种化合物共溢出导致出现重叠峰[21],这样在鉴定单甲基烷烃时需要借助其他方法进行研究。针对以上问题,本研究对鄂尔多斯盆地上三叠统延长组吴56井长8烃源岩样品饱和烃中检出的一系列单甲基烷烃进行了鉴定,其鉴定结果对烃源岩母质来源和沉积环境的研究具有重要意义。
1 样品和分析样品为黑色页岩,采自鄂尔多斯盆地上三叠统延长组长8段吴56井(2 111.28NSymbol~A@02 111.36 m)。将样品用氯仿淋洗,除去残留表面的其他物质。粉碎至大于100 目,用氯仿索氏抽提72 h,可溶有机质用正己烷沉淀沥青质后,经硅胶—氧化铝(3∶1)进行柱色层分离,分别用正己烷、二氯甲烷和甲醇为溶剂,洗提出饱和烃、芳烃和非烃馏分。对饱和烃馏分进行GC-MS分析。 使用分析仪器为GC6890N/MSD5973N联用仪,GC 汽化室温度250℃,美国J&W.HP-5(30 m×0.25 mm×0.25 μm)弹性石英毛细管柱,以4℃/min由80℃程序升温至290℃,恒温30分钟,载气为99.995%高纯氦。MSD 离子源为EI源,离子源温度230℃,电子能量70 eV;四极杆温度为150℃,质谱与色谱接口为280℃;使用美国NIST02谱库。
分析结果如图 1a所示:在正构烷烃色谱峰之间出现了一系列有规律的化合物,其相对丰度远低于正构烷烃,但依然清晰可见。为了进一步研究该化合物,选用5分子筛对正构烷烃和其他支链烷烃进行分离。将分子筛在550℃恒温活化4 h,按饱和烃:5分子筛质量比4 mg∶3 g分别称量样品和分子筛,用精馏异辛烷作为溶剂溶解饱和烃馏分并移入500 mL锥形瓶,异辛烷的量需覆盖分子筛样品,在85℃的水浴锅中蒸发回流15h,用漏斗过滤出异辛烷,自然晾干异辛烷得到支链烷烃,再用GC-MS进行分析,条件同上。

|
|
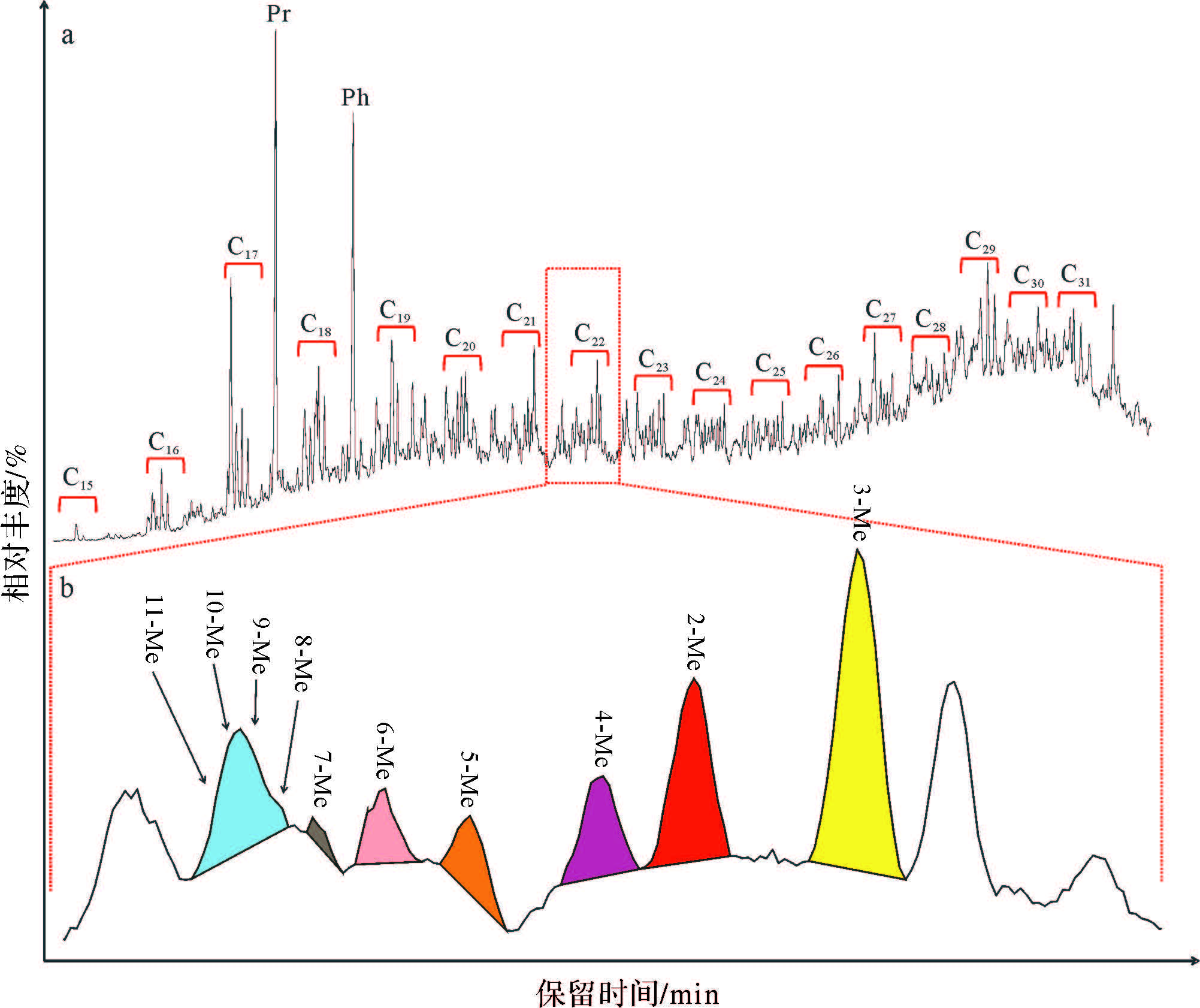
图 1 吴56井长8烃源岩岩样饱和烃总离子流图 a.吴56井长8烃源岩总离子流图;b. C19~C26部分放大图,其中2NSymbol~A@07数字表示单甲基烷烃甲基位置 Fig. 1 Total ion chromatogram of the saturated hydrocarbons in the Well Wu 56 source rocks of the Member 8 of Yanchang Formation a. represents the Total ion chromatogram; b. shows the enlarged figure for C19 to C26 and the number from 2 to 7 indicates the position of the methyl in monomethylalkanes |
吴56井长8烃源岩样品饱和烃馏分总离子流图如图 1a,正构烷烃(nC12~nC31)之间可检测出一系列结构相似的化合物(图 1a中用“*”号标记)。根据与谱库中的图谱进行对比易发现样品饱和烃质量色谱图中存在C12NSymbol~A@0C31,甲基位置位于2位和3位的单甲基烷烃系列(也称异构和反异构烷烃),其中2-甲基烷烃出峰时间在前,包含M+-15和M+-43的特征离子碎片;3-甲基烷烃出峰于后,含M+-29和M+-57特征离子碎片。此外,在相邻正构烷烃之间,除了2-和3-甲基烷烃以外,还存在一系列结构相似的化合物,其离子碎片与紧邻其后的正构烷烃的离子碎片相似,仅部分离子碎片相对丰度不同,表明为一系列的无环饱和烃。
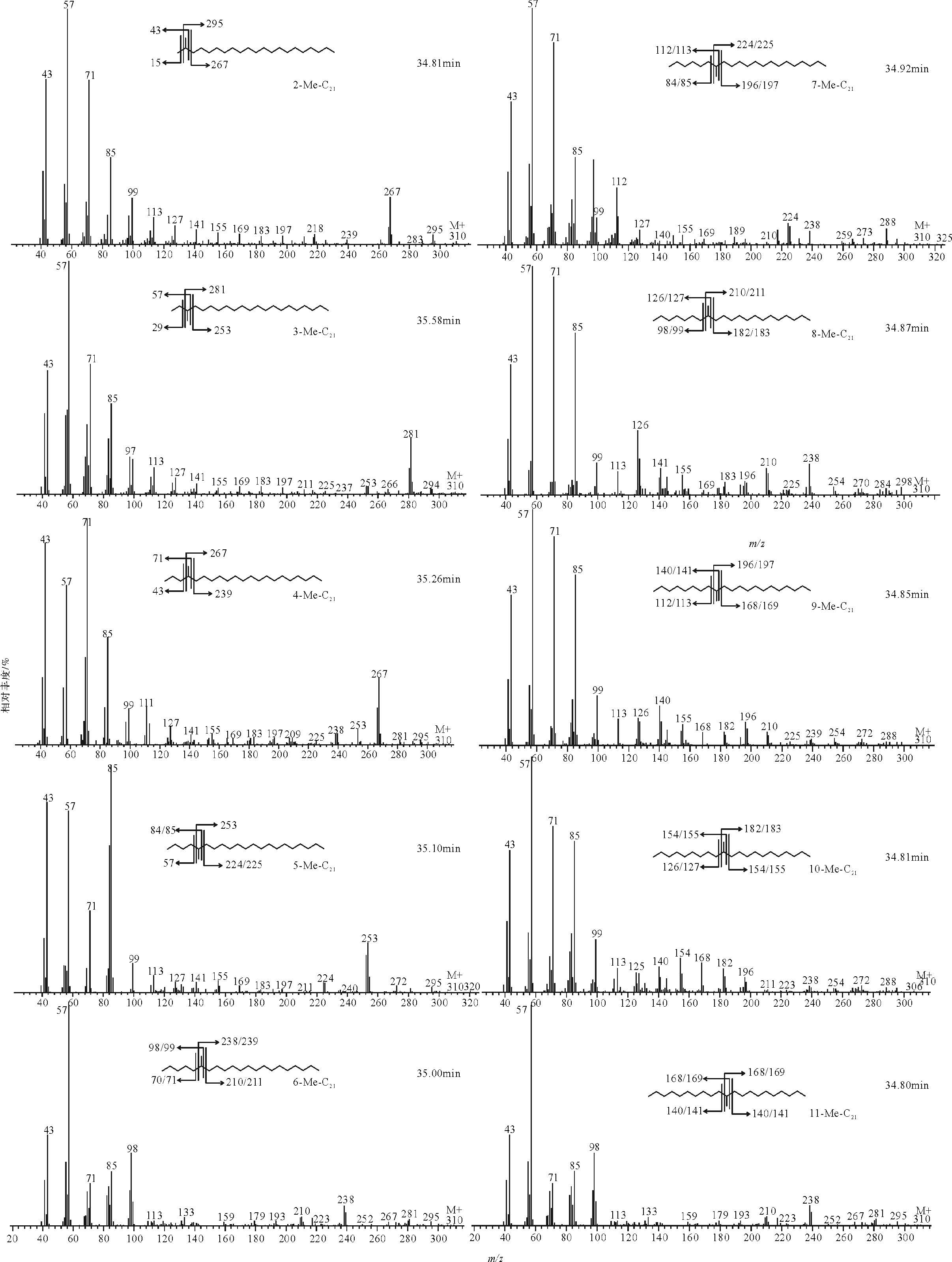
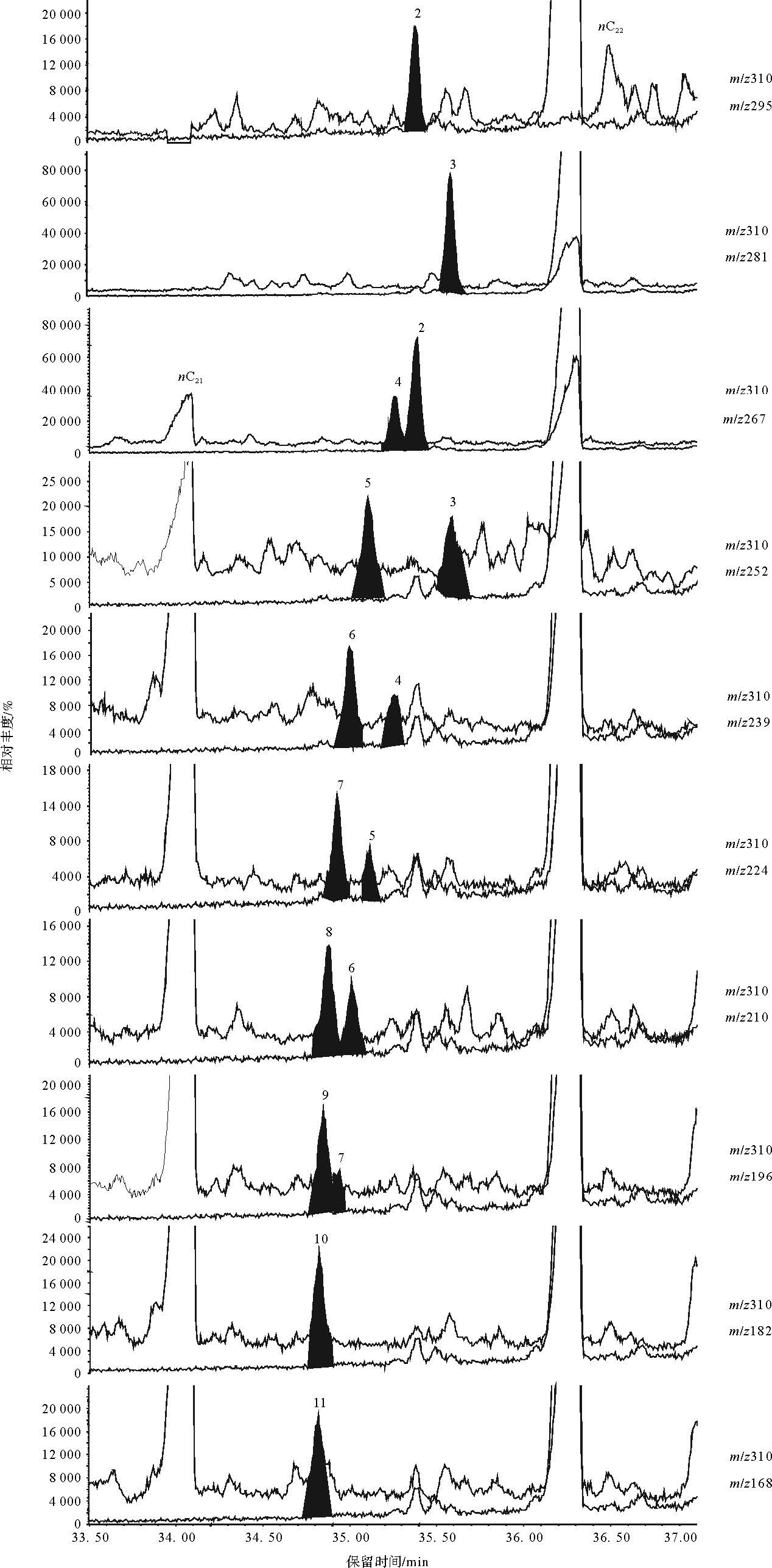
为了对该无环饱和烷烃作进一步的定性研究,选取nC22前的一系列化合物进行分析(图 2)。nC22正构烷烃质谱图存在m/zCnH2n+1(n=1,2,3…21)离子系列,质量数为M=310。通过对无环饱和烃质谱图分析发现:nC22前无环饱和链烃含有与C22正构烷烃相似的离子系列,仅部分离子碎片相对丰度存在差异(图 3)。在样品饱和烃TIC图中分别调取m/z310和离子碎片为m/zCnH2n+1或m/zCnH2n(如m/z=168/169、182/183、196/197…)的质量色谱图组合图进行对比研究(图 4,黑色阴影部分为与各特征离子相对应的烷烃位置),通过对其质谱图研究发现:各特征离子质量色谱图对应的化合物为一系列的单甲基烷烃,甲基位置从2位到11位,质谱鉴定结果如图 3,每个单甲基烷烃质谱图中均包含m/z CnH2n+1离子系列,仅部分离子相对丰度存在差异(称为特征离子峰),如2-Me-C21(Me为Methyl,甲基)中,根据离子断裂规律,会同时产生m/z295和m/z267两个离子碎片,对应于质谱图中,m/z267、m/z295丰度明显高于相邻的离子碎片,3-Me-C21中则m/z253、m/z281离子碎片丰度较高,依此递推,4-MeNSymbol~A@011-Me-C21质谱图均拥有特有的特征离子峰(图 3、表 1)。根据对C22单甲基烷烃系列化合物的研究可以得出以下结论:在相同实验条件下,随着单甲基烷烃主链碳原子数的增加,同碳数甲基烷烃甲基取代位置从第2碳原子到中间碳原子,相对丰度呈现出降低的趋势,同时,取代基位置越靠近主链中部越不容易分离,并且甲基取代基越接近中间碳原子,相邻甲基烷烃出峰时间越接近(如10-Me-C21和11-Me-C21保留时间间隔为0.01 min,而3-Me-C21和2-Me-C21出峰时间间隔为0.23 min),这是因为随着主链碳数的增加以及甲基取代位置的升高,相邻甲基取代基的单甲基烷烃物理性质越接近,从而越不容易分离[22],如图 2b所示,C22甲基烷烃中8-、9-、10-、11-Me-C21共溢出,在质谱图中(图 3),共溢出的几个化合物彼此之间相互干扰,导致部分离子碎片在各化合物中均有较大丰度,干扰了化合物的鉴定。此外,取代基为5-及以上的单甲基烷烃质谱图中出现了以CnH2n为主的离子碎片峰(图 3),如9-Me-C21质谱图存在140、168、182、196、210等偶数离子碎片,与前人已发表文章相似[8, 11, 17, 20, 21],这是由分子离子峰(奇电子离子)经过氢重排后再碎裂而产生的[23],是高位单甲基取代的典型特征,图 4中甲基取代位置为5-及以上的单甲基烷烃均使用这些偶数离子的质谱图进行鉴定,并依据鉴定结果在图 2b中标示出了未被气相色谱分离的几种单甲基烷烃(8-、9-、10-、11-C21)的位置。
|
|
图 2 吴56井长8烃源岩中单甲基烷烃分布图 a.吴56井长8烃源岩岩样饱和烃经5分子筛除去正构烷烃后的异构和环烷烃TIC图;b. C22系列单甲基烷烃分布图 Fig. 2 The distribution of monomethylalkanes in the Well Wu 56 source rocks of the Member 8 of Yanchang Formation a. total ion chromatogram of the saturated hydrocarbon after treatment with 5 molecular sieve; b. the distribution of the monomethyldocosane |
| 分子量 | 碳数 | 特征离子 | ||||||||||||||||||
| 170 | C12 | 169 | ||||||||||||||||||
| 184 | C13 | 2M-12 | 183 | |||||||||||||||||
| 198 | C14 | 3M-13 | 2M-13 | 197 | ||||||||||||||||
| 212 | C15 | 4M-14 | 3M-14 | 2M-14 | 211 | |||||||||||||||
| 226 | C16 | 5M-15 | 4M-15 | 3M-15 | 2M-15 | 225 | ||||||||||||||
| 240 | C17 | 6M-16 | 5M-16 | 4M-16 | 3M-16 | 2M-16 | 239 | |||||||||||||
| 254 | C18 | 7M-17 | 6M-17 | 5M-17 | 4M-17 | 3M-17 | 2M-17 | 253 | ||||||||||||
| 268 | C19 | 8M-18 | 7M-18 | 6M-18 | 5M-18 | 4M-18 | 3M-18 | 2M-18 | 267 | |||||||||||
| 282 | C20 | 9M-19 | 8M-19 | 7M-19 | 6M-19 | 5M-19 | 4M-19 | 3M-19 | 2M-19 | 281 | ||||||||||
| 296 | C21 | 10M-20 | 9M-20 | 8M-20 | 7M-20 | 6M-20 | 5M-20 | 4M-20 | 3M-20 | 2M-20 | 295 | |||||||||
| 310 | C22 | 11M-21 | 10M-21 | 9M-21 | 8M-21 | 7M-21 | 6M-21 | 5M-21 | 4M-21 | 3M-21 | 2M-21 | 309 | ||||||||
| 324 | C23 | 11M-22 | 10M-22 | 9M-22 | 8M-22 | 7M-22 | 6M-22 | 5M-22 | 4M-22 | 3M-22 | 2M-22 | 323 | ||||||||
| 338 | C24 | 12M-23 | 11M-23 | 10M-23 | 9M-23 | 8M-23 | 7M-23 | 6M-23 | 5M-23 | 4M-23 | 3M-23 | 2M-23 | 337 | |||||||
| 352 | C25 | 12M-24 | 11M-24 | 10M-24 | 9M-24 | 8M-24 | 7M-24 | 6M-24 | 5M-24 | 4M-24 | 3M-24 | 2M-24 | 351 | |||||||
| 366 | C26 | 13M-25 | 12M-25 | 11M-25 | 10M-25 | 9M-25 | 8M-25 | 7M-25 | 6M-25 | 5M-25 | 4M-25 | 3M-25 | 2M-25 | 365 | ||||||
| 380 | C27 | 13M-26 | 12M-26 | 11M-26 | 10M-26 | 9M-26 | 8M-26 | 7M-26 | 6M-26 | 5M-26 | 4M-26 | 3M-26 | 2M-26 | 379 | ||||||
| 394 | C28 | 14M-27 | 13M-27 | 12M-27 | 11M-27 | 10M-27 | 9M-27 | 8M-27 | 7M-27 | 6M-27 | 5M-27 | 4M-27 | 3M-27 | 2M-27 | 393 | |||||
| 408 | C29 | 14M-28 | 13M-28 | 12M-28 | 11M-28 | 10M-28 | 9M-28 | 8M-28 | 7M-28 | 6M-28 | 5M-28 | 4M-28 | 3M-28 | 2M-28 | 407 | |||||
| 注:根据Thiel等[15]、Summons等[17]、Audino M等[18]、Ingeborg M Höld等[20]、Ž.Krkošová等[22]等总结(2M-21表示2-甲基-C21)。 | ||||||||||||||||||||
|
| 图 3 C22单甲基烷烃系列质谱图(n-Me-C21中,n表示甲基取代基位置) Fig. 3 Mass spectrum of the monomethyldocosane (n in the expression of n-Me-C21 represents the position of the methyl) |
|
| 图 4 C22单甲基烷烃质量色谱图 Fig. 4 Mass chromatograms of the monomethyldocosane |
对C22系列单甲基烷烃的定性研究可以确定吴56井长8烃源岩饱和烃中,位于正构烷烃前同碳数的单甲基烷烃系列化合物包含甲基位置为C2NSymbol~A@0中间碳原子的不同异构体,其中高位甲基取代烷烃分布比较集中,部分单甲基取代烷烃共流于同一峰,单甲基烷烃的质谱图研究发现每个单甲基烷烃均存在一对特征离子碎片,并且同碳数的单甲基烷烃的特征离子存在规律性的变化,结果总结于表 1,利用特征离子的质量色谱图的反褶积(图 4)可以确定单甲基烷烃的保留时间,但在本实验中,由于存在大量的重叠峰,部分单甲基烷烃依然无法识别。为进一步鉴定这部分无法识别的单甲基烷烃,在已鉴定单甲基烷烃的基础上,本文作者利用科瓦茨指数(Kovats index)和同形性因子(homomorphy factors)与碳数的关系对单甲基烷烃进行鉴定和预测。
科瓦茨指数常被用于鉴定具有相似立体结构的异构体,是化学物质在分离柱中对应于正构烷烃的一种比较稳定的性质,只要用于分离的色谱柱性质相同,气相色谱条件相近,同种组分在不同仪器上所计算的KI值通常为常数,又称保留指数(retention index)。计算方法为KI=100n+100(tx-tn)/(tn+1-tn),其中tn、tx、tn+1分别为被分析的组分和碳原子为n和n+1的正构烷烃的流出峰保留时间(tn
| 系列 | 化合物名称 | 甲基位置 | KI | Hp | 总碳数 | 系列 | 化合物名称 | 甲基位置 | KI | Hp | 总碳数 |
| A3 | 4-Me-C11 | ω8 | 1 157.34 | -42.66 | 12 | I5 | 6-Me-C21 | ω16 | 2 141.55 | -58.45 | 22 |
| A4 | 5-Me-C12 | ω8 | 1 251.82 | -48.18 | 13 | I6 | 7-Me-C22 | ω16 | 2 238.20 | -61.8 | 23 |
| A6 | 6-Me-C13 | ω8 | 1 347.41 | -52.59 | 14 | I7 | 8-Me-C23 | ω16 | 2 335.29 | -64.71 | 24 |
| B2 | 3-Me-C11 | ω9 | 1 168.71 | -31.29 | 12 | I8 | 9-Me-C24 | ω16 | 2 433.01 | -66.99 | 25 |
| B3 | 4-Me-C12 | ω9 | 1 256.56 | -43.44 | 13 | I9 | 10-Me-C25 | ω16 | 2 531.39 | -68.61 | 26 |
| B4 | 5-Me-C13 | ω9 | 1 350.56 | -49.44 | 14 | I10 | 11-Me-C26 | ω16 | 2 630.08 | -69.82 | 27 |
| B8 | 9-Me-C17 | ω9 | 1 738.92 | -61.08 | 18 | I11 | 12-Me-C27 | ω16 | 2 729.11 | -70.89 | 28 |
| C1 | 2-Me-C11 | ω10 | 1 161.62 | -38.38 | 12 | I12 | 13-Me-C28 | ω16 | 2 828.62 | -71.38 | 29 |
| C2 | 3-Me-C12 | ω10 | 1 268.10 | -31.9 | 13 | J1 | 2-Me-C18 | ω17 | 1 859.28 | -40.72 | 19 |
| C3 | 4-Me-C13 | ω10 | 1 355.48 | -44.52 | 14 | J2 | 3-Me-C19 | ω17 | 1 967.27 | -32.73 | 20 |
| C6 | 7-Me-C16 | ω10 | 1 642.34 | -57.66 | 17 | J3 | 4-Me-C20 | ω17 | 2 052.92 | -47.08 | 21 |
| C7 | 8-Me-C17 | ω10 | 1 740.04 | -59.96 | 18 | J4 | 5-Me-C21 | ω17 | 2 146.27 | -53.73 | 22 |
| C9 | 10-Me-C19 | ω10 | 1 935.16 | -64.84 | 20 | J5 | 6-Me-C22 | ω17 | 2 241.14 | -58.86 | 23 |
| D1 | 2-Me-C12 | ω11 | 1 261.31 | -38.69 | 13 | J6 | 7-Me-C23 | ω17 | 2 337.94 | -62.06 | 24 |
| D2 | 3-Me-C13 | ω11 | 1 367.56 | -32.44 | 14 | J7 | 8-Me-C24 | ω17 | 2 435.13 | -64.87 | 25 |
| D3 | 4-Me-C14 | ω11 | 1 456.07 | -43.93 | 15 | J8 | 9-Me-C25 | ω17 | 2 533.23 | -66.77 | 26 |
| D5 | 6-Me-C16 | ω11 | 1 644.44 | -55.56 | 17 | J9 | 10-Me-C26 | ω17 | 2 631.33 | -68.67 | 27 |
| D6 | 7-Me-C17 | ω11 | 1 741.24 | -58.76 | 18 | J10 | 11-Me-C27 | ω17 | 2 730.18 | -69.82 | 28 |
| D7 | 8-Me-C18 | ω11 | 1 838.25 | -61.75 | 19 | J11 | 12-Me-C28 | ω17 | 2 829.44 | -70.56 | 29 |
| D8 | 9-Me-C19 | ω11 | 1 936.06 | -63.94 | 20 | K1 | 2-Me-C19 | ω18 | 1 959.25 | -40.75 | 20 |
| D9 | 10-Me-C20 | ω11 | 2 034.05 | -65.95 | 21 | K2 | 3-Me-C20 | ω18 | 2 067.58 | -32.42 | 21 |
| D10 | 11-Me-C21 | ω11 | 2 132.60 | -67.4 | 22 | K3 | 4-Me-C21 | ω18 | 2 153.15 | -46.85 | 22 |
| E1 | 2-Me-C13 | ω12 | 1 360.84 | -39.16 | 14 | K4 | 5-Me-C22 | ω18 | 2 246.33 | -53.67 | 23 |
| E2 | 3-Me-C14 | ω12 | 1 467.99 | -32.01 | 15 | K5 | 6-Me-C23 | ω18 | 2 341.37 | -58.63 | 24 |
| E3 | 4-Me-C15 | ω12 | 1 555.33 | -44.67 | 16 | K6 | 7-Me-C24 | ω18 | 2 437.95 | -62.05 | 25 |
| E4 | 5-Me-C16 | ω12 | 1 648.77 | -51.23 | 17 | K7 | 8-Me-C25 | ω18 | 2 535.07 | -64.93 | 26 |
| E5 | 6-Me-C17 | ω12 | 1 743.83 | -56.17 | 18 | K8 | 9-Me-C26 | ω18 | 2 632.95 | -67.05 | 27 |
| E6 | 7-Me-C18 | ω12 | 1 839.90 | -60.10 | 19 | K9 | 10-Me-C27 | ω18 | 2 731.53 | -68.47 | 28 |
| E7 | 8-Me-C19 | ω12 | 1 937.01 | -62.99 | 20 | K10 | 11-Me-C28 | ω18 | 2 830.67 | -69.33 | 29 |
| 系列 | 化合物名称 | 甲基位置 | KI | Hp | 总碳数 | 系列 | 化合物名称 | 甲基位置 | KI | Hp | 总碳数 |
| E8 | 9-Me-C20 | ω12 | 2 035.55 | -64.45 | 21 | L1 | 2-Me-C20 | ω19 | 2 058.60 | -41.4 | 21 |
| E9 | 10-Me-C21 | ω12 | 2 133.05 | -66.95 | 22 | L2 | 3-Me-C21 | ω19 | 2 167.54 | -32.46 | 22 |
| E10 | 11-Me-C22 | ω12 | 2 232.02 | -67.98 | 23 | L3 | 4-Me-C22 | ω19 | 2 253.48 | -46.52 | 23 |
| E11 | 12-Me-C23 | ω12 | 2 330.78 | -69.22 | 24 | L4 | 5-Me-C23 | ω19 | 2 346.47 | -53.53 | 24 |
| F1 | 2-Me-C14 | ω13 | 1 460.81 | -39.19 | 15 | L5 | 6-Me-C24 | ω19 | 2 441.77 | -58.23 | 25 |
| F2 | 3-Me-C15 | ω13 | 1 567.85 | -32.15 | 16 | L6 | 7-Me-C25 | ω19 | 2 537.95 | -62.05 | 26 |
| F3 | 4-Me-C16 | ω13 | 1 654.23 | -45.77 | 17 | L7 | 8-Me-C26 | ω19 | 2 634.85 | -65.15 | 27 |
| F4 | 5-Me-C17 | ω13 | 1 748.07 | -51.93 | 18 | L8 | 9-Me-C27 | ω19 | 2 733.84 | -66.16 | 28 |
| F5 | 6-Me-C18 | ω13 | 1 843.19 | -56.81 | 19 | L9 | 10-Me-C28 | ω19 | 2 831.43 | -68.57 | 29 |
| F6 | 7-Me-C19 | ω13 | 1 938.94 | -61.06 | 20 | M1 | 2-Me-C21 | ω20 | 2 159.08 | -40.92 | 22 |
| F7 | 8-Me-C20 | ω13 | 2 036.46 | -63.54 | 21 | M2 | 3-Me-C22 | ω20 | 2 267.84 | -32.16 | 23 |
| F8 | 9-Me-C21 | ω13 | 2 134.85 | -65.15 | 22 | M3 | 4-Me-C23 | ω20 | 2 354.02 | -45.98 | 24 |
| F9 | 10-Me-C22 | ω13 | 2 232.68 | -67.32 | 23 | M4 | 5-Me-C24 | ω20 | 2 446.35 | -53.65 | 25 |
| F10 | 11-Me-C23 | ω13 | 2 331.18 | -68.82 | 24 | M5 | 6-Me-C25 | ω20 | 2 541.26 | -58.74 | 26 |
| F11 | 12-Me-C24 | ω13 | 2 430.20 | -69.80 | 25 | M6 | 7-Me-C26 | ω20 | 2 637.89 | -62.11 | 27 |
| F12 | 13-Me-C25 | ω13 | 2 528.82 | -71.18 | 26 | M7 | 8-Me-C27 | ω20 | 2 735.81 | -64.19 | 28 |
| G1 | 2-Me-C15 | ω14 | 1 561.00 | -39.00 | 16 | M8 | 9-Me-C28 | ω20 | 2 833.06 | -66.94 | 29 |
| G2 | 3-Me-C16 | ω14 | 1 667.31 | -32.69 | 17 | N1 | 2-Me-C22 | ω21 | 2 258.72 | -41.28 | 23 |
| G3 | 4-Me-C17 | ω14 | 1 754.07 | -45.93 | 18 | N2 | 3-Me-C23 | ω21 | 2 368.68 | -31.32 | 24 |
| G4 | 5-Me-C18 | ω14 | 1 847.55 | -52.45 | 19 | N3 | 4-Me-C24 | ω21 | 2 454.05 | -45.95 | 25 |
| G5 | 6-Me-C19 | ω14 | 1 942.39 | -57.61 | 20 | N4 | 5-Me-C25 | ω21 | 2 546.77 | -53.23 | 26 |
| G6 | 7-Me-C20 | ω14 | 2 038.26 | -61.74 | 21 | N5 | 6-Me-C26 | ω21 | 2 641.25 | -58.75 | 27 |
| G7 | 8-Me-C21 | ω14 | 2 135.93 | -64.07 | 22 | N6 | 7-Me-C27 | ω21 | 2 738.18 | -61.82 | 28 |
| G8 | 9-Me-C22 | ω14 | 2 233.66 | -66.34 | 23 | N7 | 8-Me-C28 | ω21 | 2 835.51 | -64.49 | 29 |
| G9 | 10-Me-C23 | ω14 | 2 331.81 | -68.19 | 24 | O1 | 2-Me-C23 | ω22 | 2 359.12 | -40.88 | 24 |
| G10 | 11-Me-C24 | ω14 | 2 430.90 | -69.10 | 25 | O2 | 3-Me-C24 | ω22 | 2 468.55 | -31.45 | 25 |
| G11 | 12-Me-C25 | ω14 | 2 529.55 | -70.45 | 26 | O3 | 4-Me-C25 | ω22 | 2 554.07 | -45.93 | 26 |
| G12 | 13-Me-C26 | ω14 | 2 628.67 | -71.33 | 27 | O4 | 5-Me-C26 | ω22 | 2 646.94 | -53.06 | 27 |
| G13 | 14-Me-C27 | ω14 | 2 727.59 | -72.41 | 28 | O5 | 6-Me-C27 | ω22 | 2 742.12 | -57.88 | 28 |
| H1 | 2-Me-C16 | ω15 | 1 660.20 | -39.8 | 17 | O6 | 7-Me-C28 | ω22 | 2 838.38 | -61.62 | 29 |
| H2 | 3-Me-C17 | ω15 | 1 767.12 | -32.88 | 18 | P1 | 2-Me-C24 | ω23 | 2 458.93 | -41.07 | 25 |
| H3 | 4-Me-C18 | ω15 | 1 853.55 | -46.45 | 19 | P2 | 3-Me-C25 | ω23 | 2 569.40 | -30.6 | 26 |
| H4 | 5-Me-C19 | ω15 | 1 946.38 | -53.62 | 20 | P3 | 4-Me-C26 | ω23 | 2 654.47 | -45.53 | 27 |
| H5 | 6-Me-C20 | ω15 | 2 041.53 | -58.47 | 21 | P4 | 5-Me-C27 | ω23 | 2 746.79 | -53.21 | 28 |
| H6 | 7-Me-C21 | ω15 | 2 138.13 | -61.87 | 22 | P5 | 6-Me-C28 | ω23 | 2 842.82 | -57.18 | 29 |
| H7 | 8-Me-C22 | ω15 | 2 235.30 | -64.7 | 23 | Q1 | 2-Me-C25 | ω24 | 2 558.79 | -41.21 | 26 |
| H8 | 9-Me-C23 | ω15 | 2 333.53 | -66.47 | 24 | Q2 | 3-Me-C26 | ω24 | 2 669.59 | -30.41 | 27 |
| H9 | 10-Me-C24 | ω15 | 2 431.76 | -68.24 | 25 | Q3 | 4-Me-C27 | ω24 | 2 754.50 | -45.5 | 28 |
| H10 | 11-Me-C25 | ω15 | 2 530.45 | -69.55 | 26 | Q4 | 5-Me-C28 | ω24 | 2 846.90 | -53.1 | 29 |
| H11 | 12-Me-C26 | ω15 | 2 629.54 | -70.46 | 27 | R1 | 2-Me-C26 | ω25 | 2 659.02 | -40.98 | 27 |
| H12 | 13-Me-C27 | ω15 | 2 728.38 | -71.62 | 28 | R2 | 3-Me-C27 | ω25 | 2 769.93 | -30.07 | 28 |
| H13 | 14-Me-C28 | ω15 | 2 827.80 | -72.2 | 29 | R3 | 4-Me-C28 | ω25 | 2 854.56 | -45.44 | 29 |
| I1 | 2-Me-C17 | ω16 | 1 759.54 | -40.46 | 18 | S1 | 2-Me-C27 | ω26 | 2 759.74 | -40.26 | 28 |
| I2 | 3-Me-C18 | ω16 | 1 867.20 | -32.8 | 19 | S2 | 2-Me-C28 | ω27 | 2 860.34 | -39.66 | 29 |
| I3 | 4-Me-C19 | ω16 | 1 952.96 | -47.04 | 20 | T1 | 3-Me-C28 | ω26 | 2 871.32 | -28.68 | 29 |
| I4 | 5-Me-C20 | ω16 | 2 046.35 | -53.65 | 21 |
|
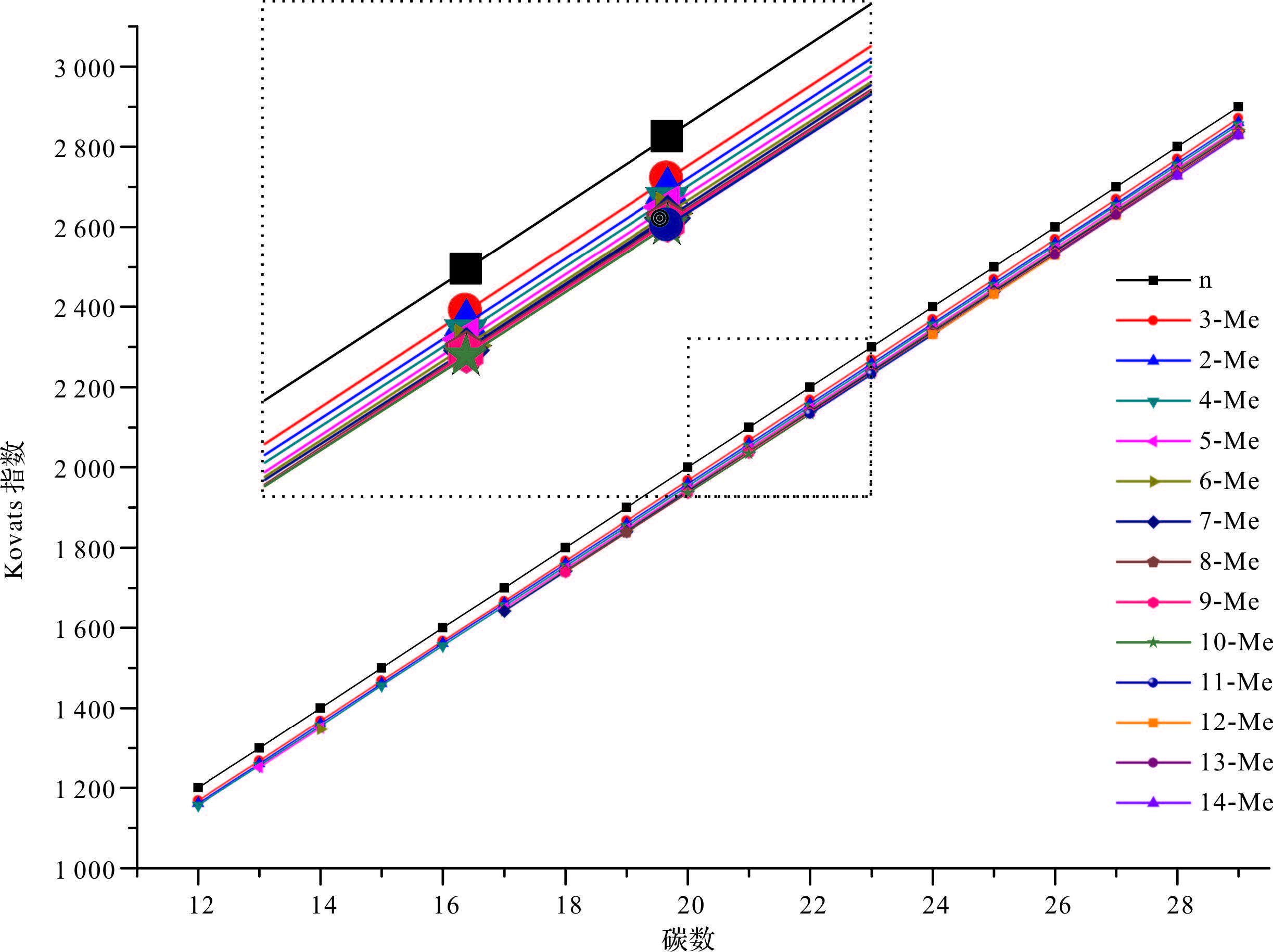
| 图 5 不同系列甲基烷烃同系物Kovats指数—碳数关系图 Fig. 5 The relationship between Kovats index and total carbon number obtained from different series of methyl alkanes homologues |
Sojak等[25]在鉴定角鲨烯中链状烯烃系列同系物时使用同形性因子(Hp)对该系列化合物进行鉴定,同形性因子计算方法为Hpsq.=KIn-烯烃sq.-KIn-烷烃sq.,同时他指出Hp仅受异构体的分子结构的影响。本实验检出的单甲基烷烃为一系列化学结构相似的同系物,根据Sojak的描述,则相同碳数的单甲基烷烃Hp仅受到甲基位置的影响,而与其他因素无关。据此建立Hp与碳数的相关性图(图 6,图 7),图 6可以看出甲基取代位置相同的单甲基烷烃随着碳数的增加,Hp值越接近,最后趋近于一个常数;此外,具有相同碳数的甲基烷烃,甲基取代位置越接近主链中部,相邻甲基烷烃的Hp值差值越小。例如,ΔHp13Me-14Me为0.93、ΔHp12Me-13Me为1.08,以此类推,依次为1.32、1.42、2.10、1.64、2.68、3.67、5.14、6.81、5.30、8.52,其中ΔHp3Me-2Me为8.52,与前述正好相反,这是因为2-甲基烷烃中叔碳原子导致同碳数2-甲基烷烃出峰时间早于3-甲基烷烃[22]。图 7中纵轴按照化合物甲基取代基位置相对于末端碳位置相同的原则将检出的单甲基烷烃分为A~T 20个类别,如表 2E类化合物,分别为2Me-C13,3Me-C14……12-Me-C23,甲基位置均为ω12,可以看出每一种分类随着碳数的增加,相邻化合物Hp值的差值越来越小。图 6和图 7中Hp和碳数Cn的趋势线可以看作是一指数函数或对数函数,本实验用下式表示该关系[22]: Hp=α×e-Cn/b+c
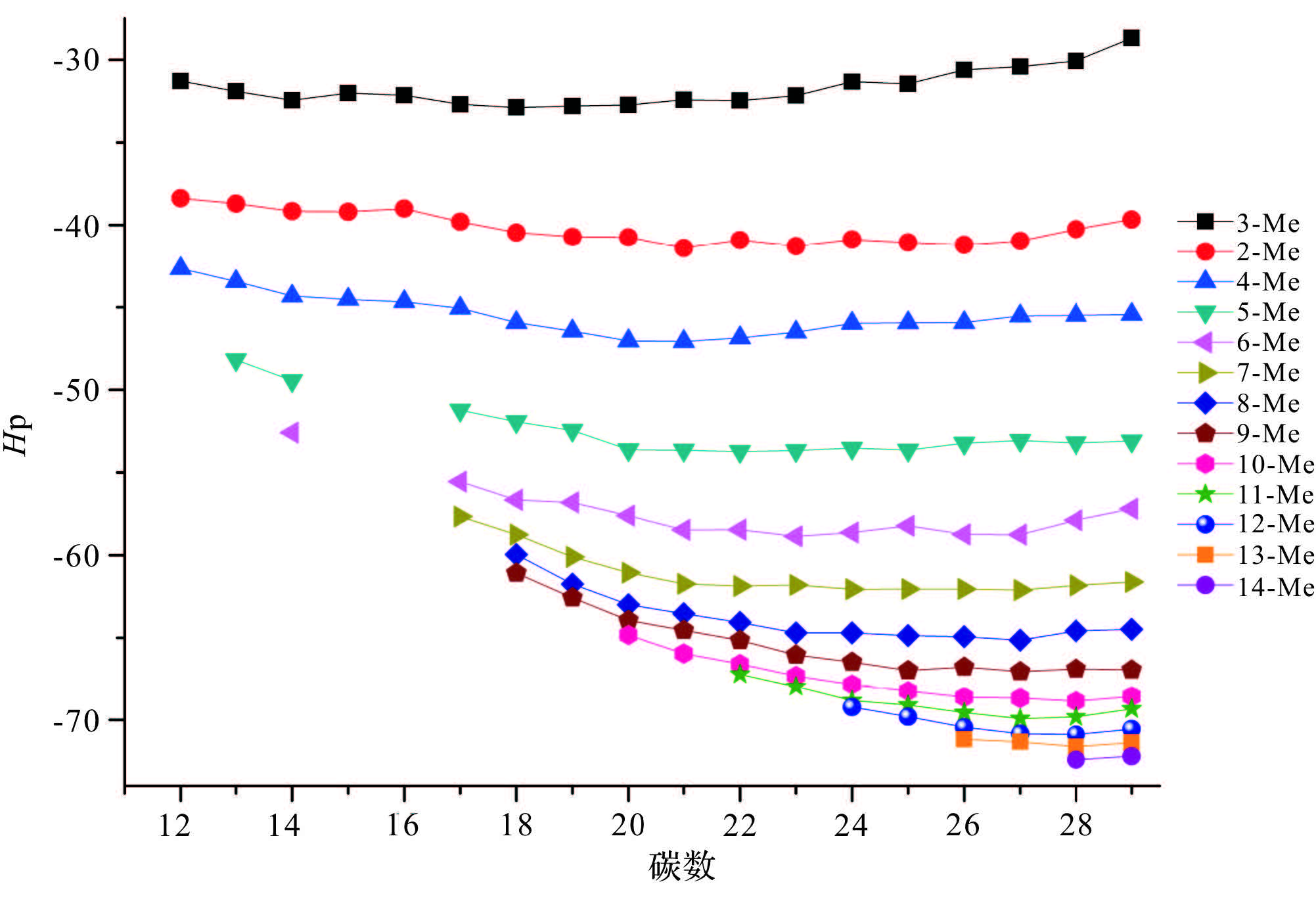
|
| 图 6 同形性因子Hp—碳数关系图 Fig. 6 Dependence of homomorphy factors on the number of carbon atoms of monomethylalkane homologues series |
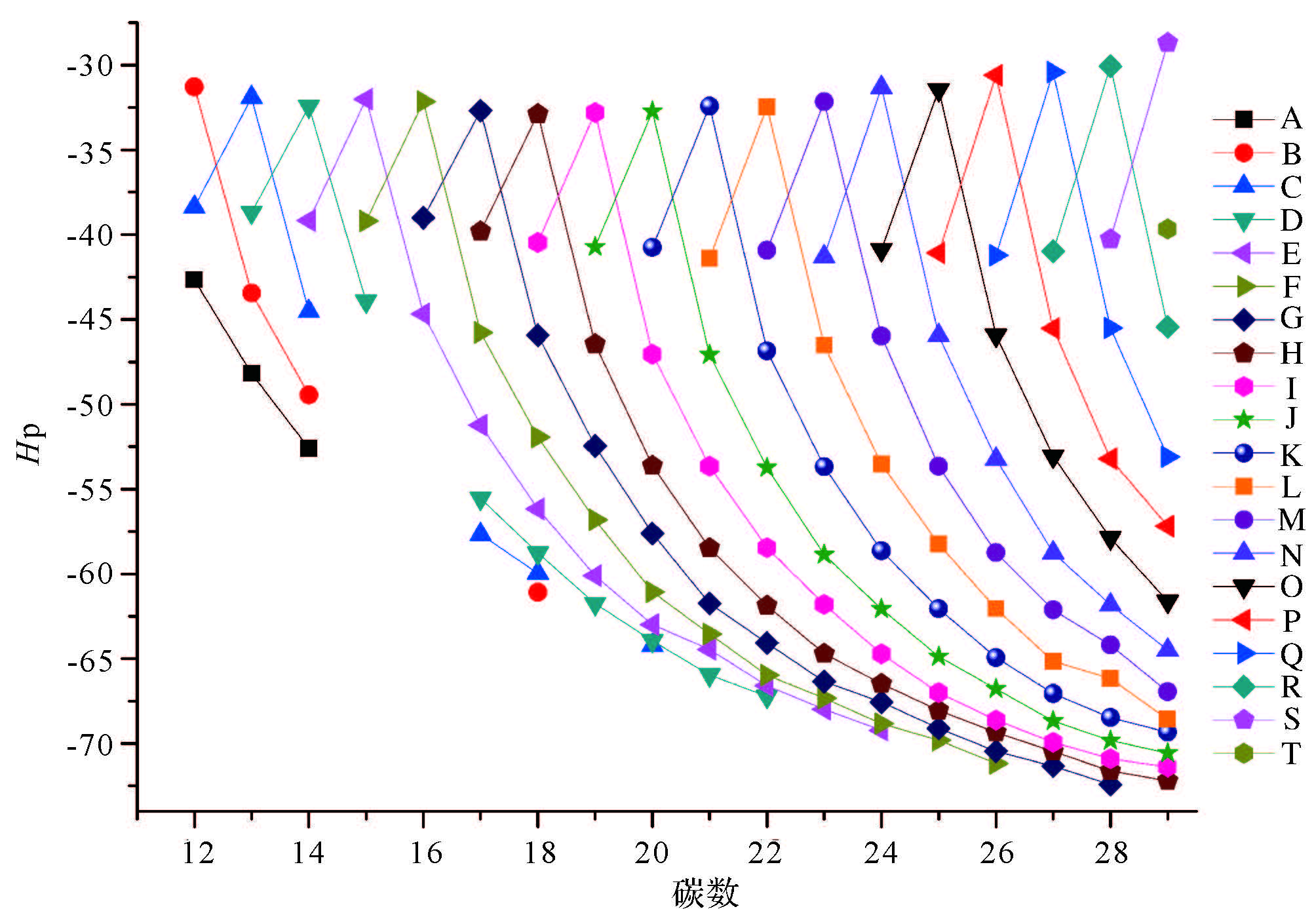
|
|
图 7 同形性因子Hp—碳数关系图 E系列:2-Me-C13、3-Me-C14、4-Me-C15、5-Me-C16,等 Fig. 7 Dependence of homomorphy factors on the number of carbon atoms of monomethylalkane homologues series E series:2-Me-C13、3-Me-C14、4-Me-C15、5-Me-C16,etc. |
其中a、b、c均为常数。已知同一系列相邻3个甲基烷烃的Hp值即可推出相邻的甲基烷烃的Hp值,并且甲基取代基位置越高,算出的值越准确,如F8、F9、F10的Hp值分别为-65.15、-67.32、-68.82,带入等式求得F11的Hp值为-69.86,从而反推出F11保留时间为39.053 min,而实验中利用反褶积检出的F11的保留时间为39.066 min,计算Hp值为-69.80,计算值与实测值相差0.06。此外,也可以利用该公式对未检出但理论上应该存在的单甲基烷烃进行预测,例如,D系列化合物中D4(5-Me-C15)由于相对丰度较高的类异戊二烯烷烃存在,导致该化合物无法利用质谱法进行鉴定,但D5、D6、D7的Hp值是能被鉴定的,分别为-55.56、-58.76、-61.75,将三个值带入公式得出D4的Hp值为-52.135,进而推算出保留时间为19.766 min,而通过图 5中Kovats指数与碳数的线性关系推算出的时间为19.794 min,从已检出的低位甲基取代烷烃的保留时间来看,0.02 min的误差是在合理范围内。基于以上讨论,可利用Kovats指数—碳数线性关系图和Hp—碳数线性关系图对同系列单甲基烷烃进行鉴定及预测,两者相互印正。
3 结论单甲基烷烃是广泛存在于沉积物,原油及生物体中的一种潜在的“生物标志化合物”,准确的定性是研究其地球化学意义所必须的前提条件。然而,根据前人的研究可知,沉积环境、物质来源不同的沉积物和原油中检出的单甲基烷烃的分布存在很大差异(短链,中链,中—长链甲基烷烃),鉴定方式多与谱库中质谱图进行对比,但是,相同碳数、甲基位置不同的单甲基烷烃具有十分相似的特征碎片和质谱图,同时,会出现多个单甲基烷烃共溢出,单纯依靠与谱库的对比来鉴定此类化合物是很困难的。本实验中,在鄂尔多斯盆地上三叠统吴56井长8段烃源岩中检出了相对丰度较高,碳数分布在C12~C31的单甲基烷烃系列化合物。本文作者以C22单甲基烷烃为例,对该系列化合物质谱图的特征离子碎片和化学键断裂方式进行了精细研究,并结合Kovats指数和同形性因子(Hp),对甲基位置不同的单甲基烷烃系列化合物进行分析、鉴定和预测,总结出单甲基烷烃系列化合物特征离子表(表 1),为此类化合物的准确定性提供了有效而适用的鉴定方法。
| [1] | Han J, Calvin M. Branched alkanes from blue-green algae[Z]. Lawrence Berkeley National Laboratory, 2008. |
| [2] | Carlson D A, Bernier U R, Sutton B D. Elution patterns from capillary GC for methyl-branched alkanes[J]. Journal of Chemical Ecology, 1998, 24(11): 1845-1865. |
| [3] | Nelson D R, Sukkestad D R, Zaylskie R G. Mass spectra of methyl-branched hydrocarbons from eggs of the tobacco hornworm[J]. Journal of Lipid Research, 1972, 13(3): 413-421. |
| [4] | Shiea J, Brassell S C, Ward D M. Mid-chain branched mono-and dimethyl alkanes in hot spring cyanobacterial mats: a direct biogenic source for branched alkanes in ancient sediments?[J]. Organic Geochemistry, 1990, 15(3): 223-231. |
| [5] | Robinson N, Eglinton G. Lipid chemistry of Icelandic hot spring microbial mats[J]. Organic Geochemistry, 1990, 15(3): 291-298. |
| [6] | Kenig F, Huc A Y, Purser B H, et al. Sedimentation, distribution and diagenesis of organic matter in a recent carbonate environment, Abu Dhabi, U. A. E[J]. Organic Geochemistry, 1990, 16(4/5/6): 735-747. |
| [7] | Kenig F, Sinninghe Damsté J S, De Leeuw J W, et al. Molecular palaeontological evidence for food-web relationships[J]. Naturwissenschaften, 1994, 81(3): 128-130. |
| [8] | Kenig F, Sinninghe Damsté J S, Kock-van Dalen A C, et al. Occurrence and origin of mono-, di-, and trimethylalkanes in modern and Holocene cyanobacterial mats from Abu Dhabi, United Arab Emirates[J]. Geochimica et Cosmochimica Acta, 1995, 59(14): 2999-3015. |
| [9] | Jackson M J, Powell T G, Summons R E, et al. Hydrocarbon shows and petroleum source rocks in sediments as old as 1.7× 109 years[J]. Nature, 1986, 322(6081): 727-729. |
| [10] | Klomp U C. The chemical structure of a pronounced series of iso-alkanes in South Oman crudes[J]. Organic Geochemistry, 1986, 10(4/5/6): 807-814. |
| [11] | Fowler M G, Douglas A G. Saturated hydrocarbon biomarkers in oils of Late Precambrian age from Eastern Siberia[J]. Organic Geochemistry, 1987, 11(3): 201-213. |
| [12] | Lu Hong, Peng Ping'an, Sun Yongge. Molecular and stable carbon isotopic composition of monomethylalkanes from one oil sand sample: source implications[J]. Organic Geochemistry, 2003, 34(6): 745-754. |
| [13] | 吉利明,李剑峰,宋之光. 鄂尔多斯盆地延长组葡萄藻的石油地质意义[J]. 石油勘探与开发,2009,36(2):156-165. [Ji Liming, Li Jianfeng, Song Zhiguang. Petroleum geological significance of Botryococcus in Triassic Yanchang Formation, Ordos Basin[J].Petroleum Exploration and Development, 2009, 36(2): 156-165.] |
| [14] | Kenig F. C16-C29 homologous series of monomethylalkanes in the pyrolysis products of a Holocene microbial mat[J]. Organic Geochemistry, 2000, 31(2/3): 237-241. |
| [15] | Thiel V, Jenisch A, Wörheide G, et al. Mid-chain branched alkanoic acids from "living fossil" demosponges: a link to ancient sedimentary lipids?[J]. Organic Geochemistry, 1999, 30(1): 1-14. |
| [16] | Summons R E, Powell T G, Boreham C J. Petroleum geology and geochemistry of the Middle Proterozoic McArthur Basin, Northern Australia: III. Composition of extractable hydrocarbons[J]. Geochimica et Cosmochimica Acta, 1988, 52(7): 1747-1763. |
| [17] | Summons R E. Branched alkanes from ancient and modern sediments: isomer discrimination by GC/MS with multiple reaction monitoring[J]. Organic Geochemistry, 1987, 11(4): 281-289. |
| [18] | Audino M, Grice K, Alexander R, et al. Unusual distribution of monomethylalkanes in Botryococcus braunii–rich samples: origin and significance[J]. Geochimica et Cosmochimica Acta, 2001, 65(12): 1995-2006. |
| [19] | Kissin Y V. Catagenesis and composition of petroleum: Origin of n-alkanes and isoalkanes in petroleum crudes[J]. Geochimica et Cosmochimica Acta, 1987, 51(9): 2445-2457. |
| [20] | Hld I M, Schouten S, Jellema J, et al. Origin of free and bound mid-chain methyl alkanes in oils, bitumens and kerogens of the marine, Infracambrian Huqf Formation (Oman)[J]. Organic Geochemistry, 1999, 30(11): 1411-1428. |
| [21] | Katritzky A R, Chen Ke, Maran U, et al. QSPR correlation and predictions of GC retention indexes for methyl-branched hydrocarbons produced by insects[J]. Analytical Chemistry, 2000, 72(1): 101-109. |
| [22] | Krkošová Ž, Kubinec R, Addová G, et al. Gas chromatographic-mass spectrometric characterization of monomethylalkanes from fuel diesel[J]. Petroleum & Coal, 2007, 49 (3): 51-62. |
| [23] | McCarthy E D, Han J, Calvin M. Hydrogen atom transfer in mass spectrometric fragmentation patterns of saturated aliphatic hydrocarbons[J]. Analytical Chemistry, 1968, 40(10): 1475-1480. |
| [24] | Kovats E. Gas-chromatographische charakterisierung organischer verbindungen. Teil 1: Retentionsindices aliphatischer halogenide, alkohole, aldehyde und ketone [J]. Helvetica Chimica Acta, 1958, 41(7): 1915-1932. |
| [25] | Sojak L, Hrivnak J, Majer P, et al. Capillary gas chromatography of linear alkenes on Squalane[J]. Analytical Chemistry, 1973, 45(2): 293-302. |
 2015, Vol. 33
2015, Vol. 33


