扩展功能
文章信息
- 史春潇, 雷怀彦, 赵晶, 张劼, 韩超
- SHI Chun-xiao, LEI Huai-yan, ZHAO Jing, ZHANG Jie, HAN Chao
- 南海北部九龙甲烷礁邻区沉积物层中垂向细菌群落结构特征研究
- Vertical Microbial Community Structure Characteristics of Sediment in Gas Hydrate Potential Area of Northern South China Sea Jiulong Methane Reef
- 沉积学报, 2014, 32(6): 1072-1082
- ACTA SEDIMENTOLOGICA SINCA, 2014, 32(6): 1072-1082
-
文章历史
- 收稿日期:2013-09-27
- 收修改稿日期:2014-01-10
2. 厦门大学近海海洋环境科学国家重点实验室 福建厦门 361102
2. State Key Laboratory of Marine Environment Science, Xiamen University, Xiamen, Fujian 361102
The environment parameters show that the total organic carbon content decrease from surface to deep, and the content was between 0.20% to 1.83%, mostly greater than 0.5%, it can provide source for the formation of gas hydrate; the average sediment grain is between 6 μm to 8 μm; the age of the bottom of 973-4 core is 43 431 a, reveal to oxygen isotopic Ⅲ period, and the average deposition rate of this core was 34.6 cm·ka-1, meet the deposition rate of natural gas hydrate formation conditions.
The result of T-RFLP show that there were much higher values of richness, Shannon-wiener index and evenness index in surface layer sediments and deep layer than the middle layer, but 716 cm was higher than other depths sediments in middle layer by the analysis of terminal restriction fragment(T-RFs). The Shannon-wiener index in some depth was lower than 2.0, show the low diversity of microbial. The three parameters have the same trend. Three parameters increased initially then reduced from deep layer to 716 cm, and the trend from 716 cm to surface layer was decrease and then increase. Though clustering result on the terminal restriction fragments(T-RFs) areas and denaturing gradient gel electrophoresis patterns shows that: the surface sediments 20 cm to 192 cm have higher similarity, the value is 52%, 236 cm were similar to 1 196, the similarity is 76%, 382 cm to 1 082 cm similarity is 38%, besides have similarity with 326 cm, 552 cm, 796 cm; the different depths in middle layer have similarity, simultaneously 716 cm and 862 cm were higher similar, this is connection with the methane level in middle layer, and methane can affect the community composition of microbial. Middle layer located in oxygen isotopicⅡ period, the template is cool, it led to the sea levels drop and made the change of the methane, and the change of methane concentration lead to great difference of microbial community structure in middle with surface and deep layers. The deep sediments microbial community has higher similarity with the surface layer because of the methane concentration was lower than middle layer and the similar total organic carbon content. Through clustering analysis and sediment environment parameters indicated that the vertical distribution of bacterial was coincided with the sediment total organic carbon content, grain size and methane concentration. And the difference of microbial community structure related to the geologic conditions for example depth, the change of sediment properties, methane concentration.
Through compare T-RFLP chromatogram to Mica3 database and sequencing the DGGE bands to analysis the diversity of the sediments and the result showed that:Proteobacteria were the dominant phylum, and α-,γ-,δ-Proteobacteria were the main class within Proteobacteria, other bacteria include Actionmycetes, Firmicutes and Chloroflexi. The dominate bacteria in surface layer is δ-Proteobacteria, most of microbial were related to the hydrothermal vent of deep sea sediments, and δ-Proteobacteria have related with sulfur cycle, indicated that sulfide metabolism especially the sulfate reduction was important process; in middle layer α-Proteobacteria, δ-Proteobacteria were the dominant bacteria and almost related to the deep-sea methane seep and pacific deep-sea sediment, suggest that sulfate reduction and methane oxidation were the main process in middle layer; α-Proteobacteria was dominated in deep layer, we conclude that methane oxidation was the main process, indicating that our deep-sea sampling might be influence by the gas hydrate. In addition, methane oxidizing bacteria such as Methanotrophs and Sulfate-reducing bacteria occur in middle layer where has higher methane concentration areas, and the bacterial were related to the bacterial retrieved from sulfide chimneys, hydrothermal vent environment and areas where has confirm existing gas hydrate, indicated that the microbial community structure in core 973-4 have relation with gas hydrate decomposition and release, suggest that this zone maybe exist gas hydrate. Our data suggest that other bacteria are also involved in methane oxidation in these environments, and combine with the environment parameters we conclude that this zone exist gas hydrate, and conclusion the sulfate reduction methane oxidation transform zone located in the depths of 500 cm to 900 cm.
低温、高压、气源充足条件下形成的天然气水合物具有诱人的资源潜力和开发前景,据保守估计,全球水合物形式存在的碳汇是地球已知化石燃料(包括煤、石油、天然气等)的两倍[1]。近年来,美国、日本、俄罗斯等分别在阿拉斯加北坡、南海海槽、西西伯利亚永久冻土带发现天然气水合物,并将天然气水合物的开发提升至国家能源战略层次,并都宣称将于2015年前后进行商业性开采。中国也在2007年5月于南海北部陆坡神狐海域钻探到天然气水合物样品,国家有关重大项目“863”、“973”开展了一些前沿性研究,发现了与天然气水合物分解相关的细菌和古菌,但是许多尚未被培养,如生产天然气水合物主要气体组分—甲烷的厌氧产甲烷古菌[2]。海底深部生物圈微生物类群通过产生和消耗CH4,与海底天然气水合物的形成与稳定密切相关[3]。因此,国内外学者通过沉积物中细菌、古菌等微生物群落结构和优势类群对水合物的形成和分解进行研究[4, 5, 6]。由于沉积物中微生物代谢活性较低,且99%以上的微生物不可培养。因此,目前主要利用基于16SrDNA的分子生物学技术调查沉积物天然气水合物中相关微生物群落的组成和多样性,以便了解微生物群落与天然气水合物的相关关系。
目前关于九龙甲烷礁区域微生物群落的研究是基于Han等[7]认为的九龙甲烷礁是甲烷渗漏经微生物作用形成的较大的冷泉碳酸盐岩的观点,邬黛黛[9]、曹超[10]等研究也发现九龙甲烷礁碳酸盐岩沉淀是通过微生物消耗渗漏烃类形成的,具有强13C亏损和18O富集的特点,与Hydrate Ridge、Gulf of Mexico、Okhotsk Sea等典型天然气水合物区的碳酸盐岩的碳氧同位素特征相同[7,11]。表明此区域碳源为甲烷相关菌的厌氧氧化后形成的HCO-或CO2,成岩环境与甲烷活动相关,其较高的沉积速率及较强的似海底反射波显示该区与天然气水合物密切相关,且甲烷气体来源以微生物成因为主[12] ,但迄今为止对该区域微生物群落及其分布特征并未了解。
本文利用PCR-TRFLP和DGGE技术,对南海九龙甲烷礁附近973-4柱中不同深度沉积物(表层,中层,深层共12个深度)中细菌分布特征进行了比较分析,并综合地球化学多项参数探讨了微生物分布与沉积物中天然气水合物存在及形成的相关性,确定南海天然气水合物潜在区微生物群落特征和多样性,以期了解天然气水合物赋存区微生物对天然气水合物的形成的关键作用,为研究微生物成因的天然气水合物勘探开采提供重要的科学参考和理论依据。 1 实验材料和方法 1.1 样品概况
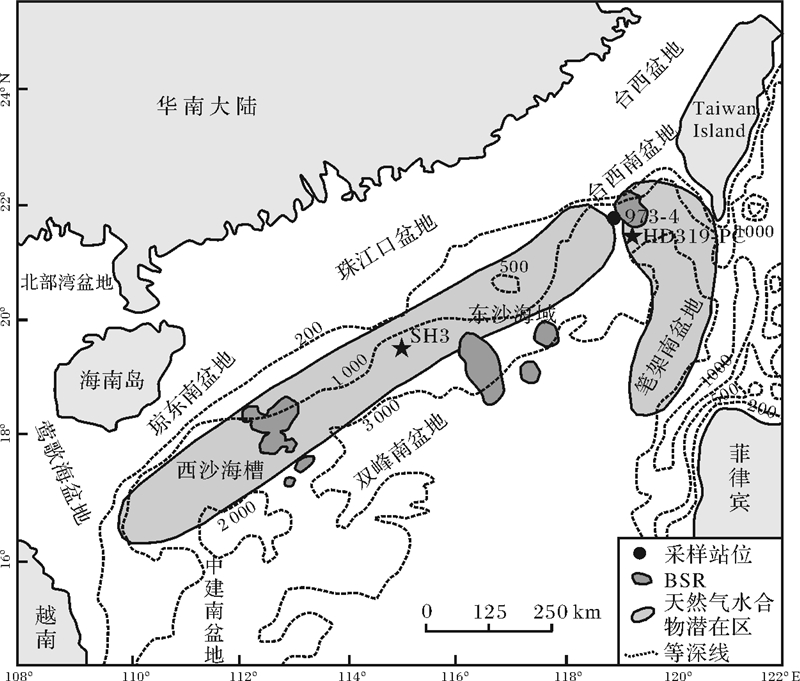
973-4站位样品是2011年搭载“海洋六号”船执行南海北部HY6-2011-1航次于东沙群岛九 龙甲烷礁附近(21°54.3247′ N,118°49.0818′ E)所获,如图 1,水深 1 666 m,钻孔深度13.95 m。样品采集后按深度进行切割,置于无菌离心管中储存于-20℃。按最大取样密度对样品进行分割取样,并根据不同深度对应的同位素期次,将选取的12个样品分为:表层(20~386 cm)5个样品,中层(552~800 cm)4个样品,深层(862~1 200 cm)3个样品进行研究,取样深度如表 1。
|
| 图 1 973-4采样站位图,图中圆点代表本研究采样位点 Fig. 1 Station of 973-4 Core,the dot stands for the sampling site |
| 973-4柱样取样编号 | 深度/cm | 所属层位 |
| 1 | 20~25 | |
| 2 | 192~196 | |
| 3 | 236~240 | 表层 |
| 4 | 326~329 | |
| 5 | 382~386 | |
| 6 | 552~556 | |
| 7 | 592~596 | 中层 |
| 8 | 716~720 | |
| 9 | 796~800 | |
| 10 | 862~866 | |
| 11 | 1 082~1 086 | 深层 |
| 12 | 1 196~1 200 |
将973-4柱状样12个不同深度样品进行以下测试:通过重铬酸钾加热法测定总有机碳TOC,通过Mastersize2000进行沉积物粒径分析,采用了4个深度的有孔虫N.dutertrei进行AMS14C测年,测年由中国科学院西安环境研究所加速质谱中心完成。
1.3 DNA提取及PCR扩增
采用Power Soil DNA Isolation Kit试剂盒,按照使用方法进行DNA提取,电泳检测,获得的DNA样品直接进行PCR扩增。以提取得到DNA为模板,16SrDNA通用引物27F/1492R进行PCR扩增,之后用V3区通用引物341F/534R进行二次扩增。扩增体系为25 μL:10×PCR Buffer 2.5 μL,dNTP(2.5 mmol/L) 2 μL,DNA模板1 μL,正反向引物各0.5 μL,Taq酶0.5 μL,加ddw至25 μL。PCR扩增条件参见文献[12,13]。两种引物扩增所得片段长度应为1 500 bp、200 bp,扩增后进行电泳检测并纯化回收,用于下一步DGGE及T-RFLP实验分析。
1.4 T-RFLP多态性分析
将细菌16SrDNA纯化回收后的PCR产物在37℃用MspⅠ内切酶酶切3.5 h,65℃终止反应15 min。送往上海生工生物工程有限公司进行STR检测。测定结果用Peak scanner1.0软件分析。将部分特征和优势片段通过Mica3数据库推测同源性菌群。计算细菌丰度(S),香农指数(H)及均匀度(E),并通过聚类分析比较不同深度沉积物细菌群落的相似性。
1.5 DGGE电泳与DNA回收
采用DGGE分离973-4柱状样不同深度的特征性微生物。变性胶浓度为8%,变性梯度为30%~60%。在1×TAE缓冲液中30 V预跑30 min后60 V运行13 h,电泳后用银染法进行染色。借助UV成像系统进行观察并拍照。对DGGE凝胶图谱中的优势DNA条带和特征条带进行切胶回收,放于无菌1.5 mL离心管中,加入20 μL无菌水,65℃放置15 min,4℃培养过夜。之后以回收的DNA进行扩增纯化,纯化产物在上海生工生物工程有限公司进行测序。
973-4柱状样沉积物总有机碳分析及沉积物粒径分析如图 3:表层至深层有机碳(TOC)含量呈减小趋势,含量在0.20%~1.83%之间。沉积物粒度大小平均为6~8 μm之间,主要粒级为粉砂。通过测年得到220~230 cm,456~462 cm,750~760 cm,1 280~1 290 cm深度沉积物年龄,并对973-4柱状样的沉积速率进行估算,分别为38.51,34.60,33.72,31.57 cm·ka-1,如图 2所示。除控制点之外的数据点采用线性插值法建立年代框架如表 2。通过SPECMAP δ18O曲线对比可得出氧同位素期次。973-4孔底年龄43 431 a,揭示到氧同位素Ⅲ期。该站位与HD-319PC站位相近,引用其现场测试得到的甲烷含量[19],716 cm甲烷含量达1 499 μg·L-1。
T-RFLP图谱中,波峰数量、波峰面积以及峰的T-RFs长度分别代表群落多样性,微生物的相对生物量和微生物类型。分别对12个不同深度的细菌T-RFLP色谱图进行分析,由表层至深层12个深度得到的T-RF数分别为24、18、10、18、9、14、8、21、9、8、10、17,浅层微生物丰度相对较大,中层丰度相对较小,到716 cm处微生物丰度突然升高,之后至深层微生物丰度呈先升后降趋势。通过波峰对应的片段和峰面积,对各深度的香农指数(H)和均匀度(E)进行
计算,结果见图 4:深层至浅层香农指数呈先下降后上升趋势,其中20 cm、326 cm、716 cm、1 196 cm处香农指数较大,说明这些站位微生物多样性相对较高。由深层到浅层均匀度相当,但深度796 cm至1 082 cm处均匀度较低,说明生物量分布较不均匀。
对12个深度色谱图的荧光片段长度进行匹配,以峰面积作为相对生物量,计算不同深度细菌群落的相似性(图 4),由图中可以看出:192 cm与20 cm相似度为52%,236 cm与1 196 cm相似性最高达76%,382 cm与1 082 cm深度相似性达38%,并与326 cm,552 cm,796 cm有相关性,592 cm与796 cm深度微生物相似度达58%,716 cm与862 cm相似性较低,为41%,592 cm与996 cm相似度71%。
对12个深度的优势末端荧光片段长度(89 bp,91 bp,92 bp,489 bp,493 bp)及存在于6个以上深度的末端荧光片段长度及
716 cm特征片段长度比对其可能的同源性菌群,结果如表 3。主要分布于变形菌门(Proteobacteria),放线菌(Actinobacteria),厚壁菌门(Firmicutes)。由图 5可看出,表层沉积物中δ-Proteobacteria为优势菌,其次为α-、γ-Proteobacteria、Firmicutes和硫酸盐还原菌;中层δ-、α-、γ-Proteobacteria为优势菌,其次为Actinobacteria;深层主要为α-、γ-Proteobacteria,其次为Actinobacteria。通过比对甲烷氧化菌及硫酸盐还原菌多出现在236 cm、716 cm、862 cm及1 196 cm深度处,552 cm至716 cm处细菌与分离自太平洋东北部、冲绳海槽热液喷口、加利福尼亚圣巴巴拉海盆等海底沉积物细菌相关性较高,如硫还原菌Desulfuromonadales bacterium(92 bp)及甲烷相关菌type Ⅱ methanotroph(114 bp)、Methylophilaceae(496 bp)、Thermoanaerobacteriaceae(179 bp)并且中层甲烷含量较高,由此可以看出与甲烷相关微生物多出现在甲烷含量高的区域。
不同深度样品各分离到10到25条不同的条带,如图 6所示,其中条带数目最多的站位是20 cm,最少的出现在862 cm,由图 6B可看出,表层、中层、深层微生物群落结构差异较大,同一层内不同深度微生物群落相似性较高,如表层20 cm与192 cm,326 cm与382 cm、456 cm相同条带较多,但表层5个深度与中层592 cm、716 cm、796 cm相同条带较少。以相应位置是否出现条带作为分析依据,得到聚类分析结果,20 cm与192 cm相似性较高,592 cm、796 cm相聚类,716 cm与862 cm达60%以上,与T-RFLP结果基本一致。根据DGGE指纹图谱,对12个深度均出现的条带及部分特征条带进行回收测序,通过与GenBank数据库进行比对,匹配同源性最高的序列,结果见表 4。根据比对,大部分条带都与数据库中未培养或未鉴定的细菌具96%~99%的最高同源性,04_09与分离自Guaymas Basin厌氧甲烷氧化区微生物有较高的相似性,04_12与分离自Lau Basin硫化物烟囱区的Methylococcales相似性较高,04_11与分离自Guanabara Bay的 Uncultured epsilon Proteobacterium有较高的相似性,回收条带所得细菌多与甲烷代谢相关,显示该区碳循环占重要地位。
海底沉积物的理化因子对微生物的多样性及群落结构有很大影响。碳是形成天然气水合物的必需元素,也是微生物进行各种代谢活动的必须物质。沉积物中的有机质含量对生物气形成有较大影响,在海洋沉积物中,有机质含量>0.5%,既能为天然气水合物的成藏提供条件,本研究中有机碳含量0.20%~1.83%之间,与布莱克海沉积物0.39%~1.26%相似,满足天然气水合物成藏条件。并且本柱状样平均沉积速率为34.6 cm·ka-1,大于3 cm·ka-1,满足天然气水合物形成的沉积速率条件。此外,海洋沉积物中,甲烷含量对微生物丰度及多样性分布有较大影响[15]。通过测年与氧同位素期次比较,研究区中层处于氧同位素Ⅱ期,沉积物年龄范围为13 266 a至23 874 a,气候寒冷,末次冰期极盛期,且南海在晚第四纪以来的海平面受全球气候变化影响较大[16],海平面下降150 m,且海底压力降低1.5×106 Pa[17],与海平面变化天然气水合物失稳释放甲烷的地质时期一致。HD319PC与973-4站位都位于南海东北部东沙海域,500 cm至800 cm属于氧同位素Ⅱ期,与973-4测年所得不同深度氧同位素期次相符,且沉积物类型均为粉砂,富含有孔虫及超微化石,沉积环境符合水合物赋存条件,而HD-319PC站位测得620~730 cm深度范围甲烷含量较高[14],由此推测本站位处于末次冰期的552~796 cm深度为富甲烷区。研究表明,同一岩芯中微生物的丰度变化与甲烷浓度变化相吻合,甲烷浓度高,微生物丰度大,反之亦然[15]。本柱状样716 cm处微生物丰度突然增大,均匀度较低,香农指数较高,可能与水合物分解释放甲烷有关,水合物释放导致甲烷浓度升高,高含量的甲烷突破硫酸盐—甲烷界面(sulfate methane interface,SMI) 和甲烷厌氧氧化(anaerobic oxidation of methane,AOM)带,过程中发生甲烷氧化及硫酸盐还原作用,影响微生物丰度及群落结构,使得与甲烷相关菌种成为优势种群,其他微生物生长减慢或受到抑制,导致不同群落生物量相差较大。表层沉积物年龄揭示至10 887 a,与氧同位素期次比较表明表层处于氧同位素Ⅰ期,随着末次冰期结束,气温逐渐变暖,有机含量较高,甲烷含量小,对不同种微生物的抑制作用减小,群落分布较平均,香农指数整体呈增大趋势。并且表层沉积物埋藏环境较浅,沉积速率较高达38.51 cm·ka-1,有机物埋藏快,可利用的营养成分较高,微生物丰度较高。深层沉积物处于氧同位素Ⅲ期,气候较温暖,有机碳含量较低,微生物丰度相对表层较低但微生物丰度变化不大,1 200 cm处细菌丰度突然增大,与有机碳含量变化一致。
3.2 不同深度微生物群落相似性分析
T-RFLP与DGGE方法在本研究沉积物中微生物群落结构中得到的聚类分析结果相符,说明本研究中微生物丰度,香浓指数和均匀度等数据可靠,不同深度间相似性分析结果能够反应本站位的微生物群落分布。T-RFLP和DGGE实验的聚类分析结果均表明716 cm与862 cm有相似性,此深度范围为富甲烷环境,微生物群落如Methanotroph、Desulfuromonas等多与水合物分解相关,因此微生物相似性较高可能与甲烷含量有关;中层沉积物处于氧同位素Ⅱ期,水合物释放使该深度甲烷含量升高,且有机质含量丰富,因此中层不同深度微生物相似性较高;表层20 cm至192 cm微生物群落相似性较高,处于同一氧同位素期次,相同的温度条件,有机质含量、甲烷含量相差不大,导致微生物丰度及群落结构相似。,深层及表层分别处于氧同位素Ⅲ期、Ⅰ期,气候温暖,环境稳定,导致1 082 cm、1 196 cm与236 cm至382 cm群落结构相似。由此可知,微生物群落结构差异可能与所处的深度有关,沉积物性质的变化、甲烷含量不同可能导致微生物群落结构特征不同。因此,沉积物环境条件的差异包括水合物存在与否,甲烷含量等变化会导致优势微生物种属改变,使微生物群落结构呈现空间差异性。
3.3 不同深度微生物群落结构分析
本研究采用T-RFLP和DGGE等分子生物学方法,对南海九龙甲烷礁沉积物进行了微生物群落结构研究和分析。通过对本柱样12个深度微生物群落结构分析,可看出本区域甲烷对群落结构产生了较大的影响,微生物群落与天然气水合物有关。通过比对DGGE指纹图谱,选取8个荧光强度较强及特征条带对DGGE条带回收,测序后进行同源性比较,虽然本区域未知细菌含量较高,但与日本海域天然气水合物区、Guaymas Basin热液沉积物等微生物同源性较高,表明该区微生物多与水合物相关。通过T-RFLP分析,结果表明,973-4沉积物样品中变形杆菌(Proteobacteria)为主要类群,其他还有厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)、绿弯菌门(Chloroflexi),且大多数属于未培养细菌。海洋沉积物中Proteobacteria分布广泛,有很多不同的亚群,分离于海洋中的许多嗜压菌、嗜冷菌、嗜热菌等均属于Proteobacteria[18],Julian R.等对Cascadia天然气水合物区研究发现Proteobacteria为优势菌种,且γ-Proteobacertia为优势亚种[19],曾润颖等研究发现西太平洋暖池区γ-Proteobacertia为优势菌群[20],太平洋帕里西维拉海盆5 010 m深处沉积物中γ-、α-变形菌为优势细菌种群[21],在南海西沙海槽沉积物中β-变形菌占多数[22],南海南沙海槽沉积物中γ-,β-变形菌占优势[23],因此微生物群落中优势类群的差异可能与沉积物理化性质、地理位置以及气候条件等环境因素有关。973-4柱状样中的Proteobacteria包含α、β、γ、δ 4个亚群,其中γ-Proteobacertia及δ-Proteobacertia为主要的优势亚菌,结果与孙慧敏等研究发现南海北部海域群落结构分析结果基本一致[25]。甲烷营养菌中I/X型属于γ-Proteobacertia,主要分布于甲烷含量低的地区,Freitag在研究海洋沉积物厌氧条件氨代谢情况时也发现,γ-Proteobacertia与厌氧氨氧化作用有关[26],甲烷营养菌中类型 II 属于α-和β-Proteobacertia亚群,主要分布于甲烷浓度相对较高的地区,δ-Proteobacteria属于有机化能营养菌,并且绝大多数与硫酸盐还原菌有关。本柱样存在α、β、γ、δ 4个亚群,由此可以推测该区沉积物中细菌与碳、氮、硫循环相关。表层至深层中α-Proteobacteria(67 bp),δ-Proteobacteria(91 bp,135 bp,507 bp)均占优势,并且与日本3 100 m深海、太平洋深海、Wadden Sea深海、Antarctica等区甲烷代谢、硫代谢细菌有较高同源性,说明本区甲烷氧化,硫酸盐还原占重要地位。如图 5所示,本区表层微生物中δ-Proteobacteria占28%,为优势菌,同源序列主要来源于深海热液喷口,由此可知,该区沉积物物质循环过程中硫化物代谢占重要地位,推测表层主要以硫酸盐还原反应为主。中层微生物以α-Proteobacteria,δ-Proteobacteria为主,各占25%,与太平洋中部深海沉积物有较高的同源性,其他为γ-Proteobacteria,Chloroflexi,多以未培养微生物为主,表明中层主要以甲烷氧化反应及硫还原反应为主。对比甲烷含量最高的716 cm深度特征片段,虽然大部分为未培养细菌,但与深海及甲烷代谢菌同源性较高,如Thermoanaerobacteriaceae(179 bp)、uncultured bacterium(181 bp,308 bp,313 bp,317 bp)与稻田区、California Santa Barbara Basin甲烷氧化—硫酸盐还原带及冲绳海槽热液喷口、太平洋等区甲烷微生物相关[27,28]。已有研究表明α-、γ-Proteobacteria 共同参与了甲烷厌氧氧化过程,而本站位中层为富甲烷区,且type Ⅱ Methanotroph(114 bp)、Methylophilaceae(496 bp)分别在716 cm及552 cm出现,结合中层主要发生甲烷氧化及硫酸盐还原,因此推测该区存在天然气水合物,由于海平面下降等原因水合物释放分解为甲烷,并且本区500 cm至800 cm为甲烷氧化—硫酸盐还原过渡带(SMTZ)。由于甲烷释放逸散使716 cm处甲烷含量升高,因此推测深层862 cm存在逸散的甲烷,而深层微生物主要以α-Proteobacteria为主,因此深层可能主要发生甲烷厌氧氧化。
对于973-4柱状样中微生物与天然气水合物的关系进一步的探讨有待建立在更多的微生物和地质环境分析的基础上。天然气水合物赋存区中微生物对天然气水合物的影响、微生物对此环境的改变和稳定性的影响以及天然气水合物环境中微生物之间的相互作用等需要进行更深入的研究。
4 结论
(1) 表层与深层微生物相似性较高,甲烷含量较高的中层微生物类群与表层、深层有较大不同,表明甲烷对该站位微生物群落有较大的影响。
(2) 细菌丰度与甲烷有较好的相关性,甲烷含量较高的深度微生物丰度也较高,微生物多样性较丰富,并且甲烷含量高的中层包含与甲烷氧化相关的微生物如type Ⅱ Methanotroph,与其他层位相比有一定的独特性。
(3) 微生物群落随深度变化有较明显的变化,表层以δ-Proteobacteria为主,中层以α-Proteobacteria,δ-Proteobacteria为主,深层以α-Proteobacteria及未培养微生物为主,由T-RFLP结果可知,中层优势菌与硫酸盐还原及甲烷氧化作用密切相关,表明在该区域海底沉积物的物质和能量循环中,通过微生物完成甲烷代谢及硫代谢,结合本站位较高的甲烷浓度,推测硫酸盐—甲烷转化界面(SMI)位于此深度,说明该区存在天然气水合物的分解释放。
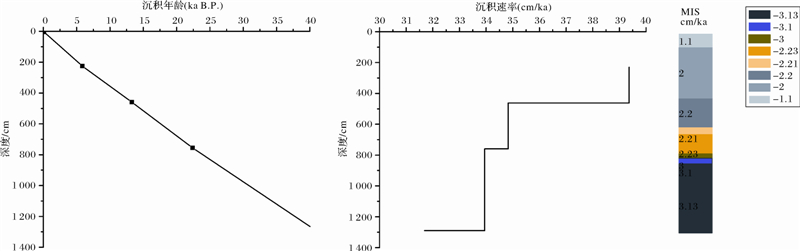
图 2 973-4站位地层框架及沉积速率
Fig. 2 Stratigraphic framework and sedimentation rate of Core 973-4
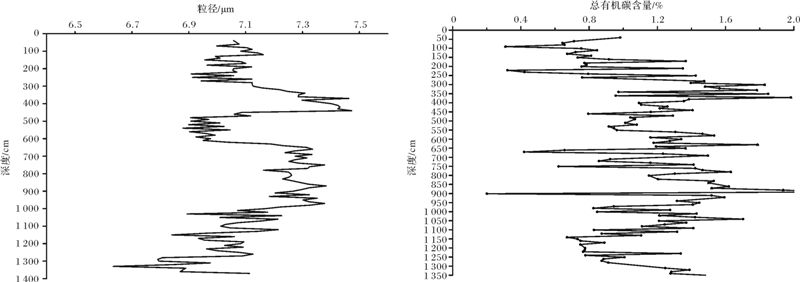
图 3 973-4柱状样沉积物粒度分布及总有机碳分布
Fig. 3 Sediment particle size and TOC distribution of Core 973-4
样品深度/cm 氧同位素期次① 年龄/a B.P. ② w(TOC)/% ρ(CH4)③/(μg·L-1) 沉积物类型
20~25 1.1 593 2.17
192~196 1.1 5 038 0.79 黏土质粉砂
236~240 — 6 255 0.80 3.08 含砂黏土质粉砂
326~329 — 9 095 1.67 3.1 黏土质粉砂
382~386 1.1 10 887 1.36 3.4 含砂黏土质粉砂
456~462 2 13 266 0.79 含砂黏土质粉砂
552~556 — 16 194 1.13 2.87 含砂黏土质粉砂
592~596 — 17 426 1.25 2.8 含砂黏土质粉砂
716~720 2.21 21 248 0.89 1 499.1 黏土质粉砂
796~800 2.23 23 874 1.23 黏土质粉砂
862~866 3.12 6 154 1.57 黏土质粉砂
1 082~1 086 — 33 756 1.26 黏土质粉砂
1 196~1 200 — 37 695 0.75 含砂黏土质粉砂 注:①据文献[29],30万年以来高分辨率的氧同位素底层年代表摘录相同层位;②有孔虫AMS14C年龄数据由中国科学院西安环境研究所加速质谱中心分析;③据文献[4],在南海北部陆坡现场测试沉积物中甲烷含量选择相同或者相近层位引用。
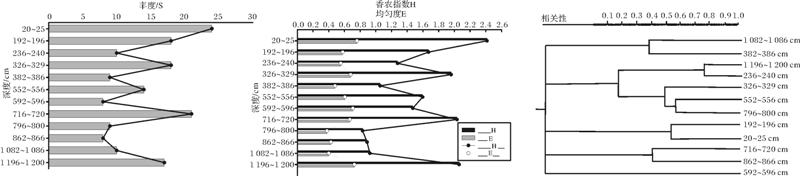
图 4 973-4柱状样不同深度细菌丰度、香农指数、均匀度及不同深度细菌聚类分析
Fig. 4 Phylotype richness(S),Shannon-wienewe Index(H) and Evenness(E) values for the bacterial communities from T-RFLP profiles of 973-4 cores and bacterial clusters of Core 973-4 different depth
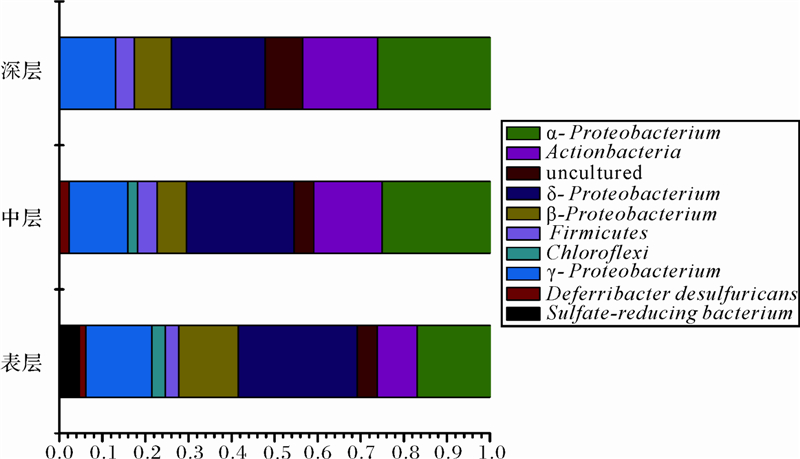
图 5 三个层次细菌所占比例
Fig. 5 Proportion of different bacterial in three layers
片段长度(bp) 可能匹配序列(mica3数据库) 所属层位/cm
89 AP011529; Deferribacter desulfuricans 592
91 AB121109; uncultured δ-Proteobacterium 192,326,382,552,796,862,1 082
92 HQ132471; uncultured Desulfuromonadales bacterium 716,236,1 196
114 AY163571; uncultured type Ⅱ Methanotroph 192,326,236,1 196,716
120 EU328089;uncultured γ-Proteobacterium 592,382,1 082,192,552,1 196,236,716
121 AB519265; uncultured bacterium D85CN11OTU1 592,382,1 082,192,552,1 196,236,716
67 AJ567596; uncultured α-Ρroteobacterium MBAE43 592,382,862,1 196,236,716
97 GQ452894; uncultured Αctinobacterium 716
69 EU104839; uncultured Firmicutes bacterium 2R2U10 192,716,1 196
130 EU328027; uncultured Desulfuromonas sp. B93 862
131 DQ867001; Desulfovibrio alaskensis HEB223 862
135 AM774314; δ-Proteobacterium JSSRB50Hy 192
142 EU523092; uncultured sulfate-reducing bacterium BpP93 20,192
179 AY684080; uncultured Thermoanaerobacteriaceae 716
181 HQ672507; uncultured bacterium F9P4500SP05 716
200 GQ249578; uncultured Chloroflexi bacterium D36 592
308 EU107485; uncultured γ-Proteobacterium B59 716
313 FJ189565; uncultured bacterium EUB44 716
317 EU181472; uncultured bacterium 5BAVA3JS1 716
424 HQ397143; uncultured α-Proteobacterium 326,552,592,796
493 AY951932; Methanotrophic bacterial 20
495 AJ567559; uncultured Proteobacterium MBMPE45 326,552,796
496 AY360527; uncultured Methylophilaceae bacterium 10-3Ba03 326,382,552
466 AB013262; uncultured α-Proteobacterium 1 196
473 AY251063; uncultured Proteobacterium FT17B33 1 196
484 AY007296; Methylosarcina lacus (T) LW14 20
490 DQ394993; uncultured δ-Proteobacterium VHS-B4 20,1 196
499 GQ472814; uncultured γ-Proteobacterium b45 192,552,796
507 DQ767884; Desulfovibrio sp. FSR12B 20,1 196
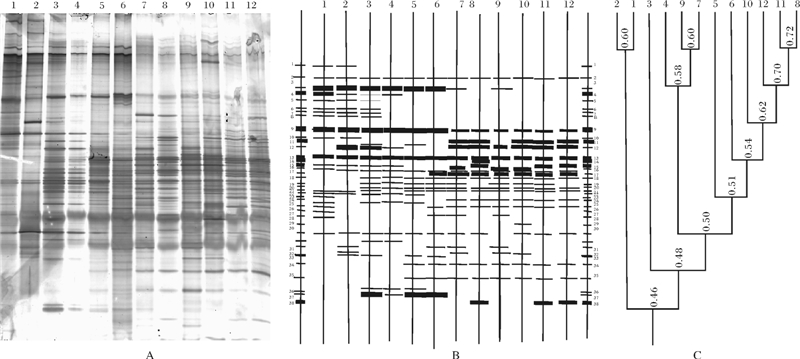
图 6 不同深度细菌16SrRNA基因片段DGGE电泳图谱(A,B)及聚类分析结果(C)(1-12与表 1中取样深度相对应)
Fig. 6 Image of DGGE gels containing bacterial 16SrRNA gene fragment(A,B) and clustering of different deeps(C)
(1-12 corresponding to the sample number of the Table 1)
编号 相似度最高细菌 相似度 所属深度
SCX_04_01 Unculture bacterium AB770304.1 MD179_57_MD3329G_O_632cm_28 99% 表层
SCX_04_03 Uncultured bacterium FN296085.1 clone Clueless (52 ROV 5-7) X-C03 99% 表层、中层
SCX_04_06 Uncultured bacterium AB275987.1 96% 表层
SCX_04_08 Uncultured bacterium KC631527.1 99% 表层
SCX_04_09 Uncultured Proteobacterium isolate a1b024 AF420343.1 99% 表层、中层、深层
SCX_04_11 Uncultured epsilon Proteobacterium clone b1pl2B11 EF092699.1 97% 中层、深层
SCX_04_12 Uncultured bacterium clone ABEsIN_E7 KC682703.1 99% 中层、深层
| [1] | 张洪涛,张海启,祝有海. 中国天然气水合物调查研究现状及其进展[J]. 中国地质,2007,34(6):953-961[Zhang Hongtao, Zhang Haiqi, Zhu Youhai. Gas hydrate investigation and research in China: Present status and progress [J]. Geology in China, 2007, 34(6): 953-961] |
| [2] | Whiticar M J. Carbon and hydrogen isotope systematics of bacterial formation and oxidation of methane[J]. Chemical Geology, 1999, 161(1/2/3): 291-314 |
| [3] | 党宏月,宋林生,李铁刚,等. 海底深部生物圈微生物的研究进展[J]. 地球科学进展,2005,20(12):1306-1313[Dang Hongyue, Song Linsheng, Li Tiegang, et al. Progresses in the studies of subseafloor deep biosphere microorganisms[J]. Advances in Earth Science, 2005, 20(12):1306-1313] |
| [4] | 张勇,苏新,陈芳,等. 南海北部陆坡神狐海域HS-373PC岩心表层沉积物古菌多样性[J]. 海洋科学进展,2010,28(3):318-324[Zhang Yong, Su Xin, Chen Fang, et al. Archaeal diversity in surface marine sediment of rock core from Shenhu area (HS-373PC) on continental slope of northern South China Sea[J]. Advance in Marine Science, 2010, 28(3):318-324] |
| [5] | 苏新,陈芳,张勇,等. 海洋天然气水合物勘查和识别新技术:地质微生物技术[J]. 现代地质,2010,24(3):409-423[Su Xin, Chen Fang, Zhang Yong, et al. Geomicrobiology as a new tool for exploration of marine gas hydrates[J]. Geoscience, 2010, 24(3): 409-423] |
| [6] | Inagaki F T, Nunoura S, Akagawa N, et al. Biogeographical distribution and diversity of microbes in methan hydrate-bearing deep marine sediment on the Pacific Ocean Margin[J]. Proceedings of the National Academy of Sciences of the United States of America, 2006, 103(8): 2815 |
| [7] | Han X, Suess E, Huang Y, et al. Jiulong methane reef: Microbial mediation of seep carbonates in the South China Sea[J]. Marine Geology, 2008, 249(3/4): 243-256 |
| [8] | 黄永样, ERWIN SUESS, 吴能友,等. 南海北部陆坡甲烷和天然气水合物地质[M]. 北京:地质出版社,2008[Huang Yongyang, Suess E, Wu Nengyou. Methane and Natural Gas Hydrate Geology in the Northern of South China Sea[M]. Beijing: Geological Publishing House, 2008] |
| [9] | 邬黛黛,吴能友,叶瑛,等. 南海北部陆坡九龙甲烷礁冷泉碳酸盐岩沉积岩石学特征[J]. 热带海洋学报,2009,29(3):74-81[Wu Daidai, Wu Nengyou, Ye Ying, et al. Petrographic characteristics of authigenic carbonates from Jiulong methane reef of northern South China Sea[J]. Journal of Tropical Oceanography, 2009, 29(3): 74-81] |
| [10] | 曹超,雷怀彦,官宝聪,等.东沙海域沉积物有机碳、氮含量及其同位素分布特征对富甲烷环境指示意义[J]. 厦门大学学报:自然科学版,2010,49(6):838-844[Cao Chao, Lei Huaiyan, Guan Baocong, et al. Carbon and nitrogen concentration and stable isotopic composition of sediments from Dongsha area to indicator of methane-rich environment[J]. Journal of Xiamen University: Natural Science, 2010, 49(6): 838-844] |
| [11] | 陆红锋,刘坚,陈芳,等. 南海台西南区碳酸盐岩矿物学和稳定同位素组成特征—天然气水合物存在的主要证据之一[J]. 地学前缘,2005,12(3):268-276[Lu Hongfeng, Liu Jian, Chen Fang, et al. Mineralogy and stable isotopic composition of authigenic carbonates in bottom sediments in the offshore area of southwest Taiwan, South China Sea: Evidence for gas hydrates occurrence[J]. Earth Science Frontiers, 2005, 12(3): 268-276] |
| [12] | Gulledge J, Almad A, Steudier P A,et al. Family and genus level 16SrRNA-targeted oligonucleotide probes for ecological studies of methanotrophic bacteria[J]. Applied and Environment Microbiology, 2001, 67(10): 4726-4733 |
| [13] | DeLong E F. Archaea in coastal marine environments[J]. Proceeding of the National Academy of Sciences, USA, 1992, 89(12): 5685-5689 |
| [14] | 周洋,陈芳,苏新,等. 南海东沙海域HD319岩心富甲烷环境底栖有孔虫群落结构[J]. 海洋地质与第四纪地质,2009, 29(3):1-8[Zhou Yang, Chen Fang, Su Xin, et al. Benthic foraminifera communities in methane-rich environment showed by Core HD319 in Dongsha sea area of the South China Sea[J]. Marine Geology & Quaternary Geology, 2009, 29(3): 1-8] |
| [15] | 苏新,陈芳,魏士平,等. 南海北部冷泉区沉积物中微生物丰度与甲烷浓度变化关系的初步研究[J]. 现代地质, 2007, 21(1):101-104[Su Xin, Chen Fang, Wei Shiping, et al. Preliminary study on the correlation between microbial abundance and methane concentration in sediments from Cold Seeps in the northern South China Sea[J]. Geoscience, 2007, 21(1): 101-104] |
| [16] | 曹超,雷怀彦. 南海北部有孔虫碳氧同位素特征与晚第四纪水合物分解的响应关系[J]. 吉林大学学报:地球科学版,2012,42(1):162-171[Cao Chao, Lei Huaiyan. Response between carbon and oxygen isotopic characteristics of foraminifera from the northern South China Sea and Late Quaternary hydrate released[J]. Journal of Jilin University: Earth Science Edition, 2012, 42(1): 162-171] |
| [17] | Lei Huaiyan, Cao Chao, Ou Wenjia, et al. Carbon and oxygen isotope characteristics of foraminiferan from northern South China Sea sediments and their significance to Late Quaternary hydrate decomposition[J]. Journal of Central South University, 2012, 19(6): 1728-1740 |
| [18] | Delong E F, Franks D G, Yayanos A A. Evolutionary relationships of cultivated psychrophilic and barophilic deep sea bacteria[J].Applied and Environment Microbiology, 1997, 63(5): 2105-2108 |
| [19] | Julian R. Marchesi, Andrew J. Weightman, Barry A. Cragg,et al. Methanogen and bacterial diversity and distribution in deep gas hydrate sediments from the Cascadia Margin as revealed by 16SrRNA molecular analysis[J]. FEMS Microbiology Ecology, 2001, 34(3): 221-228 |
| [20] | 曾润颖,赵晶,张锐,等. 西太平洋暖池区沉积物中的细菌类群及其与环境的关系[J]. 中国科学(D辑):地球科学,2004,34(3):265-271[Zeng Runying, Zhao Jing, Zhang rui, et al. Microbial groups relation about environment of western Pacific warm pool sediments[J]. Science China(Seri. D): Earth Sciences, 2004, 34 (3): 265-271] |
| [21] | Xu M, Wang P, Wang F,et al. Microbial diversity at a deep-sea station of the Pacific nodule province[J]. Biodiversity and Conservation, 2005, 14(14): 3363-3380 |
| [22] | 李涛,王鹏,汪品先,等. 南海西沙海槽沉积物细菌多样性初步研究[J]. 地球科学进展,2006,21(10):1058-1062[Li Tao, Wang Peng, Wang Pinxian. A preliminary study on the diversity of bacteria in the Xisha trough sediment, the South China Sea[J]. Advance in Earth Science, 2006, 21(10): 1058-1062] |
| [23] | Newberry C J, Webster G, Cragg B A, et al. Diversity of prokaryotes and methanogenesis in deep subsurface sediments from the Nankai Trough, Ocean Drilling Program Leg190[J]. Environmental Microbiology, 2004, 6(3): 274-287 |
| [24] | 邹扬,曾胤新,田蕴,等. 白令海北部表层沉积物中细菌多样性的研究[J]. 极地研究,2009,21(1):15-24[Zou Yang, Zeng Yinxin, Tian Yun, et al. Investigation of bacterial diversity in surface sediment form the northern Bering Sea Chinese[J]. Journal of Polar Reserach, 2009, 21(1):15-24] |
| [25] | 孙慧敏,戴世鲲,王广华,等. 南海北部巴士海峡深海沉积物中细菌多样性分析[J]. 热带海洋学报,2010,29(3):41-46[Sun Huimin, Dai Shikun, Wang Guanghua, et al. Phylogenetic diversity analysis of bacteria in the deep-sea sediments from the Bashi Channel by 16SrDNA BLAST[J]. Journal of Tropical Oceanography, 2010, 29(3): 41-46] |
| [26] | Fregitag T E, Prosser J I. Community structure of ammonia oxidizing bacteria within anoxic marine sediments[J]. Applied and Environment Microbiology, 2003, 69(3): 1359-1371 |
| [27] | Harrison B K, Zhang H, Berelson W, et al. Variations in archaeal and bacterial diversity associated with the sulfate-methane transition zone in continental margin sediments (Santa Barbara Basin, California)[J]. Applied and Environment Microbiology, 2009, 75(6): 1487-1499 |
| [28] | Allers E, Wright J J, Konwar, et al. Diversity and population structure of Marine Group A bacteria in the Northeast subarctic Pacific Ocean[J]. ISME J 2013, 7(2): 256-268 |
| [29] | Martinson D G, Imbrie T C, Shachleton N J,et al. Age dating and the orbital theory of the ice ages: Development of a high-resolution 0 to 300 000 year chronostratigraghy[J]. Quaternary Research, 1987, 27(1): 1-29 |
 2014, Vol. 32
2014, Vol. 32


