扩展功能
文章信息
- 陈立雷, 张媛媛, 贺行良, 张培玉, 朱志刚, 李小琳
- CHEN Li-lei, ZHANG Yuan-yuan, HE Xing-liang, ZHANG Pei-yu, ZHU Zhi-gang, LI Xiao-lin
- 海洋沉积物有机碳和稳定氮同位素分析的前处理影响
- The Research on Sample-pretreatment of Organic Carbon and Stable Nitrogen Isotopes in Marine Sediments
- 沉积学报, 2014, 32(6): 1046-1051
- ACTA SEDIMENTOLOGICA SINCA, 2014, 32(6): 1046-1051
-
文章历史
- 收稿日期:2013-09-03
- 收修改稿日期:2014-09-25
2. 青岛海洋地质研究所 山东青岛 266071;
3. 青岛大学环境科学与工程系 山东青岛 266071
2. Qingdao Institute of Marine Geology, Qingdao, Shandong 266071;
3. Department of Environmental Science and Engineering, Qingdao University, Qingdao, Shandong 266071
沉积物中有机碳同位素δ13C能够确定有机质的来源,它反映表层水生产力、陆源有机质的供应状况和大量的古环境信息,有助于了解碳循环、沉积物循环的生物地球化学过程及其气候变化响应[1,2,3]。典型海洋浮游植物的δ13C值为-19‰~-22‰,湖相藻类的δ13C值为-25‰~-30‰;陆生C3植物的δ13C值约为-26‰~-28‰,C4植物的δ13C值约为-10‰~-16‰[4,5,6,7,8]。稳定氮同位素δ15N则被广泛的用来示踪食物链的摄食路径、有机质的源汇、水中脱氮、硝化过程、氮的固定化和富营养化等方面[9]。典型的海洋浮游生物的δ15N值,范围为4‰~10‰,平均为6‰;陆源有机质的δ15N值的范围为-10‰~10‰,平均为2‰;化肥的δ15N值在-2‰~4‰之间变化,土壤有机氮硝酸盐的δ15N值在3‰~8‰之间变化,人类和动物排泄的废物中的硝酸盐的δ15N值在10‰~20‰之间变化[8]。
目前δ13C和δ15N分析主要采用EA-IRMS在线技术。该技术主要是把元素分析仪(EA)与稳定同位素比值质谱仪(IRMS)通过一个ConFlo接口连接起来,样品由EA燃烧并经气相色谱分离,通过载气将待测气体带入IRMS进行稳定同位素比值测定,一步操作即可完成CO2、N2气体的生成和质谱分析,中间减少了人为因素引起的误差。在仪器方法高速发展的前提下,酸化处理的方式、残余无机碳和有机质的形态与组成等因素成为δ13C、δ15N分析准确性的主要限制因素。因此,如何有效地去除无机碳,并减少有机质的损失成为δ13C、δ15N分析测试前处理方法研究的重点。此前,针对总有机碳和稳定氮及其同位素测定结果的实验影响因素,开展了大量的前处理条件实验[9~15]。形成了一套采用盐酸酸处理,并水洗酸至中性的δ13C、δ15N分析前处理方案,该方案被国内大多数学者所接受。
本文在此研究基础上,进行了酸处理器皿选择,分析了不同干燥方式、驱酸方式和洗酸次数对δ13C和δ15N结果的影响。制定出一套详细的前处理方法,并讨论了该方法的精密度以及该方法在实际海洋沉积物测试中的应用。以期为高精度δ13C和δ15N分析提供更为合理、可靠的前处理实验方法。 1 实验部分 1.1 仪器与材料
Flash EA 1112型元素分析仪,MAT 253同位素比值质谱仪,连续流接口ConFlo Ⅳ,以上仪器配置均为Thermo Finnigan公司产品;FDA8508型SIM冻干机(美国S.I.M. International Co.,Ltd.);实验快速球磨机(长沙天创化工有限公司);WH-3微型旋涡混合仪(上海沪西分析仪器厂有限公司);飞鸽LXJ-IIB离心机(上海安亭科学仪器厂);GZX-9140 MBE数显鼓风干燥箱(上海博讯实业有限公司医疗设备厂);玻璃离心管和聚丙烯塑料离心管。
海洋沉积物实际样品均利用重力采样法采集,采样后将样品密封,尽快转移到实验室,取样分装置于冰箱中冰冻保存。 1.2 样品前处理 1.2.1 实际样品干燥及粉碎
a. 热烘干燥:将样品于60℃下,烘至恒重。
b. 冷冻真空干燥:取经-20℃冷冻24 h的沉积物样品放入冷冻真空干燥机中,在-70℃和抽真空条件下冷冻干燥约48 h。
将干燥后的样品用玛瑙研钵研磨成粉末,过100 目筛备用。 1.2.2 样品无机碳的去除
加酸水洗法:取0.5 g磨好的样品,放入离心管中,加入5 mL盐酸(1+9),反应8~12 h,期间于旋涡混合仪上混匀2~3次。离心6 min(2 000 r/min)后,用滴管小心吸出上清液,再加入5 mL高纯水对样品进行旋涡洗涤,离心6分钟后,吸出上清液。重复洗涤多次,直至上清液约为中性。
加酸蒸干法:取0.5 g磨好的样品,放入试管中,加入5 mL盐酸(1+9),反应8~12 h,期间于旋涡混合仪上混匀2~3次。随后于烘箱中烘至半干,再次加适量高纯水烘干,反复操作多次。 1.2.3 酸处理水洗后样品的干燥
a. 热烘干燥:将酸处理水洗后的样品放入烘箱中,60℃烘干至恒重,接着对干燥后的样品进行称重,然后将样品从器皿中取出再次研磨,混匀后用450℃灼烧过的锡纸包好放入干燥器中保存。
b. 冷冻真空干燥:将酸处理水洗后的样品放入冷冻真空干燥机中,-70℃抽真空冻干48 h,接着对干燥后的样本进行称重,然后将样品从器皿中取出再次研磨,混匀后用450℃灼烧过的锡纸包好放入干燥器中保存。 1.3 样品δ13C、δ15N测定分析方法
采用EA-IRMS进行δ13C、δ15N测定,仪器条件参见文献[16]。
δ13C、δ15N测定结果的表达式如下:
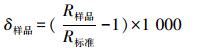
测定海洋沉积物样品中有机碳和稳定氮同位素时,应尽量避免酸处理容器材质对样品造成污染。分别选用聚丙烯塑料离心管(PP)和玻璃离心管(GG)对沉积物样品B2152、B2150进行酸化处理,经冷冻真空干燥,考察两种材质的酸处理容器对样品中δ13C和δ15N测定的影响,结果见表 1。从表 1看出,在冷冻干燥方式下,使用聚丙烯和玻璃离心管进行酸处理所得样品的δ13C和δ15N基本无差别。早先,迟云平等[17]亦比较了采用玻璃烧杯和PC离心管在低温加热的情况下测定样品有机碳同位素值,发现PC材质的离心管对结果基本无影响,并指出在前处理中采用PC材质离心管相对于玻璃烧杯而言,更加方便,效率更高。同时,笔者发现玻璃管在冷冻干燥及洗酸离心处理过程中,容易破碎,故建议选用聚丙烯离心管进行样品前处理。
| 组分 | B2152 平行样 |
离心管材质 | B2150 平行样 |
离心管材质 | ||
| PP | GG | PP | GG | |||
| δ13C/‰ | S1 | -27.27 | -27.29 | S1 | -26.77 | -26.71 |
| S2 | -27.39 | -27.33 | S2 | -26.79 | -26.82 | |
| S3 | -27.32 | -27.36 | S3 | -26.71 | -26.76 | |
| 平均值 | -27.33 | -27.33 | 平均值 | -26.76 | -26.76 | |
| δ15N/‰ | S1 | 7.04 | 6.94 | S1 | 3.95 | 3.80 |
| S2 | 6.92 | 7.09 | S2 | 3.93 | 3.90 | |
| S3 | 7.09 | 7.10 | S3 | 4.03 | 4.19 | |
| 平均值 | 7.02 | 7.04 | 平均值 | 3.97 | 3.96 | |
为验证低温热烘干燥和冷冻真空干燥两种方式对海洋沉积物δ13C和δ15N测定的影响,选取东海冲绳海槽和闽浙近岸不同站位的表层沉积物新鲜样品,分别用-70℃冷冻真空和60 ℃热烘干燥两种干燥方式进行干燥,采用聚丙烯离心管进行酸处理,结果见表 2。
| 组分 | 新鲜样品 干燥方式 | 酸处理后 干燥方式 | D-010 | D-172 | ||||||
| S1 | S2 | S3 | 平均值 | S1 | S2 | S3 | 平均值 | |||
| δ13C/‰ | 热烘干燥 | 热烘干燥 | -20.44 | -20.43 | -20.43 | -20.43 | -22.02 | -22.07 | -22.02 | -22.04 |
| 热烘干燥 | 冷冻干燥 | -20.46 | -20.45 | -20.46 | -20.46 | -22.03 | -22.09 | -22.10 | -22.07 | |
| 冷冻干燥 | 热烘干燥 | -21.08 | -20.85 | -21.00 | -20.98 | -22.49 | -22.53 | -22.37 | -22.46 | |
| 冷冻干燥 | 冷冻干燥 | -21.34 | -21.30 | -21.45 | -21.36 | -23.12 | -23.15 | -23.03 | -23.10 | |
| δ15N/‰ | 热烘干燥 | 热烘干燥 | 3.79 | 4.04 | 4.04 | 3.96 | 4.16 | 4.37 | 4.44 | 4.32 |
| 热烘干燥 | 冷冻干燥 | 4.17 | 4.09 | 4.35 | 4.20 | 4.65 | 4.72 | 4.55 | 4.64 | |
| 冷冻干燥 | 热烘干燥 | 4.13 | 4.22 | 4.20 | 4.18 | 4.69 | 4.47 | 4.62 | 4.59 | |
| 冷冻干燥 | 冷冻干燥 | 4.32 | 4.21 | 4.21 | 4.25 | 4.71 | 4.78 | 4.57 | 4.69 | |
从表 2看出,若新鲜样品先是经热烘干燥,酸处理后再次干燥,无论冷冻干燥还是热烘干燥,其δ13C平均值差别甚小(仅相差0.03‰~0.04‰);若新鲜样品先是经冷冻干燥,酸处理后再次干燥,样品采用热烘干燥所得的δ13C值较冷冻干燥偏正(相差0.38‰~0.64‰);同时酸处理后样品采用冷冻干燥,最初热烘干燥新鲜样品所得的δ13C值较冷冻干燥偏正,差值高达1.0‰左右。这表明样品经热烘干燥后会导致样品中轻碳组分(12C)和易挥发组分的逸散,引起样品中总有机碳同位素的分馏。此前,于雯泉等[18]针对海洋沉积物有机碳的预处理研究,也发现并证明了低温热烘干燥会造成部分小分子、低熔点有机物的丢失,并且认为在目前的分析检测系统误差范围内,对沉积物样品的冷冻真空干燥前处理不会造成有机碳的丢失。表 2同时表明,不论新鲜样品最初是经热烘干燥还是冷冻干燥,酸处理后再次干燥时,冷冻干燥所得的δ15N平均值基本无差别(差值为0.04‰~0.05‰)。但若新鲜样品最初是热烘干燥,酸处理后再次干燥时,热烘干燥较冷冻干燥所得δ15N偏负0.3‰左右;若新鲜样品最初是经冷冻干燥,酸处理后再次干燥时,热烘干燥较冷冻干燥所得δ15N偏负0.1‰左右。可见热烘干将可能会引起样品中稳定氮同位素发生分馏,且连续烘干引起的分馏更明显,具体原因有待进一步研究。综合考虑,最佳新鲜样品干燥方式、酸处理后干燥方式均选用冷冻真空干燥为宜。 2.3 驱酸方式和洗酸次数对结果的影响
海底沉积物中存在一定的碳酸盐矿物,因而在进行δ13C、δ15N的测定前,需要对样品进行酸化处理以去除无机碳组分,否则会影响有机碳同位素的测定。通常,采用加入稀HCl去除其中的无机碳,但样品中残留氯离子和在制备过程中所形成的氯化氢气体将会影响实验结果。并且,由于样品中含有强酸性气体,在进行样品测试时会对测试仪器产生影响,所以必须驱除残余的酸至中性[13]。选取沉积物HDS-1、HDS-2、HDS-3,比较水洗和酸蒸两种驱酸方式对结果的影响(如表 3所示)。酸蒸法减少了溶解性有机物损失,因此,表 3中酸蒸法δ13C值均偏负于水洗法的结果说明:水洗造成溶解性有机碳损失,致使δ13C值较真实值偏正。但是酸蒸法处理后的样品很难干燥,并极易吸潮,且不能保证氯离子的有效驱除,所以本文仍建议采取离心水洗的驱酸方法。
| 组分 | 处理方式 | HDS-1 | HDS-2 | HDS-3 |
| δ13C/‰ | 酸蒸 | -22.74 | -22.21 | -22.20 |
| 离心水洗 | -22.17 | -21.33 | -21.19 |
随后选取无机碳含量不同的三个样品PC-1、PC-2和PC-3,比较样品洗至中性、以及中性之后继续多洗1~2次时δ13C和δ15N值的变化,均一式三份,结果如图 1。图 1表明,随着洗涤次数的增加,样品中δ13C值变化不显著,但δ15N值有明显逐渐变正的趋势。而未经酸处理的三个样品δ13C和δ15N值分别为,PC-1:-17.64‰,5.41‰;PC-2:-1.71‰,6.07‰;PC-3:-3.64‰,11.88‰。可见,无机碳的存在会导致δ13C值偏正;洗涤将导致δ15N偏正,且δ15N值随洗涤次数的增加有变正的趋势,可能是由洗涤次数过多导 致样品中溶解氮被逐次洗除引起的。王浩然等[19]的研究同样提出酸处理后清洗会造成样品损失和部分有机碳损失。因此,样品酸化处理后,应尽量控制洗酸次数,洗至中性即可。
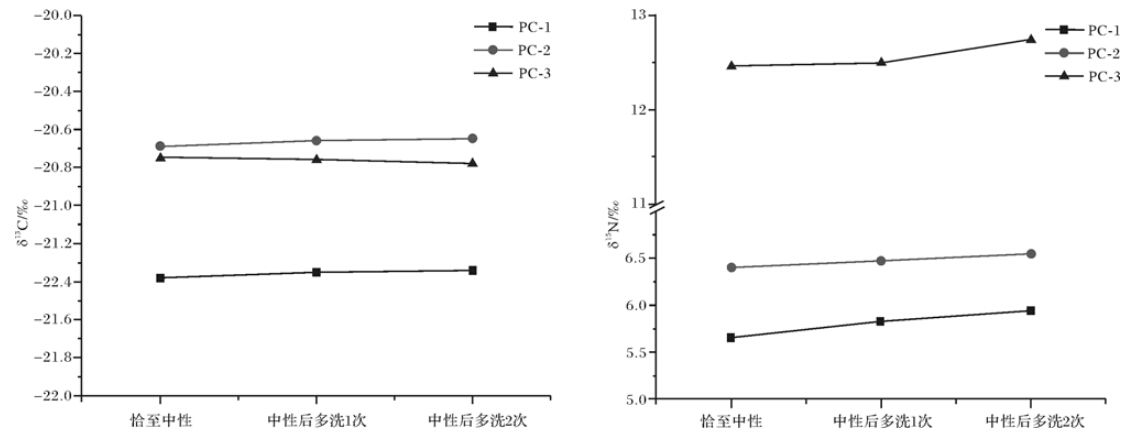
|
| 图 1 洗酸次数对沉积物δ13C和δ15N测定的影响 Fig. 1 Effects of acid wash times on total organic carbon and stable nitrogen isotope |
| 样品编号 | δ13C/‰ | 标准偏差/‰ | δ15N/‰ | 标准偏差/‰ |
| D010-PC | -21.34,-21.51,-21.30 -21.45,-21.33,-21.40 | 0.080 | 4.32,4.11,4.21 4.21,3.95,4.12 | 0.124 |
| D172-PC | -23.15,-23.12,-23.15 -23.03,-23.05,-22.96 | 0.077 | 4.86,4.71,4.78 4.57,4.94,4.94 | 0.145 |
在确定选用PP离心管作为前处理容器、对样品应全程进行冷冻真空干燥和酸化处理样品离心水洗应尽量控制洗酸程度等条件后,对东海D010、D172号实际样品各自取6份平行样做了δ13C和δ15N测试的可重复性分析,以检验该前处理方法的精密度。表 4结果显示,D010平行样品δ13C的标准偏差只有0.080‰,δ15N的标准偏差只有0.077‰;D172平行样品δ13C的标准偏差只有0.136‰,δ15N的标准偏差只有0.145‰。两个样品的测定精密度均较好,说明实验确定的前处理方法具有很好的重复性,可获得较理想、准确的实验数值。 2.5 实际样品分析
选取东海冲绳海槽、辽河三角洲、大连湾、珠江口、深圳湾、东海闽浙沿海沉积物样品做了进一步实际样品的δ13C、δ15N分析,结果如表 5。东海冲绳海槽深海样品远离内陆,碳和氮源为典型的海相来源。其它河口和近海站位样品汇聚的有机质有多种来源,包括陆地河流携带的和海洋外来的组分,这些组分在海岸带与来自当地的浮游和底栖初级生产力的生物量相混合。另外,还有部分有机质的输入来自边缘植被和人类活动。因此,在海岸地区有机质组成既有来自藻类的,又有来自陆地C3和C4植物的,使同位素来源信号在此变得非常复杂[20]。
| 区域 | 样品编号 | δ13C/‰ | δ15N/‰ |
| 东海冲绳海槽 | DC011 | -20.97 | 3.64 |
| 辽河三角洲 | LH022 | -24.04 | 6.20 |
| 大连湾 | DL002 | -21.53 | 5.68 |
| 珠江口 | ZJ015 | -23.58 | 8.20 |
| 深圳湾 | SZ028 | -24.83 | 3.81 |
| 东海闽浙沿海 | DB113 | -22.81 | 4.46 |
(1) 使用聚丙烯和玻璃离心管进行酸处理所得样品的δ13C和δ15N基本无差别。但玻璃管在冷冻干燥及洗酸离心处理过程中,极容易破碎,故聚丙烯离心管更适用于海洋沉积物δ13C和δ15N分析的前处理。
(2) 样品经热烘干燥会导致样品中轻碳组分和易挥发组分的逸散,引起样品中总有机碳同位素的分馏。不论新鲜样品最初是经低温热烘干还是冷冻干燥,酸处理后冷冻干燥所得的δ15N平均值基本无差别,但酸处理后热烘干燥将会引起样品中稳定氮同位素发生分馏。所以新鲜样品和酸处理后样品的干燥方式均应选用冷冻真空干燥。
(3) 水洗造成溶解性有机碳和氮损失,致使δ13C和δ15N值较真实值偏正,但能保证氯离子的有效驱除。洗至中性后的洗酸次数对δ13C影响甚小,但会导致δ15N继续偏正。因此样品酸化处理后,应尽量控制洗酸次数,洗至中性即可。
(4) 建议测定海洋沉积物δ13C、δ15N采用前处理方法:室温条件下,选用PP离心管,将0.5 g经冷冻真空干燥后球磨并过100目筛的样品与5 mL盐酸(1+9)充分反应8~12小时,期间定时旋涡混匀多次,采用高速离心加速沉淀的方法清洗酸处理样品至中性,再次冷冻真空干燥后,研磨均匀上机测定。该方法具有简便、快捷、经济、精密度好等优点,能够很好的满足海洋沉积物实际样品的分析检测。
| [1] | Lamb A L, Vane C H, Wilson G P,et al. Assessing δ13C and C/N ratios from organic material in archived cores as Holocene sea level and palaeoenvironmental indicators in the Humber Estuary, UK[J]. Marine Geology, 2007, 244(1): 109-128 |
| [2] | Mackie E A, Lloyd J M, Leng M J,et al. Assessment of δ13C and C/N ratios in bulk organic matter as palaeosalinity indicators in Holocene and Late glacial isolation basin sediments, northwest Scotland[J]. Journal of Quaternary Science, 2007, 22(6): 579-591 |
| [3] | Wilson G P, Lamb A L, Leng M J,et al. δ13C and C/N as potential coastal palaeoenvironmental indicators in the Mersey Estuary, UK[J]. Quaternary Science Reviews, 2005, 24(18): 2015-2029 |
| [4] | Sharp Z. Principles of stable isotope geochemistry.Upper Saddle River, NJ, USA: Pearson Education, 2007 |
| [5] | Mampuku M, Yamanaka T, Uchida M,et al. Changes in C3/C4 vegetation in the continental interior of the Central Himalayas associated with monsoonal paleoclimatic changes during the last 600 kyr[J]. Climate of the Past, 2008, 4(1): 1-9 |
| [6] | Scholz C A, Talbot M R, Brown E T,et al. Lithostratigraphy, physical properties and organic matter variability in Lake Malawi Drillcore sediments over the past 145,000 years[J]. Palaeogeography, Palaeoclimatology, Palaeoecology, 2011, 303(1): 38-50 |
| [7] | Brodie C R, Leng M J, Casford J S L,et al. Evidence for bias on C and N concentrations and δ13C composition of terrestrial and aquatic organic materials due to pre-analysis acid preparation methods[J]. Chemical Geology, 2011, 282(3): 67-83 |
| [8] | 葛晨东,王颖,Pedersen T F,等. 海南岛万泉河口沉积物有机碳、氮同位素的特征及其环境意义[J]. 第四纪研究,2007,27(5):845-852[Ge Chendong, Wang Ying, Pedersen T F, et al. Variability of organic carbon isotope, nitrogen isotope, and C/N in the Wanquan river estuary, eastern Hainan island, China and its environmental implications[J]. Quaternary Sciences, 2007, 27(5): 845-852] |
| [9] | Brodie C R, Casford J S, Lloyd J M,et al. Evidence for bias in C/N, δ13C and δ15N values of bulk organic matter, and on environmental interpretation, from a lake sedimentary sequence by pre-analysis acid treatment methods[J]. Quaternary Science Reviews, 2011, 30(21): 3076-3087 |
| [10] | King P, Kennedy H, Newton P P,et al. Analysis of total and organic carbon and total nitrogen in settling oceanic particles and a marine sediment: an interlaboratory comparison[J]. Marine Chemistry, 1998, 60(3): 203-216 |
| [11] | Schubert C J, Nielsen B. Effects of decarbonation treatments on δ13C values in marine sediments[J]. Marine Chemistry, 2000, 72(1): 55-59 |
| [12] | 王金权. 样品预处理对有机碳同位素分析结果的影响[J]. 古生物学报,2005,44(3):472-477 [Wang Jinquan. Sample-pretreatment effects on analytical results of organic C-isotopes[J]. Acta Palaeontologica Sinica, 2005, 44(3): 472-477] |
| [13] | 吴夏,黄俊华,白晓,等. 沉积岩总有机质碳同位素分析的前处理影响[J]. 地球学报,2008,29(6):677-683 [Wu Xia, Huang Junhua, Bai Xiao, et al. Sample-pretreatment effects on analytical results of total organic carbon isotopes in sedimentary rocks[J]. Acta Geoscientica Sinica, 2008, 29(6): 677-683] |
| [14] | 曹蕴宁,刘卫国,宁有丰,等. 土壤有机碳同位素样品制备过程的影响因素讨论[J]. 地球化学,2005,34(4):395-403 [Cao Yunning, Liu Weiguo, Ning Youfeng, et al. Effects of soil sample preparation process on δ13C of organic matter[J]. Geochimica, 2005, 34(4): 395-403] |
| [15] | 卢凤艳,安芷生. 鹤庆钻孔沉积物总有机碳、氮含量测定的前处理方法及其环境意义[J]. 地质力学学报,2010,16(4):393-401[Lu Fengyan, An Zhisheng. Pretreatment methods for analyzing the total organic carbon and nitrogen contents of Heqing core sediments and their environmental significances[J]. Journal of Geomechanics, 2010, 16(4): 393-401] |
| [16] | 张媛媛,贺行良,孙书文,等. 元素分析仪—同位素比值质谱仪测定海洋沉积物有机碳稳定同位素方法初探[J]. 岩矿测试,2012,31(4):627-631[Zhang Yuanyuan, He Xingliang, Sun Shuwen, et al. A preliminary study on the determination of organic carbon stable isotope of marine sediment by element analyzer-isotope ratio mass spectrometer[J]. Rock and Mineral Analysis, 2012, 31(4): 627-631] |
| [17] | 迟云平,张洒,吴松,等. 不同实验条件对早新生代沉积物有机碳同位素的影响[J]. 地球学报,2012,33(6):967-976[Chi Yunping, Zhang Sa, Wu Song, et al. The influences of different experimental conditions on organic carbon isotopes of Early Cenozoic sediments[J]. Acta Geoscientica Sinica, 2012, 33(6): 967-976] |
| [18] | 于雯泉,钟少军. 海洋沉积物有机碳分析方法中干燥预处理过程人为误差的发现及其意义[J]. 环境科学学报,2007,27(5):861-867[Yu Wenquan, Zhong Shaojun. Freeze-drying pretreatment improves organic carbon determinations of marine sediments[J]. Acta Scientiae Circumstantiae, 2007, 27(5): 861-867] |
| [19] | 王浩然,陈业材. 湖泊沉积物有机碳分析的最优化方法[J]. 贵州环保科技,1996,2(4):21-24[Wang Haoran, Chen Yecai. Lake sediment organic carbon analysis, optimization methods[J]. Guizhou Environmental Science and Technology, 1996, 2(4): 21-24] |
| [20] | Fry B, Scalan R S, Parker P L. Stable carbon isotope evidence for two sources of organic matter in coastal sediments: seagrasses and plankton[J]. Geochimica et Cosmochimica Acta, 1977, 41(12): 1875-1877 |
 2014, Vol. 32
2014, Vol. 32


