文章信息
- 周子堃, 胡凌志, 蒋瑞瑞, 贺强, 张卫国, 陈群
- ZHOU Zi-kun, HU Ling-zhi, JIANG Rui-rui, HE Qiang, ZHANG Wei-guo, CHEN Qun
- 基于AFI的快速发射场B1+成像方法
- Rapid B1+ Mapping Based on Actual Flip-Angle Imaging
- 波谱学杂志, 2016, 33(4): 515-527
- Chinese Journal of Magnetic Resonance, 2016, 33(4): 515-527
- http://dx.doi.org/10.11938/cjmr20160401
-
文章历史
收稿日期: 2016-01-11
收修改稿日期: 2016-10-23


DOI:10.11938/cjmr20160401
2. 中国科学院大学, 北京 100049;
3. 上海联影医疗科技有限公司, 上海 201800
2. University of Chinese Academy of Sciences, Beijing 100049, China;
3. Shanghai United Imaging Healthcare Cooperation, Shanghai 201800, China
高场(主磁场强度B0≥3 T)磁共振成像(Magnetic Resonance Imaging, MRI)技术具有高信噪比和高空间分辨率等优点[1],近年来在科研领域和临床应用中被广泛研究[2]. 但在高场强系统中,磁共振发射射频(Radio Frequency, RF)脉冲波长较短(波长l≤30 cm),与人体尺寸相近,RF脉冲进入人体后容易产生驻波[3],导致射频场(B1)不均匀.射频场可用左旋和右旋的基矢表示,其中与质子进动方向相同的极化分量(B1+)主要决定发射场[4],与质子进动方向相反的极化分量(B1-)主要决定接收场.RF脉冲与人体组织的作用会影响发射场的均匀性,从而影响图像的均匀性和对比度[5],在很大程度上限制了高场MRI的临床应用[6].
解决发射场不均匀问题的途径之一是采用多通道并行发射技术[7],通过调节每个发射通道的RF波形与幅相[8],实现发射场的空间均匀分布.但要达到这个目标,需先得到发射场空间分布图[9],进而针对发射场的不均匀性进行匀场(B1+ shimming).此外,通过多通道并行发射实现局部激发和成像,也是磁共振领域里的一个重要课题.在并行发射和局部激发的研究中,同样需要预先采集发射场图(B1+ map)[10-12],才能准确地设计各发射通道的RF脉冲和相应梯度波形.
发射场测量的经典方法是双角度法(Double Angle, DA),即根据翻转角(Flip-Angle, FA)分别为a和2a的扫描图像,计算发射场[13].该序列为了避免纵向弛豫时间(T1)的影响,重复时间(TR)必须足够长,因此总扫描时间较长[14].除此之外,双角度法通常采用二维(2D)采集,当层激发片型不够理想时,测量到的翻转角是激发片型积分后的等效翻转角,从而导致发射场图不准确.另外双角度法中使用了翻转角为2a的RF脉冲,在人体中能量沉积比吸收率(Specific Absorption Rate, SAR)较大,可能引起组织局部发热[15].
2007年,Yarnykh[16]提出了实际翻转角成像(Actual Flip-angle Imaging, AFI)方法,该方法采用三维(3D)采集技术,对T1不敏感,无需等待完全弛豫,可采集整个物体内的实际翻转角分布,其测量速度和准确性均优于DA.但传统AFI方法使用梯度回波(GRadient Echo, GRE)采集信号,在低分辨率下单次扫描耗时在分钟数量级.在高场MRI成像中,因为B1+分布不均匀,需要动态地针对每个病人进行B1+测量和匀场时,该序列过长的扫描时间难以满足临床要求.
磁共振序列中的快速采集方法有很多种,其中平面回波成像(Echo Planar Imaging, EPI)是基于GRE的快速采集序列.该方法一次激发后采集整个或者部分k空间的数据,成像时间很短,可以在几十毫秒量级的时间[17]完成一幅2D图像的采集.多次激发EPI(Multi-shot EPI)方法经过几次激发也可采满整个k空间.在RF脉冲每次激发后,多次激发EPI方法通过交变读出梯度和递增相位梯度填充k空间的Netl条相位编码(Phase Encoding, PE)线,而GRE每次激发仅采集一条PE线,因此相比GRE,多次激发EPI方法将成像加速Netl倍.相比单次激发EPI方法,多次激发EPI回波链长度短、相位采集带宽较宽,因此其化学位移飘移程度、图像伪影和模糊效应均低于单次激发EPI.
基于以上所述,我们提出一种快速AFI(Fast AFI, FAFI)序列,将多次激发EPI采集方法与AFI测量方法相结合,在极短的时间内对发射场进行成像.该方法通过调节回波链长度,能够有效平衡图像质量和成像速度.并且,我们在球形水模和人体头部、腹部及盆腔上验证了FAFI方法测量的准确性,取得了与传统AFI方法相吻合的成像结果,实现了发射场图采集速度的大幅提升.
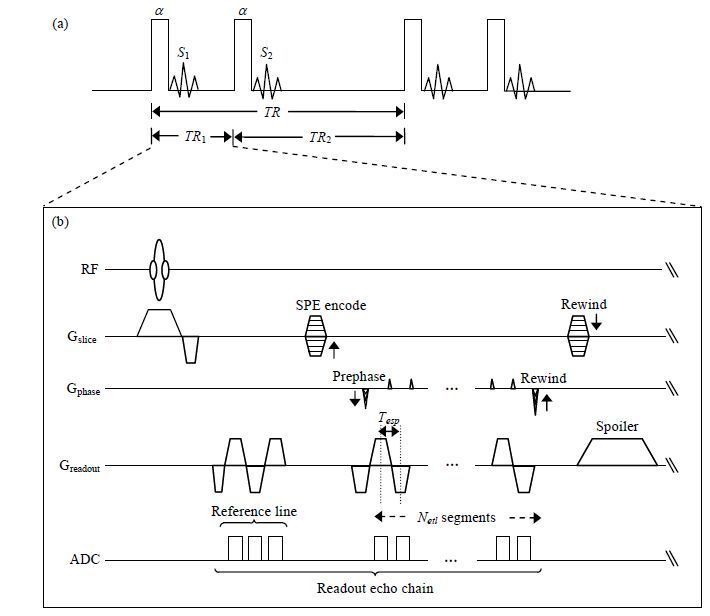
1 实验部分 1.1 序列设计AFI方法主要包含两个相同的RF脉冲(目标翻转角为a),在每个脉冲后使用梯度回波采集自由感应衰减(Free Induction Decay, FID)信号.两次激发后恢复的时间分别为TR1和TR2,组成了序列的重复时间TR,见图 1(a).在磁化矢量达到稳态后,每次RF激发前的纵向磁化矢量可使用a、T1、TR1或TR2等表示,进而得出两次接收到信号的表达式.在短TR和横向磁矢充分散相的条件下,经过推导[16],a可近似表示为(1) 式,其中m=TR2/TR1;r=S2/S1,是TR2、TR1中两次采集信号S2和S1的比值.
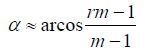
|
(1) |
|
| 图 1 FAFI序列示意图. (a) AFI通过两次相同的RF脉冲激发,实现发射场图测量;(b) FAFI利用多次激发EPI方法采集回波图像 Fig. 1 Schematic diagram of FAFI sequence. (a) AFI method consists of two identical RF pulses for B1+ measurements; (b) The echo signals are acquired in a multi-shot EPI form by FAFI sequence |
根据文献[18],m=5时,测量值对翻转角有足够的敏感性.为消除每次数据采集后残余横向磁化矢量的干扰,避免刺激回波的影响,在每次数据采集结束后均须使用较大的扰相梯度.同时,RF脉冲采用射频扰相(RF Spoiling)技术,在每次激发时,射频相位依次增加.m = 5时,使用129˚的相移增量做扰相[19].
本文提出的FAFI方法将多次激发EPI采集方法应用于AFI序列,见图 1(b).该序列为3D采集序列,因此在选层梯度方向施加有层方向相位编码(Slice Phase Encoding, SPE)梯度和回聚(Rewind)梯度.另外,为矫正EPI中常见的N/2伪影[17],需要在施加相位编码梯度之前采集3条相位矫正参考线.最后在读出(Readout)方向加入较大的扰相(Spoiler)梯度,以保证(1) 式的成立条件.
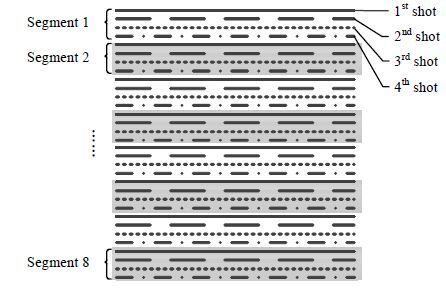
多次激发EPI方法的k空间采集分多次完成,排布方式有很多种,其中交错排布的相位采集带宽较宽,可以减轻化学位移飘移和图像畸变,故本文使用交错排布方式(Interleaved Multi-shot EPI),见图 2.在TR1和TR2内,FAFI均沿相位编码方向采集Netl条线,分别填充S1和S2的k空间.在S1和S2的k空间中,这Netl条相位编码线间隔排列,将2D k空间分成Netl部分(Segment).经过多次激发(Shot)可将S1和S2的2D k空间采满,每次激发采集的PE线呈现交错排布.FAFI基于AFI方法,也是3D激发序列.其k空间在层方向的填充方式与AFI保持一致,即排满层方向第一个k值对应的2D k空间后,再采集层方向下一个k值对应的2D k空间数据.
|
| 图 2 多次激发EPI交错排布的k空间示例 Fig. 2 Diagram of a k-space distribution for interleaved multi-shot EPI |
根据上述原理,AFI在每次RF脉冲激发后只采集一条相位编码线,而FAFI采集Netl条,所以FAFI采集时间缩短为传统AFI方法的1/Netl.例如,图 2中k空间相位编码方向共需采集32条PE线,FAFI每次激发采集8条,间隔排布,将2D k空间分为8个部分,经过4次激发可采满.而传统基于GRE的AFI方法则需要32次激发才能填满2D k空间,采集时间是FAFI的8倍.
对于单次激发EPI序列,信号在被采集的过程中,总是存在相位累积和幅度衰减.但多次激发EPI在每次激发后,相位和幅度被重置,相邻激发之间的相位和幅度出现不连续,在图像域会引起伪影.为了消除多次激发引起的相位和幅度的不连续,采集回波链的起始时间随着激发次数的增加,依次向后偏移(Time-shift)[17],使k空间相邻PE线的相位间隔连续变化.
另外,FAFI在序列开始使用空扫(Dummy)保证在采集时磁化矢量达到稳态.根据文献[20]报道,20个空扫足以在人体和水模成像中将磁化矢量激发到稳态,故本文在图像采集前均加入20个空扫.
1.2 实验材料和参数本文图像均在3 T MRI谱仪(上海联影医疗科技有限公司,uMR770)上扫描完成.其中人体测试征得所有被试者知情并同意,测试过程符合世界医学大会赫尔辛基宣言标准.实际扫描中,RF线圈的形状位置很大程度上决定发射场的分布[15].为了减少局部线圈因接收不均匀性以及其与体发射线圈相互耦合对测得的发射场结果的影响,本文扫描的序列均使用体线圈发射和接收.为验证使用FAFI方法得到的发射场图像的准确性,我们在水模和人体头部、腹部及盆腔上做了对比实验,定量比较了相同采集参数下使用AFI和FAFI测得的发射场图.
1.2.1 水模实验参数本文使用的球形水模直径为150 mm,由NiSO4·6H2O(1.243 g/L)和NaCl(2.6 g/L)配比而成,T1 = 314 ms,T2 = 267 ms.
FAFI与AFI序列的扫描参数如下:视野(FOV)=400 mm(读出方向)×400 mm(相位编码方向)×96 mm(块层厚),扫描矩阵=128(读出方向)×128(相位编码方向)×16(层),TR1/TR2 = 25 ms/125 ms,TE = 8.1 ms,平均扫描4次.FAFI序列中回波间隔时间(Tesp)= 0.66 ms,每次激发采集的PE线数(Netl)= 8(相位方向分辨率是128,故需激发16次).
RF脉冲使用该设备波形库中的SLR(Shinnar-Le Roux)3D激发脉冲,持续时间为1 ms,带宽为1 444 Hz.RF的实际翻转角,在本文中为待测量值(FA),是空间位置的函数,正比于发射场B1+.而临床序列中的翻转角,是目标翻转角(a).当系统校准正确、发射场均匀时,FA与a相等;当系统校准正确、发射场不均匀时,FA在某些地方高于a,某些地方低于a;当系统校准不正确时,FA与a不再有对应关系.为对比FAFI和AFI在不同a下发射场成像效果,我们取a分别为10˚、20˚、30˚、40˚,依次测量了水模的发射场.
1.2.2 人体实验参数在人体实验中,主要对比了利用FAFI和AFI方法在人体盆腔、腹部和头部测量的发射场图.盆腔采集5例发射场图,腹部采集5例,头部采集6例,志愿者年龄分布在20~30岁之间.
扫描参数如下:扫描矩阵=64(读出方向)×64(相位编码方向)×16(层),TR1/TR2 = 20 ms/100 ms,TE = 5.7 ms,目标翻转角(a)= 45˚.FAFI序列仍取Tesp = 0.66 ms,Netl = 8.盆腔和腹部视野(FOV)= 400 mm(读出方向)× 400 mm(相位编码方向)×160 mm(块层厚),头部视野(FOV)= 350 mm(读出方向)× 350 mm(相位编码方向)×160 mm(块层厚).AFI使用上述参数一次扫描时间为130 s,志愿者正常呼吸.FAFI扫描时间是17 s,要求志愿者在腹部扫描时进行屏气.
2 结果与讨论 2.1 水模测试结果水模测试中,分别使用AFI和FAFI两种方法,在目标翻转角(a)为10˚、20˚、30˚、40 ˚时依次测量发射场.传统AFI方法的扫描时间是1 040 s,而FAFI方法只需136 s.
在目标翻转角(a)为40˚时,球形水模中间层的发射场测量结果见图 3.图 3(a)和图 3(b)分别是使用AFI和FAFI测得的结果.第一、二幅图像分别对应了序列中第一、二个回波信号(S1,S2)重建产生的图像,第三幅图由两个回波信号(S1、S2)计算得到的实际翻转角(FA)分布,也即发射场图.从图中看出,两种方法测得的分布相近,均为中间高、边缘略低.类似的分布在其他目标翻转角时也存在.在发射场图的视野中心取水平和竖直方向的两条线,分别计算使用FAFI和AFI在线上各像素点测量的FA值,绘制对比曲线[图 3(c)和(d)].从图中可以看出,无论是水平方向还是垂直方向,FAFI与AFI测量的FA值在各像素点都非常接近,两条曲线几乎重合.

|
| 图 3 球形水模在目标翻转角(a)为40˚时的发射场图结果.(a)和(b)分别是使用AFI和FAFI测得的结果. (a)和(b)中第一、二幅图像分别对应了序列中第一、二个回波信号(S1、S2)重建产生的图像,第三幅图由两个回波信号(S1、S2)计算得到的实际翻转角(FA)分布,也即发射场图.(c)和(d)分别是发射场图在视野中心水平和竖直方向的翻转角测量值(FA)逐点对比结果 Fig. 3 The B1+ map in spherical water phantom with nominal flip-angle a= 40˚. (a) and (b)are the results in spherical water phantom by AFI and FAFI. The first two figures in (a) and (b) are two echo signals S1 and S2 while the third image is the result of the calculated flip-angle (FA) distribution, also known as B1+ map.(c) and (d) are the profiles of measured flip-angle (FA) in the center of FOV, acquired by AFI and FAFI in the horizontal/vertical direction |
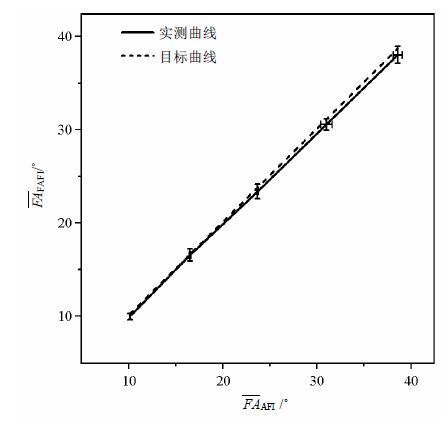
在目标翻转角(a)为10˚~40˚范围内,分别计算AFI和FAFI测量的实际翻转角的平均值(
|
|
图 4 目标翻转角(a)在10˚~40˚范围内,FAFI和AFI测量的水模平均翻转角( |
综上所述,在水模测试中,FAFI场图取得与传统AFI方法较一致的结果,且采集时间仅为AFI的1/8左右.
2.2 人体测试结果分别使用AFI和FAFI两种序列采集人体盆腔、腹部和头部发射场图,其中采集盆腔数据5组、腹部数据5组、头部数据6组.传统AFI方法的扫描时间是130 s,而FAFI的扫描时间是17 s.
两种序列在盆腔、腹部和头部得到的图像和发射场图结果见图 5.(a)、(b)和(c)分别是使用AFI方法在盆腔、腹部和头部得到的结果;(d)、(e)和(f)是使用FAFI方法在同一志愿者的相应部位取得的结果.每个部位的扫描结果由三幅图像组成:第一、二幅图像分别对应了序列中第一、二个回波信号(S1、S2)重建产生的图像;第三幅图由两个回波信号(S1、S2)计算得到的实际翻转角(FA)分布,即发射场图.
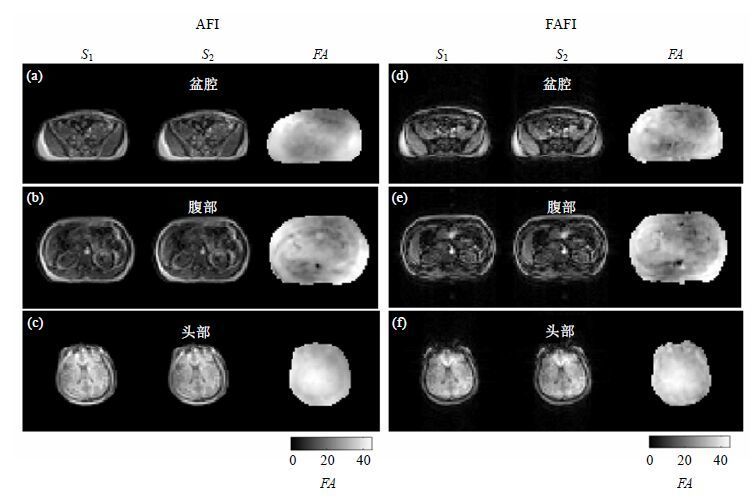
|
| 图 5 使用AFI与FAFI序列在盆腔、腹部和头部得到的图像和发射场图.(a)、(b)和(c)是使用AFI方法在人体三个部位得到的结果,(d)、(e)和(f)是使用FAFI方法得到的结果.(a)~(f)中前两幅图分别为序列中第一、二个回波信号(S1、S2)重建产生的图像,第三幅图是由两个回波信号(S1、S2)计算得到的实际翻转角(FA)分布,即发射场图 Fig. 5 Images and B1+ maps measured by FAFI and AFI sequence in human pelvis, abdomen and head. (a)、(b) and (c) are the results in the body by AFI method. (d)、(e) and (f) are the corresponding results using FAFI method. The first two images in (a)~(f) are two echo signals S1 and S2, while the third image is the result of the calculated flip-angle (FA) distribution, also known as B1+ map |
对比图 5(a)和(d)、(b)和(e)、(c)和(f),我们可以看出两种方法得到的发射场图总体分布类似.例如盆腔和腹部发射场图,均为左上方和右下方较亮,左下方和右上方较暗;头部场图均为中间偏左下方较亮,边缘区(尤其是右上方)略暗.而FAFI的回波图像S1、S2使用多次激发EPI采集,在相位方向有轻微化学位移飘移和形变(由于发射场是RF脉冲与人体各种组织相互作用的结果,所以本文在人体实验中未使用脂肪抑制技术),但这些微弱伪影对发射场图的总体分布影响不大.
在人体三个部位发射场图的视野中心取水平和竖直方向的两条线,分别计算使用FAFI和AFI在线上各像素点测量的FA值,绘制对比曲线,见图 6.其中(a)/(b)、(c)/(d) 和(e)/(f)分别是盆腔、腹部和头部在水平/垂直方向各像素测量的FA值.AFI方法的测量值用实线表示,FAFI方法的测量值使用虚线表示.从图中看出,盆腔与头部在水平和垂直方向,使用FAFI与AFI方法的测量值在各像素点都较接近.而腹部在垂直方向,由于使用FAFI序列时是屏气采集,使用AFI序列时是自由呼吸,所以在前半部略有偏差,但总体趋势基本一致.
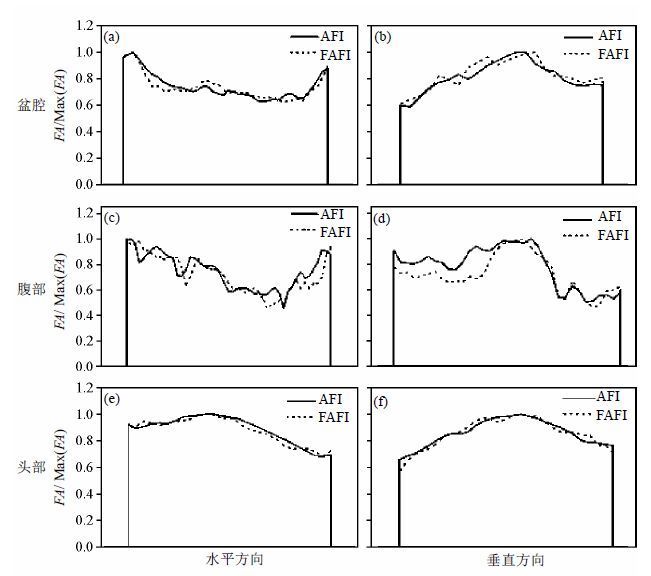
|
| 图 6 AFI与FAFI序列测得的盆腔、腹部和头部发射场图在水平和竖直方向的逐点对比图.(a)/(b)、(c)/(d)和(e)/(f)分别是盆腔,腹部和头部在视野中心水平/垂直方向各像素的翻转角测量值(FA) Fig. 6 The contrast profiles in human pelvis, abdomen and head, acquired by AFI and FAFI sequence in the horizontal/vertical direction. (a)/(b), (c)/(d) and (e)/(f) are the profiles of measured flip-angle (FA) in human pelvis, abdomen and head by AFI and FAFI in the horizontal/vertical center of the FOV |
为进一步证明FAFI与AFI测量发射场的一致性,我们对FAFI和AFI的场图做了相关性分析,结果如图 7所示.将人体各个部位的3D场图分为4个象限,分别求出每一层各象限使用FAFI和AFI方法测得的实际翻转角的平均值(
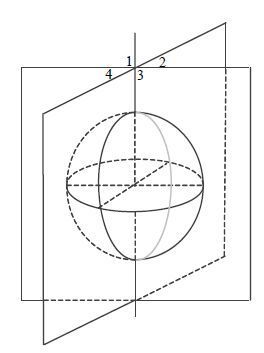
|
| 图 7 三维发射场定量分析区域划分示意图 Fig. 7 The schematic diagram of three-dimensional transmit field division for quantitative analysis |
在盆腔、腹部和头部,对所有志愿者的FAFI和AFI场图做定量抽象,针对各部位FA值进行皮尔森相关性分析,以表明两组数据的相关性.经过计算,在盆腔,腹部和头部FA值的皮尔森相关系数(r)分别为0.951、0.943和0.960,均接近1.这说明使用FAFI和AFI两种方法测量的发射场图有很好的一致性.
同时,我们使用FAFI和AFI测得的场图数据做线性拟合,结果见图 8.图 8中(a)、(b)和(c)分别是盆腔、腹部和头部线性拟合的结果.图中散点表示每层各象限的测量值,横轴为AFI测量的FA值平均值(
对各部位散点图进行线性拟合,拟合曲线(在图 8中使用实线表示)的斜率分别为0.93±0.02、0.91±0.02和1.03±0.02.当FAFI与AFI测得的值越接近,拟合曲线的斜率越接近1.盆腔、腹部和头部拟合曲线的斜率均大于0.9,表示使用FAFI和AFI两种方法测量的场图较为吻合.
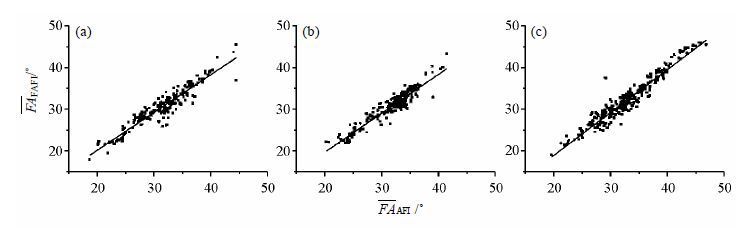
|
|
图 8 使用FAFI与AFI两种方法测量的平均翻转角值( |
此外,将上述的3D场图数据使用柱状图表示,以对比FAFI与AFI在中间层的4个象限测得的平均翻转角(
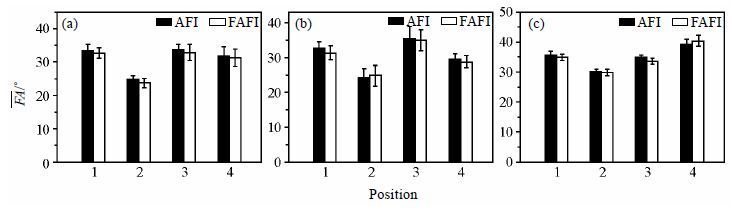
|
|
图 9 使用FAFI与AFI序列在人体(a)盆腔(b)腹部和(c)头部测得的平均翻转角( |
白色表示FAFI测量的翻转角平均值(
| 部位 | 志愿者1 | 志愿者2 | 志愿者3 | 志愿者4 |
| 盆腔 | 2.1% | 4.1% | 2.6% | 1.7% |
| 腹部 | 4.2% | -2.2% | 1.2% | 2.8% |
| 头部 | 2.3% | 1.0% | 4.1% | -1.9% |
*差值=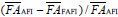 | ||||
综合分析,在人体盆腔、腹部和头部,使用FAFI方法测得的场图分布与传统AFI基本一致,并且扫描时间从130 s缩短为17 s,实现了发射场图采集速度的大幅提升.
2.3 讨论从上述结果可以看出,当水模中目标翻转角(a)在10˚~40˚范围内,使用FAFI方法测得的翻转角与AFI相差不超过3%;在人体盆腔、腹部和头部,使用FAFI与AFI方法测得的3D场图翻转角的相关系数接近1,拟合曲线斜率大于0.9,因此两者分布十分相似.使用FAFI方法的扫描时间降低为AFI的1/8左右.总体来说,使用FAFI方法测得的发射场图与传统AFI场图一致,并且扫描速度成倍提高.
在本文的实验中,每个TR除采集8条PE线外,还采集了参考线,以矫正3D EPI的相位误差.参考线的采集在一定程度上限制了每次激发后采集的PE线数,即限制了FAFI的加速潜能.在后续工作中,采用更加先进的相位矫正方法(例如与多通道并行成像技术相结合的矫正方法[21]),FAFI的加速倍数有望进一步提升.
在实际应用中,发射场的不均匀性往往是一种低频变化[21],发射场匀场是改善发射场的这种不均匀分布.使用FAFI方法测得的场图分布与AFI类似,扫描时间从 130 s降至17 s,为实时匀场提供可能.并且使用AFI方法在扫描人体腹部时,由于采集时间较长,患者无法屏气,得到的场图是呼吸周期中的平均分布,而使用FAFI方法扫描时间缩短至一次屏气时间内,所以得到的场图准确性更高.
另外,本工作仍有一些值得改进的地方:(1)EPI序列对静态场的不均匀比较敏感[17],尤其是3D EPI,故该方法在有空腔或结构复杂的部位(如腹部),成像效果不够好,3D EPI的矫正重建算法有待改进,有时需要加入高阶矫正相.(2)该序列的扫描时间可进一步降低,例如在梯度满足系统要求的条件下增加采集带宽、单个TR增加采集的PE线数或结合其他加速方法等等.
3 结论在高场磁共振系统中,发射场会因为个体尺寸和组织差异而产生不同的不均匀性[3].
目前,发射场的匀场通常使用同一套射频波形与幅相调节参数,而并未考虑个体差异[22],可能会导致匀场效果不佳.本文提出的FAFI方法,将多次激发EPI序列与AFI方法相结合,在水模以及人体盆腔、腹部和头部大幅提高了发射场测量的速度,取得了与传统AFI方法相吻合的成像结果.该方法实现了快速发射场测量,有助于实时采集发射场图、动态调节B1+匀场参数、改善图像质量.另外,快速测量发射场,提高了多通道发射波形设计效率,对多通道并行发射磁共振技术的发展与临床应用亦有积极推动意义.
| [1] | Alon L, Deniz C M, Brown R et al . Method for in situ characterization of radiofrequency heating in parallel transmit MRI[J]. Magn Reson Med , 2013, 69 (5) : 1457-1465 DOI:10.1002/mrm.v69.5 |
| [2] | Suttie J J, Delabarre L, Pitcher A et al . 7 Tesla (T) human cardiovascular magnetic resonance imaging using FLASH and SSFP to assess cardiac function:validation against 1^5 T and 3 T[J]. NMR Biomed , 2012, 25 (1) : 27-34 DOI:10.1002/nbm.v25.1 |
| [3] | Sprinkart A M, Kay N, Frank T et al . Ultrafast volumetric B1+ mapping for improved radiofrequency shimming in 3 tesla body MRI[J]. J Magn Reson Imaging , 2014, 40 (4) : 857-863 DOI:10.1002/jmri.v40.4 |
| [4] | Collins C M, Zhangwei W . Calculation of radiofrequency electromagnetic fields and their effects in MRI of human subjects[J]. Magn Reson Med , 2011, 65 (5) : 1470-1482 DOI:10.1002/mrm.22845 |
| [5] | Homann H . SAR Prediction and Management for Parallel Transmit MRI[M]. German: KIT Scientific Publishing, 2012 . |
| [6] | Yang Bao-lian(杨保联) . Future of ultra high field MRI in basic research and clinical applications(超高场磁共振人体成像应用研究和医学前景)[J]. Chinese J Magn Reson(波谱学杂志) , 2015, 32 (4) : 707-714 |
| [7] | Collins C M, Wang Z, Mao W et al . Array-optimized composite pulse for excellent whole-brain homogeneity in high-field MRI[J]. Magn Reson Med , 2007, 57 (3) : 470-474 DOI:10.1002/(ISSN)1522-2594 |
| [8] | Son H W, Cho Y K, Gopinath A et al . Shimming with SAR reduction in high-field MRI[J]. J Electromagnet Wavel , 2013, 27 (12) : 1521-1524 DOI:10.1080/09205071.2013.817958 |
| [9] | Hernandez D, Min H C, Lee S Y . Iterative multi-channel radio frequency pulse calibration with improving B1 field uniformity in high field MRI[J]. Biomed Eng Online , 2015, 14 (1) : 1-12 DOI:10.1186/1475-925X-14-1 |
| [10] | Katscher U, Börnert P . Parallel RF transmission in MRI[J]. NMR Biomed , 2006, 19 (3) : 393-400 DOI:10.1002/(ISSN)1099-1492 |
| [11] | Cloos M A, Boulant N, Luong M et al . Parallel-transmission-enabled magnetization-prepared rapid gradient-echo T1-weighted imaging of the human brain at 7 T[J]. Neuroimage , 2012, 62 (3) : 2140-2150 DOI:10.1016/j.neuroimage.2012.05.068 |
| [12] | Shao T, Xia L, Tao G et al . Advanced three-dimensional tailored RF pulse design in volume selective parallel excitation[J]. IEEE Med Imaging , 2012, 31 (5) : 997-1007 DOI:10.1109/TMI.2011.2178035 |
| [13] | Insko E, Bolinger L . Mapping of the radio frequency field[J]. J Magn Reson Ser A , 1993, 103 (1) : 82-85 DOI:10.1006/jmra.1993.1133 |
| [14] | Stollberger R, Wach P . Imaging of the active B1 field in vivo[J]. Magn Reson Med , 1996, 35 (1) : 246-251 |
| [15] | Collins C M, Wanzhan Liu M S, Wang J et al . Temperature and SAR calculations for a human head within volume and surface coils at 64 and 300 MHz[J]. J Magn Reson Imaging , 2004, 19 (5) : 650-656 DOI:10.1002/(ISSN)1522-2586 |
| [16] | Yarnykh V L . Actual flip-angle imaging in the pulsed steady state:a method for rapid three-dimensional mapping of the transmitted radiofrequency field[J]. Magn Reson Med , 2007, 57 (1) : 192-200 DOI:10.1002/(ISSN)1522-2594 |
| [17] | Bernstein M A, King K F, Zhou X J . Handbook of MRI Pulse Sequences[M]. USA: Elsevier Academic Press, 2004 . |
| [18] | Nehrke K . On the steady-state properties of actual flip angle imaging (AFI)[J]. Magn Reson Med , 2009, 61 (1) : 84 DOI:10.1002/mrm.v61:1 |
| [19] | Buonocore M H, Gao L . Ghost artifact reduction for echo planar imaging using image phase correction[J]. Magn Reson Med , 1997, 38 (1) : 89-100 DOI:10.1002/(ISSN)1522-2594 |
| [20] | Busse R F, Riederer S J . Steady-state preparation for spoiled gradient echo imaging[J]. Magn Reson Med , 2001, 45 (4) : 653-661 DOI:10.1002/(ISSN)1522-2594 |
| [21] | Yuval Z . Two-dimensional phase correction method for single and multi-shot echo planar imaging[J]. Magn Reson Med , 2011, 66 (6) : 1616-1626 DOI:10.1002/mrm.v66.6 |
| [22] | Hsu Y C, Chern I, Zhao W et al . Mitigate B1+ inhomogeneity using spatially selective radiofrequency excitation with generalized spatial encoding magnetic fields[J]. Magn Reson Med , 2014, 71 (4) : 1458-1469 DOI:10.1002/mrm.v71.4 |

本作品采用知识共享署名 4.0 国际许可协议进行许可。
 2016, Vol. 33
2016, Vol. 33



