硫酸盐存在于大多数天然环境(土壤、湖泊、河水、地下水以及大气圈)中,在全球生物地球化学循环中发挥着关键作用(Rafter,1967)。硫酸盐中的硫、氧同位素组成可以提供不同自然环境中有关硫酸盐起源、迁移和转化的线索,特别是氧同位素研究可以揭示硫的氧化还原反应和环境水的氧同位素组成;并且在大多数地表条件下,硫酸盐和水之间氧同位素的交换可以忽略不计(Alpers and Blowes, 1994)。因此,氧同位素组成是一个非常有效的示踪硫酸盐的起源及其形成环境的工具(Alpers and Blowes, 1994; Clayton and Mayeda, 1996; Bao et al., 2000)。
由化石燃放的大量SO2通过植物气孔(或皮孔)进入叶肉细胞,通过水和作用,最终以硫酸盐形式在植物液泡中积累。已有研究表明,植物叶片组织硫同位素组成特征能够有效示踪大气硫源(Ohizumi et al., 1997; Prietzel et al., 2004; Adamo et al., 2008; Xiao et al., 2008, 2009; 关晖等,2013)。但是,土壤硫酸盐也在很大程度上受大气干湿沉降的影响,如贵阳地区,雨水的δ34S值偏负(-4.9‰)(Xiao et al., 2002),接近土壤的δ34S值(-5.5‰)(关晖等,2013),这是由贵阳燃煤来源的大气硫沉降影响所致。因此,单凭针叶硫同位素组成只能示踪硫源,并不能指示针叶硫酸盐的来源(根部吸收的土壤硫酸盐、叶片吸收的大气SO2在叶肉中氧化或是叶片直接吸收大气硫酸盐)。通过分析针叶硫酸盐和叶水的氧同位素组成或许可以解决这一难题。因为大气的氧化过程中硫同位素分馏很小,而氧同位素分馏却很大,硫酸盐的氧同位素组成受控于氧化作用发生的条件和不同氧化物(O3,O2,OH,金属)(Cortecci and Longinelli, 1970; Holt et al., 1981, 1982; Bao,2015)。硫酸盐很稳定,在正常大气条件下是没有同位素的交换,所以一旦硫酸盐形成之后,就会保持参与反应的氧化物的氧同位素特征(Lloyd,1968; Chiba and Sakai, 1985)。
本研究选取贵州省的贵阳市和云南省的昆明市、曲靖市和晋宁山区的马尾松针叶作为研究对象,对其硫酸盐和叶水的氧同位素组成(δ18OSO42-和δ18OH2O)进行分析,以了解SO2在植物中的氧化机制,探讨影响针叶组织δ18OSO42-变化的原因,进而揭示针叶中硫酸盐的来源,以期为继续开展应用植物组织监测和研究大气硫沉降及其生态环境效应打下理论基础。
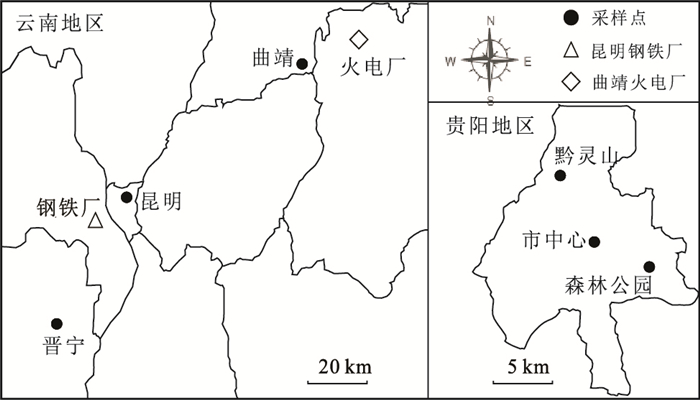
1 材料与方法 1.1 研究区域研究区域包括贵州省贵阳市(市中心、黔灵山、森林公园)和云南省的昆明市区、曲靖市区、晋宁山区(图 1)。贵阳地处生态环境较脆弱的西南喀斯特地区,20世纪90年代酸雨出现频率较高,后关闭和转移了一些重型污染工厂(Xiao and Liu, 2002,2004)后环境质量有所改善,但其大气硫沉降水平仍较高,大气SO2浓度明显高于云南几个采样地(表 1)。此外,还选择了两个特定点源(昆明钢铁厂和曲靖火电厂)按照离工厂的距离进行采样。松树在贵阳和云南都分布很广泛。
|
图 1 采样点分布示意图 Figure 1 The sketch map of sampling locations |
|
|
表 1 采样点SO2浓度以及针叶硫酸盐、土壤硫酸盐、叶水的氧同位素组成 Table 1 SO2 concentration, δ18 OSO42- of leaves and soil, and δ18 O H2O of leaves at different sampling sites |
选取的植物种类为马尾松(Pinusmassoniana Lamb.),为减少松树种类的差异和因根在土壤中生长深度的不同而造成营养吸收上的差别,因此松树选取长势相同、树龄相近且生长都超过8年,树高约为10 m的进行研究。所有树叶都是当年生的成熟叶。市区采样点集中在城市山体附近,离开市区后所选采样点避开了主要公路。采样时间为2012年2月23日~ 2012年4月30日,共采集针叶样品52个,植物根系土壤样品23个。采集的样品放入自封袋带回验室。用超纯水(Milli-Q)反复冲洗以彻底去除表面吸附的尘土和颗粒物,再用冷冻干燥机冻72 h,然后用粉碎机粉碎,过100目筛。土壤样品自然风干后,用研钵粉碎,过100目筛。
1.3 同位素测定针叶组织δ18OSO42-测定采用湿硝化硫酸钡比浊法制备样品(Kaiser et al., 1989),然后用连续流同位素质谱仪(CF-IRMS,EA-IsoPrime,型号为Euro3000,GV instruments)测定δ18O值。测定数据采用标准NBS127校正,其结果以VSMOW为标准表示,精度小于±0.3‰(n=5)。针叶组织δ18OH2O测定采用真空蒸馏法提取针叶水分(刘文茹等,2012),然后采用LGR液态水同位素分析仪(美国Los Gatos Research公司,型号为DLT-100)测定δ18O值。测定数据采用标准VSMOW校正,其结果以VSMOW为标准表示,精度小于±0.1‰(n=5)。以上测定都是在中国科学院地球化学研究所环境地球化学国家重点实验室完成。
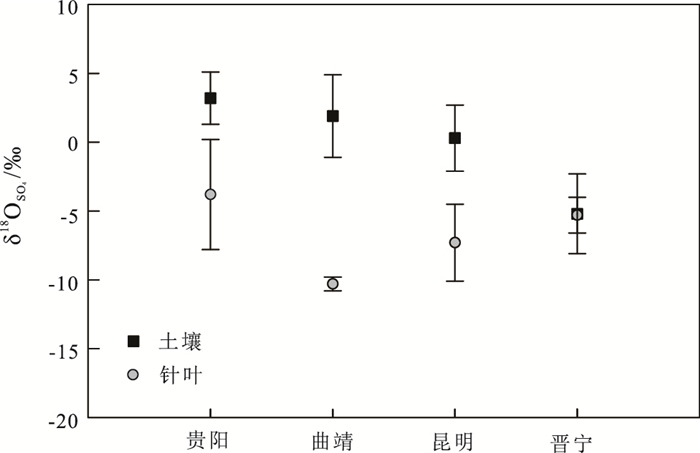
2 结果与讨论 2.1 不同地区样品硫酸盐氧同位素组成特征和指示意义不同研究区的所有样品的针叶δ18OSO42-值变化很大,其变化范围为-12.5‰~5.4‰,表明不同地区针叶硫酸盐有不同的来源或是硫酸盐的形成过程不同。针叶δ18OSO42-值整体偏负,所有地区均值为-5.5‰。其中曲靖市区最低,均值为-10.3‰±0.5‰;贵阳市区最高,均值也只有-3.8‰(图 2)。大气沉降中硫酸盐的δ18OSO42-值的一般值为7‰~18‰(Mayer,2005),富集重氧,与本研究中针叶的δ18OSO42-值明显不同。
|
图 2 不同地区针叶组织和土壤硫酸盐的δ18O值变化 Figure 2 Variation of δ18OSO42- in needles and soils in different locations |
为进一步分析大气沉降的δ18OSO42-与针叶δ18OSO42-的关系,还测定了2008年10月1日~ 2009年9月30日采集的100个贵阳市的雨水样品的δ18OSO42-值。结果显示,贵阳雨水的δ18OSO42-值这一时间段内变化不大(变化范围为12.1‰~16.0‰,均值为14.0‰),落在大气沉降中硫酸盐的氧同位组成(+7‰~+18‰)的范围内,这与本研究中针叶的δ18OSO42-值差别很大。由于硫酸盐很稳定,在正常大气条件下很少有同位素的交换(Lloyd,1968; Chiba and Sakai, 1985),并且针叶通过气孔吸收大气中的细颗粒物或是溶解的粗颗粒物的过程几乎不发生同位素分馏;硫酸盐在叶片中的运输过程中同位素分馏很小(Forstel and Hutzen, 1983; White et al., 1985)。因此,以上结果表明,本研究中针叶硫酸盐很少来源于直接通过叶片吸收的大气硫酸盐。
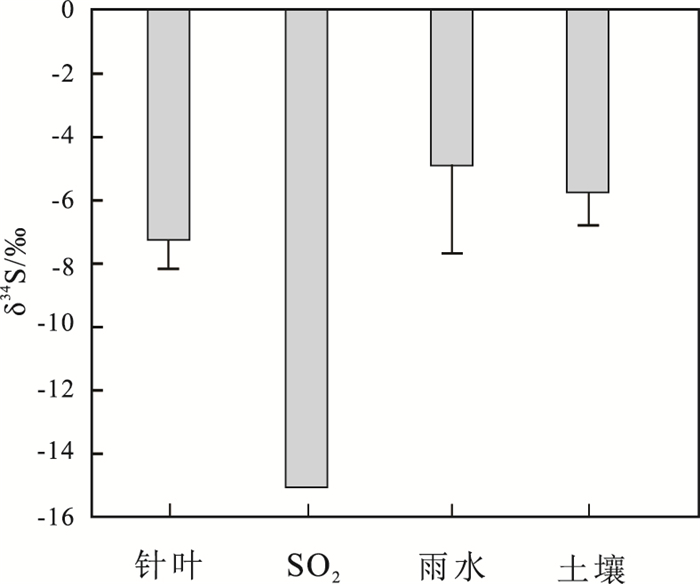
不同地区松树根际土壤的δ18OSO42-值变化范围为-7.3‰~6.5‰,均值为1.2‰,明显比针叶的δ18OSO42-值偏正。除了晋宁地区,其他地区植物根际土壤的δ18OSO42-值都是正值。晋宁地区根际土壤的δ18OSO42-值为-5.2‰,与其针叶的δ18OSO42-(-5.3‰)非常接近,其他地区植物根际土壤的δ18OSO42-值与针叶δ18OSO42-值相差很大(图 2)。一般情况下,植物通过根部从土壤中吸收硫酸盐是主要的硫营养来源(Trust and Fry, 1992)。特别是在一些没有SO2污染的地区,比如晋宁山区,针叶中无机硫酸盐的含量是最低的,基本都来源于土壤。所以晋宁山区针叶δ18OSO42-值接近于植物根际土壤δ18OSO42-值,针叶硫酸盐主要来源于根部直接吸收的土壤硫酸盐。但在大部分城市,特别是大气SO2浓度较高的地区,SO2也能作为植物硫营养的来源(Ashenden,1979; Bao et al., 2009)。这些地区针叶硫酸盐主要有两个来源,一个是土壤硫酸盐,另一个则是通过针叶气孔吸收大气SO2,再经氧化过程形成。本研究中除晋宁外,其他各地土壤δ18OSO42-值和针叶δ18OSO42-值都有较大差异,可能是由于相当大一部分针叶硫酸盐来源于大气SO2氧化所致。为更好分析针叶硫酸盐来源,对比分析了贵阳地区大气SO2的δ34S(-15.1‰)(刘广深等,1996)、雨水δ34S(-4.9‰±2.8‰)(Xiao et al., 2002),土壤硫酸盐的δ34S(-5.8‰±1.0 ‰)(关晖等,2013)以及针叶δ34S(-7.2‰±0.9‰)(关晖等,2013)。如图 3所示,只有大气SO2的δ34 S值比针叶硫酸盐的δ34 S值更低,这进一步证实了相当大一部分针叶硫酸盐来源于大气SO2氧化。
|
图 3 贵阳市区针叶、雨水和土壤硫酸盐及大气SO2的δ34S值 Figure 3 δ34S values in needle sulfates, SO2, rainwater sulfates and soil sulfates(Guiyang data) |
大气SO2通过植物叶片的气孔进入到叶肉组织,溶于叶水从而形成亚硫酸根离子、亚硫酸氢根离子和质子(Peiser and Yang, 1985)。他们能通过氧化或者还原过程进行解毒。亚硫酸盐本身不会在植物体内进行积累(Dittrich et al., 1992)。研究表明,对于松柏类植物,氧化途径是SO2进行解毒的主要途径(Huve et al., 1995)。通过氧化途径生成了质子和硫酸根离子,随后硫酸盐就被摄入到液泡中(Kaiser et al., 1989)。
在氧化过程中,SO2(g)和HSO3-(aq)都与水发生了快速平衡反应,这就意味着生成物已经完全没有了SO2初始的氧同位素特征(Jamieson and Wadleigh, 1999),已有研究表明,该过程生成的硫酸盐的δ18O取决于参与反应水的δ18O(Mizutani and Rafter, 1973; Fritz et al., 1989)。通过这个过程形成的硫酸盐的δ18OSO42-值和参加反应水的δ18OH2O值之间应该是正相关关系(Cortecci and Longinelli, 1970; Longinelli and Bartelloni, 1978)。因为生成的SO42-中的氧一部分来自于H2O,一部分来自于光合作用生成的O2。
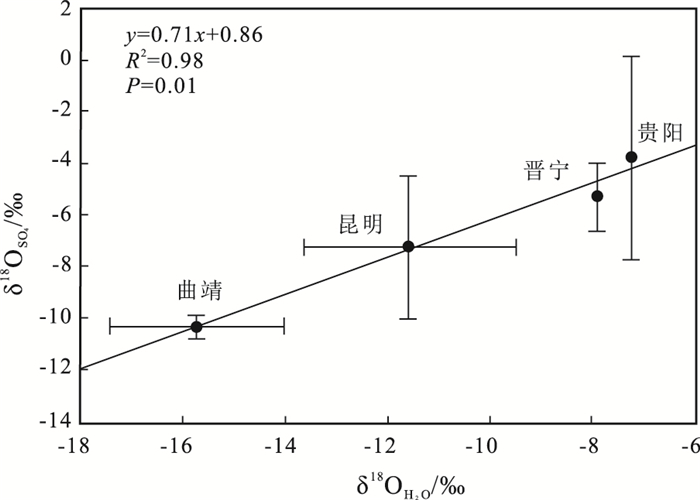
在本研究中,不同地区叶水δ18OH2O值变化范围是-0.8‰~-15.8‰,均值为-10.6‰,整体相当偏负,富集轻氧。贵阳叶水δ18OH2O均值最高为-7.2‰,曲靖最低为-15.7‰。相对于各地区针叶硫酸盐δ18OSO42-值,叶水δ18OH2O值更负。这与降水、温度、纬度、海拔和蒸发速率有关(Roden and Ehleringer, 1999; Barbour and Farquhar, 2000; Liu et al., 2008)。对比叶水δ18OH2O值和针叶δ18OSO42-值,发现各地区叶水δ18OH2O值与针叶硫酸盐δ18OSO42-值显著正相关(y=0.71x+0.86,R2=0.98,p=0.01)(图 4)。这与前人的研究结果是一致的(Cortecci and Longinelli, 1970; Longinelli and Bartelloni, 1978),表明不同地区针叶δ18OSO42-值主要受叶水δ18OH2O值所控制,也进一步证明了大气SO2在叶肉组织中氧化对针叶硫酸盐的贡献是相当大的。
|
图 4 针叶硫酸盐氧同位素组成和叶水氧同位素组成的关系 Figure 4 The correlation between δ18OSO42- and δ18OH2O in needles |
在昆明钢铁厂附近,针叶的δ18OSO42-值变化范围为-13.6‰~3.5‰,均值为-6.6‰,和不同地区针叶δ18OSO42-值一样,整体偏负。不同的是,钢铁厂附近针叶δ18OSO42-值随着与钢铁厂距离的变大而越来越偏负(图 5a):在离钢铁厂10 m处δ18OSO42-为2.7‰,1000 m处为-6.7‰,8000 m处为-7.4‰。曲靖火电厂附近针叶δ18OSO42-值也表现出与昆明钢铁厂同样的变化规律(图 5b)。
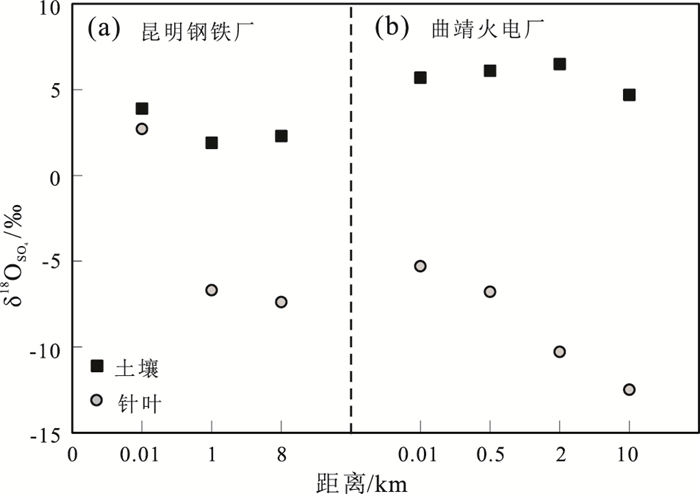
|
图 5 点源附近从近到远针叶和土壤δ18OSO42-的空间变化 Figure 5 Spatial variations of δ18OSO42- in needles vs. the distance from plants |
对比针叶样品的根际土壤样品,昆明钢铁厂附近,10 m和1000 m处土壤的δ18OSO42-值都偏正,且相差很小(1‰)。只有8000 m处土壤的δ18OSO42-值偏负(图 5a),可能是由于离钢铁厂8000 m处位于森林地区,土壤中的硫化物含量比较高(Mayer,2005)。在曲靖火电厂附近,土壤的δ18OSO42-值变化很小,都保持在5‰左右(图 5b)。两个点源附近根际土壤的δ18OSO42-值都比针叶的δ18OSO42-值明显偏正,但并没有随着与钢铁厂距离的变化而变化的趋势,这表明点源附近针叶硫酸盐并不是主要来源于土壤。和各个城市地区一样,叶水δ18OH2O值同样很负(表 1),针叶硫酸盐相当大一部分来源于大气SO2的氧化。但是,两个点源附近针叶δ18OSO42-值随着与钢铁厂距离的变化规律并不是由土壤硫酸盐造成的,也不是由SO2氧化形成硫酸盐造成的,因为δ18OH2O值并没有随着与钢铁厂距离的变化而变化(表 1)。因此,推断昆明钢铁厂和曲靖火电厂附近的针叶δ18OSO42-值都受到了一个δ18O值偏正源的影响,很可能是同样的一个硫酸盐来源,在靠近工厂的地方,受到的影响相对较大,远离工厂的地方受到的影响较小一些。
SO2氧化成SO42-的过程有两种情况,一是如果发生在大约450℃高温中,会产生燃烧堆栈;二是当SO2逸出到空气中,温度较低。前一种情况生成的硫酸盐称为原生硫酸盐(primary sulfates),后者称为次生硫酸盐(secondary sulfates)。Holt等(1982)研究发现,原生硫酸盐(形成于高温燃烧,例如电厂、冶炼厂等)一般富集18O(δ18O=40‰~45‰),烟道气中测得的δ18OSO42-值在这个范围内,变化范围为26‰~40‰。在两个点源昆明钢铁厂和曲靖火电厂附近,针叶的硫酸盐除了大气SO2氧化和土壤硫酸盐两个来源外,可能还有一个来源,就是大气颗粒物中的硫酸盐,也就是工厂烟道排放的原生硫酸盐。离工厂距离越近,原生硫酸盐的浓度也就越高,植物叶片吸收的原生硫酸盐也就相对越多。因此,针叶δ18OSO42-值随着与工厂距离变化而发生的规律性变化很有可能是吸收工厂烟道排放的原生硫酸盐的多寡造成的。
关于SO2在植物中的氧化过程以及发生的氧同位素分馏还不是很清楚,相关的研究也非常少。本研究首次应用维管束植物叶片中硫酸盐和叶水的δ18O来探讨针叶硫酸盐的来源,为维管束植物叶组织指示区域大气硫沉降提供了更加有利的理论支撑,为进一步研究大气硫沉降对西南地区城市生态系统营养元素循环的影响提供理论指导。
3 结论(1) 所有采样点的针叶的δ18OSO42-值都整体偏负(均值-5.5‰),而大气沉降中硫酸盐的δ18OSO42-值偏正(+7‰~+18‰),表明针叶硫酸盐很少来源于直接通过叶片吸收的大气硫酸盐。在大气SO2浓度很低的背景区(晋宁山区),针叶δ18OSO42-值接近于根际土壤δ18OSO42-,说明背景区针叶硫酸盐主要来源于根部直接吸收的土壤硫酸盐。但在其他大气SO2浓度相对较高的城市地区,针叶硫酸盐δ18OSO42-远低于土壤硫酸盐δ18OSO42-,并且各地区叶水δ18OH2O值与针叶硫酸盐δ18OSO42-值显著正相关,表明城市地区针叶硫酸盐有相当大一部分来源于大气SO2在叶肉中氧化。
(2) 两个点源附近针叶δ18OSO42-值和δ18OH2O值同样偏负。和各城市不同的是,针叶δ18OSO42-值都随着与工厂距离的变大而趋于偏负,这可能是由于植物通过叶片吸收了一些来自工厂烟道排放的原生硫酸盐造成的。针叶组织硫酸盐和叶水氧同位素组成能够指示针叶硫酸盐的来源。
| [] | Adamo P, Bargagli R, Giordano S, Modenesi P, Monaci F, Pittao E, Spagnuolo V, Tretiach M. 2008. Natural and pre-treatments induced variability in the chemical composition and morphology of lichens and mosses selected for active monitoring of airborne elements. Environmental Pollution, 152(1): 11–19. DOI:10.1016/j.envpol.2007.06.008 |
| [] | Alpers C N, Blowes D W. 1994. Environmental geochemistry of sulfide oxidation. Washington, DC:American Chemical Society, 446-480 |
| [] | Ashenden T W. 1979. Effects of SO2 and NO2 pollution on transportation in Phaseolus vulgaris L.. Environmental Pollution(1970), 18(1): 45–50. |
| [] | Bao H M, Thiemens M H, Farquhar J, Campbell D A, Lee C C W, Heine K, Loope D B. 2000. Anomalous17O compositions in massive sulphate deposits on the Earth. Nature, 406(6792): 176–178. DOI:10.1038/35018052 |
| [] | Bao H M. 2015. Sulfate:A time capsule for Earth's O2, O3, and H2O. Chemical Geology, 395: 108–118. DOI:10.1016/j.chemgeo.2014.11.025 |
| [] | Bao L M, Zhang G L, Zhang Y X, Li Y, Lin J, Liu W, Cao Q C, Zhao Y D, Ma C Y, Han Y. 2009. Transfer characterization of sulfur from coal-burning emission to plant leaves by PIXE and XANES. Chinese Physics C, 33(11): 1010–1015. DOI:10.1088/1674-1137/33/11/016 |
| [] | Barbour M M, Farquhar G D. 2000. Relative humidity-and ABA-induced variation in carbon and oxygen isotope ratios of cotton leaves. Plant, Cell & Environment, 23(5): 473–485. |
| [] | Chiba H, Sakai H. 1985. Oxygen isotope exchange rate between dissolved sulfate and water at hydrothermal temperatures. GeochimicaetCosmochimicaActa, 49(4): 993–1000. |
| [] | Clayton R N, Mayeda T K. 1996. Oxygen isotope studies of achondrites. GeochimicaetCosmochimicaActa, 60(11): 1999–2017. |
| [] | Cortecci G, Longinelli A. 1970. Isotopic composition of sulfate in rain water, Pisa, Italy. Earth and Planetary Science Letters, 8(1): 36–40. DOI:10.1016/0012-821X(70)90096-8 |
| [] | Dittrich A P M, Pfanz H, Heber U. 1992. Oxidation and reduction of sulfite by chloroplasts and formation of sulfite addition compounds. Plant physiology, 98(2): 738–744. DOI:10.1104/pp.98.2.738 |
| [] | Forstel H, Hutzen H. 1983.18O/16O ratio of water in a local ecosystem as a basis of climate record. In:Palaeoclimatesandpalaeowaters:A collection of environmental isotope studies. Vienna:International Atomic Energy Agency, 1:67-81 |
| [] | Fritz P, Basharmal G M, Drimmie R J, Ibsen J, Qureshi R M. 1989. Oxygen isotope exchange between sulphate and water during bacterial reduction of sulphate. Chemical Geology:Isotope Geoscience Section, 79(2): 99–105. DOI:10.1016/0168-9622(89)90012-2 |
| [] | Holt B D, Cunningham P T, Kumar R. 1981. Oxygen isotopy of atmospheric sulfates. EnvironmentalScience & Technology, 15(7): 804–808. |
| [] | Holt B D, Kumar R, Cunningham P T. 1982. Primary sulfates in atmospheric sulfates:Estimation by oxygen isotope ratio measurements. Science, 217(4554): 51–53. DOI:10.1126/science.217.4554.51 |
| [] | Hüve K, Dittrich A, Kindermann G, SlovikS, HeberU. 1995. Detoxification of SO2 in conifers differing in SO2-tolerance. Planta, 195(4): 578–585. |
| [] | Jamieson R E, Wadleigh M A. 1999. A study of the oxygen isotopic composition of precipitation sulphate in eastern Newfoundland. Water, Air, and Soil Pollution, 110(3-4): 405–420. |
| [] | Kaiser G, Martinoia E, Schröppel-Meier G, Heber U. 1989. Active transport of sulfate into the vacuole of plant cells provides halotolerance and can detoxify SO2. Journal of Plant Physiology, 133(6): 756–763. DOI:10.1016/S0176-1617(89)80085-9 |
| [] | Liu Z F, Tian L, Chai X R, Yao T D. 2008. A model-based determination of spatial variation of precipitation δ18O over China. Chemical Geology, 249(1-2): 203–212. DOI:10.1016/j.chemgeo.2007.12.011 |
| [] | Lloyd R M. 1968. Oxygen isotope behavior in the sulfate-water system. Journal of Geophysical Research, 73(18): 6099–6110. DOI:10.1029/JB073i018p06099 |
| [] | Longinelli A, Bartelloni M. 1978. Atmospheric pollution in Venice, Italy, as indicated by isotopic analyses. Water, Air, and Soil Pollution, 10(3): 335–341. |
| [] | Mayer B. 2005. Assessing sources and transformations of sulphate and nitrate in the hydrosphere using isotope techniques. In:Aggarwal PK, Gat J R, Froehlich K F(eds). Isotopes in the Water Cycle. Dordrecht:Springer, 67-89 |
| [] | Mizutani Y, Rafter T A. 1973. Isotopic behaviour of sulphate oxygen in the bacterial reduction of sulphate. Geochemical Journal, 6(4): 183–191. DOI:10.2343/geochemj.6.183 |
| [] | Ohizumi T, Fukuzaki N, Kusakabe M. 1997. Sulfur isotopic view on the sources of sulfur in atmospheric fallout along the coast of the sea of Japan. Atmospheric environment, 31(9): 1339–1348. DOI:10.1016/S1352-2310(96)00278-6 |
| [] | Peiser G, Yang S F. 1985. Biochemical and physiological effects of SO2 on nonphotosynthetic processes in plants. In:Winner WE, Mooney HA, Goldstein RA, eds. Sulfur dioxide and vegetation. Stanford, CA:StanfordUniversity Press, 148-161 |
| [] | Prietzel J, Mayer B, Legge A H. 2004. Cumulative impact of 40 years of industrial sulfur emissions on a forest soil in west-central Alberta(Canada). Environmental Pollution, 132(1): 129–144. DOI:10.1016/j.envpol.2004.03.016 |
| [] | Rafter T A. 1967. Oxygen isotopic composition of sulphates-Part Ⅰ. A method for the extraction of oxygen and its quantitative conversion to carbon dioxide for isotope radiation measurements. The New Zealand Journal of Science, 10:493-510 |
| [] | Roden J S, Ehleringer J R. 1999. Observations of hydrogen and oxygen isotopes in leaf water confirm the Craig-Gordon model under wide-ranging environmental conditions. Plant Physiology, 120(4): 1165–1174. DOI:10.1104/pp.120.4.1165 |
| [] | Trust B A, Fry B. 1992. Stable sulphur isotopes in plants:A review. Plant, Cell & Environment, 15(9): 1105–1110. |
| [] | White J W C, Cook E R, Lawrence J R, Broecker W S. 1985. The DH ratios of sap in trees:Implications for water sources and tree ring DH ratios. GeochimicaetCosmochimicaActa, 49(1): 237–246. |
| [] | Xiao H Y, Liu C Q. 2002. Sources of nitrogen and sulfur in wet deposition at Guiyang, Southwest China. Atmospheric Environment, 36(33): 5121–5130. DOI:10.1016/S1352-2310(02)00649-0 |
| [] | Xiao H Y, Liu CQ. 2004. Chemical characteristics of water-soluble components in TSP over Guiyang, SW China, 2003. Atmospheric Environment, 38(37): 6297–6306. DOI:10.1016/j.atmosenv.2004.08.033 |
| [] | Xiao H Y. Tang C G, Liu X Y, Xiao H W, Liu C Q. 2008. Sulphur isotopic ratios in mosses indicating atmospheric sulphur sources in southern Chinese mountainous areas. Geophysical Research Letters, 35(19): L19807. DOI:10.1029/2008GL034255 |
| [] | Xiao H Y, Tang C G, Xiao H W, Liu X Y, Liu C Q. 2009. Identifying the change in atmospheric sulfur sources in China using isotopic ratios in mosses. Journal of Geophysical Research:Atmospheres, 114(D16): D16304. DOI:10.1029/2009JD012034 |
| [] | 关晖, 肖化云, 朱仁果, 郑能建, 瞿玲露. 2013. 马尾松针叶组织稳定硫同位素地球化学特征及来源示踪. 环境科学, 34(10): 3777–3781. |
| [] | 刘广深, 洪业汤, 朴河春, 曾毅强. 1996. 贵阳城、郊近地面大气颗粒物的硫同位素组成特征. 矿物学报, 16(4): 353–357. |
| [] | 刘文茹, 沈业杰, 彭新华, 陈效民. 2012. 提取方式对土壤和植物水分提取率的影响及其氢氧同位素分析. 生态学杂志, 31(7): 1870–1875. |
 2017, Vol. 36
2017, Vol. 36


