2. 中国科学院大学, 北京 100049
2. University of Chinese Academy of Science, Beijing 100049, China
中国西南喀斯特地区是全球最大的碳酸盐岩连片出露的喀斯特地区, 以贵州为中心涵盖滇、黔、桂、川、湘、鄂、粤、赣和渝9省区(市), 总面积达54万多平方千米。有研究认为喀斯特石漠化是中国西南喀斯特地区最严重的生态地质环境问题, 影响着珠江和长江的生态安全, 制约着区域社会经济的可持续发展(王世杰, 2003), 但喀斯特石漠化成因与机制的研究比较薄弱, 对喀斯特区域土壤性质与演化等科学问题的认识尤为不足。
土壤迅速流失是喀斯特石漠化发生的一个重要直观表现。所以, 改善土壤质量, 提高土壤生产力, 增强土壤抵抗流水侵蚀能力, 被认为是石漠化防治的重要手段。土壤有机质(soil organic matter, SOM)是土壤的重要组分, 显著地影响着土壤结构和理化性质, 是土壤养分的主要来源, 是决定土壤质量的主要参数。SOM主要来源于动植物的残体, 是经微生物部分分解和非生物转化后所形成的组分和结构特征复杂的有机混合物质, 包括腐殖物质和非腐殖物质(Kinniburgh et al., 1998)。腐殖质是SOM的主要成分, 含量高达60%~90%, 根据其在酸碱水溶液里的溶解性, 腐殖质可进一步分为富里酸(fulvic acid, FA)、胡敏酸(humic acid, HA)和胡敏素(Humin)3类亚组分。对SOM进行分组是深入研究SOM的直接途径。但是, SOM与土壤矿物通常结合紧密导致其亚组分难以被分离提取, 极大地阻碍了相关研究的开展。前人在其他区域的研究表明, 土壤HA/FA值与土壤的种类和理化环境显著相关。一般而言, 酸性多水且通气性差的土壤中FA含量较高, 而富含盐基且排水通气性较好的土壤中HA含量较高(窦森等, 2009)。HA是稳定土壤团聚体结构的重要SOM组分, 关于中国西南喀斯特地区SOM与HA形成与演化的研究依然空白。
近年来, 碳同位素技术被广泛用于土壤有机质的研究, 主要集中于判断土壤有机质来源(朴河春等, 2000, 2001;Li and Wang, 2001)和分解程度(Heidorn et al., 1995;Feng, 2002)、衡量土壤碳周转周期、重现C3/C4植被变化(Victoria et al., 1995;张平中等, 1998;Krull and Bray, 2005)及示踪土壤过程(Yonekura et al., 2013)等方面。迄今针对中国西南喀斯特地区土壤有机质碳同位素的研究工作并不多, 主要集中在土壤总有机质的13 C与区域碳循环方面(朱书法等, 2007;刘涛泽等, 2008;李龙波等, 2012), 而对于SOM亚组分的δ13 C值却少见报道。黄壤是中国西南喀斯特地区分布面积最大、最广的地带性土壤(刘丛强等, 2009), 了解土壤有机质不同组分可能的降解过程与归宿, 有助于深刻认识西南喀斯特地区土壤退化与流失过程及形成机理, 为喀斯特石漠化治理提供基础数据。本文利用稳定碳同位素技术研究了黄壤SOM和HA的δ13 C组成, 对比研究了黄壤SOM与HA的稳定碳同位素组成及其在土壤剖面上的变化趋势, 以及黄壤HA和不同分子量HA亚组分δ13 C组成的差异。
1 样品采集与分析方法 1.1 采样点概况与样品制备研究所用的黄壤采自贵州省贵阳都溪森林公园, 公园位于贵阳市北郊, 成土母质为砂岩, 公园内林木以1960年前后营造的马尾松纯林为主, 具有典型的西南地区森林特点。贵阳市年平均气温14℃, 年降将雨量为1180~1271 mm, 年平均日照时数为1354 h, 全年无霜期约270 d, 属于亚热带季风湿润性气候。
黄壤分上、中、下3层采集, 每隔12 cm为一层, 剖面深度共36 cm。自然风干、拣去动植物残体及碎石, 取大约25 g土样, 用玛瑙研钵研磨至过200目筛(Y1、Y2、Y3) , 装袋待用。再分别提取每份土样的胡敏酸, 得到HAY1、HAY2、HAY3。将表层胡敏酸通过超滤分组:MW>500 K为Y1F1、300 K<MW<500 K为Y1F2、100 K<MW<300 K为Y1F3……MW<5 K为Y1F8。
1.2 分析方法胡敏酸的提取、纯化、分组方法根据马连刚(2014), 具体流程如下:
提取:取5 kg黄壤置于除去O2的0.5 mol/L NaOH溶液中, 搅拌4 h, 离心将上层清夜转入玻璃瓶中, 加入6 mol/L HCl酸化, 调节pH=1, 离心所得沉淀即为粗HA, 对残渣连续提取12次。
纯化:向粗HA中加入浓度为0.1 mol/L的KOH及KCl固体, 离心, 去除悬浮液中的固体, 加HCl使pH=1.0, 静止24 h, 离心舍去上清液, 加入HCl与HF重新沉淀, 冻干得HA。
分组:配制浓度为100 mg/L的HA溶液, 在超滤系统(Perllicon ΙΙ, Millipore)上通过一系列超滤膜[分子截留量(MW) K, 10 K, 30 K, 50 K, 100 K, 300 K, 500 K]得到。
将过200目筛的土样约10 g于50 mL离心管中, 加入浓度为1 mol/L的盐酸适量(排除无机碳的影响)。每间隔2 h用玻璃棒搅拌一次使之充分反应, 反应时间为6~24 h(视无机碳量多少而定), 待不再有气泡产生, 表明反应结束。酸过量的样品需用去离子水洗3~5次至中性, 后置于冷冻干燥机中干燥24 h。然后用4 mm×6 mm锡杯包样(样品绝对含碳量为20~25 μg), 胡敏酸样与超滤组分无需进行酸处理, 直接研磨至过200目筛并包样(同上), 最后上连续流同位素质谱仪Iso-Prime测定碳同位素比值。进行δ13 C测试时, 先做4个标准样品后再进行样品测试, 一般每隔12个样品放一个标准样品。用国际原子能机构提供的纤维素标样(δ13 CIAEA=-24.9‰)进行校正, 结果用PDB表示。
2 结果与讨论 2.1 剖面δ13 C值变化特征分析测得黄壤有机质上、中、下层的δ13 C值分别为:-21.467‰、-21.867‰、-21.554‰(表 1)。表层最高, 中层略微下降, 下层又上升。整个剖面变化幅度不大, 为0.394‰。黄壤地区优势种为马尾松, 马尾松作为典型的C3植物, 叶片δ13 C值为-26.7‰(朱书法等, 2006), 枯枝落叶的δ13 C为-28.2‰(李龙波等, 2012)。这与Krull等(2002)研究结果相似, 植物叶片δ13 C值为-27.3‰, 而测得土壤表层δ13 C值为-27.2‰~-20.4‰。Boutton等(1998)发现有机质的δ13 C值比对应的枯枝落叶的δ13 C值高出1‰~10‰。Lichtfouse等(1995a)观察到, 与植被相比, 土壤有机质的δ13 C值要偏正1.5‰~4.3‰。黄壤表层与马尾松枯枝落叶δ13 C值呈现出了大幅度的增幅(约为6‰), 推断可能是由于出现了植被的转变或者由于有机质强烈降解所导致(Pessenda et al., 1996;Pessenda and Valencia, 1996)。要区分导致δ13 C值变幅的原因, 可以利用δ15N值作为对比, 因为δ15N值与光合作用类型无关, 只受降解过程的影响(Mariotti et al., 1980;Natelhoffer and Fry, 1988;Turekian et al., 1998)。
|
|
表 1 土壤有机质与对应胡敏酸δ13 C值组成 Table 1 δ13 C values of SOC and HA) |
黄壤有机质的δ13 C值随着剖面深度的加深, 呈现先减少后增大的趋势, 这与前人(陈庆强等, 2005;朱书法等, 2007;李龙波等, 2012)的结果一致。前人研究表明(Natelhoffer and Fry, 1988;Balesdent et al., 1993), 20 cm以下的土壤剖面中, 较老有机质的δ13 C值比表层剖面高出1‰~3‰。可能的原因有:陆地Suess效应(Ehleringer et al., 2000), 即工业革命以来, 大量化石燃料燃烧进入空气, 同时化石燃料贫13 C, 导致大气δ13 C值降低, 从而使得输入到植物-土壤系统的δ13 C值也降低。所以形成较早的深层土壤有机质富集13 C, 新形成的表层土壤则贫13 C;微生物分解作用(Macko and Estep, 1984), 微生物在利用植物的枯枝落叶这个过程中, 总是先分解较轻(贫13 C)的碳源, 导致12 C被分解进入空气中, 从而使残余有机质中δ13 C值逐渐升高。深层有机质通常降解比较彻底, 导致下层土壤有机质δ13 C偏正;地下与地表生物量富集13 C程度不同(朱书法等, 2006), 通常根等地下生物量比叶片等地表生物更富集13 C, 地下生物量与地面生物量δ13 C值的平均差异最大值约为1.5‰, 例如小麦的根片δ13 C值为-27.79‰、茎片为-28.47‰、而叶片为-29.61‰(Lichtfouse et al., 1995a);细菌和真菌残体残体作用(朱书法等, 2006), 羧化作用使细菌和真菌固定的有机碳化合物富集13 C, 即细菌和真菌的δ13 C值高于它们食物源的δ13 C值。随着时间的推移, 土壤中含有的细菌及真菌残体增多, 导致土壤有机质δ13 C值升高, 即下层埋藏较久的有机质13 C偏正。另外, 研究发现(于水强, 2003;张晋京等, 2004)土壤表层或者是高氧状态下有利于胡敏酸的形成, 下层有利于FA积累。而δ13 C值有δ13CFA>δ13CHA(陈骏和王鹤年, 2004), 这也将导致δ13 C值随剖面的加深而偏正。
2.2 黄壤全样有机质与相应胡敏酸δ13 C分析结果(表 1)表明, 黄壤剖面上中层的δ13 C值均大于其胡敏酸样品, 尤以表层最为明显, 相差1.31‰, 而下层几乎完全吻合。有机质与对应胡敏酸δ13 C相差分别为:1.31‰、0.36‰和0。这与Lichtfouse等(1995b)的研究结果一致, 且有机质δ13 C值比相应胡敏酸的δ13 C值高出1.2‰。窦森等(1995)在研究中也发现全土有机质δ13 C值大于对应胡敏酸。
腐殖质的形成目前尚无定论, 如木质素起源说和多阶段腐殖化-多酚氧化聚合学说等(Page, 1932;Wakesman, 1936;Kononova, 1966;Balogh et al., 2006)。木质素起源说认为, 木质化组织在土壤中发生变化形成腐殖质, 首先形成相对分子量较大的HM或HA, 然后HM或HA在微生物作用下分裂成分子量较小的FA, 最后矿化成CO2和H2O。多酚学说认为微生物将枯枝落叶降解成酚类和氨基酸类, 然后经化学氧化和聚合形成腐殖质。这一过程认为最先生成的是相对分子量较小的FA, 然后FA进一步缩合为HA和HM。不同学说认定的腐殖质组分形成的顺序不同, 木质素起源说认为是先形成HA, 然后由HA分解形成FA, 而多酚理论则认为先形成FA, 然后由FA聚合形成HA。也有观点认为腐殖质各组分之间没有一定的形成顺序, 认为HA与FA只是腐殖质不同的表现形式, FA既可以作为HA的降解产物, 也可以作为HA的起始产物。而FA可以视为原始蛋白质——碳水化合物与腐殖酸之间的过渡产物, 高O2浓度能促使FA进一步的缩聚形成胡敏酸和腐黑物。有机质在形成胡敏酸的过程当中, 不管是先形成HA, 然后分解形成FA, 又或者先形成FA, 再缩合形成HA, 都存在着缩合作用, 缩合作用会导致重CO2损失(陈骏和王鹤年, 2004), 使形成的胡敏酸δ13 C值偏负。Park andEpstein(1960)认为胡敏酸的δ13 C值较低, 可能是由于木质素贫13 C。
分析结果显示, 全土有机质δ13 C值大于相应的胡敏酸, 说明二者成分不同, 全土有机质中含更多的富集13 C的化合物, 而胡敏酸中则含较多贫13 C的成分;有机质在形成胡敏酸的过程当中, 存在着缩合作用, 导致重CO2的损失, 使得δ13 C值偏负。
2.3 黄壤胡敏酸超滤组分δ13 C值变化分析结果(表 1)表明, 黄壤超滤组分δ13 C值随分子量的减少而偏正(图 1)。胡敏酸超滤组Y1F1(MW>500 K)δ13 C值低于胡敏酸全样δ13 C值, Y1F2(300 K<MW<500 K)的δ13 C值最接近胡敏酸的δ13 C值, 之后随着分子量的减少, 胡敏酸超滤组分的δ13 C值大于胡敏酸全样。说明分子量在300 K~500 K的胡敏酸与胡敏酸全样组成最为接近。由胡敏酸超滤组分含量及δ13 C值计算出总HA的δ13 C值为-22.78‰, 与实验测量值(-22.78‰)相同, 说明超滤过程可能不会改变土壤有机质δ13 C的组成。
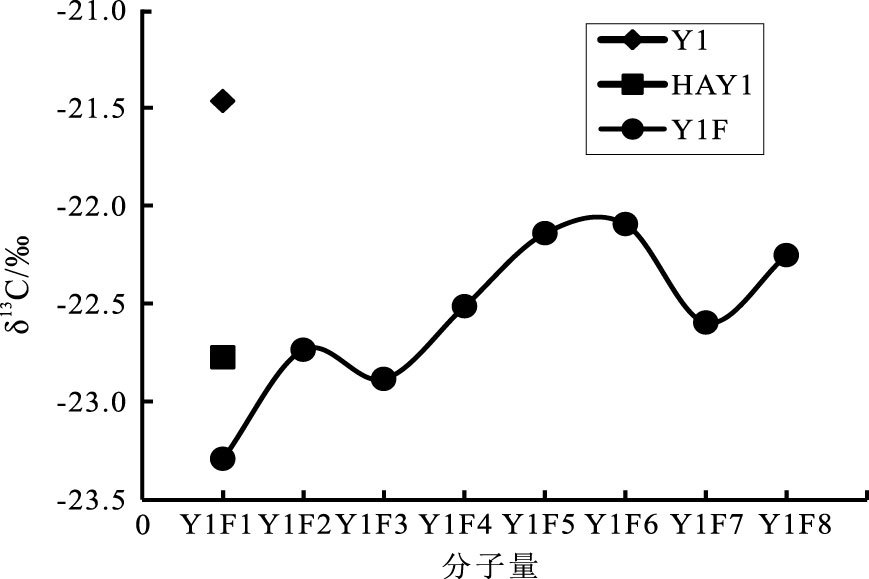
|
Y1F1表示胡敏酸分子量MW>500 K, 依次Y1F2为300 K<MW<500 K, Y1F3为100 K<MW<300 K, Y1F4为50 K<MW<100 K, Y1F5为30 K<MW<50 K, Y1F6为10 K<MW <30 K, Y1F7为5 K<MW<10 K, Y1F8为MW<5 K 图 1 黄壤胡敏酸超滤组分δ13 C值随分子量的变化 Figure 1 Variation of δ13 C values with molecular weight of HA UF in yellow soil |
李丽等(2004)研究表明, 相对分子量较低的胡敏酸中含有较多的木本植物来源的芳香结构, 而相对分子量较高的胡敏酸中含较多的微生物和植物来源的聚脂肪结构。刘新超等(2009)也发现分子量较低的胡敏酸中含较多氧和木质素来源的芳香烃结构, 分子量较大的胡敏酸中含较多碳和来源于生物的聚酯纺结构。各种物质对13 C的富集程度不同, 导致δ13 C值组成差异。黄壤超滤组分δ13 C值随分子量的减少而偏正说明, 分子量较小的胡敏酸中含富13 C组分较多, 分子量较大胡敏酸中含贫13 C组分较多。根据腐殖质多酚与氨基化合物氧化聚合学说, 土壤有机质的腐殖化可以大致概括为3个过程(Swift et al., 1970): ①有机残体的降解, 包括木质素、纤维素、蛋白质等大分子的降解;②降解碎片的氧化聚合形成腐殖质;③腐殖质本身的氧化分解。首先, 在过程①中, 表层较易降解的化合物如纤维素、蛋白质被降解为更小分子的多糖及多肽, 木质素也被不同程度的降解形成不同降解程度的木质素碎片。然后木质素碎片在表层与糖类等物质聚合形成分子量较大的胡敏酸。同时小分子物质由上层迁移到下层发生氧化聚合, 形成分子量较小的胡敏酸。比较而言, 分子量较大的胡敏酸中, 由于木质素部分含量较高, 且木质素贫13 C, 所以形成的胡敏酸δ13 C值偏低。
3 结论影响土壤中稳定碳同位素组成的因素很多, 包括环境效应、植被类型和土壤质地等。笔者的研究表明, 中国西南喀斯特地区黄壤中有机质δ13 C值随剖面深度的增加有偏正的趋势, 这是由于土壤本身的降解过程及其所处环境等多方面因素综合作用的结果;黄壤全样有机质的δ13 C值高于相应的胡敏酸, 这可能是由于胡敏酸的形成过程所导致。随着胡敏酸分子量的减少, δ13 C值偏正, 说明分子量较低的胡敏酸中可能含更多富集13 C的组分, 而分子量较高胡敏酸中可能含更多贫13 C组分。
| [] | Balesdent J, Girardin C, Mariotti A. 1993. Site-Related δ13C of tree leaves and soil organic matter in a temperate forest. Ecology , 74 (6) : 1713–1721. DOI:10.2307/1939930 |
| [] | Balogh K V, Présing M, Vörös L, Tóth N. 2006. A study of the decomposition of reed(Phragmites australis)as a possible source of aquatic humic substances by measuring the natural abundance of stable carbon isotopes. International Review of Hydrobiology , 91 (1) : 15–28. DOI:10.1002/(ISSN)1522-2632 |
| [] | Boutton T W, Archer S R, Midwood A J, Zitzer S F, Bol R. 1998. δ13C values of soil organic carbon and their use in documenting vegetation change in a subtropical savanna ecosystem. Geoderma , 82 (1-3) : 5–41. DOI:10.1016/S0016-7061(97)00095-5 |
| [] | Ehleringer J R, Buchmann N, Flanagan L B. 2000. Carbon isotope ratios in belowground carbon cycle processes. Ecological Applications , 10 (2) : 412–422. DOI:10.1890/1051-0761(2000)010[0412:CIRIBC]2.0.CO;2 |
| [] | Feng X H. 2002. A theoretical analysis of carbon isotope evolution of decomposing plant litters and soil organic matter. Global Biogeochemical Cycles , 16 (4) : 66–1. |
| [] | Heidorn C M, Wedin D, Lollar B S. 1995. Soil organic matter dynamics in eutrophied grasslands:An application of stable carbon isotope analysis. Bulletin of the Ecological Society of America , 76 : 114. |
| [] | Kinniburgh D G, van Riemsdijk W H, Koopal L K, Benedetti M F. 1998. Chapter 23-Ion binding to humic substances:Measurements, models, and mechanisms. In:Jenne E A(ed). Adsorption of Metals by Geomedia:Variables, Mechanisms, and Model Applications. New York:Academic Press, 483-520 |
| [] | Kononova M M. 1966. Soil organic matter. New York: Pergamon, Elmsford . |
| [] | Krull E G, Bray S S. 2005. Assessment of vegetation change and landscape variability by using stable carbon isotopes of soil organic matter. Australian Journal of Botany , 53 (7) : 651–661. DOI:10.1071/BT04124 |
| [] | Krull E S, Bestland E A, Gates W P. 2002. Soil organic matter decomposition and turnover in a tropical Ultisol:Evidence from delta(super 13) C, delta(super 15) N and geochemistry. Radiocarbon , 44 (1) : 93–112. DOI:10.1017/S0033822200064705 |
| [] | Li T Y, Wang S J. 2001. Application of carbon isotope for discriminating sources of soil CO2 in karst area, Guizhou. Science in China Series E:Technological Sciences , 44 (S1) : 134–137. DOI:10.1007/BF02916804 |
| [] | Lichtfouse É, Dou S, Girardin C, Grably M, Balesdent J, Behar F, Vandenbroucke M. 1995a. Unexpected C-13-enrichment of organic components from wheat crop soils:Evidence for the in situ origin of soil organic matter. Organic Geochemistry , 23 (9) : 865–868. DOI:10.1016/0146-6380(95)80009-G |
| [] | Lichtfouse É, Dou S, Houot S, Barriuso E. 1995b. Isotope evidence for soil organic carbon pools with distinct turnover rates-Ⅱ. Humic substances. Organic Geochemistry , 23 (9) : 845–847. DOI:10.1016/0146-6380(95)80005-C |
| [] | Macko S A, Estep M L F. 1984. Microbial alteration of stable nitrogen and carbon isotopic compositions of organic matter. Organic Geochemistry , 6 : 787–790. DOI:10.1016/0146-6380(84)90100-1 |
| [] | Mariotti A, Pierre D, Vedy J C, Bruckert S, Guillemot J. 1980. The abundance of natural nitrogen 15 in the organic matter of soils along an altitudinal gradient(Chablais, Haute Savoie, France). Catena , 7 (1) : 293–300. DOI:10.1016/S0341-8162(80)80020-8 |
| [] | Natelhoffer K J, Fry B. 1988. Controls on natural nitrogen-15 and carbon-13 abundances in forest soil organic matter. Soil Science Society of America Journal , 52 (6) : 1633–1640. DOI:10.2136/sssaj1988.03615995005200060024x |
| [] | Page H J. 1932. Studies on the carbon and nitrogen cycles in the soil. V. The origin of the humic matter of the soil. The Journal of Agricultural Science , 22 (2) : 291–296. |
| [] | Park R, Epstein S. 1960. Carbon isotope fractionation during photosynthesis. Geochimica et Cosmochimica Acta , 21 (1-2) : 110–126. DOI:10.1016/S0016-7037(60)80006-3 |
| [] | Pessenda L C R, Aravena R, Melfi A J, Telles E C C, Boulet R, Valencia E P E, Tomazello M. 1996. The use of carbon isotopes(13C, 14C)in soil to evaluate vegetation changes during the Holocene in Central Brazil. Radiocarbon , 38 (2) : 191–201. DOI:10.1017/S0033822200017562 |
| [] | Pessenda L R, Valencia E E. 1996. Natural radio carbon measurements in Brazilian soils developed on basic rocks. Radiocarbon , 38 (2) : 203–208. DOI:10.1017/S0033822200017574 |
| [] | Piccolo A. 2002. The supramolecular structure of humic substances:A novel understanding of humus chemistry and implications in soil science. Advances in Agronomy 75, 57-134. |
| [] | Stevenson F J. 1994. Humus chemistry. New York: Wiley . |
| [] | Swift R S, Thornton B K, Posner A M. 1970. Spectral characteristics of a humic acid fractionated with respect to molecular weight using an agar gel. Soil Science , 110 (2) : 93–99. DOI:10.1097/00010694-197008000-00003 |
| [] | Turekian V C, Macko S, Ballentine D, Swap R J, Garstang M. 1998. Causes of bulk carbon and nitrogen isotopic fractionations in the products of vegetation burns:Laboratory studies. Chemical Geology , 152 (1-2) : 181–192. DOI:10.1016/S0009-2541(98)00105-3 |
| [] | Victoria R L, Fernandes F, Martinelli L A, Piccolo M D C, Decamargo P B, Trumbore S. 1995. Past vegetation changes in the brazilian pantanal arboreal grassy savanna ecotone by using carbon isotopes in the soil organic-matter. Global Change Biology , 1 (3) : 165–171. DOI:10.1111/gcb.1995.1.issue-3 |
| [] | Wakesman S A. 1936. Humus. MD: Williams and Wilkins . |
| [] | Yonekura Y, Ohta S, Kiyono Y, Aksa D, Morisada K, Tanaka N, Tayasu I. 2013. Soil organic matter dynamics in density and particle-size fractions following destruction of tropical rainforest and the subsequent establishment of Imperata grassland in Indonesian Borneo using stable carbon isotopes. Plant and Soil , 372 (1-2) : 683–699. DOI:10.1007/s11104-013-1763-4 |
| [] | 陈骏, 王鹤年. 2004. 地球化学. 北京: 科学出版社 . |
| [] | 陈庆强, 沈承德, 孙彦敏, 彭少麟, 易惟熙, 李志安, 姜漫涛. 2005. 鼎湖山土壤有机质δ13C时空分异机制. 应用生态学报 , 16 (3) : 469–474. |
| [] | 窦森, LichtofouseE, MariiottiA. 1995. C3和C4植物条件下土壤HA的水解、热解和GC-MS·δ13C、δ15N研究. 土壤通报 , 26 (6) : 271–273. |
| [] | 窦森, TardyY, 张晋京, 李凯, 于水强, 平立凤, 关松, 候素艳, 林学巍, 高娴. 2010. 土壤胡敏酸与富里酸热力学稳定性及其驱动因素初步研究. 土壤学报 : 71–76. |
| [] | 窦森, 关松, 李凯. 2009. 土壤团聚体中有机质研究进展. 见:2009土壤资源持续利用与生态环境安全学术研讨会. 广州:中国土壤学会 |
| [] | 李丽, 冉勇, 傅家谟, 盛国英, 彭平安. 2004. 超滤分级研究腐殖酸的结构组成. 地球化学 , 33 (4) : 387–394. |
| [] | 李龙波, 刘涛泽, 李晓东, 刘文景, 刘丛强. 2012. 贵州喀斯特地区典型土壤有机碳垂直分布特征及其同位素组成. 生态学杂志 , 31 (2) : 241–247. |
| [] | 刘丛强, 郎赟超, 李思亮, 朴何春, 涂成龙, 刘涛泽, 张伟, 朱书法. 2009. 喀斯特生态系统生物地球化学过程与物质循环研究:重要性、现状与趋势. 地学前缘 , 16 (6) : 1–12. |
| [] | 刘涛泽, 刘丛强, 张伟, 涂成龙. 2008. 喀斯特地区坡地土壤有机碳的分布特征和δ13C值组成差异. 水土保持学报 , 22 (5) : 115–118. |
| [] | 刘新超, 李俊, 谢丽, 何小娟, 栾富波, 周琪. 2009. 腐殖酸表征方法研究进展. 净水技术 , 28 (3) : 6–9. |
| [] | 马连刚. 2014. 中国西南喀斯特地区典型土壤/泥炭剖面胡敏酸分子特征及演化研究. 硕士学位论文. 贵阳:中国科学院地球化学研究所, 118 |
| [] | 朴河春, 刘启明, 余登利, 郭景恒, 冉景丞. 2001. 用天然13C丰度法评估贵州茂兰喀斯特森林区玉米地土壤中有机碳的来源. 生态学报 , 21 (3) : 434–439. |
| [] | 朴河春, 余登利, 刘启明, 郭景恒, 冉景丞. 2000. 林地变为玉米地后土壤轻质部分有机碳的13C/12C比值的变化. 土壤与环境 , 9 (3) : 218–222. |
| [] | 王世杰. 2003. 喀斯特石漠化——中国西南最严重的生态地质环境问题. 矿物岩石地球化学通报 , 22 (2) : 120–126. |
| [] | 于水强. 2003. CO2和O2浓度对土壤腐殖质形成与转化的影响. 硕士学位论文. 长春:吉林农业大学 |
| [] | 袁红朝, 李春勇, 简燕, 耿梅梅, 许丽卫, 王久荣. 2014. 稳定同位素分析技术在农田生态系统土壤碳循环中的应用. 同位素 , 27 (3) : 170–178. |
| [] | 张晋京, 窦森, 李翠兰, 王淑华. 2004. 土壤腐殖质分组研究. 土壤通报 , 35 (6) : 706–709. |
| [] | 张平中, 王先彬, 王苏民, 沈永平, 刘光秀, 羊向东, 薛滨, 吴锡浩. 1998. 江西九江地区晚更新世生态变迁的土壤有机质碳同位素证据. 冰川冻土 , 20 (2) : 54–60. |
| [] | 朱书法, 刘丛强, 陶发祥, 王中良, 朴河春. 2006. 喀斯特地区土壤有机质的稳定碳同位素地球化学特征. 地球与环境 , 34 (3) : 51–58. |
| [] | 朱书法, 刘丛强, 陶发祥, 王中良, 朴河春. 2007. 贵州喀斯特地区棕色石灰土与黄壤有机质剖面分布及稳定碳同位素组成差异. 土壤学报 , 44 (1) : 169–173. |
 2017, Vol. 36
2017, Vol. 36


