地球形成至今约有46亿年历史, 微生物进程对地球产生影响可以追溯到38.5~36亿年前的太古宙时期(Schidlowski, 1988; Hazen et al., 2008)。微生物与矿物在广泛的空间分布与漫长的历史时期中, 微生物诱导形成矿物、微生物参与下矿物分解、微生物影响矿物晶体结构转化及微生物氧化还原矿物的协同作用等(Dong, 2010; Dong and Lu, 2012)都伴随电子转移过程。矿物与微生物间电子转移更被认为是地表关键带系统中最为重要的地球化学过程之一(Lu et al., 2012)。特别是伴随胞外呼吸作用(Lovley, 2008)的发现, Geobacter, Shewanella等异化铁金属还原菌(Lovley et al., 2004;Weber et al., 2006)胞外电子传递进程及传递机制近年来引起了各界学者广泛关注(Lovley, 2006;Kotloski and Gralnick, 2013; Pirbadian et al., 2014)。虽然铁锰氧化物作为异化铁金属还原菌胞外电子受体已经得到广泛认可, 然而自然环境中铁锰矿物作为电子受体时对微生物产生的影响尚不清晰;且现阶段研究聚焦于矿物-微生物原位接触, 对除胞外分泌物作用外的胞外电子影响作用研究较少。中国南方红壤中, 赤铁矿、针铁矿、水钠锰矿等铁锰矿物广泛存在(鲁安怀, 2003), 其中可能蕴含着复杂的矿物-微生物电子流动关系网络, 探究其电子流动进程是矿物-微生物交互作用研究重要问题之一。电化学技术适用于表征矿物氧化还原特性并模拟微生物还原金属氧化物矿物过程。同时, 通过基于化学原电池原理构建的双室反应体系, 可表征研究对象间的电子转移过程。此体系在能源、环保、微生物燃料电池、生物电反应器等诸多研究领域都得到了广泛应用(Logan et al., 2006;丁竑瑞等, 2009, 2011)。籍由构建微生物氧化有机物底物为阳极反应, 矿物还原为阴极反应的双室研究体系, 宏观展现矿物-微生物氧化还原反应, 结合电化学技术模拟并解析微生物与矿物各自端元所发生的电子转移过程。
本文运用双室红壤微生物-天然赤铁矿矿物研究体系, 模拟与表征了天然赤铁矿原矿在微生物还原作用下的氧化还原特性, 证明自然红壤环境中铁氧化物能够有效参与并明显促进微生物胞外电子传递。电化学实验分析了赤铁矿促进微生物胞外电子转移机制, 完善了天然红壤微生物与生境中铁氧化物矿物交互作用机制及其研究方法。
1 实验材料和方法 1.1 微生物培养及实验条件实验所使用微生物为无菌操作采集的表层红壤原始微生物群落样品。实地考察长沙和海口两地郊区人为活动影响较少地段, 以无菌工具除去地表较大砾石, 多点采取重量近似的土壤装袋混匀。采集到的红壤微生物经活化富集后用于实验, 所用培养基为自配乙酸水溶液, 成分为: 8 g/L无水乙酸钠、10.31 g/L Na2HPO4· 12H2O、3.31 g/L NaH2PO4·2H2O、0.31 g/L NH4Cl、0.13 g/L KCl、0.5 g/L酵母粉, 调节pH值约为7.0。红壤与培养基按照1 : 10(质量:体积)接种活化3天, 再以20%(体积比)接种富集培养1周后用于后续实验。
实验所用试剂均为分析纯, 购自北京化工厂。溶液均使用18 MΩ去离子水配置, 所有实验在恒温生化培养箱(LRH-250)中进行, 温度为30±0.5℃。
1.2 天然赤铁矿表征与分析天然赤铁矿采集自河北石家庄灵寿县, 矿粉研磨后过400目筛进行矿物学表征及电极制备。样品物相分析使用北京大学分析测试中心X射线粉晶衍射仪(Rigaku Dmax-2400)测定, 测试电压40 kV, 电流100 mA, X射线源为Cu靶的Kα1(λ=0.15406 nm)射线, 步长0.02°, 扫描速度4 °/min, 扫描范围3°~75°。
赤铁矿样品拉曼光谱使用北京大学地球与空间科学学院仪器测试中心显微共焦激光拉曼光谱仪(Renishaw inVia Reflex, UK)采集, 400目粉末样品压实于有机玻璃板凹槽中, 使用50×物镜采集信号。激光波长为532 nm、激光强度50%、束斑直径约1 μm、光栅2400刻线、单次曝光10 s、累计5次。
溶液中Fe2+及总铁离子含量采用邻菲罗啉比色法(Stookey, 1970), 使用紫外可见分光光度计(Evolution 220, Thermo Scientific)测定510 nm处吸光度计算得出。
1.3 胞外电子实验体系构建实验装置为H型双室玻璃反应器, 两室容积均为135 mL, 中间以直径4 cm质子交换膜(PEM, Dupont, USA)分隔。质子交换膜使用前依次经30% H2O2煮沸1 h、去离子水超声清洗10 min、1 mol/L硫酸浸泡1 h处理;阳极、阴极电极分别为梳状、板状石墨电极(上海弘枫石墨制品有限公司), 外尺寸均为7.5 cm×3.5 cm×0.5 cm, 石墨电极依次经1 mol/L HCl、1 mol/L NaOH浸泡1 h并超声清洗;实验装置整体装配完毕后于121℃灭菌20 min。阳极室分别按10%接种量向自配乙酸水培养基中接入长沙、海口的红壤富集液, 磁力搅拌24 h使体系混合均匀, 体系初始pH值分别约为6.1、6.3;阴极室加入120 mL 0.1 mol/L KCl溶液, 使用空气泵持续低速鼓入空气。
阴极赤铁矿石墨电极制作方法: 准确称取0.04 g天然赤铁矿, 加入4 mL无水乙醇稀释, 超声分散5 min, 加入20 μL Nafion乳液(Dupont, USA)再次超声分散5 min混合均匀, 玻璃棒均匀涂布于板状石墨电极的两面, 自然晾干10 h后用于实验。
1.4 电学参数测试及电化学技术表征实验装置阳极与阴极间连接变阻箱作为外负载, 使用数据记录仪(ADC-16, Pico Technologies Limited, UK)实时监测负载电压, 通过调节负载阻值获得体系电流、电压相关电学参数, 进而计算长沙、海口体系极化曲线及功率密度曲线。分别由UT33B型数字万用表测定阴阳两极相对于饱和甘汞电极(0.245 V vs. 标准氢电极;NHE)的电压, 记录电极电势。本文中电势除特别说明为均为相对于饱和甘汞电极的电极电势。
电化学实验采用三电极体系, 对电极为213型铂电极、参比电极为232型饱和甘汞电极、工作电极为涂布赤铁矿的FTO(Fluorine-doped Tin Oxide, 氟掺杂氧化锡)电极, 溶液介质为1 mol/L KCl溶液。赤铁矿FTO电极制备方法: FTO依次经过丙酮、无水乙醇、去离子水超声清洗30 min(Hsu et al., 2012), 干燥后在导电侧均匀滴加含有400 μL无水乙醇、50 mg 400目赤铁矿粉、10 μL Nafion的超声分散溶液, 自然晾干10 h后用于电化学测试(CHI 760E电化学工作站, 上海辰华仪器有限公司)。
循环伏安测试: 扫描速度10 mV/s, 扫描范围0~1.0 V, 初始扫描方向负向。电化学阻抗谱(EIS)测试: 频率范围0.1 Hz~100 kHz, 电位设定为工作电极的开路电极电势(OCP)及1/2 OCP, 信号振幅5 mV, 测试完毕使用电化学工作站自带软件按单一时间常数模型(OTCM)对体系结果进行等效电路拟合求解各电学原件参数。
2 结果与讨论 2.1 赤铁矿物相鉴定天然赤铁矿样品XRD分析(图 1)确定主要矿物相为赤铁矿(Fe2O3)、石英(SiO2), XRD图谱24.14°、33.15°、35.61°、54.1°分别对应赤铁矿(012)、(104)、(110)、(116)4个特征衍射晶面(PCPDF: 33-0664);20.86°、26.64°、50.13°分别对应石英(100)、(101)、(112)3个特征衍射晶面(PCPDF: 46-1045)。
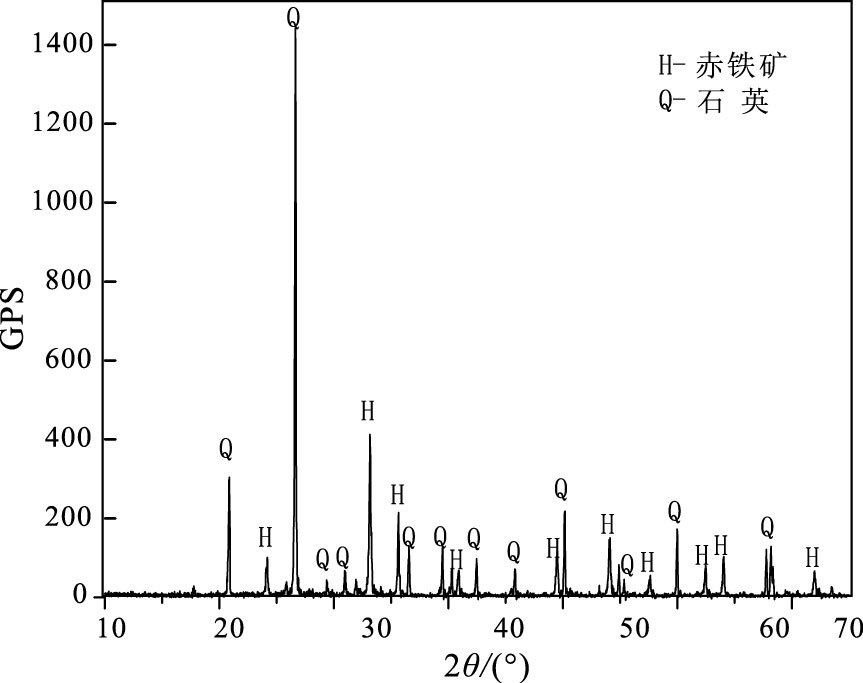
|
图 1 天然赤铁矿样品XRD图谱 Figure 1 The XRD spectrum of natural hematite sample |
α-Fe2O3属于三方晶系, 其拉曼活性主要包括2个A1g振动模式(225, 498 cm-1)和5个Eg振动模式(247, 293, 299, 412, 613 cm-1)(de Faria et al., 1997;Cesar et al., 2006)。天然赤铁矿样品拉曼谱图与之吻合, 证明其成分主要为α-Fe2O3。实验装置中微生物胞外电子作用后的赤铁矿未出现新峰, 说明未有新物相出现;但半峰宽较原始样品增加近两倍(图 2), 推测胞外电子作用下赤铁矿结晶程度有所降低。
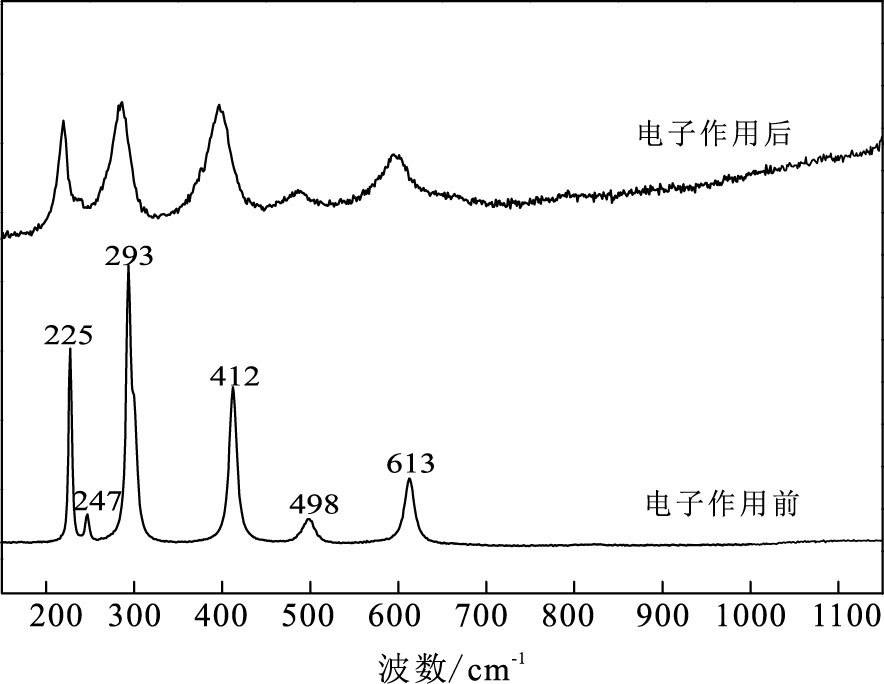
|
图 2 赤铁矿样品Raman图谱 Figure 2 The Raman spectrum of hematite sample |
根据体系实测电流-电压数据(Logan et al., 2006)绘制极化曲线与功率密度曲线(图 3)。经拟合计算发现: 阴极石墨板涂布赤铁矿后, 长沙、海口两红壤反应体系开路电压显著提升约100 mV(表 1), 长沙反应体系开路电压提升120%, 最大输出功率增加至原体系195%;海口红壤反应体系开路电压提升128%, 最大输出功率增加至原体系152%, 但两体系内阻变化较小, 推测内阻主要由装置本身所决定, 在反应体系未调整情况下变化不显著。
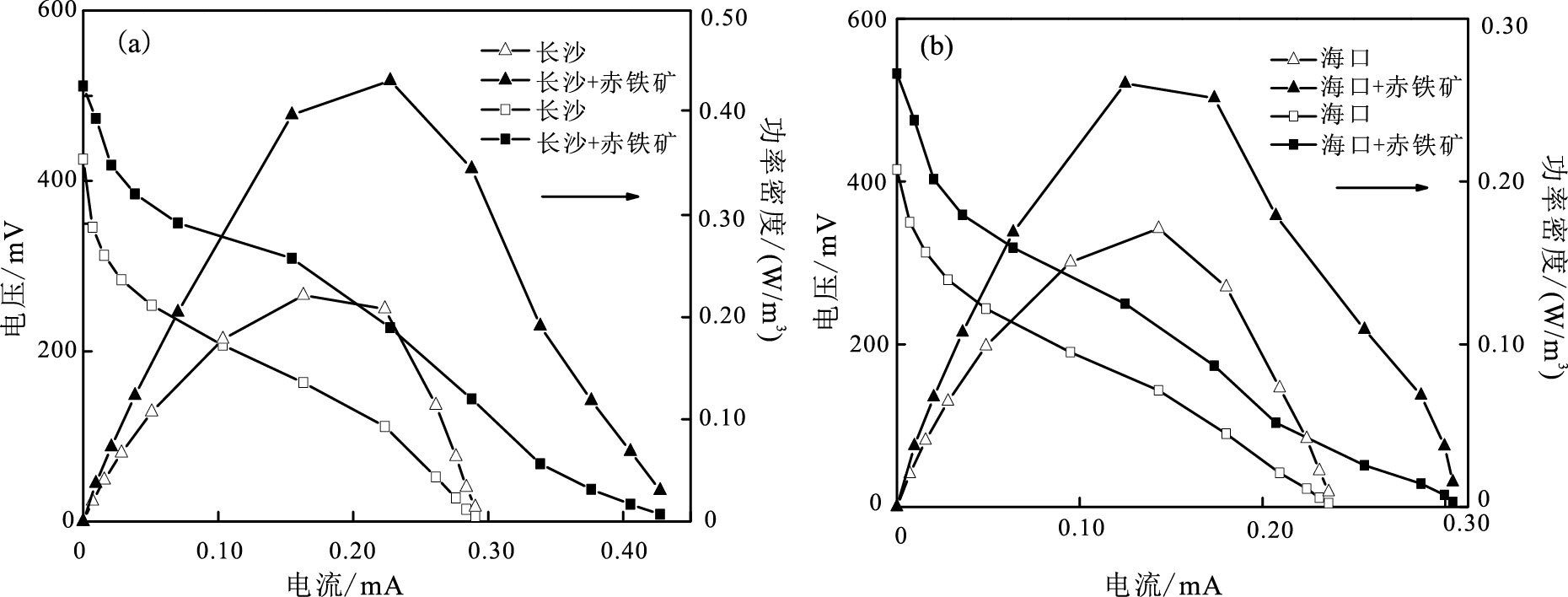
|
图 3 极化曲线与功率密度曲线:(a)长沙红壤体系;(b)海口红壤体系 Figure 3 Polarization curves and power density curves:(a)Changsha red soil system;(b)Haikou red soil system |
|
|
表 1 反应体系电子转移过程电学参数 Table 1 The electrical parameters of electron transfer in reaction systems |
长沙、海口实验体系阴阳两极电势-电流曲线变化趋势较为一致(图 4), 赤铁矿与空气共同作为阴极终端电子受体时长沙反应体系阴极电极电势提升约120 mV, 海口反应体系阴极电极电势提升约90 mV, 且不同负载条件下始终维持稳定状态;阳极电极电势相对稳定, 减小10~20 mV, 由电池电动势E0=E阴极-E阳极可知电池总电动势的提升为阴阳两极共同作用结果, 且阴极贡献更大。分析长沙、海口红壤体系, 在氧气为电子受体时, 体系的极限电流分别为0.29、0.23 mA, 引入赤铁矿后体系极限电流突破至0.43、0.31 mA, 且阳极电势有所降低, 说明更多的微生物胞外电子自阳极传出, 认为其代谢活动得以增强。实验结果表明赤铁矿协同氧气作为阴极终端电子受体时可显著提升阴极电极电势, 并一定程度上降低阳极电势, 从而提升体系输出电压。
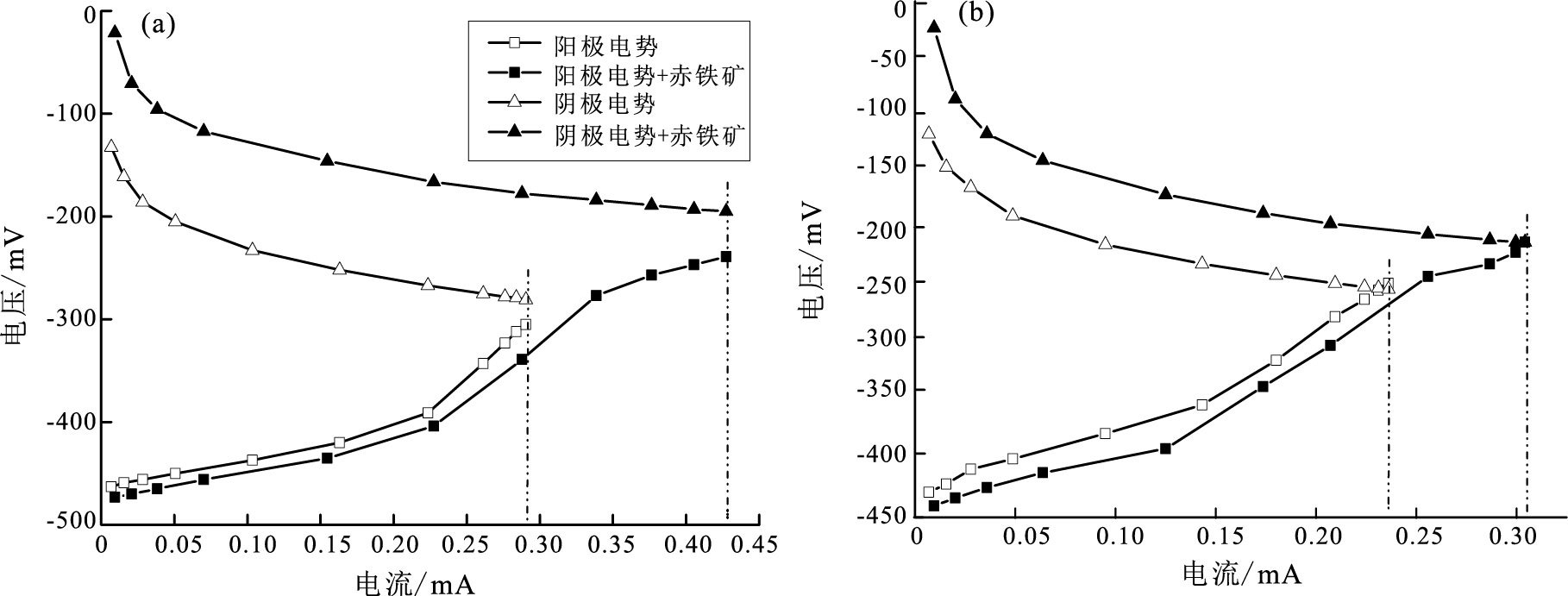
|
图 4 电极电势-电流曲线:(a)长沙红壤体系;(b)海口红壤体系 Figure 4 Electrode potential versus elctric current curves:(a)Changsha red soil system;(b)Haikou red soil system |
双室电学研究结果表明赤铁矿作为电子受体时, 阴极电极电势显著提升约100 mV(图 4), 为明确赤铁矿对阴极电极的影响情况以及作用机理, 分别对空白FTO和赤铁矿FTO电极进行电化学循环伏安测试(图 5)。实验发现空白FTO在0.82 V附近位置出现氧气还原峰;赤铁矿FTO电极在0.55、0.43 V位置出现新的一对氧化还原峰, 氧化还原反应电势位于0.49 V, 推断其为Fe(Ⅱ)/Fe(Ⅲ)氧化还原反应(迪安, 1991;White and Peterson, 1996)。本文长沙、海口红壤体系微生物阳极电势分别为-0.45、-0.4 V, 与前人报道中乙酸盐微生物燃料电池阳极电势、Shewanella核黄素, Geobacteracea生物膜细胞色素c蛋白等胞外电子传递相关反应的氧化还原电势一致(Madigan and Martinko, 2006;Marsili et al., 2008; Richter et al., 2009)。赤铁矿FTO电极在0.43 V位置的Fe(Ⅲ)还原峰说明赤铁矿可接收微生物胞外电子, 同时0.55 V位置的Fe(Ⅱ)氧化峰说明其可被溶解氧氧化, Fe(Ⅱ)/Fe(Ⅲ)氧化还原反应电势介于微生物与氧气之间, 极可能作为循环介体参与了胞外电子传递过程。为验证实验体系中赤铁矿是否可能为胞外电子还原并释放铁离子, 使用邻菲罗啉分光光度法连续检测7天内阴极室溶液铁离子含量, 结果未检出任何价态溶解性铁, 证实胞外电子作用下赤铁矿并未以离子形式大量释放。且赤铁矿FTO电极较空白FTO电流值有所提升, 说明赤铁矿在环境中参与电子传递过程较为活跃。
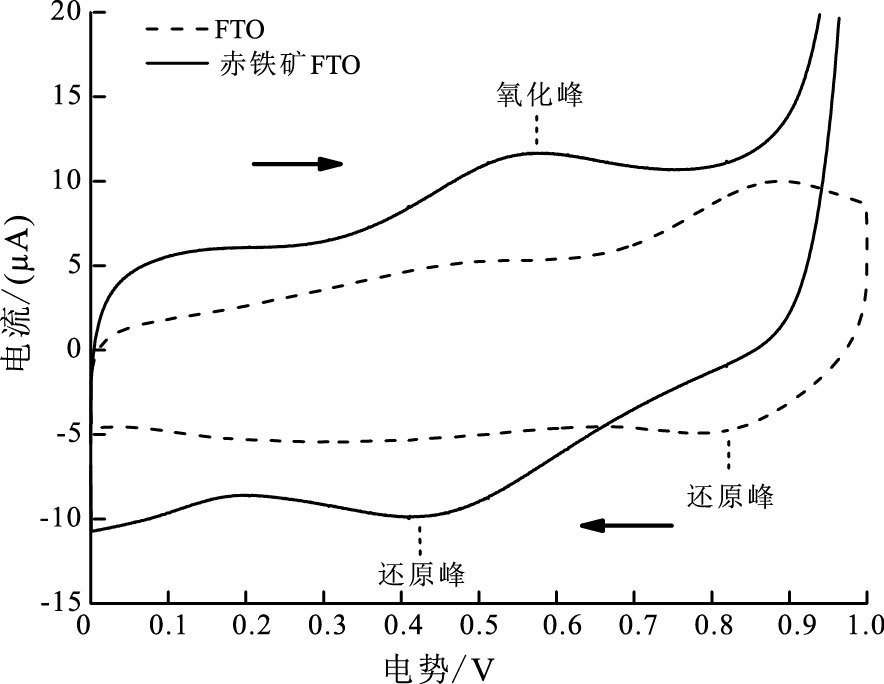
|
图 5 赤铁矿电极循环伏安曲线 Figure 5 Cyclic voltammetry curves of hematite electrodes |
电化学阻抗谱(EIS)定量分析赤铁矿参与电子传递作用机理(图 6), 传质电阻Rs主要反映体系欧姆性质内阻, 其受体系自身结构影响较大因此FTO上赤铁矿存在与否影响不显著;极化内阻Rp正相关于电极界面反应过电势, 因此Rp可体现电极反应发生难易程度(Giorgi et al., 1998)。单一时间常数模型拟合结果(表 2)显示, 在开路电位及半开路电位电势下, FTO涂布赤铁矿前后体系极化内阻Rp分别从44840、44890 Ω降至665.2、547.7 Ω, 降幅高达98.5%、98.7%, 证明赤铁矿的存在降低了电极表面反应过电势, 在动力学上加快反应进程, 有利于微生物胞外电子在阴极的传递过程, 并最终促进整体电子转移。
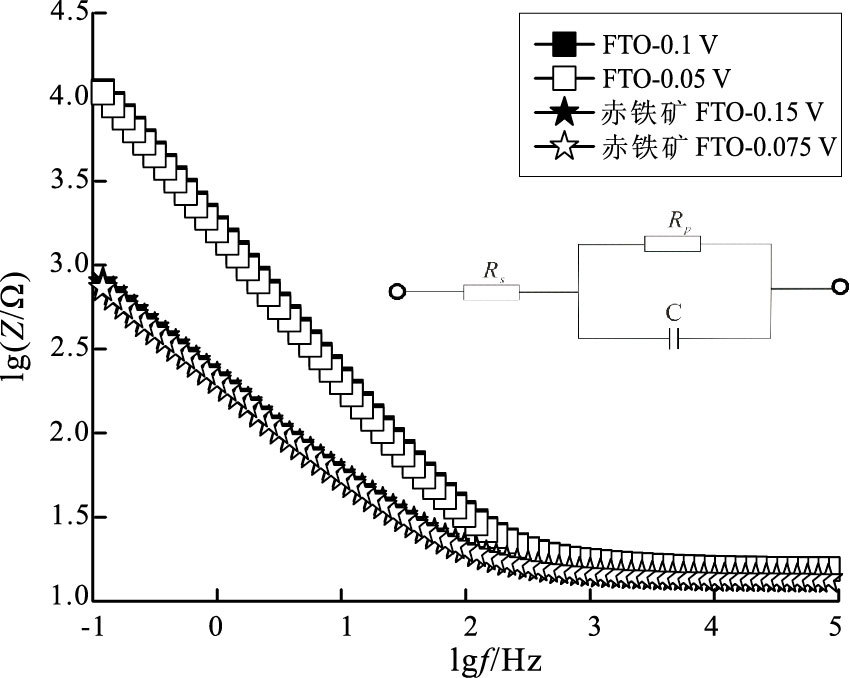
|
图 6 FTO/赤铁矿EIS参数拟合结果 Figure 6 Fitting results of EIS for FTO/hematite electrodes |
|
|
表 2 赤铁矿电极EIS拟合参数 Table 2 EIS fitting parameters of hematite electrodes (uncoated FTO as control) |
综合微生物胞外电子作用前后赤铁矿矿物学分析及体系铁离子浓度测试结果, 认为赤铁矿促进胞外电子传递过程中并非发生简单的矿物还原释放Fe2+作用, 结合天然赤铁矿电化学特性, 认为其电子传递机制为(图 7): 赤铁矿和氧气共同作为微生物终端电子受体时, Fe(Ⅱ)/Fe(Ⅲ)氧化还原反应电势介于微生物与氧气之间, 因此赤铁矿晶格中Fe(Ⅲ)可接收来自阳极微生物的胞外电子发生还原反应并最终将电子传递至阴极溶解氧, 通过引入新的氧化还原反应促进胞外电子传递;同时赤铁矿可显著降低电极表面反应过电势, 在动力学层面上加速电子转移过程, 两者共同作用提升阴极电势电极并加速阳极微生物电子流动速率, 从而使得赤铁矿能够有效参与微生物胞外电子转移并对其具有明显的促进作用。
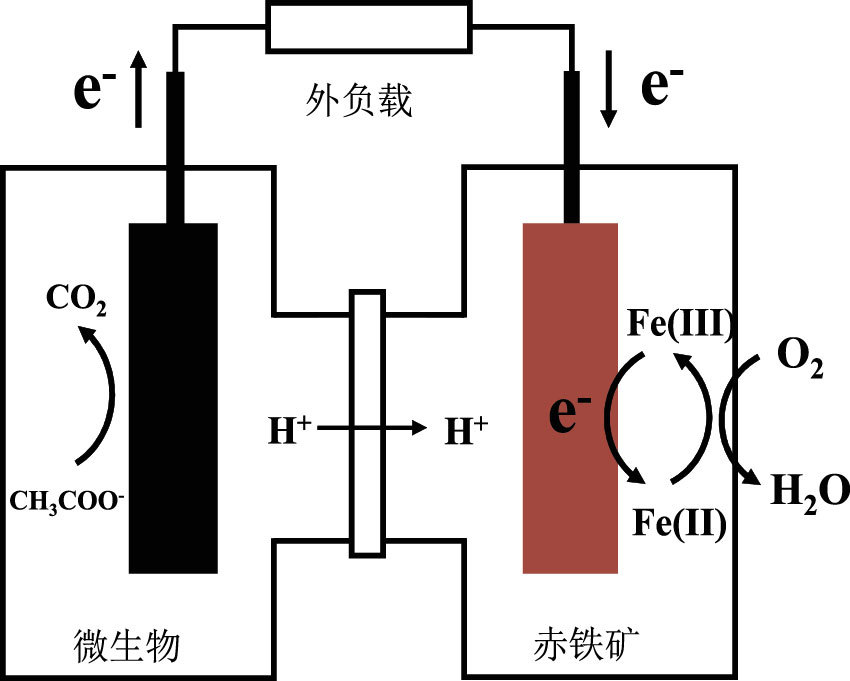
|
图 7 天然赤铁矿促进微生物胞外电子传递示意图 Figure 7 The schematic diagram of the microbial extracellular electron transfer promoted by natural hematite |
本文构建的红壤微生物-赤铁矿双室电学体系表明, 阴极赤铁矿晶格中Fe(Ⅲ)可获取来自阳极微生物端元的电子发生还原反应, 引入的新的氧化还原反应促进双室体系中电子流动加强了微生物胞外电子还原作用;赤铁矿降低阴极电极表面反应过电势, 在动力学上促进电子转移。红壤中富含赤铁矿等铁矿物, 地表有氧条件下赤铁矿等无机矿物可与氧气共同作为微生物新陈代谢活动过程的终端电子受体, 有利于拓展微生物能量传递方式并提升其在生境中的生存能力。除此之外, 本文采用的电化学研究体系可为自然界微生物与铁锰矿物等交互作用研究提供思路与方法的借鉴。
| [] | Cesar I, Kay A, Gonzalez Martinez J A, Grätzel M. 2006. Translucent thin film Fe2O3 photoanodes for efficient water splitting by sunlight:Nanostructure-directing effect of Si-doping. Journal of the American Chemical Society , 128 (14) : 4582–4583. DOI:10.1021/ja060292p |
| [] | de Faria D L A, Venâncio Silva S, de Oliveira M T. 1997. Raman microspectroscopy of some iron oxides and oxyhydroxides. Journal of Raman Spectroscopy , 28 (11) : 873–878. DOI:10.1002/(ISSN)1097-4555 |
| [] | Dong H L, Lu A H. 2012. Mineral-microbe interactions and implications for remediation. Elements , 8 (2) : 95–100. DOI:10.2113/gselements.8.2.95 |
| [] | Dong H L. 2010. Mineral-microbe interactions:A review. Frontiers of Earth Science in China , 4 (2) : 127–147. DOI:10.1007/s11707-010-0022-8 |
| [] | Giorgi L, Antolini E, Pozio A, Passalacqua E. 1998. Influence of the PTFE content in the diffusion layer of low-Pt loading electrodes for polymer electrolyte fuel cells. Electrochimica Acta , 43 (24) : 3675–3680. DOI:10.1016/S0013-4686(98)00125-X |
| [] | Hazen R M, Papineau D, Bleeker W, Downs R T, Ferry J M, McCoy T J, Sverjensky D A, Yang H X. 2008. Review Paper. Mineral evolution. American Mineralogist , 93 (11-12) : 1693–1720. DOI:10.2138/am.2008.2955 |
| [] | Hsu Y K, Chen Y C, Lin Y G, Chen L C, Chen K H. 2012. Birnessite-type manganese oxides nanosheets with hole acceptor assisted photoelectrochemical activity in response to visible light. Journal of Materials Chemistry , 22 (6) : 2733–2739. DOI:10.1039/C1JM14355G |
| [] | Kotloski N J, Gralnick J A. 2013. Flavin electron shuttles dominate extracellular electron transfer by Shewanella oneidensis. mBio , 4 (1) : E00553–12. |
| [] | Logan B E, Hamelers B, Rozendal R, Schröder U, Keller J, Freguia S, Aelterman P, Verstraete W, Rabaey K. 2006. Microbial fuel cells:Methodology and technology. Environmental Science & Technology , 40 (17) : 5181–5192. |
| [] | Lovley D R, Holmes D E, Nevin K P. 2004. Dissimilatory Fe(Ⅲ)and Mn(Ⅳ)reduction. Advances in Microbial Physiology , 49 : 219–286. DOI:10.1016/S0065-2911(04)49005-5 |
| [] | Lovley D R. 2006. Bug juice:Harvesting electricity with microorganisms. Nature Reviews Microbiology , 4 (7) : 497–508. DOI:10.1038/nrmicro1442 |
| [] | Lovley D R. 2008. Extracellular electron transfer:Wires, capacitors, iron lungs, and more. Geobiology , 6 (3) : 225–231. DOI:10.1111/j.1472-4669.2008.00148.x |
| [] | Lu A H, Li Y, Jin S, Wang X, Wu X L, Zeng C P, Li Y, Ding H R, Hao R X, LÜ M, Wang C Q, Tang Y Q, Dong H L. 2012. Growth of non-phototrophic microorganisms using solar energy through mineral photocatalysis. Nature Communications , 3 : 768. DOI:10.1038/ncomms1768 |
| [] | Madigan, M. T. Martinko, J. M. 2006. Brock Biology of Microorganisms. 11th Ed. International Edition. Chapter 5:Nutrition, Laboratory Culture, and Metabolism of Microorganisms. Pearson Prentice Hall, Permian Saddle River, N J : 101–134. |
| [] | Marsili E, Baron D B, Shikhare I D, Coursolle D, Gralnick J A, Bond D R. 2008. Shewanella secretes flavins that mediate extracellular electron transfer. Proceedings of the National Academy of Sciences of the United States of America , 105 (10) : 3968–3973. DOI:10.1073/pnas.0710525105 |
| [] | Pirbadian S, Barchinger S E, Leung K M, Byun H S, Jangir Y, Bouhenni R A, Reed S B, Romine M F, Saffarini D A, Shi L, Gorby Y A, Golbeck J H, El-Naggar M Y. 2014. Shewanella oneidensis MR-1 nanowires are outer membrane and periplasmic extensions of the extracellular electron transport components. Proceedings of the National Academy of Sciences of the United States of America , 111 (35) : 12883–12888. DOI:10.1073/pnas.1410551111 |
| [] | Richter H, Nevin K P, Jia H F, Lowy D A, Lovely D R, Tender L M. 2009. Cyclic voltammetry of biofilms of wild type and mutant Geobacter sulfurreducens on fuel cell anodes indicates possible roles of OmcB, OmcZ, type IV pili, and protons in extracellular electron transfer. Energy & Environmental Science , 2 (5) : 506–516. |
| [] | Schidlowski M. 1988. A 3, 800-million-year isotopic record of life from carbon in sedimentary rocks. Nature , 333 (6171) : 313–318. DOI:10.1038/333313a0 |
| [] | Stookey L L. 1970. Ferrozine-a new spectrophotometric reagent for iron. Analytical Chemistry , 42 (7) : 779–781. DOI:10.1021/ac60289a016 |
| [] | Weber K A, Urrutia M M, Churchill P F, Kukkadapu R K, Roden E E. 2006. Anaerobic redox cycling of iron by freshwater sediment microorganisms. Environmental Microbiology , 8 (1) : 100–113. DOI:10.1111/EMI.2006.8.issue-1 |
| [] | White A F, Peterson M L. 1996. Reduction of aqueous transition metal species on the surfaces of Fe(Ⅱ)-containing oxides. Geochimica et Cosmochimica Acta , 60 (20) : 3799–3814. DOI:10.1016/0016-7037(96)00213-X |
| [] | 迪安J A. 1991. 兰氏化学手册. 尚久方, 译. 第13版. 北京:科学出版杜, 533-538 |
| [] | 丁竑瑞, 李艳, 鲁安怀, 权超, 王鑫, 颜云花, 曾翠平, 王长秋. 2009. 微生物电化学体系中金红石可见光还原降解偶氮染料的实验研究. 岩石矿物学杂志 , 28 (6) : 541–546. |
| [] | 丁竑瑞, 李艳, 鲁安怀, 王鑫, 曾翠平, 颜云花, 王长秋. 2011. 微生物还原铁氧化物矿物的电化学研究. 矿物岩石地球化学通报 , 30 (3) : 299–303. |
| [] | 鲁安怀. 2003. 无机界矿物天然自净化功能之矿物光催化作用. 岩石矿物学杂志 , 22 (4) : 323–331. |
 2017, Vol. 36
2017, Vol. 36


