钙(Ca)是岩石圈中丰度最高的碱土金属元素,在岩石圈、水圈、生物圈和地表系统中广泛存在且容易迁移,其在陆壳、上陆壳、下陆壳的丰度分别为3.85%、2.95%、4.86%。Ca有6个稳定同位素,其原子量(amu)和丰度分别为:40 Ca(96.941%)、42 Ca(0.647%)、43 Ca(0.135%),44 Ca(2.086%)、46 Ca(0.004%)和48 Ca(0.187%)(李亮和蒋少涌,2008)。Ca同位素在扩散过程和化学交换反应中发生动力学分馏,使得其同位素产生变化,因此在物源示踪(Kreissig and Elliott,2005;Reynard et al.,2011;Fantle et al.,2012;Holmden et al.,2012;Huang et al.,2012)、同位素分馏机理(Jacobson and Holmden,2008;Teichert et al.,2009;DePaolo,2011)、古气候古环境(Kasemann et al.,2005,2008;Payne et al.,2010)以及生物生命活动(Hirata et al.,2008;Heuser and Eisenhauer,2010)等领域有广泛的应用前景。
对Ca同位素的测试工作始于上世纪60年代,由于Ca同位素在化学分离和测试过程中均会产生同位素分馏,导致测试的外部精度超出7‰,明显大于Ca同位素在自然界中的分馏范围(~4‰),因而最初人们认为自然界中Ca同位素是均一的。Russell et al .,(1978)首次运用“双稀释剂技术”消除了分离和测试过程中产生的同位素分馏的影响,而且,首次提出了“指数校正法则”(exponential law)对Ca同位素分馏进行了校正,配合双稀释剂,使人们第一次能够观测到天然样品中Ca同位素确实存在分馏,然而由于受仪器分析精度的限制,Ca同位素的研究在相当长一段时间内进展缓慢,直至近些年高分辨的多接收质谱仪(MC-TIMS和MC-ICP-MS)的发展,Ca同位素的测试精度才逐步得到提高,目前Ca同位素测试的外部精度可以达到0.04‰(Lehn et al.,2013)。
获取高精度Ca同位素数据受很多因素的影响:①在质谱测试时,40 Ca的丰度为97%,接收40 Ca的信号同时,低丰度同位素总计数量低,会影响同位素测试的精度(Fantle and Tipper,2014); ②在测定丰度差大的同位素对时(如40 Ca与42 Ca或40 Ca与48 Ca),为了保证低丰度的同位素满足测试要求,高离子流强度的40 Ca,有可能导致法拉第接收杯的损坏,降低其接收效率(Fantle and Tipper,2014)。目前,质谱仪最大的接收信号是55V,使用的放大器电阻为1011Ω,为了更好地接收低丰度的同位素信号,可以采取更换放大器电阻的方法,对Thermo Scientific Triton TIMS和Neptune Plus MC-ICP-MS仪器,可以针对性地将放大器电阻更换至1010Ω,1011Ω和1012Ω。但是,在应用“动态多接收”技术时,不同电阻在计数时的衰减时间不一样,可能会影响最终测试结果(Heuser et al.,2002)。另外,测试过程中的基体效应干扰和仪器的质量歧视效应也影响着Ca同位素的精度,因此,在TIMS和MC-ICP-MS分析之前需要对样品进行纯化以消除基体效应的干扰。
本文系统阐述了目前常用的Ca同位素标准物质、样品分解方法和化学分离方法以及测定Ca同位素的主要测试仪器的方法原理和特点,同时,对双稀释剂法测定Ca同位素过程中,双稀释剂组合配比、杯结构设置和点样操作等有可能对Ca同位素测试精度的影响程度进行了讨论,旨在进一步促进国内外学者在Ca同位素方法研究领域的进步与发展。
1 Ca同位素组成的表示方法及标准物质Ca同位素的表示方法因测试方法的不同而不同,一般使用TIMS测试的文献中数据表示为δ44/40Ca,而使用MC-ICP-MS测试的文献中数据表示为δ44/42Ca。

Ca同位素标准物质有天然萤石,现代海水(李亮和蒋少涌,2008),美国国家标准技术研究所(NIST)认证的超纯碳酸钙SRM 915a和SRM915b等。目前,SRM 915a存世不多,而SRM 915b作为其替代标样,由于Sr含量较高,在MC-ICP-MS测试过程中容易受双电荷干扰的限制,影响测试的准确度,而在TIMS测试过程中双电荷干扰的影响较小,因而可以获得较为理想的数据。钙元素在海水中的驻留时间(~1 Ma)(Zhu and Macdougall,1998)远远大于全球海水混合时间(~1 500a),因此全球海水中Ca同位素是均一的(Schmitt et al.,2003),并可以作为Ca同位素的标准物质,但不同实验室得到的海水中Ca同位素推荐值并不相同,全球海水δ44 Caseawater-SRM915a值变化范围在1.69‰~2.29‰,平均值为1.88‰(Fantle and Tipper,2014)。虽然对同一个标样各实验室测得的Ca同位素比值存在着明显差异,但是在同一个实验室,双稀释剂的不确定性对于样品和标样的影响是相同的,在经过上述“δ”表示法变换后样品和标样之间可以计算出“相对值”(李亮和蒋少涌,2008)。不同标样A,B的Ca同位素比值可通过转化后进行比较:

岩石样品经研磨、粉化后,用酸溶法消解。目前主要的消解方法有HF-HNO3-HCl溶样法、醋酸离心溶解法、聚四氟乙烯密闭高压酸溶法和HBr-HF-HNO3溶样法。
HF-HNO3-HCl溶样法是在样品中加入1 mL HF和1 mL HNO3,混匀后加盖在90℃电热板上加热48 h后开盖蒸干,然后加入稀王水或稀盐酸(刘峪菲等,2015),加盖在90℃电热板上加热至样品溶解。开盖蒸干后用稀HNO3定容。可多次重复加入稀王水或稀盐酸至样品溶解。如果多次加入稀酸样品仍未溶解,则需重新溶样。此方法在电热板上即可完成操作,无需高温高压环境或离心,是Ca同位素测试中最常见的溶样方法。
硅酸盐样品可以采用聚四氟乙烯密闭高压酸溶法,样品放入PTFE消解罐中,加入HF和HNO3,将PTFE消解罐用不锈钢外套封住,放入烘箱中,190℃消解48 h;消解罐冷却至室温后,从不锈钢外套中取出,在120℃电热板上蒸至近干;向消解罐中加入HNO3和超纯水再次放入不锈钢外套,在190℃加热12 h。蒸干后用稀HNO3定容。
Nägler和Kamber(1996)使用HBr-HF-HNO3法溶解超基性岩。在样品中加入8.8N HBr,混匀后在160℃环境下加热72 h,在加热过程中将样品超声若干次,每次10 min,使阳离子从晶格中被充分释放出来。样品冷却后的离心并取上清液。硅酸盐残留物用前面所述HF-HNO3-HCl溶样法溶解。对于低钙含量样品,一般不使用HF以避免CaF2的产生。由于额外添加的酸,这种方法的空白一般比常规HF-HNO3高3倍。
大部分纯碳酸盐样品几乎不需要化学分离。Ewing等(2008)指出,在使用TIMS测试碳酸盐样品时,使用1mol/L醋酸淋滤样品可以防止Ca被硝酸或醋酸从碎屑黏土矿物中溶解出来。向样品中加入2 mL醋酸,静置超过6 h后,离心1 h后取上清液,并用MQ水2 mL清洗底层固体后再次离心,取上清液,重复3、4次。
对于水样,一般经孔径0.2 μm左右滤膜过滤,用高纯HNO3调节至pH≈1。在测试时取适量水样蒸干后用高纯HNO3溶解,离心分离取上清液。
对于植物样品,先研磨、粉化,置于150℃浓盐酸中消解1周后,蒸干;再用1.5 mol/L的盐酸溶解,离心分离取上清液(刘占民等,2005)。
对有孔虫化石和碳酸质软泥样品样品,以超纯水为介质进行多次超声,去除化石内壁、细粒黏土等杂质后,加稀盐酸溶解,离心分离取上清液(Zhu and Macdougall,1998)。
2.2 样品的纯化与分离 2.2.1 基体元素干扰高精度测定Ca同位素首先要克服样品中潜在的各种干扰。Ca同位素的干扰主要来源于包括同量异位素(如40K、 40 Ar 对40 Ca,46Ti对46 Ca,48Ti对48 Ca)、双电荷离子(84 Sr++、 86 Sr++、 88 Sr++、96Mo++)以及多原子离子(见 表 1)的干扰。其中以多原子干扰来源最为复杂也最难消除。样品中的杂质元素对Ca同位素的测定也存在很大干扰。研究表明,只有高纯样品才能产生稳定和高强度的信号,即使微量的杂质(如Al,Fe等)也可能使样品的离子化效率下降两个数量级(Boulyga,2010;Hindshaw et al.,2011)。杂质的干扰往往通过影响钙的离子化效率、增加氧化物产率以及影响离子源稳定等方式间接影响Ca同位素测试结果。因此,尽可能的消除测试过程中的基体效应以及同量异位素的干扰是实现高精度Ca同位素测定的前提。
|
|
表 1 Ca同位素测试时存在的多原子干扰及其丰度 Table 1 Potential isobaric interferences and their abundance during calcium isotope analysis |
早期的分离方法为沉淀法。是通过化学反应将样品中的钙转化为难溶物,经过滤等方法将杂质元素去除,也可以将杂质元素转化为沉淀过滤后去除留下钙元素。Holmden(2009)分析石灰岩样品的Ca同位素时,在样品中逐滴加入6 mol/L HCl溶解CaCO3,至溶液停止冒泡反应完全,通过离心收集上清液蒸干待上机测试。沉淀法操作简单,但由于很难对杂质元素进行完全分离,一般只适用于高钙而低杂质的样品。另外,沉淀法的致命缺点是在沉淀反应中钙会发生明显的同位素分馏,较轻的同位素优先进入溶液,而导致沉淀中重同位素相对富集(DePaolo,2011)。相比之下,离子交换法(色谱法)的适用范围更广,几乎所有Ca同位素分析都采用这种方法(DePaolo,2004;Heuser and Eisenhauer,2010;Simon and DePaolo,2010;Morgan et al.,2011)。
离子交换法的原理是根据酸淋洗过程中元素在离子交换树脂中吸附能力不同达到元素分离的目的。通过建立淋洗曲线,收集淋洗曲线中目标元素对应的淋洗液部分即可达到对分离富集的目的。离子交换法虽然过程较为繁琐,但是对目标元素选择性强,分离效果好。需要注意的是,元素在离子交换过程中也会产生同位素分馏(Russell and Papanastassiou,1978)。因此,需要尽可能的提高目标元素的回收率(>95%),另外,在离子交换分离前加入一定量的双稀释剂,可以对分离过程中产生同位素分馏进行校正。因此,建立钙的纯化分离流程需要综合考虑树脂类型、样品类型、消耗时间以及钙的回收率等因素的影响,虽然采用多次离子交换可以提高产物中钙的纯度,但是也会导致回收率较低、繁琐耗时以及引入新的杂质(器皿、树脂、试剂的本底)等不利因素的影响。Marshall和Depaolo(1989)发现Dowex-50树脂在离子交换过程中有钙的流失,并导致明显的Ca同位素分馏。目前,广泛采用的离子交换树脂有Bio Rad AG-50W-X8(Schiller et al.,2012;Wombacher et al.,2009),Bio Rad AG-50W-X12(Morgan et al.,2011)。Ca在淋洗过程中的拖尾现象会导致其与杂质元素(Al、Sr等)产生重叠。如在AG-50W-X8树脂的分离曲线中,少量的Al与Ca的淋洗区间存在重叠,加州大学伯克利分校(UCB)实验室对部分Al/Ca值高的样品,通过两次分离纯化(AG-50W-X8)可以得到较稳定的离子流(Horwitz et al.,2005)。AG-50W-X12的分离曲线中,少量的Sr与Ca的淋洗区间重叠,Morgan等(2011)对部分高Sr样品(如碳酸盐岩、白云岩等)和碳质球粒陨石样品,采用Eichron DGA/Sr特效树脂分离Sr。
Horwitz等(2005)发现,在使用3 mol/L HNO3做淋洗酸时,DGA树脂对Sr,Ca有很强的吸附性,而对K、Ti、Fe和Al吸附性较弱。UCB实验室采用DGA(Eichrom Technologies)特效树脂也可以获得较好的回收率,且TIMS测试过程中具有较高的分析精度。本实验室采用的分离流程与UCB实验室的一致(Feng et al.,2015)。
Lehn等(2013)和刘峪菲等(2015)使用AG-MP-50(100-200目)树脂及HCl淋洗可达到较理想的分离效果,刘峪菲等(2015)采用装有1 mL AG MP-50树脂的微柱作为离子交换柱,淋洗酸为1.6 mol/L HCl。
3 仪器及测试目前Ca同位素的分析测定主要仪器有热电离质谱仪(TIMS),多接收电感耦合等离子体质谱仪(MC-ICP-MS)和原位离子探针二次离子质谱(SIMS)。
3.1 SIMSRussell等(1998)利用二次离子质谱仪测定了陨石中的Ca同位素,其中 88 Sr2+对44 Ca的干扰通过在质量数43.5处的 87 Sr2+进行监控,其原位离子探针技术的精度在3.1‰~6.6‰之间。Rollion-Bard等(2007),Kasemann等(2008)在原位高空间分辨率(15~20 μm)下,在2个法拉第杯中同时测试二次40 Ca+和44 Ca+,使用SIMS测试Ca同位素的外部精度为0.3‰(2σ)。在使用SIMS测试时,88 Sr2+对44 Ca+的干扰低于0.04‰,对于40K+和88 Sr2+的干扰,需要严格监控41(41K+)和43.5(87 Sr2+)质量数的信号强度。Rollion-Bard等(2007)指出利用原位离子探针方法可以提供有孔虫生物矿化等方面的信息,但该方法在系统测试时仍需克服诸多干扰问题。SIMS测试Ca同位素不仅受测试精度限制,而且缺乏合适的标准样品,因此,SIMS测试Ca同位素的研究报道并不多见。
3.2 MC-ICP-MS与传统热电离同位素质谱(TIMS)相比,多接收电感耦合等离子体质谱(MC-ICP-MS)除具有更易激发的优点外,还有灵敏度相对较高,分析速度快,质量分馏随时间的变化相对较小等优势,但是缺点是分析过程中存在非常明显的质量分馏效应(~5%),并且44 Ca/42 Ca的质量分馏在4 h内漂移可以达到0.1‰(Wieser et al.,2004)。
Halicz等(1999)最早使用MC-ICP-MS(Nu instrument)对Ca同位素进行了测定,得到了部分标准物质的44 Ca/42 Ca值。他们利用SSB法对样品与标样进行交错测量,扣除仪器产生的质量分馏效应,修正仪器质量歧视,并且提出非光谱干扰及双电荷离子的矫正问题,得到的NIST 915a δ44/42Ca精度可以达到±0.16‰(2δ)。同时发现在不使用内标法或者外标法校正44/42Ca的情况下,44/42Ca值的质量漂移可以达到0.1‰~0.15‰。另外,Mg浓度高于Ca浓度2倍时,对Ca同位素结果没有影响。利用该方法得到的陆相碳酸盐与海相碳酸盐的δ44 Ca变化范围为为0.7‰,与使用TIMS测试得到的结果一致。
MC-ICP-MS测定过程中需要使用氩气作为载气,40 Ar+会对40 Ca+产生非常大的同量异位素干扰,质谱上区分 40 Ar+和40 Ca+需要的分辨率大于24 000,而MC-ICP-MS即使是在高分辨下(~8000 Neptune Plus)也远远不能排除来自 40 Ar+的干扰。因此,MC-ICP-MS测定过程中一般不接收40 Ca+,只接收42 Ca、43 Ca、44 Ca或者48 Ca的信号,44 Ca/42 Ca和43 Ca/42 Ca值分别表示为δ44/42Ca和δ43/42Ca。Fietzke等(2004)使用冷焰法(cool plasma)将离子焰从1300W降至400W,大量降低 40 Ar+对40 Ca+的干扰,从而测量44 Ca/40 Ca。 但是冷焰法对基质的要求很高,当HCl+HNO3混酸中HCl的成分从2.9%升至9%时,δ44/40Ca值升高了30‰,因此,该方法并没有得到广泛使用。
在使用MC-ICP-MS测试44 Ca/42 Ca和43 Ca/42 Ca时,需要克服3个技术难点:①由于40 Ca具有很高的丰度(~97%),需要更高Ca浓度的样品(~×10-6)才能使得42 Ca、43 Ca、44 Ca或者48 Ca满足测试的要求。如果测试44 Ca/42Ca或43 Ca/42Ca钙浓度大约需要(5×10-6~10×10-6,在50~100 μL/min的流速下,总共需要5~30 μg Ca(测试时间为20~30 min),所需样品量是TIMS测试的25倍。在MC-ICP-MS测定过程中,高浓度的钙需要更长的洗脱时间,可能导致明显的记忆效应。另外,覆盖在样品锥上的CaO也会影响测试的灵敏度;②多原子干扰和同量异位素,如 40 Ar H+12、14N3+和2C16O2+分别会对42 Ca+和44 Ca+造成干扰,这种干扰的大小与仪器参数设置密切相关,甚至可以发生数量级的变化。Halicz等(1999)使用膜去溶,在Nu Plasma低质量分辨率静态接收条件下,以0.1 M HNO3作为介质酸,测得背景低于1 mV。Wieser等(2004)发现在Neptune高分辨率条件下,14N3+的干扰超过20 mV。在高分辨率条件下,如在一个狭窄的“小平台”范围内(~0.015amu),可以消除部分同量异位素的干扰,但是,“平台”的稳定性对获得高准确度和高精度的结果非常重要。膜去溶装置可以有效的减少多原子干扰,其原理是在高温条件下样品与具有化学修饰表面的离子交换膜相互作用除去溶剂,达到降低氧化物和氢氧化物产率的目的,并且可以增加样品的传输效率。常见的膜去溶装置有CETAC Aridus,ESI Apex(Q/HF/IR)和Nu DSN100等。Wieser等(2004)发现将以上3种膜去溶进行联用,可以将多原子干扰降到较低的水平,同时可以增加信号稳定性和灵敏度。利用该方法使得44 Ca/42Ca的精度达到±0.11‰(2δ)。③飞行管道上 40 Ar+和40 Ca+离子束的背散射效应(~5 nA)(Halicz et al.,1999)。Wieser等(2004)观察到背散射效应会产生不良的基线结构,并通过调整接收杯位置来消除以上不良影响。其他类型的干扰如 88 Sr2+(对44 Ca+)、48Ti+(对48 Ca+)并不能在MC-ICP-MS测定过程中采用简单的光学原理进行分离,88 Sr2+对44 Ca+的信号干扰甚至可以产生数量级的变化。对 88 Sr2+的干扰,通常使用化学离子交换法完全分离Sr和Ca,并通过在43.5质量数的信号监控 87 Sr2+,在质量数44的测量结果上扣除干扰信号,来消除Sr对Ca的干扰。48Ti+对48 Ca+的干扰难以使用简单的方法进行校正,必须防止环境和试剂中的任何Ti污染,Ti的主要污染形式是TiO2。理论上,如果一个样品含有可测量到的Ti,可以采用接收47Ti+的方式来监控48Ti+对48 Ca+的影响。通常会同时测试44 Ca/42 Ca和43 Ca/42 Ca以确认同量异位素干扰已经达到可以被忽略的程度。
近年来,许多研究者在Halicz的方法基础上进行改进。Sime等(2005)报导了一组44 Ca/42 Ca数据的长期外部重现性可以达到0.06‰(2 s,n=45),这种情况只有在干扰非常小的条件下出现(如多次过柱或使用Sr特效离子交换树脂)。Sime等(2005)指出,对于Sr同位素的干扰,Sr/Ca必须低于4×10-5才能保证44 Ca/42 Ca系统偏差低于0.1‰。使用MC-ICP-MS测试时,通常使用SSB法来校正质量歧视效应,这意味着在每一个样品测试时,必须对应测试一个标样(通常是SRM 915a),因此,导致测试时间以及标样的消耗大大增加。由于仪器或环境温度会产生一定程度的波动,在分析过程中需要对仪器参数进行调整。Tipper等(2008)对一个样品进行了3次连续的44 Ca/42 Ca和43 Ca/42 Ca测定,积分时间设置为200 s,洗脱时间大于3 min,加上取样时间,单个样品的测试时间大约需要1 h。由于单次测量两、三次才能估算外部精度,在如此长的测试过程中,仪器的参数均有明显的变动,因而很难对比其外部精度。
Tipper等(2008)将标准加入法和SSB法联用,以扣除样品和标样间的微小质量偏差。将4组不同浓度SRM 915a加入海水后,测试6个样品,其中4个海水-SRM 915a混合溶液,1个海水样品和1个纯SRM 915a标样。根据获得的标准曲线,计算出海水的δ44/42Ca。尽管该方法花费时间较多,但得到了非常理想的测试结果,海水的测试值(相对于SRM 915a)为0.93±0.03‰(95%置信区间),各个样品44 Ca/42 Ca的外部精度可以达到0.03‰~0.06‰,与使用双稀释剂法测试得到的数据一致,并具有相似的分析精度(44 Ca/40 Ca外部精度小于0.12‰)。
3.3 TIMS早期TIMS方法用”跳峰法”或磁场分级法,在一个测定周期内使用单接收杯接收需要测定的4个同位素(通常是40 Ca、42 Ca、44 Ca和48 Ca)(Russell et al .,1978;Skulan et al.,1997),与目前广泛采用的多接收测试方法相比,该方法可以获得良好的内部精度,但是需要具有稳定的离子流。多接收杯在同时接收所有同位素时能提高单次测量的精度,但是在质量分析器运行时会产生一种无法解释的漂移,使得重现性变差(Heuser et al.,2002)。Russell等(1978)使用Ca同位素的双稀释剂技术,将44 Ca/40 Ca的测试误差降低到0.5‰(2σ mean),通过增加离子束强度的方法使得测试精度提高了大约50%。由于在质谱仪测定过程中,40 Ca+离子强度一般需要达到10 V,一般需要3~5 μg的钙,由于所有被测量的离子束集中在一个狭窄的范围内,当离子束强度不变时,测量时的非线性影响最低。
在高精度多接收质谱仪测定Ca同位素的过程中,需要考虑峰形缺陷、非线性的质量分散、离子流阻断、接收杯退化等因素的影响。Fletcher等(1997)报道了VG354质谱仪测定过程中产生的不对称的峰形,并通过微调磁场参数使其形成对称的峰形,由于任何一个小的光学色散都有可能加剧峰形缺陷的形成,因此每一次测试前,必须对磁场参数进行调整。Heuser等(2002)使用MAT262质谱仪测试时,认为微小的峰形缺陷可以忽略。Heuser等(2002)还提到,离子流的非线性分散导致很难使用“动态多接收程序”接收全部信号,但是可以通过使用“跳峰接收法”进行克服。Holmden(2005)在使用43 Ca-42 Ca稀释剂测试Ca同位素时发现,由于40 Ca离子束离轴向接收杯最远,靠近飞行管道内的管壁,因此离子流可能被挡板阻断,也可能被管道内的自由粒子中和。Holmden(2005)还指出,法拉第接收杯长期接收高强度离子流时,有可能导致其接收效率降低。Holmden和Bélanger(2010)在测试时为离子流强度最大的40 Ca设置了一个较短的积分时间,以减弱接收效率退化的影响。目前大部分研究者使用TIMS(如Thermo公司生产的Triton)测定Ca同位素组成,可以获得较理想的测试精度(Lehn et al.,2013; Feng et al.,2015;Lehn et al .,2015)。
通常,TIMS测试Ca同位素需要200~10 μg的纯钙样品,样品以氯化物或硝酸盐的形式被承载在经过去气的钽带或铼带上(Fantle and Bullen,2009)。灯丝必须先经过去气步骤才可以使用,其目的在于将灯丝上附着的气体或杂质赶出,以免在样品分析时,因加热灯丝而释放出大量干扰物质,如40K+会干扰40 Ca+的分析。在TIMS测试中,单个样品测试50~200 cycle。另外一些研究者试图在点样过程中利用草酸钙或钙的卤化物形式等作为发射剂,以提高离子化效率和离子流强度,并降低仪器的质量歧视效应。在点样时加入Ta2O5或磷酸,可以提高离子化效率和获得稳定的离子流(Skulan et al.,1997;Heuser et al.,2002;Fantle and Bullen,2009)。Ca同位素测定的外部精度通常优于0.2‰,目前的研究结果中,Lehn等(2013)报道了TIMS测试Ca同位素的最好外部精度优于0.04‰。
4 TIMS测试时的条件选择目前进行质量歧视校正的最有效的方法是双稀释剂法。稀释剂的原理相当于“内标法”,即向待测样品溶液中加入该元素两种丰度较低的超纯质同位素,假设稀释剂在加入样品之后的所有过程中(离子交换、质谱测试)与样品受到相同的质量歧视,计算出稀释剂的“分馏因子”,对混合物的Ca同位素比值进行校正,最后再减去已知的稀释剂的值即可得到样品的真实值。目前常用的双稀释剂对有42 Ca/48 Ca(Russell et al .,1978;Skulan et al.,1997;Feng et al.,2015)、43 Ca/48 Ca(Heuser et al.,2002;Gussone et al.,2003;Hippler et al.,2003)、43 Ca/46 Ca(Fletcher et al.,1997)和42 Ca/43 Ca(Gopalan et al.,2006;Lehn et al.,2013)等。双稀释剂的配比以及与样品混合的配比、测试条件选择、杯结构以及人为点样都有可能对Ca同位素的测试精度造成影响。
4.1 稀释剂配比与混合比例问题Rudge等(2009)利用蒙特卡洛方法讨论了双稀释剂中2个单质量数稀释剂的配比以及和样品的混合浓度变化对测试精度的影响。测试条件为10 V的平均离子流信号强度和8 s的积分时间。Ca同位素的6个质量数决定了在选择双稀释剂时,有15种不同质量数的组合可供选择,对应着90组双稀释剂对,在模拟优化条件下,Rudge等(2009)改变模拟实验条件,包括双稀释剂配比,双稀释剂-样品混合物配比和接收的Ca同位素质量对(在同一组序列中只接收其中4个质量数的信号,另外2个质量数的信号不接收)。测试结果表明,以上实验条件的改变均会对测试精度产生影响。
Ca同位素测试过程中,除各类干扰产生的误差以外,附加误差主要来自测试中不恰当的聚焦和多储库效应(Fantle and Bullen,2009)。Lehn等(2013)提出Ca同位素测试过程中的误差受离子流强度、积分时间和运行周期数的影响,并且“杯中毒效应”也可能导致测试精度变差。Feng等(2015)运用蒙特卡洛模拟优化,证明了理论条件下在双稀释剂中不同稀释剂的配比和积分时间的分配均有可能对内部精度产生影响。
4.2 杯结构设置在Ca同位素测定Ca同位素过程中,可以在质谱中设置多组杯结构,可以将40 Ca-48 Ca的6个同位素分为2段及以上,通过跳峰的方式测定所有的Ca同位素。杯结构的选择首先取决于需要测定的Ca同位素类型:双稀释剂校正计算中用到的Ca同位素也必须出现在杯结构中;同时,对监测其他同位素干扰的法拉第杯也需要考虑,如在杯结构中加入39K监测40K对40 Ca干扰。一般在测定过程中会先接收一组“低质量序列”同位素值40 Ca-44 Ca,在第二序列里接收“高质量序列”同位素值42 Ca-48 Ca。
Holmden等(2012)认为,对称接收同位素可以减小电子器件带来的谱线分散,同时通过减少相邻接受杯的质量差可减少这种分散。而Heuser等(2002)却认为增大接收杯之间的质量差有助于观察测定过程中产生的质量分馏。Holmden(2005),Lehn等(2013)在测定Ca同位素时使用42 Ca-43 Ca双稀释剂,选择42 Ca-43 Ca组合的原因之一是质量差较小的同位素更易校正。此外,4种同位素(40 Ca,42 Ca,43 Ca和44 Ca)可以在一个杯序列中同时被接收,从而减少因跳峰引起的质量误差和分析时间(Lehn et al.,2013)。
Feng等(2015)列举了42 Ca-48 Ca,43 Ca-48 Ca,46 Ca-48 Ca双稀释剂测试Ca同位素比值的杯结构组合(图 1)。其中,杯结构(a)和杯结构(b)在跳峰接收时在两组接收杯中都接收了42 Ca,43 Ca或46 Ca,在不同的杯组合中接收44 Ca。杯结构(c)和杯结构(d)在跳峰接收时在两组接收杯中都接收了44 Ca,在不同的杯组合中接收42 Ca,43 Ca或46 Ca。杯结构(e)在同一组杯结构中接收所有质量数的Ca同位素,42 Ca-43 Ca双稀释剂法一般使用杯结构(e)同时接收40 Ca,42 Ca,43 Ca和44 Ca。
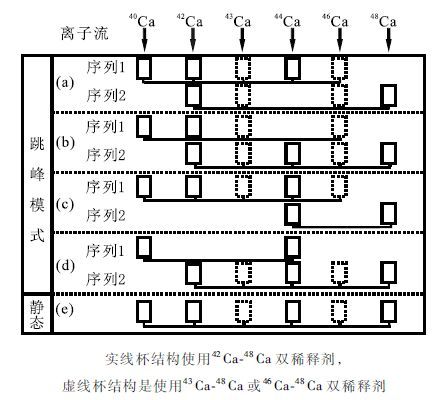
|
图 1 常见稀释剂理论杯结构原理图(据Feng et al.,2015修改) Fig. 1 chematic diagram of theoretically possible cup configurations(modified after Feng et al., 2015) |
TIMS测定Ca同位素组成时采用的带材质通常有Ta、Re、W带等,测试时有单带、双带和三带之分,所点Ca元素的化合物也有不同(如Ca(NO3)2、CaCO3、CaI2、CaCl2及Ca3(PO4)2等)(表 2)(祝红丽等,2015)。在样品加热时,由于不同的元素电离温度不同,使用三带测试时,先预热其中的蒸发带,可以降低测试过程中K元素的干扰(Fletcher et al.,1997)。
|
|
表 2 双稀释剂TIMS测试钙同位素常用的样带组合 Table 2 The typically filament combinations in double sipke TIMS method |
样品在离子源中加热时,双带可以改善离子流的稳定性(Fantle and Tipper.,2014)。一些实验室也使用单带,利用预热程序极其缓慢地加热样品,使离子流强度缓慢上升至所需强度。在Ca同位素测试过程中,Ta的加入可使样品具有更稳定的离子流,但由于钽带本身在加热过程中有损耗,随着样品测试的进行,在后期容易出现由于钽带本身变薄而导致样带上电流变化大,使Ca同位素无法在稳定的实验条件下测试,从而影响测试精度。在使用42 Ca-43 Ca双稀释剂时,由于测样时间大大缩短,因此许多研究者会使用钽单带。而在需要进行跳峰的双稀释剂法测定过程中,在蒸发过程中不容易损耗的铼带更具有优势。相较于单带,双带法具有小的质量分馏以及更稳定的离子流(Boulyga,2010)。
点样操作蒸干后的钙化合物在样带上的均匀程度不同,可能导致“多储库效应”,在样带上,钙化合物可能被分配到不同的储库中去,在热电离的过程中,轻的同位素被优先电离,灯丝上未电离的样品富集重同位素,轻重同位素比值与测试时间存在良好的负线性关系。同位素任何阶段出现逆向分馏行为或者测试时分馏不稳定都意味着灯丝上的Ca分散到了多个储库,并且这些储库都具有不同的同位素比值。当两个或者多个处于不同分馏程度的储库同时激发出信号时,这些混合信号的同位素比值与测定时间并不存在负线性关系,其分馏偏离理想的指数分馏定律。经分馏校正后,结果与真实值仍然存在一定的偏差。该偏差与不同储库所占混合信号的比例有关,比例越相当,偏差越大(祝红丽等,2015)。Lehn和Tacobson(2015)举例说明了单次测试中3种不同储库的测试结果。测试结果较理想的储库中,40 Ca/43 Ca负线性趋势在经过分馏校正后被消除,样品δ44/40Ca测试值的外部重现性良好;而其他储库中,40 Ca/43 Ca不规则的线性关系在经过分馏校正后仍然存在。在实际测试过程中,40 Ca/43 Ca不规则的线性关系并不能直接说明该次测试的精度受到影响。当样品分馏程度较大时,校正后的结果可能出现偏离真实值的情况。目前的研究工作尚没有明确多储库效应对测试结果的影响程度。
在点样的过程中,应尽量使样品发生均匀的化学反应生成钙化合物,并且在样带表面均匀覆盖,而改变样带形状又有可能导致样带表面温度存在不均一性,故一些研究中利用封口膜限制溶液态钙在样带表面的扩散,以达到集中样品的目的,取得了良好的测试效果(Holmden et al.,2010;Lehn et al.,2013)。
5 结论近年来,国内外分析工作者在Ca同位素样品前处理,分离富集及仪器测定方面都取得了诸多进展。针对不同样品采用不同的消解流程,化学分离流程回收率达到近100%,提高了分析效率,降低了基体效应对分析测试的影响。随着高分辨的多接收质谱仪(MC-TIMS和MC-ICP-MS)的普及,Ca同位素的测试精度得到极大提高。TIMS作为高精度测试Ca同位素的主要仪器,对于已日趋成熟的实验流程,仍需要重视实际测试中对稀释剂配比、样带选择、积分时间以及点样技术等方面的优化,蒙特-卡洛等模拟实验也可以为优化测试条件提供参考。
| [1] | Allmen K, Nägler T F, Pettke T, Hippler D, Griesshaber E, Logan A, Eisenhauer A, Samankassou E. 2010. Stable isotope profiles(Ca, O, C) through modern brachiopod shells of T. septentrionalis and G. vitreus: Implications for calcium isotope paleo-ocean chemistry. Chemical Geology, 269(3-4): 210-219 |
| [2] | Becker J S, Füllner K, Seeling U D, Fornalczyk G, Kuhn A J. 2008. Measuring magnesium, calcium and potassium isotope ratios using ICP-QMS with an octopole collision cell in tracer studies of nutrient uptake and translocation in plants. Analytical and Bioanalytical Chemistry, 390(2): 571-578 |
| [3] | Boulyga S F. 2010. Calcium isotope analysis by mass spectrometry. Mass Spectrom Reviews, 29(5): 685-716 |
| [4] | DePaolo D J. 2004. Calcium isotopic variations produced by biological, kinetic, radiogenic and nucleosynthetic processes. In: Johnson C M, Beard B L, Albarede F eds. Geochemistry of the non-traditional stable isotopes. Reviews in mineralogy and geochemistry. Washington, DC: The Mineralogical Society of America, 255-288 |
| [5] | DePaolo D J. 2011. Surface kinetic model for isotopic and trace element fractionation during precipitation of calcite from aqueous solutions. Geochimica et Cosmochimica Acta, 75(4): 1039-1056 |
| [6] | Ewing S A, Yang W B, DePaolo D J, Michalski G, Kendall C, Stewart B W, Thiemens M, Amundson R. 2008. Non-biological fractionation of stable Ca isotopes in soils of the Atacama Desert, Chile. Geochimica et Cosmochimica Acta, 72(4): 1096-1110 |
| [7] | Fantle M S, Bullen T D. 2009. Essentials of iron, chromium, and calcium isotope analysis of natural materials by thermal ionization mass spectrometry. Chemical Geology, 258(1-2): 50-64 |
| [8] | Fantle M S, Tipper E T. 2014. Calcium isotopes in the global biogeochemical Ca cycle: Implications for development of a Ca isotope proxy. Earth-Science Reviews, 129: 148-177 |
| [9] | Fantle M S, Tollerud H, Eisenhauer A, Holmden C. 2012. The Ca isotopic composition of dust-producing regions: Measurements of surface sediments in the Black Rock Desert, Nevada. Geochimica et Cosmochimica Acta, 87: 178-193 |
| [10] | Feng L P, Zhou L, Yang L, Tong S Y, Hu Z C, Gao S. 2015. Optimization of the double spike technique using peak jump collection by a Monte Carlo method: An example for the determination of Ca isotope ratios. Journal of Analytical Atomic Spectrometry, 30(12): 2403-2411 |
| [11] | Fietzke J, Eisenhauer A, Gussone N, Bock B, Liebetrau V, Nägler T F, Spero H J, Bijma J, Dullo C. 2004. Direct measurement of44Ca/40Ca ratios by MC-ICP-MS using the cool plasma technique. Chemical Geology, 206(1-2): 11-20 |
| [12] | Fletcher I R, Maggi A L, Rosman K J R, McNaughton N J. 1997. Isotopic abundance measurements of K and Ca using a wide-dispersion multi-collector mass spectrometer and low-fractionation ionisation techniques. International Journal of Mass Spectrometry and Ion Processes, 163(1-2): 1-17 |
| [13] | Gopalan K, Macdougall D, Macisaac C. 2006. Evaluation of a 42Ca-43Ca double-spike for high precision Ca isotope analysis. International Journal of Mass Spectrometry, 248(1-2): 9-16 |
| [14] | Gussone N, Eisenhauer A, Heuser A, Dietzel M, Bock B, Böhm F, Spero H J, Lea D W, Bijma J, Nägler T F. 2003. Model for kinetic effects on calcium isotope fractionation(δ44Ca) in inorganic aragonite and cultured planktonic foraminifera. Geochimica et Cosmochimica Acta, 67(7): 1375-1382 |
| [15] | Gussone N, Filipsson H L. 2010. Calcium isotope ratios in calcitic tests of benthic foraminifers. Earth and Planetary Science Letters, 290(1-2): 108-117 |
| [16] | Halicz L, Galy A, Belshaw N S, O'Nions R K. 1999. High-precision measurement of calcium isotopes in carbonates and related materials by multiple collector inductively coupled plasma mass spectrometry(MC-ICP-MS). Journal of Analytical Atomic Spectrometry, 14(12): 1835-1838 |
| [17] | Heuser A, Eisenhauer A, Gussone N, Bock B, Hansen B T, Nägler T F. 2002. Measurement of calcium isotopes (δ44Ca) using a multicollector TIMS technique. International Journal of Mass Spectrometry, 220(3): 385-397 |
| [18] | Heuser A, Eisenhauer A. 2008. The calcium isotope composition (δ44/40Ca) of NIST SRM 915b and NIST SRM 1486. Geostandards and Geoanalytical Research, 32(3): 311-315 |
| [19] | Heuser A, Eisenhauer A. 2010. A pilot study on the use of natural calcium isotope(44Ca/40Ca)fractionation in urine as a proxy for the human body calcium balance. Bone, 46(4): 889-896 |
| [20] | Hindshaw R S, Reynolds B C, Wiederhold J G, Kretzschmar R, Bourdon B. 2011. Calcium isotopes in a proglacial weathering environment: Damma glacier, Switzerland. Geochimica et Cosmochimica Acta, 75(1): 106-118 |
| [21] | Hippler D. Schmitt A D, Gussone N, Heuser A, Stille P, Eisenhauer A, Nägler T F. 2003. Calcium isotopic composition of various reference materials and seawater. Geostandards and Geoanalytical Research, 27(1): 13-19 |
| [22] | Hirata T, Tanoshima M, Suga A, Tanaka Y K, Nagata Y, Shinohara A, Chiba M. 2008. Isotopic analysis of calcium in blood plasma and bone from mouse samples by multiple collector-ICP-mass spectrometry. Analytical Sciences, 24(11): 1501-1507 |
| [23] | Holmden C, Bélanger N. 2010. Ca isotope cycling in a forested ecosystem. Geochimica et Cosmochimica Acta, 74(3): 995-1015 |
| [24] | Holmden C, Papanastassiou D A, Blanchon P, Evans S. 2012. δ44/40Ca variability in shallow water carbonates and the impact of submarine groundwater discharge on Ca-cycling in marine environments. Geochimica et Cosmochimica Acta, 83: 179-194 |
| [25] | Holmden C. 2005. Measurement of δ44Ca using a43Ca-42Ca double-spike TIMS Technique. Saskatchewan Geological Survey, 1: 1-7 |
| [26] | Holmden C. 2009. Ca isotope study of Ordovician dolomite, limestone, and anhydrite in the Williston Basin: Implications for subsurface dolomitization and local Ca cycling. Chemical Geology, 268(3-4): 180-188 |
| [27] | Horwitz E P, McAlister D R, Bond A H, Barrans Jr R E. 2005. Novel extraction of chromatographic resins based on tetraalkyldiglycolamides: Characterization and potential applications. Solvent Extraction and Ion Exchange, 23(3): 319-344 |
| [28] | Huang S C, Farkaš J, Yu G, Petaev M I, Jacobsen S B. 2012. Calcium isotopic ratios and rare earth element abundances in refractory inclusions from the Allende CV3 chondrite. Geochimica et Cosmochimica Acta, 77: 252-265 |
| [29] | Jacobson A D, Holmden C. 2008. δ44Ca evolution in a carbonate aquifer and its bearing on the equilibrium isotope fractionation factor for calcite. Earth and Planetary Science Letters, 270(3-4): 349-353 |
| [30] | Kasemann S A, Hawkesworth C J, Prave A R, Fallick A E, Pearson P N. 2005. Boron and calcium isotope composition in Neoproterozoic carbonate rocks from Namibia: Evidence for extreme environmental change. Earth and Planetary Science Letters, 231(1-2): 73-86 |
| [31] | Kasemann S A, Schmidt D N, Pearson P N, Hawkesworth C J. 2008. Biological and ecological insights into Ca isotopes in planktic foraminifers as a palaeotemperature proxy. Earth and Planetary Science Letters, 271(1-4): 292-302 |
| [32] | Kısakürek B, Eisenhauer A, Böhm F, Hathorne E C, Erez J. 2011. Controls on calcium isotope fractionation in cultured planktic foraminifera, Globigerinoides ruber and Globigerinella siphonifera. Geochimica et Cosmochimica Acta, 75(2): 427-443 |
| [33] | Kreissig K, Elliott T. 2005. Ca isotope fingerprints of early crust-mantle evolution. Geochimica et Cosmochimica Acta, 69(1): 165-176 |
| [34] | Lehn G O, Jacobson A D, Holmden C. 2013. Precise analysis of Ca isotope ratios (δ44/40Ca) using an optimized43Ca-42Ca double-spike MC-TIMS method. International Journal of Mass Spectrometry, 351: 69-75 |
| [35] | Lehn G O, Jacobson A D. 2015. Optimization of a48Ca-43Ca double-spike MC-TIMS method for measuring Ca isotope ratios (δ44/40Ca and δ44/42Ca): Limitations from filament reservoir mixing. Journal of Analytical Atomic Spectrometry, 30(7): 1571-1581 |
| [36] | Marshall B D, DePaolo D J. 1989. Calcium isotopes in igneous rocks and the origin of granite. Geochimica et Cosmochimica Acta, 53(4): 917-922 |
| [37] | Morgan J L L, Gordon G W, Arrua R C, Skulan J L, Anbar A D, Bullen T D. 2011. High-precision measurement of variations in calcium isotope ratios in urine by multiple collector inductively coupled plasma mass spectrometry. Analytical Chemistry, 83(18): 6956-6962 |
| [38] | Nägler T F, Kamber B S. 1996. A new silicate dissolution procedure for isotope studies on garnet and other rock forming minerals. Schweizerische Mineralogische und Petrographische Mitteilungen, 76(1): 75-80 |
| [39] | Payne J L, Turchyn A V, Paytan A, DePaolo D J, Lehrmann D J, Yu M Y, Wei J Y. 2010. Calcium isotope constraints on the end-Permian mass extinction. Proceedings of the National Academy of Sciences of the United States of America, 107(19): 8543-8548 |
| [40] | Reynard L M, Day C C, Henderson G M. 2011. Large fractionation of calcium isotopes during cave-analogue calcium carbonate growth. Geochimica et Cosmochimica Acta, 75(13): 3726-3740 |
| [41] | Rollion-Bard C, Vigier N, Spezzaferri S. 2007. In situ measurements of calcium isotopes by ion microprobe in carbonates and application to foraminifera. Chemical Geology, 244(3-4): 679-690 |
| [42] | Rudge J F, Reynolds B C, Bourdon B. 2009. The double spike toolbox. Chemical Geology, 265(3-4): 420-431 |
| [43] | Russell S S, Huss G R, Fahey A J, Greenwood R C, Hutchison R, Wasserburg G J. 1998. An isotopic and petrologic study of calcium-aluminum-rich inclusions from CO3meteorites. Geochimica et Cosmochimica Acta, 62(4): 689-714 |
| [44] | Russell W A, Papanastassiou D A. 1978. Calcium isotope fractionation in ion-exchange chromatography. Analytical Chemistry, 50(8): 1151-1154 |
| [45] | Russell W A, Papanastassiou D A, Tomrello T A. 1978. Ca isotope fractionation on the Earth and other solar system materials. Geochimica et Cosmochimica Acta, 42(8): 1075-1090 |
| [46] | Schiller M, Paton C, Bizzarro M. 2012. Calcium isotope measurement by combined HR-MC-ICPMS and TIMS. Journal of Analytical Atomic Spectrometry, 27(1): 38-49 |
| [47] | Schmitt A D, Chabaux F, Stille P. 2003. The calcium riverine and hydrothermal isotopic fluxes and the oceanic calcium mass balance. Earth and Planetary Science Letters, 213(3-4): 503-518 |
| [48] | Sime N G, De La Rocha C L, Galy A. 2005. Negligible temperature dependence of calcium isotope fractionation in 12species of planktonic foraminifera. Earth and Planetary Science Letters, 232(1-2): 51-66 |
| [49] | Simon J I, DePaolo D J. 2010. Stable calcium isotopic composition of meteorites and rocky planets. Earth and Planetary Science Letters, 289(3-4): 457-466 |
| [50] | Simpson L A, Hearn R, Merson S, Catterick T. 2005. A comparison of double-focusing sector field ICP-MS, ICP-OES and octopole collision cell ICP-MS for the high-accuracy determination of calcium in human serum. Talanta, 65(4): 900-906 |
| [51] | Skulan J. DePaolo D J, Owens T L. 1997. Biological control of calcium isotopic abundances in the global calcium cycle. Geochimica et Cosmochimica Acta, 61(12): 2505-2510 |
| [52] | Stürup S, Bendahl L, Gammelgaard B. 2006. Optimisation of dynamic reaction cell(DRC) -ICP-MS for the determination of 42Ca/43Ca and 44Ca/43Ca isotope ratios in human urine. Journal of Analytical Atomic Spectrometry, 21(3): 297-304 |
| [53] | Teichert B M A, Gussone N, Torres M E. 2009. Controls on calcium isotope fractionation in sedimentary porewaters. Earth and Planetary Science Letters, 279(3-4): 373-382 |
| [54] | Tipper E T, Louvat P, Capmas F, Galy A, Gaillardet J. 2008. Accuracy of stable Mg and Ca isotope data obtained by MC-ICP-MS using the standard addition method. Chemical Geology, 257(1-2): 65-75 |
| [55] | Wieser M E, Buhl D, Boumana C, Schwieters J. 2004. High precision calcium isotope ratio measurements using a magnetic sector multiple collector inductively coupled plasma mass spectrometer. Journal of Analytical Atomic Spectrometry, 19(7): 844-851 |
| [56] | Wombacher F, Eisenhauer A, Heuser A, Weyer S. 2009. Separation of Mg, Ca and Fe from geological reference materials for stable isotope ratio analyses by MC-ICP-MS and double-spike TIMS. Journal of Analytical Atomic Spectrometry, 24(5): 627-636 |
| [57] | Zhu P, Macdougall J D. 1998. Calcium isotopes in the marine environment and the oceanic calcium cycle. Geochimica et Cosmochimica Acta, 62(10): 1691-1698 |
| [58] | 李亮, 蒋少涌. 2008. 钙同位素地球化学研究进展. 中国地质, 35(6): 1088-1100 |
| [59] | 刘峪菲, 祝红丽, 刘芳, 王桂琴, 许继峰, 张兆峰. 2015. 钙同位素化学分离方法研究. 地球化学, 44(5): 469-476 |
| [60] | 刘占民, 刘丛强, 韩贵琳, 王中良. 2005. 钙同位素方法在环境地球化学研究中的应用与进展. 地球与环境, 33(1): 71-78 |
| [61] | 祝红丽, 张兆峰, 刘峪菲, 刘芳, 康晋霆. 2015. 钙同位素地球化学综述. 地学前缘, 22(5): 44-53 |
 2016, Vol. 35
2016, Vol. 35


