2. 中国科学院大学, 北京 100049;
3. 汕头职业技术学院, 广东 汕头 515078;
4. 上海深渊科学工程研究中心海洋科学学院, 上海海洋大学, 上海 201306
2. Graduate School of the Chinese Academy of Sciences, Beijing 100049, China;
3. Shantou Polytechnic, Shantou, Guangdong 515078, China;
4. Shanghai Engineering Research Center of Hadal Science and Technology, College of Marine Sciences, Shanghai Ocean University, Shanghai 201306, China
在地球表层环境中,沉积物中的有机质会在微生物作用下以孔隙水中的各种离子(SO42-,NO3-,Fe3+,Mn4+等)为电子受体而被氧化,在缺少这些离子的流体中,有机质将通过发酵作用被逐渐降解而产生CH4(Coleman et al.,1993;Canfield et al.,2005)。早期成岩过程中的这些反应会向孔隙流体释放过量的溶解无机碳(DIC),导致碳酸钙沉淀而形成自生碳酸盐岩(冯东等,2006)。生活垃圾填埋场与海底沉积环境相似,可类比于自然环境中的成岩体系(Baedecker and Back,1979;Manning et al.,1994;Manning,2000)。因此,接近Ⅲ型干酪根的垃圾有机质在厌氧微生物作用下会发生降解,经水解、产(乙)酸和产CH4等阶段,形成以CH4和CO2为主的垃圾填埋气和成分复杂的渗滤液(Manning et al.,1994)。产CH4作用使渗滤液的DIC浓度和pH值升高,导致碳酸钙达到过饱和,从而在渗滤液收集系统中沉淀出类似于成岩结核的自生碳酸盐矿物(Owen and Manning,1997;Manning,2000; Rittmann et al.,2003)。加拿大安大略省4个垃圾填埋场渗滤液排放系统收集的新生方解石的δ 13C值为-0.7‰~+10.2‰,推测乙酸发酵产CH4作用可能产生足够多的溶解无机碳(DIC)而CO2还原产CH4作用可能使pH升高,从而导致碳酸盐矿物得以沉淀。微生物活动可能调控碳酸钙的沉淀(Bennett,1998)。在佛罗里达一个填埋场的渗滤液收集管道中发育的碳酸盐结壳具有叠层石和鲕粒等微组构,其δ 13C值为+23.2‰~+26.8‰。硫酸盐还原细菌可能催化方解石晶体在其细胞表面成核,从而导致方解石快速沉淀和生长(Maliva et al.,2000)。因此,其形成机制可能与前寒武纪广泛发育的富13C碳酸盐岩的形成机制相似(Hayes and Waldbauer,2006)。
然而,微生物调控碳酸盐矿物沉淀是根据叠层石的同心圆纹层具有强烈荧光和铁硫化物(可能是黄铁矿)来推测的,还缺乏更多和更直接的依据。微生物活动调控的垃圾填埋场稳定化过程会使填埋气中的CO2和渗滤液DIC的δ 13C值升高(Hackley et al.,1996;Hornibrook et al.,2000;Wimmer et al.,2013)。渗滤液地球化学组成的变化可能会影响渗滤液收集系统纹层状碳酸盐岩层间的矿物学和地球化学组成,但这个问题还缺少研究。
广州火烧岗垃圾填埋场的渗滤液收集系统发育有大量碳酸盐沉淀物,形成时间为2~10年,相当于长期碳酸盐岩形成的实验产物(Land,1998),为已知形成时间的自生碳酸盐岩形成过程研究提供了机会,有助于深入理解前寒武纪富13 C碳酸盐岩的形成机制。本文以广州火烧岗垃圾填埋场渗漏管道发育的自生碳酸盐岩为研究对象,采用传统岩石学和现代地球化学分析方法,在微观尺度上对碳酸盐岩的沉积组构、矿物组成、稳定碳和氧同位素组成以及稀土元素的特征进行研究,探讨自生碳酸盐岩的微生物成因机制。
1 样品与分析方法火烧岗垃圾填埋场位于广州市番禺区,填埋场由两个单元组成,第一单元在2002年建成,到2008年封场,第二单元于2008建成,并营运至今。填埋库区底部铺设有防渗膜,垃圾渗滤液由填埋垃圾之下的开孔管道收集后自流进入渗滤液集水井,再由泵抽至调节池,送污水处理厂处理。2013年在渗滤液收集管道里发现有一层坚硬的沉淀物,根据垃圾填埋场运行时间和渗滤液收集系统流量变化判断,这些沉淀物生长了2~10年。
研究样品采集于渗滤液收集管道,使用去离子水对其清洗干净后烘干,选取典型部分制成薄片,在LEICA-DMRX光学显微镜下观测其沉积特征,使用高清晰数码相机LEICA DC500拍摄显微镜图像。样品破裂新鲜断面经喷铂金(20 s)在中国科学院广州能源研究所的场发射扫描电子显微镜HITACHI S-4800观测微结构特征,元素成分通过能谱仪HORIBA EX-250测定。
挑选出新鲜部分样品,研磨至200目,用于X射线衍射(XRD)、碳和氧稳定同位素及元素测试。同时使用手持牙钻在结壳上钻取不同特征的微区样品,进行碳和氧同位素分析。XRD分析在中国科学院广州地球化学研究所Bruker AXS D8上进行,矿物半定量依面积法确定(Taylor,1991),碳酸盐矿物中镁的含量通过d[104]峰高计算,方解石中MgCO3小于5%(mol)被定义为低镁方解石,而MgCO3大于5%(mol)被定义为高镁方解石。
碳酸盐岩的碳和氧同位素分析采用磷酸法,在中国科学院同位素地球化学国家重点实验室通过GV IsoPrimeⅡ型稳定同位素质谱仪测定,所有结果均相对于V-PDB标准,分析精度δ 13C优于±0.05‰,δ18 O 优于±0.08‰。样品的元素含量使用中科院地球化学研究所的Finnigan MAT ELEMENT高分辨率ICP-MS测定,测定过程中用GSR-1、OU-6、1633-a、GXR-2、GXR-5标准样品对分析质量进行控制,误差小于5%。
2 结果 2.1 管道结壳的岩石矿物学特征火烧岗垃圾填埋场渗滤液收集管道中生长的自生碳酸盐岩呈结壳状(Ⅰ型结壳),其断面显示有不规则的纹层,可分为早期形成的致密层和晚期胶结的疏松层(图 1a)。致密层厚为0.8~1.0 mm,内部具有明暗纹层。疏松层厚2~6 mm,内部层理不规则。一些较早形成的结壳(Ⅱ型结壳)固结性好,厚度约1 cm,内部具有交互出现的亮-暗纹层,与Ⅰ型结壳的致密部分相当,无疏松层部分,但靠管壁的结壳表面有黄褐色瘤状体(图 1b)。结壳的致密层的矿物组成主要为低镁方解石,含少量黏土矿物;疏松层的矿物组成主要为高镁方解石,含少量的石英(表 1)。

|
图 1 火烧岗垃圾场渗滤液收集管道自生碳酸盐岩的典型形貌特征 Fig. 1 Typical morphologies of authigenic carbonates from leachate collection pipes of the Huoshaogang landfill Ⅰ型结壳(P-1)断面上可见下部致密层(a)和上部疏松层(b); Ⅱ型结壳(P-2)只发育致密层 |
| 表 1 碳酸盐岩XRD分析的矿物组成 Table 1 The mineral composition of the carbonates by XRD analysis |
结壳中早期形成的致密层可分为由纤维状晶体组成的亮纹层和较多的有机质暗纹层。亮纹层较薄,由多期次垂直生长的纤维状方解石组成(图 2a)。暗纹层相对较厚,内部发育有微纹层、凝块和亮晶球体(图 2a,2b)。微纹层主要由微米级的泥微晶亮层和黑色微小颗粒暗层相间构成(图 2a)。碳酸盐凝块形状不规则,边界模糊,由泥晶方解石组成(图 2b)。亮晶球体无内部结构,主要由单晶或多晶碳酸盐矿物组成,并具有暗边(图 2b)。

|
图 2 管道结壳的光学显微镜和扫描电镜照片 Fig. 2 Optical microscopic and SEM images of crusts from leachate collection pipes (a)Ⅰ型结壳的致密层中的明暗纹层。暗纹层由亮-暗微纹层组成,单偏光;(b)致密层中的泥晶凝块(红色箭头)和亮晶球体(绿色箭头),球体直径为10~50 μm,具暗边,无内部结构,单偏光;(c)Ⅰ型结壳的疏松层中层理不规则的亮-暗纹层,单偏光;(d)疏松层中发育的团粒和凝块,正交偏光;(e)致密Ⅱ型结壳中交互出现的亮-暗纹层,单偏光;(f)致密Ⅱ型结壳的亮纹层与暗纹层,分别由纤维状和泥微晶方解石组成,正交偏光;(g)致密Ⅱ型结壳的亮纹层中的纹层(红色箭头)和鲕粒(绿色箭头),鲕粒具有泥微晶核心和由纤维状方解石组成的同心圆状纹层,单偏光;(h)结壳中的草莓状黄铁矿(1,2)和自形黄铁矿(3,4),反射光;(i)结壳中的方解石小球体,SEM。能谱结果反映Ca,O,C,Mg等的相对比例(红色十字);(j)由小球体组成的似球状团簇,SEM;(k)表面有细棱的圆柱形丝状体,直径:0.6~1 μm,长度:10~20 μm,SEM;(l)由杆状体连接而成的链状体,长1.5~2.5 μm,SEM< |
结壳中晚期形成的疏松层为不规则的亮-暗纹层,亮纹层由纤维状晶体组成,暗纹层由泥微晶组成,有机质较多(图 2c)。暗纹层中发育团粒和凝块组构。黑色的团粒呈圆形或椭圆形,直径为20~200 μm,由泥晶方解石所组成,团粒之间由微晶方解石胶结(图 2d)。部分团粒边界模糊,相连成凝块状构造,凝块大小不一,形状不规则(图 2d)。
较早形成的致密Ⅱ型结壳中的暗纹层由泥微晶方解石组成,发育边界模糊的凝块组构(图 2e),亮纹层由纤维状和微晶方解石组成,具有不规则的纹层,显示有多期次的矿物垂直生长(图 2f,2g下部)。亮纹层中还发育次圆形或圆形的鲕粒,具有深色微晶核心和由纤维状晶体组成的不规则同心圆纹层,纤维状晶体从核心向外呈放射状生长(图 2g)。大小不一的鲕粒一般紧密相连(图 2f,2g上部)。
此外,两类结壳的中均发育草莓状和自形黄铁矿,草莓状黄铁矿直径为7~10 μm,由众多黄铁矿微晶构成(图 2h1 ,2h2 )。自形黄铁矿直径为7~20 μm,晶体的形态保存较好(图 2h3,2h4)。
两类结壳的泥微晶中还保存了很多大小不等的球状体、丝状体和杆状体,可能是钙化的微生物(图 2i-2l)。SEM下可见大量小球体,其直径为3~5 μm,能谱分析显示球体主要由Ca、 S和O组成,推测其矿物成分应该是低镁方解石(图 2i)。小球体可聚合为似球状团簇(图 2j)。SEM下还可观察到结壳中保存的丝状体和杆状体。丝状体呈圆柱形,表面有细棱,直径为0.6~1.0 μm,长度为10~20 μm,部分胶结在泥晶方解石中(图 2k)。而有些圆形末端的杆状体直径为0.4~0.6 μm,长0.6~1.0 μm,相互连接成链状体,长1.5~2.5 μm(图 2l)。
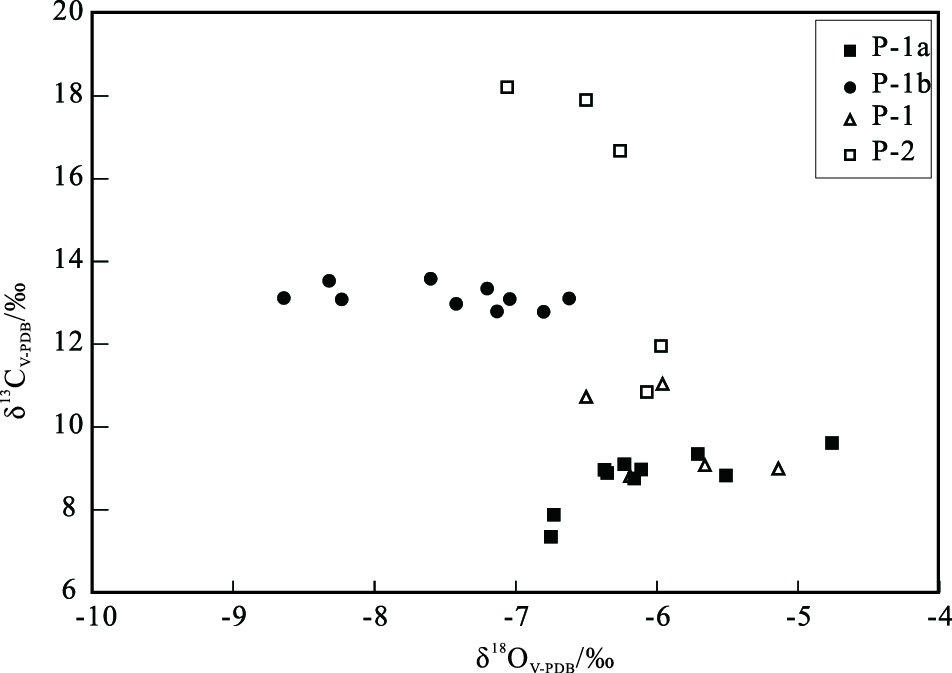
2.2 碳、氧同位素组成火烧岗垃圾填埋场管道结壳的δ 13C值为+7.34‰~+18.21‰,δ18 O值为-8.64‰~-4.76‰(V-PDB),其中下部的致密部分比上部的疏松或致密部分更富集12 C和18O(图 3)。
|
图 3 火烧岗垃圾填埋场渗滤液收集管道自生碳酸盐岩的碳、氧同位素组成 Fig. 3 Carbon and oxygen isotopic compositions of authigenic carbonates from the leachate collection pipe of the Huoshaogang landfill |
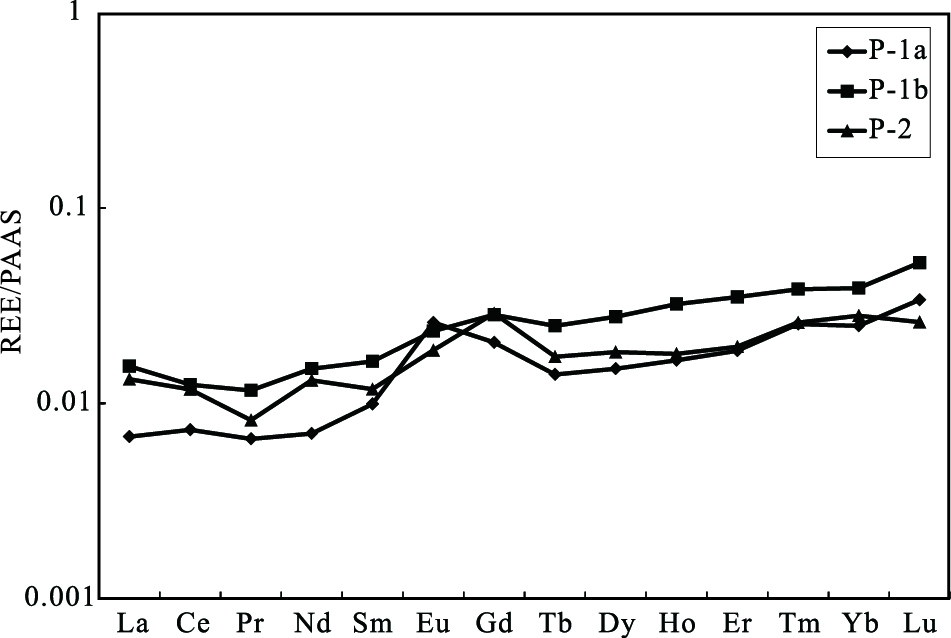
碳酸盐岩5%醋酸可溶相(碳酸盐矿物)的稀土元素地球化学测定结果见 表 1。由表 1可见,碳酸盐矿物稀土元素总量为(1.54~2.43)×10-6。各样品的澳大利亚后太古代页岩标准化稀土元素配分模式相似,显示Ⅰ型结壳致密层为Ce正异常,Ⅰ型结壳疏松层和Ⅱ型结壳为无Ce异常(Ce/Ce*为0.81~1.07)(表 2,图 4)。
| 表 2 火烧岗垃圾场自生碳酸盐岩中碳酸盐相的稀土元素含量 Table 2 REE concentrations of various carbonate phases in authigenic carbonates from Huoshaogang landfill |
碳酸盐岩的碳同位素组成可以有效地追踪其碳的来源(Schumacher,1996; Peckmann et al.,2004)。垃圾渗滤液中的DIC主要来源于填埋垃圾稳定化过程中的有机质降解反应(Walsh et al.,1993)。垃圾有机质只在短暂的有氧阶段被好氧微生物分解(Kjeldsen et al.,2002)。主要的有机质降解过程由厌氧微生物所调控,大分子有机物(糖类、蛋白质和脂肪)首先水解,产生乙酸和其他低分子量有机酸,这些有机酸再降解产生CH4(龙焰等,2006)。在氧化乙酸(或丙酸)并同时还原硫酸盐(或硝酸盐、铁离子、锰离子等)的互养细菌调控下,一部分乙酸转变为溶解碳酸盐。然而,由于渗滤液中硫酸盐(或其他电子受体)含量不足,乙酸分解主要通过乙酸发酵型产CH4作用来实现(Bennett,1998; Manning,2001)。H2充足和温度适宜的条件下CO2还原产CH4作用也会发生(Hornibrook et al.,2000)。在产CH4阶段之前,δ 13CDIC值保持在-20‰~-25‰。到了初始产CH4阶段,乙酸发酵型和氢营养型产CH4菌会优先利用12 C,使δ 13CDIC值发生大的正偏。因此,残余DIC的δ 13C 值将迅速上升并能在稳定产CH4阶段达到约+20‰的最大值(Hackley et al.,1996; Wimmer et al.,2013)。
因此,火烧岗垃圾填埋场自生碳酸盐岩的δ 13CV-PDB值为+7.34‰~+18.21‰,可能是两种途径产生的碳同位素分馏的结果。而致密和疏松部分δ 13C值的差异可能是δ 13CDIC在产CH4过程中不同阶段的记录。结壳下层较早形成的致密部分的δ 13CV-PDB值为7.34‰~11.95‰,普遍低于较晚形成的上层疏松或致密部分的值(12.78‰~18.21‰)(图 3),显示δ 13CDIC在产CH4过程中逐渐升高。
这种自生碳酸盐岩记录的渗滤液δ 13CDIC变重的演化趋势,可能是由于封闭环境中重同位素富集所导致的。在接近封闭的垃圾填埋场中,随着有机底物的不断消耗和富12 C产物(如乙酸、CH4)的不断产生,渗滤液的DIC会逐渐富集13 C(Hackley et al.,1996)。而CO2还原产CH4途径的贡献可能会增加,乃至成为主要的途径(Uz et al.,2003; Nayak et al.,2009; Qu et al.,2009),使得DIC更加亏损12 C。此外,脱气作用会使较轻的12 C优先排出,残余的CO2溶解过程中的同位素平衡效应会使13 C优先进入HCO3-中,也可导致δ 13CDIC值升高(Hornibrook et al.,2000)。因此,火烧岗垃圾填埋场自生碳酸盐岩高δ 13CV-PDB值可能是封闭环境中产CH4作用和脱气作用使DIC逐渐富集13 C的结果。
渗滤液中的水主要来自大气降水,火烧岗垃圾填埋场的自生碳酸盐岩具有较低的δ18 OV-PDB值(-8.64‰~-4.76‰),接近于当地降水的δ18 OV-PDB年平均值-5.83‰(刘忠方等,2009)。它们间的差异可能与碳酸盐矿物结晶温度的差异有关,较低的氧同位素对应较高的温度,而较高的环境温度使氢分压增大,可能更有利于CO2还原产CH4作用的发生(Bennett,1998)。结壳的下层紧密部分比上层疏松部分更富12 C和18O,指示较低的 δ18 O 值所对应的较高温度,可能使CO2还原产CH4作用的贡献增加,造成更大的碳同位素分馏,碳酸盐矿物因而具有更高的δ 13C值。
3.2 形成环境自生碳酸盐矿物的Ce异常可以有效地指示形成环境的氧化还原条件(陈多福等,2005;冯东和陈多福,2008)。火烧岗渗滤液收集系统沉淀物的Ce/Ce*显示无Ce异常和真Ce正异常(表 2,图 4),指示自生方解石形成于还原环境。还原环境的形成显然与厌氧微生物活动有关。微生物调控的垃圾有机质降解过程使渗滤液的氧化还原电位不断下降,形成适合产CH4菌的还原环境(Fannin and Roberts,2006)。
|
图 4 火烧岗填埋场自生碳酸盐岩醋酸可溶部分澳大利亚后太古代页岩稀土元素标准化配分模式图 Fig. 4 PAAS-normalized REE pattern of the acetic acid dissolved solution of authigenic carbonates from the Huoshaogang landfill |
自生碳酸盐岩沉淀的必要条件是碳酸盐矿物在孔隙水中过饱和,而且没有动力学因素限制碳酸盐矿物结晶(Burton,1993)。影响碳酸盐矿物相沉淀的因素主要包括孔隙水中碳酸盐的过饱和度、Ca2+和Mg2+浓度、SO2-4和PO3-4浓度、温度、pH、pCO2、微生物活动和有机质含量等(Clayton,1994; Naehr et al.,2007; Tourney and Ngwenya,2009)。
研究表明,乙酸发酵产生的CO2可形成碳酸并会在缺乏缓冲的情况下抑制碳酸盐矿物结晶(Clayton,1994)。但如果气相CO2存在,一部分碳酸可以从溶液中以CO2气体的形式逃逸,不能释放出H+。因此,乙酸发酵会导致垃圾渗滤液的pH大幅上升至中性。同时,CO2还原途径消耗氢组分,也会使pH上升(Rittmann et al.,2003; VanGulck et al.,2003)。而且,研究显示,在一定的pH值范围内(5.9~8.0,甚至低至5.1),渗滤液的Ca含量是影响方解石饱和度的一个关键因素(Manning and Robinson,1999)。垃圾中常含有大量富钙和硫酸盐的材料,如含石膏的灰泥和消费品、含羟钙石的水泥砂浆及含碳酸钙的纸张等(Manning,2001),垃圾在酸性条件下发生溶解通常使年轻的渗滤液含有高浓度的Ca2+和SO2-4。有机质降解过程中的硫酸盐还原作用使SO2-4浓度大幅下降,形成相对还原的环境,有利于含镁方解石的沉淀(Lahann and Siebert,1982)。处于初始产CH4阶段的渗滤液的Mg/Ca比通常小于1(Kjeldsen et al.,2002),具备沉淀低镁方解石所需的低Mg/Ca比条件(Davis et al.,2000)。因此,火烧岗垃圾填埋场低镁方解石的形成是由于初始产CH4阶段渗滤液具有活度足够高的Ca2+和溶解碳酸盐,以及上升的pH,其碳酸钙矿物相可能由低Mg/Ca比、低SO2-4浓度和高DOC浓度的渗滤液地球化学组成所控制。
随着产CH4过程的进行,渗滤液中大量Ca2+被低镁方解石固定。到了较晚的产CH4阶段,Mg/Ca(mol)值可能大于1,而此时SO2-4浓度相当低(Kjeldsen et al.,2002),这样有利于高镁方解石的形成(Lahann and Siebert,1982; Van Lith et al.,2003)。组成管道结壳的疏松层部分高镁方解石的δ 13CV-PDB值普遍较高,显示其可能形成于较晚的产CH4阶段(图 3)。
3.3 微生物作用泥微晶方解石是垃圾填埋场中形成的自生碳酸盐岩的主要矿物,发育某些特殊沉积组构,如叠层石和鲕粒(Maliva et al.,2000)。火烧岗垃圾填埋场的自生碳酸盐岩中保存了较多的特殊微组构,包括叠层石、鲕粒、凝块、团粒、葡萄状胶结物和草莓状黄铁矿等,以及不同类型的钙化微生物结构,可能指示自生碳酸盐岩的形成与微生物作用有关。
火烧岗垃圾填埋场渗滤液收集管道中的Ⅰ型和Ⅱ型结壳发育连续生长的明暗纹层,具有典型的叠层石特征(图 1,图 2a,2c,2e,2f)。Ⅰ型结壳致密部分中的暗纹层含有高含量的有机质(图 2a),可能与微生物活动有关(Maliva et al.,2000)。与此相类似,微生物调控的碳酸钙沉淀可形成具有同心圆状纹层的鲕粒(Maliva et al.,2000; Barbieri and Cavalazzi,2005),因此,Ⅱ型结壳中发育的鲕粒(图 2g)也可能与微生物活动有关。团粒和凝块也是碳酸盐沉淀物中常见的微组构(图 2b,2d)。团粒很可能是由于厌氧微生物的新陈代谢作用引起化学微环境差异而形成的。团粒聚集可过渡为边界模糊的雾状凝块,大小不同的凝块被认为是微生物成因碳酸盐岩的典型特征之一(Burne and Moore,1987)。Ⅰ型结壳中还发育亮晶球体结构(图 2b)。在一些自生碳酸盐岩(如冷泉碳酸盐岩)中发育类似的球体结构,它们可能来自于黏稠的渗漏流体气泡或液滴,其表面吸附有机质而形成暗边(Peckmann et al.,1999; 佟宏鹏和陈多福,2012)。本次研究发现的球体结构可能有相似的成因。
以往的研究显示渗滤液系统沉淀物中存在一定量铁硫化物,可能存在黄铁矿(Brune et al.,1991; Fleming et al.,1999; Maliva et al.,2000)。本次研究在管道结壳中观察到草莓状黄铁矿(图 2h1,h2),莓球体直径为7~10 μm,大小变化不明显,单体的数量估计不会超过几百个,指示了草莓状黄铁矿的生物成因,可能是微生物硫酸盐还原作用的产物(Goldhaber and Kaplan,1974; Wilkin and Barnes,1996; Popa et al.,2004)。
垃圾填埋场中主要的厌氧微生物包括纤维素降解菌群、产酸与产乙酸菌群以及产CH4菌群(主要有杆状菌、球状菌和八叠球菌等)(Semrau,2011)。SEM观察显示自生碳酸盐矿物晶体具有球状、丝状、杆状和哑铃状等特殊的形态,可能是不同类型的钙化微生物,显示其中可能保存了多种类型的厌氧菌群(图 2i-2l)。其中,球状集合体的形态(图 2i,2j)与类似垃圾填埋场的污染场地采集的污泥中的CH4球菌群或CH4八叠球菌群的形态相似(Liu et al.,1985; Robinson et al.,1985; Montenegro et al.,2003)。研究发现,众多小球状CH4球菌或CH4八叠球菌细胞常常聚集起来,可形成似球状的较大集合体(Liu et al.,1985)。因此,火烧岗填埋场自生碳酸盐岩中由小球体组成的似球状团簇可能来自钙化的CH4球菌或CH4八叠球菌。表面有细棱的圆柱形丝状体(图 2k)与产CH4菌中的Methanotrix菌有某些相似之处(Varesche et al.,1997)。虽然不能根据自生碳酸盐岩中的微生物结构确定其种类,但大量疑似微生物体胶结在其中显示出它们与自生碳酸盐岩的形成有着重要联系,可能催化了自生碳酸盐岩的沉淀。
微生物表面富含带负电荷的酸性基团,能吸附和富集阳离子,为矿物成核提供位点。同时,微生物的代谢活动可提高微环境的阳离子浓度、碱度和pH值,促进矿物的成核和沉淀(Dupraz et al.,2009;王月等,2011;王红梅等,2013)。在具有高含量有机质的渗滤液中,DOC很可能络合大量Ca2+,抑制碳酸盐矿物沉淀。微生物将有机质逐步降解为CH4和CO2,产生高浓度DIC并提高水溶液的pH值,同时释放出这部分被束缚的钙离子(Li,2014)。这使得碳酸盐矿物晶体能在细胞表面达到局部过饱和而形成晶核,并最终沉淀。
4 结论广州火烧岗垃圾填埋场渗滤液收集管道中发育自生碳酸盐岩结壳。这些碳酸盐岩发育有叠层石、鲕粒、凝块、团粒和草莓状黄铁矿等特殊沉积组构,以及保存了不同类型的微生物体。碳酸盐岩的δ 13C值指示其碳源主要是微生物产CH4作用残余CO2。封闭的垃圾填埋场中的产CH4作用使渗滤液DIC逐渐富集13 C,结壳早晚形成的两部分逐渐升高的δ 13C值记录了这一趋势。在硫酸盐还原作用和DOC对Ca2+的络合作用影响下,碳酸盐矿物倾向于沉淀方解石。微生物调控的低镁方解石快速沉淀使渗滤液的Mg/Ca比升高,继而沉淀出高镁方解石。自生碳酸盐矿物的Ce/Ce*显示无Ce异常和真Ce正异常,表明它们形成于还原环境。通过降解填埋垃圾的有机质而改变渗漏流体的地球化学特征和催化含镁方解石晶体成核,微生物活动影响了火烧岗垃圾填埋场自生碳酸盐岩的沉积组构、矿物组成、碳和氧同位素组成与稀土元素分馏模式。我们的研究结果有助于理解地质历史时期具有相似特征的碳酸盐岩的形成机制。
| [1] | Baedecker M J, Back W. 1979. Modern marine sediments as a natural analog to the chemically stressed environment of a landfill. Journal of Hydrology, 43(1-4):393-414 |
| [2] | Barbieri R, Cavalazzi B. 2005. Microbial fabrics from Neogene cold seep carbonates, Northern Apennine, Italy. Palaeogeography, Palaeoclimatology, Palaeoecology, 227(1-3):143-155 |
| [3] | Bennett P J. 1998. The stable isotopic characterization of carbon and water cycling in municipal solid waste landfills. Masters Thesis. Mississauga:University of Western Ontario |
| [4] | Brune M, Ramke H G, Collins H, Hanert H H. 1991. Incrustations process in drainage systems of sanitary landfills. In:Christensen T H, Cossu R, Stegmann R, eds. Proceedings of the Third international landfill symposium. Cagliari:CISA, Environmental Sanitary Engineering Centre, 999-1035 |
| [5] | Burne R V, Moore L S. 1987. Microbialites:Organosedimentary deposits of benthic microbial communities. Palaios, 2(3):241-254 |
| [6] | Burton E A. 1993. Controls on marine carbonate cement mineralogy:Review and reassessment. Chemical Geology, 105(1-3):163-179 |
| [7] | Canfield D E, Kristensen E, Thamdrup B. 2005. Aquatic geomicrobiology. Amsterdam:Elsevier |
| [8] | Clayton C J. 1994. Microbial and Organic Processes. In:Parker A, Sellwood B W, eds. Quantitative diagenesis:Recent developments and applications to reservoir geology. Netherlands:Springer, 125-160 |
| [9] | Coleman M L, Raiswell R, Brown A, Curtis C D, Aplin A C, Ortoleva P J, Gruszczynski M, Lyons T, Lovley D R, Eglinton G. 1993. Microbial mineralization of organic matter:Mechanisms of self-organization and inferred rates of precipitation of diagenetic minerals and discussion. Philosophical Transactions:Physical Sciences and Engineering, 344(1670):69-87 |
| [10] | Davis K J, Dove P M, De Yoreo J J. 2000. The role of Mg2+ as an impurity in calcite growth. Science, 290(5494):1134-1137 |
| [11] | Dupraz C, Reid R P, Braissant O, Decho A W, Norman R S, Visscher P T. 2009. Processes of carbonate precipitation in modern microbial mats. Earth-Science Reviews, 96(3):141-162 |
| [12] | Fannin C A, Roberts R D. 2006. Mature landfill waste geochemical characteristics and implications for long-term secondary substance release. Geochemistry:Exploration, Environment, Analysis, 6(4):369-378 |
| [13] | Fleming I R, Rowe R K, Cullimore D R. 1999. Field observations of clogging in a landfill leachate collection system. Canadian Geotechnical Journal, 36(4):685-707 |
| [14] | Goldhaber M B, Kaplan I R. 1974. The sulfur cycle. In:Goldberg E D, ed. The sea. New York:John Wiley and Sons, 5:569-655 |
| [15] | Hackley K C, Liu C L, Coleman D D. 1996. Environmental isotope characteristics of landfill leachates and gases. Ground Water, 34(5):827-836 |
| [16] | Hayes J M, Waldbauer J R. 2006. The carbon cycle and associated redox processes through time. Philosophical Transactions:Biological Sciences, 361(1470):931-950 |
| [17] | Hornibrook E R C, Longstaffe F J, Fyfe W S. 2000. Evolution of stable carbon isotope compositions for methane and carbon dioxide in freshwater wetlands and other anaerobic environments. Geochimica et Cosmochimica Acta, 64(6):1013-1027 |
| [18] | Kjeldsen P, Barlaz M A, Rooker A P, Baun A, Ledin A, Christensen T H. 2002. Present and long-term composition of MSW landfill leachate:A review. Critical Reviews in Environmental Science and Technology, 32(4):297-336 |
| [19] | Lahann R W, Siebert R M. 1982. A kinetic model for distribution coefficients and application to Mg-calcites. Geochimica et Cosmochimica Acta, 46(11):2229-2237 |
| [20] | Land L S. 1998. Failure to precipitate dolomite at 25℃ from dilute solution despite 1000-fold oversaturation after 32 years. Aquatic Geochemistry, 4(3-4):361-368 |
| [21] | Li Z Z. 2014. Modeling precipitate-dominant clogging for landfill leachate with NICA-Donnan theory. Journal of Hazardous Materials, 274:413-419 |
| [22] | Liu Y, Boone D R, Sleat R, Mah R A. 1985. Methanosarcina mazei LYC, a new methanogenic isolate which produces a disaggregating enzyme. Applied and Environmental Microbiology, 49(3):608-613 |
| [23] | Maliva R G, Missimer T M, Leo K C, Statom R A, Dupraz C, Lynn M, Dickson J A D. 2000. Unusual calcite stromatolites and pisoids from a landfill leachate collection system. Geology, 28(10):931-934 |
| [24] | Manning D A C, Rae E I C, Gestsdóttir K. 1994. Appraisal of the use of experimental and analogue studies in the assessment of the role of organic acid anions in diagenesis. Marine and Petroleum Geology, 11(1):10-19 |
| [25] | Manning D A C, Robinson N. 1999. Leachate-mineral reactions:Implications for drainage system stability and clogging. In:Proceedings of 7th International Landfill Symposium. Cagliari:CISA, Environmental Sanitary Engineering Centre, 269-276 |
| [26] | Manning D A C. 2000. Carbonates and oxalates in sediments and landfill:Monitors of death and decay in natural and artificial systems. Journal of the Geological Society, 157(1):229-238 |
| [27] | Manning D A C. 2001. Calcite precipitation in landfills:An essential product of waste stabilization. Mineralogical Magazine, 65(5):603-610 |
| [28] | McLennan S M. 1989. Rare earth elements in sedimentary rocks; Influence of provenance and sedimentary processes. Reviews in Mineralogy and Geochemistry, 21(1):169-200 |
| [29] | Montenegro M A, Araujo J C, Vazoller R F. 2003. Microbial community evaluation of anaerobic granular sludge from a hybrid reactor treating pentachlorophenol by using fluorescence in situ hybridization. Water Science & Technology, 48(6):65-73 |
| [30] | Naehr T H, Eichhubl P, Orphan V J, Hovland M, Paull C K, Ussler Ⅲ W, Lorenson T D, Greene H G. 2007. Authigenic carbonate formation at hydrocarbon seeps in continental margin sediments:A comparative study. Deep-Sea Research Part Ⅱ:Topical Studies in Oceanography, 54(11-13):1268-1291 |
| [31] | Nayak B S, Levine A D, Cardoso A, Harwood V J. 2009. Microbial population dynamics in laboratory-scale solid waste bioreactors in the presence or absence of biosolids. Journal of Applied Microbiology, 107(4):1330-1339 |
| [32] | Owen J A, Manning D A C. 1997. Silica in landfill leachates:Implications for clay mineral stabilities. Applied Geochemistry, 12(3):267-280 |
| [33] | Peckmann J, Walliser O H, Riegel W, Reitner J. 1999. Signatures of hydrocarbon venting in a middle Devonian Carbonate Mound(Hollard Mound)at the Hamar Laghdad(Antiatlas, Morocco). Facies, 40(1):281-296 |
| [34] | Peckmann J, Thiel V. 2004. Carbon cycling at ancient methane-seeps. Chemical Geology, 205(3-4):443-467 |
| [35] | Popa R, Kinkle B K, Badescu A. 2004. Pyrite framboids as biomarkers for iron-sulfur systems. Geomicrobiology Journal, 21(3):193-206 |
| [36] | Qu X, Mazéas L, Vavilin V A, Epissard J, Lemunier M, Mouchel J M, He P J, Bouchez T. 2009. Combined monitoring of changes in δ13CH4 and archaeal community structure during mesophilic methanization of municipal solid waste. FEMS Microbiology Ecology, 68(2):236-245 |
| [37] | Rittmann B E, Banaszak J E, Cooke A, Rowe R K. 2003. Biogeochemical evaluation of mechanisms controlling CaCO3(s) precipitation in landfill leachate-collection systems. Journal of Environmental Engineering, 129(8):723-730 |
| [38] | Robinson R W, Aldrich H C, Hurst S F, Bleiweis A S. 1985. Role of the cell surface of Methanosarcina mazei in cell aggregation. Applied and Environmental Microbiology, 49(2):321-327 |
| [39] | Schumacher D. 1996. Hydrocarbon-induced alteration of soils and sediments. In:Schumacher D, Abrams M A, eds. Hydrocarbon migration and its near-surface expression. Vancouver:AAPG Memoir, 71-89 |
| [40] | Semrau J D. 2011. Current knowledge of microbial community structures in landfills and its cover soils. Applied Microbiology and Biotechnology, 89(4):961-969 |
| [41] | Taylor J C. 1991. Computer programs for standardless quantitative analysis of minerals using the full powder diffraction profile. Powder Diffraction, 6(1):2-9 |
| [42] | Tourney J, Ngwenya B T. 2009. Bacterial extracellular polymeric substances(EPS)mediate CaCO3 morphology and polymorphism. Chemical Geology, 262(3-4):138-146 |
| [43] | Uz I, Rasche M E, Townsend T, Ogram A V, Lindner A S. 2003. Characterization of methanogenic and methanotrophic assemblages in landfill samples. Proceedings of the Royal Society of London B, 270(S1):S202-S205 |
| [44] | VanGulck J F, Rowe R K, Rittmann B E, Cooke A J. 2003. Predicting biogeochemical calcium precipitation in landfill leachate collection systems. Biodegradation, 14(5):331-346 |
| [45] | Van Lith Y, Warthmann R, Vasconcelos C, Mckenzie J A. 2003. Sulphate-reducing bacteria induce low-temperature Ca-dolomite and high Mg-calcite formation. Geobiology, 1(1):71-79 |
| [46] | Varesche M B, Zaiatá M, Vieira L G T, Vazoller R F, Foresti E. 1997. Microbial colonization of polyurethane foam matrices in horizontal-flow anaerobic immobilized-sludge reactor. Applied Microbiology and Biotechnology, 48(4):534-538 |
| [47] | Walsh D C, LaFleur R G, Bopp R F. 1993. Stable carbon isotopes in dissolved inorganic carbon of landfill leachate. Ground Water Management, 16:153-167 |
| [48] | Wilkin R T, Barnes H L. 1996. Pyrite formation by reactions of iron monosulfides with dissolved inorganic and organic sulfur species. Geochimica et Cosmochimica Acta, 60(21):4167-4179 |
| [49] | Wimmer B, Hrad M, Huber-Humer M, Watzinger A, Wyhlidal S, Reichenauer T G. 2013. Stable isotope signatures for characterising the biological stability of landfilled municipal solid waste. Waste Management, 33(10):2083-2090 |
| [50] | 陈多福, 黄永样, 冯东, 苏正, 陈光谦. 2005. 南海北部冷泉碳酸盐岩和石化微生物细菌及地质意义. 矿物岩石地球化学通报, 24(3):185-189 |
| [51] | 冯东, 陈多福, 苏正, 刘芊. 2006. 海底CH4缺氧氧化与冷泉碳酸盐岩沉淀动力学研究进展. 海洋地质与第四纪地质, 26(3):125-131 |
| [52] | 冯东, 陈多福. 2008. 黑海西北部冷泉碳酸盐岩的沉积岩石学特征及氧化还原条件的稀土元素地球化学示踪. 现代地质, 22(3):390-396 |
| [53] | 刘忠方, 田立德, 姚檀栋, 柴旭荣. 2009. 中国大气降水中δ18O的空间分布. 科学通报, 54(6):804-811 |
| [54] | 龙焰, 沈东升, 劳慧敏, 胡宏. 2006. 填埋场中垃圾降解微生物机理研究进展. 浙江大学学报(农业与生命科学版), 32(1):9-13 |
| [55] | 佟宏鹏, 陈多福. 2012. 西藏日喀则晚白垩世冷泉碳酸盐岩的发现及其特征. 科学通报, 57(36):3500-3510 |
| [56] | 王红梅, 吴晓萍, 邱轩, 刘邓. 2013. 微生物成因的碳酸盐矿物研究进展. 微生物学通报, 40(1):180-189 |
| [57] | 王月, 沈建伟, 杨红强, 王旭, 刘苗苗. 2011. 微生物碳酸盐沉积及其研究意义. 地球科学进展, 26(10):1038-1049 |
 2016, Vol. 35
2016, Vol. 35


