运动行为调控的神经机理是研制动物机器人的基础,明确调控特定运动行为神经核团及其调控模式具有重要意义[1]。侧向移动行为是鸽子机器人控制的基础动作之一,因此探索和研究鸽子的侧向移动行为调控相关的神经核团具有重要的应用价值[2-3]。此前,研究人员大多通过借鉴哺乳动物相关研究结果,基于经验进行同源类比来推测鸽子脑内可能参与运动调控的神经核团并验证[3-5]。但该方法在实践中仅找到少量可用核团,在神经调控过程中存在运动行为响应率低、重复性差等问题[6]。
采用c-fos原癌基因确定特定运动行为的靶点神经核团是一种比较有效的方法[7-10]。该方法需要对动物进行运动训练,一般利用条件反射可以训练动物主动完成特定运动行为,但此过程需要动物几乎全脑大多数神经核团参与,难以利用c-fos方法精确定位到目标核团[8, 11]。本文采用被动运动的实验范式,将鸽子限制在较小的空间范围,并通过传送机带动鸽子运动从而产生被动侧向移动行为。此过程仅使鸽子双腿肌肉被动发生交替运动,调用运动相关神经核团并发挥功能产生兴奋,减少了其他核团的参与,有利于精准筛选侧向移动相关的神经核团。
本文以鸽子(Columba livia)为研究对象,在实验室内利用传送机训练构建鸽子被动侧向移动行为训练实验范式;采用c-fos免疫组化方法,确定活跃神经元的空间分布,结合标准家鸽脑图谱确定可能调控侧向移动行为相关的神经核团,并对其中高密度c-fos阳性标记的外侧隔核进行验证;采用尼氏染色方法,明确外侧隔核的空间结构位置;最后对外侧隔核进行电刺激验证。
1 材料和方法 1.1 研究对象研究对象为成年鸽子(Columba livia),体重为350~450 g,雌雄不拘,单笼饲养在室内,光周期为自然光照,温度为室温。动物的饲养和护理均遵照郑州大学动物饲养中心的规定。
1.2 鸽子被动侧向移动行为训练范式构建首先设计制作了一套适用于鸽子被动侧向移动行为训练装置,目的是将鸽子限制在一定范围内,并使鸽子仅双腿发生侧向交替运动,产生被动侧向移动行为,尽量避免无关刺激,减少无关核团的参与。
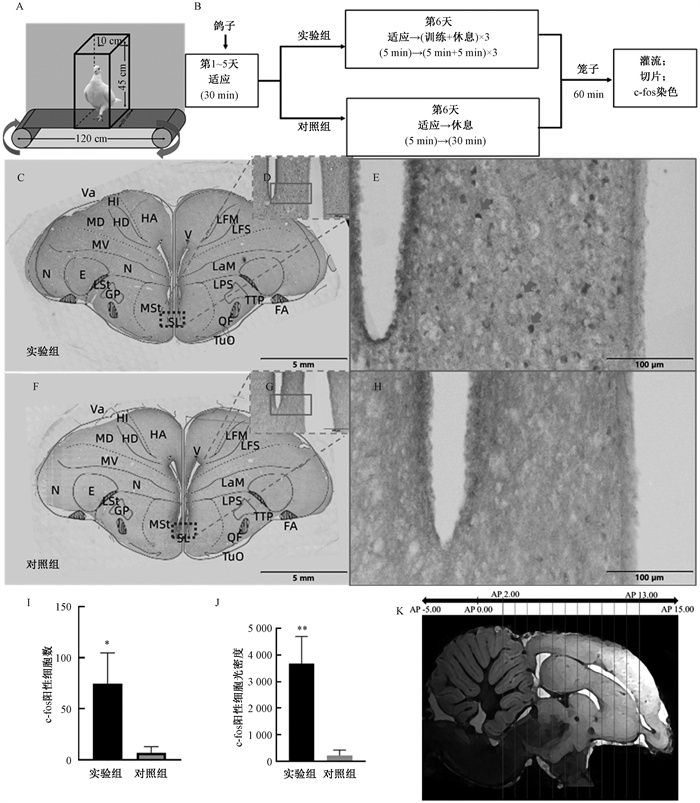
训练装置(图 1A):主要由皮带输送机(120 cm×20 cm,深圳市权邦自动化设备有限公司)和训练箱组成,皮带输送机主动运行后,带动鸽子形成被动侧向移动行为,机体速度为0~12 m/min可调。训练箱被固定在皮带输送机上,作用是将鸽子限制在固定位置并保持一定运动姿势,箱体由纸板拼接组成,内部长、宽、高分别为20、10和45 cm。
|
图 1 鸽子被动侧向移动行为训练范式和c-fos表达阳性神经核团 Fig. 1 Behavioral training paradigm of passive lateral movement in pigeons and c-fos-positive nuclei |
训练方案(图 1B):正常情况下,中枢神经系统中c-fos基因只有基础水平的表达,其mRNA和蛋白水平很低,但各种内外刺激会诱导其发生迅速、短暂且高水平的表达。C-fos表达量在一定程度上与刺激强度正相关,当受到刺激后5 min内出现转录活性,其mRNA在15~20 min内达到峰值随后降低,而在约30 min后翻译出蛋白,在60~90 min达到峰值并持续2~5 h,随后逐渐降低[12-13]。因此,我们将鸽子分为实验组(实验动物样本量n=3)和对照组(n=3)。实验组:①适应。鸽子每日固定时间(15:00)由固定人员抓取并放入训练箱,持续5 d,使鸽子适应环境及人员操作。②训练。第6天对鸽子进行运动训练,鸽子放入训练装置适应5 min,然后进行侧移训练,即右侧移5 min,休息5 min,交替重复3次(耗时30 min),速度为1.3 m/min,然后放回鸽笼,1 h后进行灌流取脑。对照组:第6天仅将鸽子放入训练装置适应5 min,静止30 min,其他与实验组相同。
1.3 基于c-fos方法定位相关神经核团鸽子训练完成后,腹腔注射过量3%戊巴比妥钠溶液麻醉,然后进行心脏灌流(0.9%氯化钠溶液和4%多聚甲醛溶液各100 mL),取出完整脑组织,梯度脱水后(15%和30%蔗糖溶液),OCT(118 mL,樱花,美国)包埋,进行全脑冠状冰冻切片(厚度25 μm)。取AP 13.00~2.00(间隔1 mm)冠状切片(图 1K)进行c-fos免疫组化染色,通过观察比较实验组与对照组切片(图 1C、F),确定阳性神经元的分布。
切片免疫组化染色前需放于恒温干燥箱中37 ℃过夜,c-fos免疫组化染色主要过程:切片放入0.01 mol/L PBS室温恢复5~10 min,滴加0.3% H2O2,室温孵育5~10 min,0.01 mol/L PBS冲洗,5 min×3次;在Tris-EDTA抗原修复液中,微波炉热修复,0.01 mol/L PBS冲洗,5 min×3次;滴加5%封闭用正常山羊血清,37 ℃孵育30 min后甩干,滴加c-fos一抗(体积比1∶200溶于PBS,Santa Cruz Biotechnology,美国),4 ℃过夜,0.01 mol/L PBS冲洗,5 min×3次;滴加生物素标记山羊抗小鼠IgG(武汉博士德生物工程有限公司),37 ℃孵育30 min,0.01 mol/L PBS冲洗,5 min×3次;滴加SABC,37 ℃孵育30 min,0.01 mol/L PBS冲洗,5 min×3次;滴加DAB显色剂8~12 min,脱水透明,中性树脂封片。
1.4 外侧隔核行为表达的电刺激验证成年鸽子3只,将双绞不锈钢微刺激电极植入外侧隔核(n=3),鸽子按照0.13~0.16 mL/(100 g)体重的比例腹腔注射3%戊巴比妥钠溶液进行麻醉,头部固定在脑立体定位仪(深圳瑞沃德生命科技有限公司)上,盐酸利多卡因(0.1~0.2 mL)皮下注射进行局麻,开颅后,按照立体定位法向鸽子外侧隔核植入电极(表 1),用自攻螺丝和牙科水泥固定电极。鸽子恢复一周后,使用YC-2程控刺激仪(成都仪器厂)进行电刺激实验,视频记录并观察鸽子在不同电刺激强度下(0.3~0.8 mA)的行为表现,刺激模式为恒流串双刺激,刺激强度为0.3~0.8 mA,延时为20 ms,波宽为5 ms,波间隔为50 ms,脉冲数为20,频率为20 Hz。鸽子需进行3组刺激测试,每组刺激之间间隔3~5 d,一组测试中每只鸽子的每个刺激强度需重复三次,主周期为60 s,不同刺激强度之间间隔约3~5 min。
|
|
表 1 电极植入位点 Tab. 1 Electrode implantation sites |
鸽子电刺激实验结束后,采用蓝点标记法验证电极植入位点准确性。鸽子定时恒压直流电(6 V,30 s)刺激后,心脏灌注0.9%氯化钠溶液、2%亚铁氰化钾溶液和4%多聚甲醛溶液各100 mL,取脑、切片、HE染色。
1.5 数据统计与分析使用研究级全玻片扫描系统(VS200,奥林巴斯)对切片结果进行观察扫描,使用OlyVIA软件对图像进行观察,确定c-fos阳性细胞所在核团,参照2004年鸟类脑重命名大会所修订的命名法[14]。通过GraphPad Prism 8对外侧隔核c-fos阳性细胞数和光密度值进行统计分析和作图,使用独立t检验进行统计学分析。
比较分析鸽子电刺激前后的运动行为变化,对记录到的行为出现的种类、运动的步数以及响应次数进行统计分析。
2 结果 2.1 C-fos表达阳性神经核团统计C-fos阳性神经元主要为卵圆形或锥形小圆点(如图 1E)。外侧隔核是c-fos表达较高的核团之一(图 1C~J),对外侧隔核c-fos表达细胞数和单位面积(1 mm2)光密度值进行统计分析,结果表明(图 1F、J),外侧隔核c-fos表达数目明显增多(独立t检验显著性水平P < 0.05)累计光密度值增加(P < 0.01),差异显著,表明外侧隔核是端脑参与度较高的核团之一。
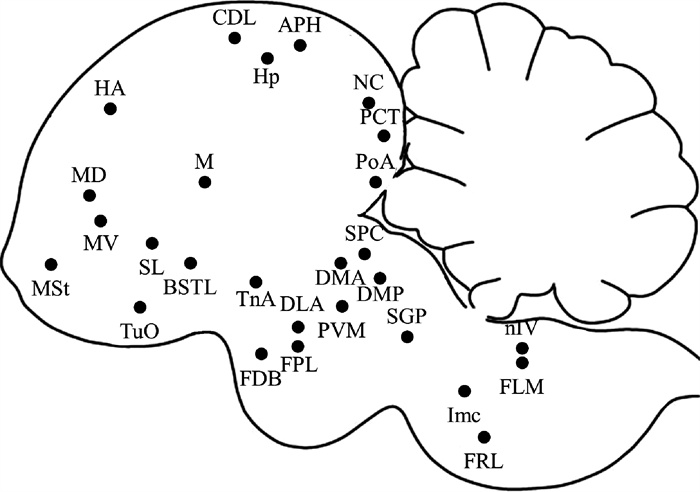
共标记到c-fos表达阳性核团25个,端脑中标记到15个,间脑4个,中脑6个(图 2及表 2),其中端脑的内侧纹状体(medial striatum)、外侧隔核、杏仁核后皮质(posterior pallial amygdala)以及中脑的浅表小细胞核(parvocellularis)有较高密度的c-fos阳性标记。
|
图 2 C-fos阳性核团在鸽脑中的分布 Fig. 2 Distribution of c-fos positive nuclei in pigeon brain |
|
|
表 2 鸽脑c-fos阳性核团统计 Tab. 2 Statistics of c-fos positive nuclei in pigeon brain |
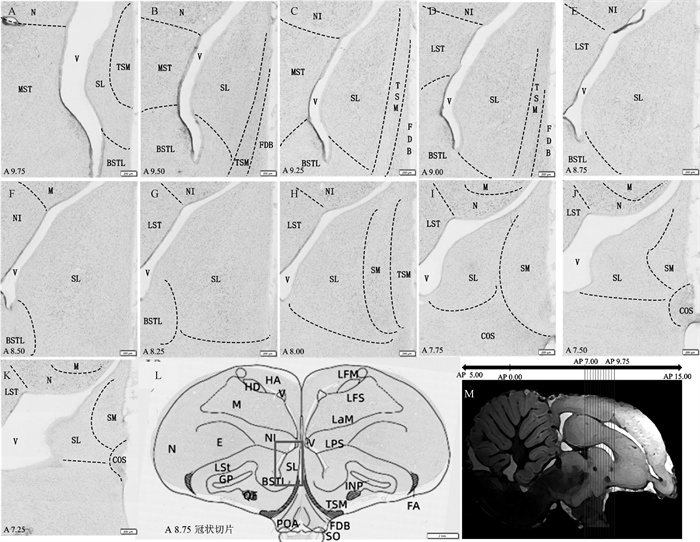
在冠状切片中(图 3),鸽子外侧隔核位于喙部端脑中下部靠近中缝的区域,呈扁椭圆形,背外侧被脑室和中缝包围,内侧与内侧隔核(nucleus septalis medialis)和中隔中脑束(tractus septopallio-mesencephalicus)相邻,腹侧被终纹床核外侧部(bed nucleus of the striaterminalis, lateral part)和隔连核(nucleus commissuralis septi)包围,空间立体定位范围为AP: 7.25~9.75 mm, ML: 0~1.50 mm, D: 4.00~7.00 mm。
|
图 3 不同冠状水平外侧隔核解剖图 Fig. 3 Anatomy of SL nuclei at different coronal levels |
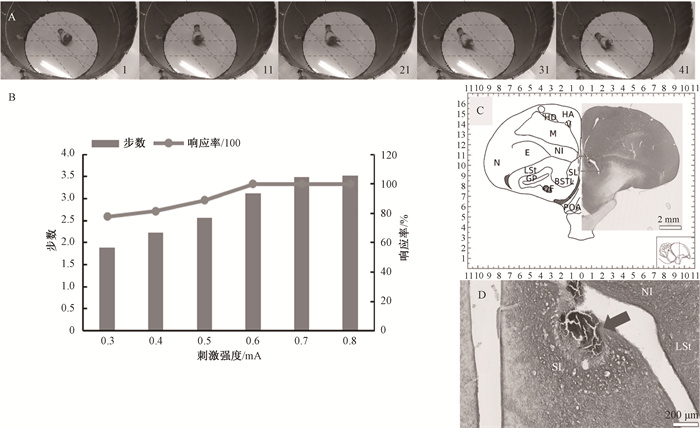
电刺激前后鸽子行为变化明显(n=3)(表 3),在电刺激之前,鸽子表现主要为安静、行为很少、偶尔有伸颈观察、啄羽等。电刺激后,鸽子出现稳定的同侧侧向移动行为(图 4A),偶尔伴随有运动后恢复原位的前行和侧移动作以及甩尾、伸颈、扇翅等行为。在不同电刺激强度(0.3~0.8 mA)下,同侧侧移行为出现的步数和响应率随电刺激强度的增加而增加(图 4B),在0.7 mA以上时响应率达到100%,并且步数大于3,最佳电刺激强度为0.7 mA。标记结果表明电极尖端植入外侧隔核内(图 4C、D)。
|
|
表 3 电刺激前后鸽子行为变化 Tab. 3 Behavioral changes of pigeons before and after electrical stimulation |
|
图 4 电刺激验证鸽子外侧隔核对侧向移动的作用 Fig. 4 Electrical stimulation to verify the function of the pigeon SL nuclei for lateral movement |
本文构建了鸽子被动侧向移动行为训练范式,利用c-fos免疫组化方法可以较为精确地确定调控鸽子运动行为的神经核团。外侧隔核是端脑参与度较高的核团之一,采用尼氏染色方法确定了鸽子外侧隔核的空间位置结构,采用电刺激方法验证了鸽子外侧隔核调控侧向移动行为的功能。
采用基于被动侧向移动行为表型范式,通过刺激鸽子中枢神经系统运动相关神经核团产生c-fos表达的方法,筛选出一系列阳性核团,选取其中的外侧隔核[15]进行电刺激验证。结果表明,电刺激鸽子外侧隔核能产生稳定的同侧侧移行为,证明利用c-fos免疫组化方法可以较为精确地确定鸽子调控运动行为的神经核团。对于c-fos方法定位到的阳性核团,有研究指出海马、海马旁区和斜交纤维束通过纤维与外侧隔核相互联系,参与处理和保持空间信息,并参与目标导向行为的调控[16-17];中脑网状结构外侧部位于中脑运动区,与中脑网状结构内侧部相联系,参与身体一侧移动[5],与本研究的运动表现相符。另外,还标记到了鸽子端脑上皮质、中皮质和下皮质等,这些高级皮质参与视觉与听觉的信息处理和学习,类似于哺乳动物的大脑皮层的一部分[18-20];后皮质杏仁核、终纹核、带状杏仁核属于后皮质杏仁核复合体的一部分,参与鸟类情绪表达与调控[2];灰质和室周纤维膜参与恐惧情绪的调控[21];丘脑背内核前部和丘脑背内核后部参与学习和记忆的产生[22],这些结果表明,鸽子的被动侧向移动行为调控过程中,有高级皮质以及情绪等功能核团参与。
本文采用尼氏染色方法对外侧隔核空间位置结构进行了定位,鸽子外侧隔核位于喙部端脑中下部靠近中缝的区域,与内侧隔核、隔海马核和尾中央隔共同构成隔区[23]。哺乳动物脑研究中,关于外侧隔核的结构与功能的研究较为成熟[15, 24-26],通常哺乳动物的外侧隔核依据其空间位置及接收和投射不同神经核团的神经分布,分为背侧、腹侧、喙侧和尾侧四个部分[15],但鸟类外侧隔核未见有亚区划分[27]。在本研究中我们将外侧隔核视为一个整体,其亚区划分有待于进一步研究。
电刺激鸽子外侧隔核主要引起的同侧侧移行为属于滑步侧移,而非交叉步侧移。在哺乳动物脑研究中,外侧隔核的结构和功能研究较为成熟,其接受Hp的主要输出,参与对情绪、动机、代谢和摄食等行为的调控,并且参与介导目标定向行为,输出与“综合运动价值信号”一致[15, 24],这与本研究中鸽子主要运动行为表现一致。
本研究证明了采用被动训练,利用c-fos免疫组化方法可以较为精确地确定调控鸽子运动行为的神经核团,鸽子外侧隔核可用于侧向移动行为的神经调控靶点核团,为鸽子机器人运动行为控制研究提供了重要研究方法和技术支持。
| [1] |
NAKAMURA K, NAKAMURA Y, KATAOKA N. A hypothalamomedullary network for physiological responses to environmental stresses[J]. Nature reviews neuroscience, 2022, 23(1): 35-52. DOI:10.1038/s41583-021-00532-x (  0) 0) |
| [2] |
TIAN X M, SHI Y H, ZHANG Y F, et al. The role of posterior pallial amygdala in mediating motor behaviors in pigeons[J]. Scientific reports, 2022, 12: 367. DOI:10.1038/s41598-021-03876-7 (  0) 0) |
| [3] |
JANG J, BAEK C, KIM S, et al. Current stimulation of the midbrain nucleus in pigeons for avian flight control[J]. Micromachines, 2021, 12(7): 788. DOI:10.3390/mi12070788 (  0) 0) |
| [4] |
HUAI R T, YANG J Q, WANG H. The robo-pigeon based on the multiple brain regions synchronization implanted microelectrodes[J]. Bioengineered, 2016, 7(4): 213-218. DOI:10.1080/21655979.2016.1197033 (  0) 0) |
| [5] |
CAI L, DAI Z D, WANG W B, et al. Modulating motor behaviors by electrical stimulation of specific nuclei in pigeons[J]. Journal of bionic engineering, 2015, 12(4): 555-564. DOI:10.1016/S1672-6529(14)60145-1 (  0) 0) |
| [6] |
苏学成, 槐瑞托, 杨俊卿, 等. 控制动物机器人运动行为的脑机制和控制方法[J]. 中国科学: 信息科学, 2012, 42(9): 1130-1146. SU X C, HUAI R T, YANG J Q, et al. Brain mechanism and methods for robo-animal motor behavior control[J]. Scientia sinica (informationis), 2012, 42(9): 1130-1146. (  0) 0) |
| [7] |
LV Y, CHEN P, SHAN Q H, et al. Regulation of cued fear expression via corticotropin-releasing-factor neurons in the ventral anteromedial thalamic nucleus[J]. Neuroscience bulletin, 2021, 37(2): 217-228. DOI:10.1007/s12264-020-00592-6 (  0) 0) |
| [8] |
ROOK N, LETZNER S, PACKHEISER J, et al. Immediate early gene fingerprints of multi-component behaviour[J]. Scientific reports, 2020, 10: 384. DOI:10.1038/s41598-019-56998-4 (  0) 0) |
| [9] |
NAKAHARA T S, DE ANDRADE CARVALHO V M, DE ANDRADE SOUZA M A, et al. Detection of activated mouse neurons with temporal resolution via dual c-fos staining[J]. STAR protocols, 2020, 1(3): 100153. DOI:10.1016/j.xpro.2020.100153 (  0) 0) |
| [10] |
DUQUE F G, RODRIGUEZ-SALTOS C A, UMA S, et al. High-frequency hearing in a hummingbird[J]. Science advances, 2020, 6(29): eabb9393. DOI:10.1126/sciadv.abb9393 (  0) 0) |
| [11] |
PERNÍA-ANDRADE A J, WENGER N, ESPOSITO M S, et al. Circuits for state-dependent modulation of locomotion[J]. Frontiers in human neuroscience, 2021, 15: 745689. DOI:10.3389/fnhum.2021.745689 (  0) 0) |
| [12] |
CULLINAN W E, HERMAN J P, BATTAGLIA D F, et al. Pattern and time course of immediate early gene expression in rat brain following acute stress[J]. Neuroscience, 1995, 64(2): 477-505. DOI:10.1016/0306-4522(94)00355-9 (  0) 0) |
| [13] |
李娜然, 商丽宏, 杨宇, 等. CNQX拮抗断尾诱发小鼠前扣带回皮质神经元c-fos基因的表达[J]. 中国医科大学学报, 2020, 49(4): 318-320. LI N R, SHANG L H, YANG Y, et al. Tail amputation induced c-fos gene expression in the anterior cingulate cortex neurons is antagonized by CNQX in mice[J]. Journal of China medical university, 2020, 49(4): 318-320. (  0) 0) |
| [14] |
REINER A, PERKEL D J, BRUCE L L, et al. Revised nomenclature for avian telencephalon and some related brainstem nuclei[J]. Journal of comparative neurology, 2004, 473(3): 377-414. DOI:10.1002/cne.20118 (  0) 0) |
| [15] |
WIRTSHAFTER H S, WILSON M A. Lateral septum as a nexus for mood, motivation, and movement[J]. Neuroscience & biobehavioral reviews, 2021, 126: 544-559. (  0) 0) |
| [16] |
HÄUSLER C O, EICKHOFF S B, HANKE M. Processing of visual and non-visual naturalistic spatial information in the "parahippocampal place area"[J]. Scientific data, 2022, 9: 147. DOI:10.1038/s41597-022-01250-4 (  0) 0) |
| [17] |
ATOJI Y, WILD J M, YAMAMOTO Y, et al. Intratelencephalic connections of the hippocampus in pigeons (Columba livia)[J]. Journal of comparative neurology, 2002, 447(2): 177-199. DOI:10.1002/cne.10239 (  0) 0) |
| [18] |
ATOJI Y, WILD J M. Afferent and efferent projections of the mesopallium in the pigeon (columba livia)[J]. Journal of comparative neurology, 2012, 520(4): 717-741. DOI:10.1002/cne.22763 (  0) 0) |
| [19] |
MANNS M, FREUND N, PATZKE N, et al. Organization of telencephalotectal projections in pigeons: impact for lateralized top-down control[J]. Neuroscience, 2007, 144(2): 645-653. DOI:10.1016/j.neuroscience.2006.09.043 (  0) 0) |
| [20] |
KOSHIBA M, YOHDA M, NAKAMURA S. Topological relation of chick thalamofugal visual projections with hyper pallium revealed by three color tracers[J]. Neuroscience research, 2005, 52(3): 235-242. DOI:10.1016/j.neures.2005.03.017 (  0) 0) |
| [21] |
MELLEU F F, LINO-DE-OLIVEIRA C, MARINO-NETO J. The mesencephalic GCt-ICo complex and tonic immobility in pigeons (Columba livia): a c-fos study[J]. Brain structure & function, 2017, 222(3): 1253-1265. (  0) 0) |
| [22] |
ENDEPOLS H, JUNGNICKEL J, BRAUN K. Physiological and morphological characterization of[J]. Neural plasticity, 2001, 8, 8(4): 219-240. DOI:10.1155/NP.2001.219 (  0) 0) |
| [23] |
REINER A, YAMAMOTO K, KARTEN H J. Organization and evolution of the avian forebrain[J]. The anatomical record part A: discoveries in molecular, cellular, and evolutionary biology, 2005, 287A(1): 1080-1102. DOI:10.1002/ar.a.20253 (  0) 0) |
| [24] |
WIRTSHAFTER H S, WILSON M A. Differences in reward biased spatial representations in the lateral septum and hippocampus[J]. Elife, 2020, 9: e55252. DOI:10.7554/eLife.55252 (  0) 0) |
| [25] |
LEROY F, PARK J, ASOK A, et al. A circuit from hippocampal CA2 to lateral septum disinhibits social aggression[J]. Nature, 2018, 564(7735): 213-218. DOI:10.1038/s41586-018-0772-0 (  0) 0) |
| [26] |
JIANG J X, LIU H, HUANG Z Z, et al. The role of CA3-LS-VTA loop in the formation of conditioned place preference induced by context-associated reward memory for morphine[J]. Addiction biology, 2018, 23(1): 41-54. DOI:10.1111/adb.12468 (  0) 0) |
| [27] |
MONTAGNESE C M, SZÉKELY A D, ÁDÁM Á, et al. Efferent connections of septal nuclei of the domestic chick (Gallus domesticus): an anterograde pathway tracing study with a bearing on functional circuits[J]. Journal of comparative neurology, 2004, 469(3): 437-456. DOI:10.1002/cne.11018 (  0) 0) |
 2023, Vol. 55
2023, Vol. 55


