2. 郑州大学 化学与分子工程学院 河南 郑州 450001
2. College of Chemistry and Molecular Engineering, Zhengzhou University, Zhengzhou 450001, China
伏马菌素作为一种霉菌毒素,是串珠镰刀菌和再育镰刀菌代谢产生的水溶性物质[1-2].特别是伏马菌素B1(FB1)毒性较强,对食品及谷物污染的情况在世界范围内普遍存在.FB1不仅降低了农产品和饲料的品质,使经济遭受巨大损失,而且还可以通过污染了FB1的肉、乳等动物源性食品进入人体,给人们的健康造成威胁[3].研究表明,FB1能引起马脑质软化症和神经性中毒而呈现运动失调和意识障碍甚至死亡,还能使猪产生肺水肿综合征,并有肝、肾毒性,可致动物肝癌和食道细胞增生[4].FB1可能会诱发人类患食道癌等疾病,已被国际癌症中心划为2B类致癌物.另外,据联合国粮食与农业组织(FAO)统计结果显示,现已有6个国家制订了玉米中FB1的限量标准,而我国对FB1的毒性研究还较少,尚未制订食品与饲料中FB1的限量标准.因此,迫切需要测定谷物及其制品中FB1的含量,故建立测定伏马菌素的快捷、精确、安全的检测方法意义深远.
对伏马菌素的痕量检测,国内外已有薄层色谱(TCL)、高效液相色谱(HPLC)[5]、色谱与质谱联用技术(LC-MS)[6]、金免疫层析(GICA)[7]及酶联免疫吸附测定(ELISA)[8]等方法.虽然HPLC或LC-MS等仪器检测方法准确性、重现性好,但样品前处理过程复杂,损耗量大,仪器昂贵,限制了其在大批量实际样品检测中的广泛应用;而ELISA免疫法的灵敏度偏低.因此,亟须建立一种快速简便、特异性好、灵敏度高的检测方法.
化学发光酶联免疫分析(chemiluminescence enzyme-linked immunoassay,CLEIA)的灵敏度高,线性范围宽,无须复杂的样品前处理,操作简便,分析速度快,可实现自动化.基于鲁米诺-H2O2-HRP的经典化学发光体系,发光信号会衰减,限制了其广泛应用.研究发现,当加入一些酚类物质,背景值会被抑制,发光信号不同程度地被增强,且发光时间有所延长.本实验选取的增强剂为对羟基联苯(PPP),与其他酚类增强剂对比,其增强效果更为显著.据此,本实验建立了一种FB1的快速CLEIA检测方法——增强化学发光酶联免疫分析(enhanced chemiluminescence enzyme-linked immunoassay,ECLEIA),并对实际样品进行了检测.
1 材料与方法 1.1 主要仪器化学发光免疫分析仪(Centro XS3 LB960,BERTHOLD公司);紫外可见分光光谱仪(UV-1601,日本岛津公司);红外光谱仪(PE-1710,西德PE公司);电热恒温培养箱(DHG-9146A,上海精宏实验设备有限公司).
1.2 主要试剂及溶液FB1单抗(Santa Cruz Biotechnology)、FB1标准抗原(Sigma)、鲁米诺(Sigma)、过氧化氢(昊天化学有限公司)、辣根过氧化物酶(Sanland)、对羟基联苯(阿拉丁)、牛血清白蛋白(Sigma);所用试剂均为分析纯,水为MillQ纯水.
包被液:Tris-HCl缓冲液(pH 9.6);封闭液:1%OVA的PBS缓冲液;洗涤液:0.05 mol/L的PBS缓冲液(含0.05%的TRITON-X100);样品稀释液:0.05 mol/L的PBS缓冲液(pH 7.4).显色液A:鲁米诺+对羟基联苯;显色液B:新鲜配制的过氧化氢(H2O2)溶液.
1.3 样品的前处理分别将正常小麦、霉变小麦和霉变玉米粉碎、研磨,过分子筛,然后进行四分法缩分.取5 g样品放入100 mL具塞试管中,加入75%的甲醇-水溶液50 mL,振荡30 min,离心15 min,滤纸过滤,4 ℃保存备用,并用PBS缓冲液做适量稀释后进行检测.
1.4 FB1酶标记物的制备根据文献[9],采用酶联免疫吸附方法,在线性范围内将不同方法制备的偶联物用于FB1标准品的测定.结果显示,一步戊二醛法有较大的响应值,灵敏度最高,故选择一步戊二醛法制备FB1-HRP偶联物并对其进行鉴定.
1.5 ECLEIA方法的建立化学发光底物浓度的大小直接影响相对光单位(RLU)的大小,从而影响测定方法的灵敏度.故对鲁米诺浓度、H2O2浓度、增强剂浓度、体系的pH值进行优化.经过优化,用包被液稀释FB1单克隆抗体至所需浓度,移取100 μL到96孔微孔板(灭菌处理)上,37 ℃温育2 h,洗涤3次,拍干.每孔加入200 μL封闭液,37 ℃温育2 h,洗涤5次,拍干.每孔加入不同浓度的FB1标准溶液、FB1-HRP偶联物各100 μL,每行的前两孔为空白对照孔(0.01 mol/L、pH 7.4的PBS缓冲液),37 ℃温育1 h,洗涤5次,拍干.每孔依次各加入等量的显色液A和B,于化学发光免疫分析仪上测定各孔的RLU.
1.6 方法学评价 1.6.1 标准曲线的绘制用PBS缓冲液(pH 7.4)配制质量浓度分别为200、400、800、1 000、1 200、1 400 μg/L的FB1标准溶液,按1.5中步骤进行ECLEIA,测定不同质量浓度下的RLU,根据FB1的标准质量浓度与RLU的关系,应用不同形式的方程对其进行线性拟合.
1.6.2 精密度评价取一块聚苯乙烯板,分别配制低、中、高3个水平质量浓度(400、800、1 200 μg/L)样品,每个水平平行测定6次,得出板内标准偏差;另取不同的聚苯乙烯板采用直接竞争ECLEIA测定FB1的含量,分别配制400、800、1 200 μg/L 3个水平质量浓度样品,每个水平平行测定6次,求出各自的板间标准偏差,考察该方法的精密度.
1.6.3 准确度评价采用加标回收率的方法对所建立方法的准确度进行评价,在空白样品中加入质量浓度分别为200、600、800 μg/L的FB1标准品,按照1.5中步骤测定加标孔的发光值,根据标准曲线求出加标回收率,考察该方法的准确度.
1.6.4 特异性评价选取真菌毒素呕吐毒素(DON)、玉米赤霉烯酮(ZEN)、黄曲霉毒素B1(AFB1),用PBS缓冲液配制各系列不同质量浓度样品,按照ECLEIA标准曲线的操作步骤得到相应的抑制率,然后计算交叉反应率,过程如下:以不同质量浓度的抗原和结构类似抗原物质分别求各自的IC50(当发光衰减至最大相对光单位一半时该物质的质量浓度),按公式S=y/Z×100%(S为交叉反应率;y为抗原的IC50;Z为结构类似抗原物质的IC50)计算交叉反应率,考察该方法的特异性.
1.6.5 方法学比较把已建立的ECLEIA法用于小麦样品中FB1的检测,分别在不含FB1的小麦样品中加入已知浓度的FB1标准品制成待测样本,按照1.5节中的步骤进行操作,检测小麦样品中FB1的含量.用FB1的常用检测方法(HPLC[10]、ELISA[11])对加标小麦样品进行检测,并进行方法学的比较,同时用ECLEIA与HPLC对霉变小麦、霉变玉米进行了测定.
2 结果与讨论 2.1 ECLEIA的原理ECLEIA的原理如图 1所示.采用直接竞争法[12],首先将FB1单克隆抗体包被到固相载体上,孵育后洗涤、封板.然后加入待测抗原和同种酶标记抗原的混合溶液,使之与固相抗体发生竞争性反应,对照孔只加酶标抗原,孵育后洗涤.结合的酶标抗原量和待测抗原量成反比,加入发光底液和增强剂,对羟基联苯可作为HRP的第二反应底物,显著加快酶的循环速度,增大鲁米诺游离基的浓度,从而增强化学发光强度,产生发光.
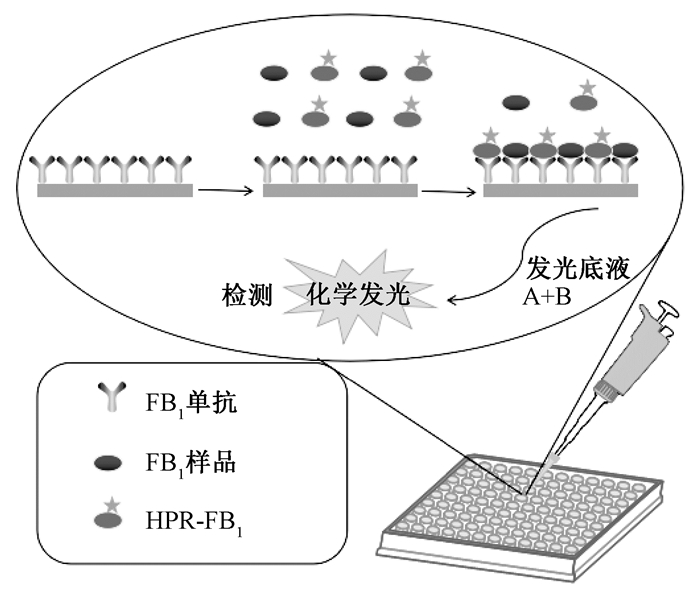
|
图 1 ECLEIA原理示意图 Figure 1 ECLEIA principle diagram |
FB1、HRP和FB1-HRP的紫外可见光谱见图 2.HRP在405、265、205 nm有最大吸收峰;FB1在200 nm附近有最大吸收峰;而FB1-HRP在405、265、205 nm也有最大吸收峰,初步推断偶联成功.
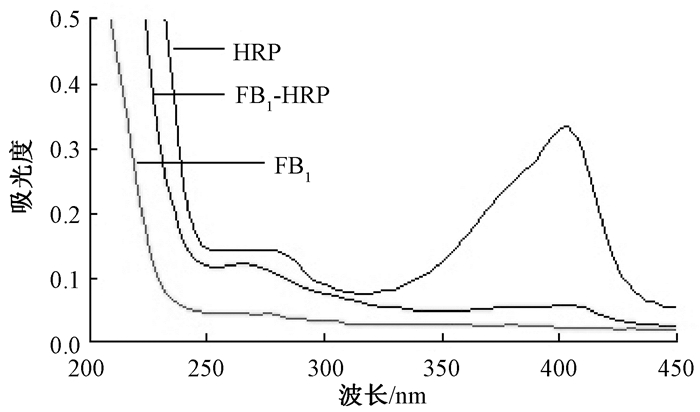
|
图 2 FB1、HRP和FB1-HRP的紫外可见光谱 Figure 2 UV-Vis spectra of FB1, HRP and FB1-HRP |
FB1、HRP和FB1-HRP的红外吸收光谱见图 3.FB1-HRP在3 410~3 460 cm-1范围内具有较强、较宽的吸收峰,既有FB1分子N—H键伸展振动产生的3 410 cm-1吸收峰,也有HRP分子内O—H键伸展振动产生的3 462 cm-1吸收峰;并且在1 612 cm-1出现FB1的吸收峰,故可判断偶联成功.
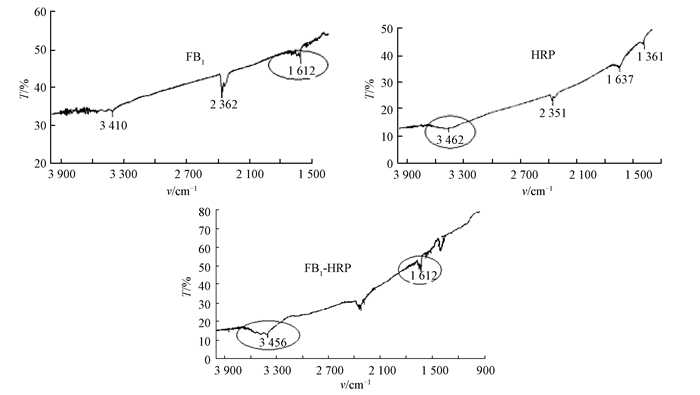
|
图 3 FB1、HRP和FB1-HRP的红外光谱 Figure 3 Infrared spectra of FB1, HRP and FB1-HRP |
由图 4可知,随着鲁米诺(luminol)浓度的增加,体系发光强度逐渐增加,当鲁米诺浓度大于7×10-4 mol/L时,发光值开始衰减,故选择鲁米诺的浓度为7×10-4 mol/L用于后续实验.同理,过氧化氢(H2O2)的浓度选择为4.0×10-3 mol/L,对羟基联苯(PPP)的浓度选择为2×10-4 mol/L,缓冲体系Tris-HCl的pH选择为8.5,此时RLU最大.
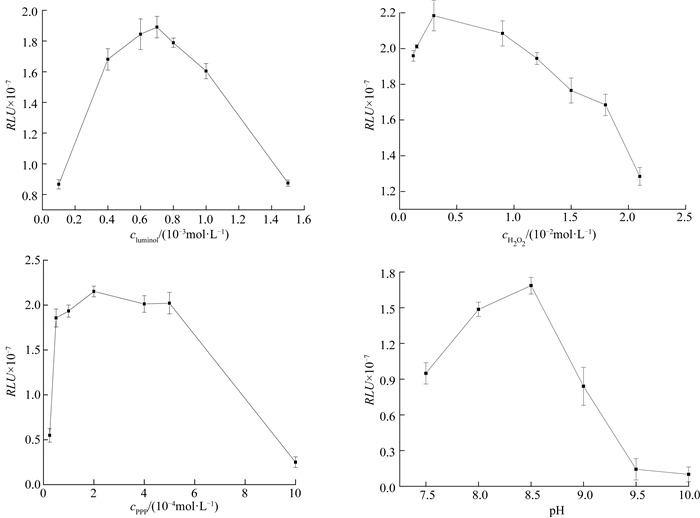
|
图 4 化学发光实验条件的优化 Figure 4 Optimization of chemical experiment conditions |
根据FB1标准品质量浓度与RLU的关系,应用不同形式的方程对其进行拟合,并计算不同回归方程的相关系数.选择实际走势和拟合曲线最吻合(即曲线相关系数最接近1.0)的方程,作为实验最终的线性方程.如表 1中用不同方法进行拟合的相关系数R中,B/B0-C与RLU-C数值接近,考虑到检测限及回收率的计算,最终采用B/B0-C为本实验的标准曲线方程,在200~1 400 μg/L范围内,回归方程为y=-0.000 3x+0.857 4,相关系数R=0.991 6,R2=0.983 3.
|
|
表 1 拟合的标准曲线及相关系数的比较 Table 1 The standard curves and the comparision of correlation coefficient |
通过表 2中数据可知,采用直接竞争ECLEIA方法检测FB1,在低、中、高3个质量浓度的板内相对标准偏差为9.1%~10.2%(n=6),板间相对标准偏差为10.6%~12.4%(n=6).由此可以看出,建立的方法精密度很好,可以用于实际样品的检测.
|
|
表 2 直接竞争ECLEIA方法的板内和板间的相对标准偏差(n=6) Table 2 The RSD of intra-and inter-assay of dc-ECLEIA method (n=6) |
由表 3数据可知,高、中、低3个质量浓度的加标回收率在85.9%~115.4%范围内,整体而言,方法准确度良好,可以用于实际样品的检测.
|
|
表 3 加标回收率测定结果(n=6) Table 3 The results of the standard addition recovery rate(n=6) |
通过对比谷物中常见的3种生物毒素DON、ZEN、AFB1,对方法的特异性进行了论证.由表 4可知,FB1单抗针对谷物中常见的3种生物毒素的交叉反应率(S)均低于2.0%,接近无交叉反应,说明伏马菌素FB1单克隆抗体对其他真菌毒素无特异性反应,从而间接表明了建立的ECLEIA方法测定FB1具有良好的特异性.
|
|
表 4 ECLEIA方法测定FB1的特异性(n=6) Table 4 The specificity of FB1 by ECLEIA(n=6) |
用FB1的传统检测方法(HPLC[10]、ELISA[11])对加标小麦样品进行检测,并进行方法学的比较,评价3种检测方法的特点.3种方法的检测限、线性范围、回收率及精密度结果如表 5所示.并同时用ECLEIA与HPLC对霉变小麦、霉变玉米进行测定,结果如表 6所示.
|
|
表 5 3种方法测定FB1的结果比较 Table 5 The result comparison of FB1 by three methods |
|
|
表 6 ECLEIA与HPLC测定霉变小麦、霉变玉米比较 Table 6 The comparision between ECLEIA and HPLC which detected the degenerative wheat and corn |
由表中数据分析可知,虽然ECLEIA、ELISA两种方法具有免疫分析方法所特有的低成本、高通量、预处理简单及快速等优点,但光吸收是ELISA方法检测的特点,OD值会受到外源性物质的影响;而ECLEIA方法与其他发光现象的区别在于发光来源的不同,它吸收化学反应过程中释放的能量,避免了外来光源的干扰,提高了信噪比,增强剂和仪器光电倍增管的存在可增强发光强度以及延长发光时间,从而提高了体系检测的灵敏度.
从前处理角度看,ECLEIA和ELISA占据优势,但ELISA方法的线性范围窄;从样品检测的灵敏度角度看,ECLEIA和HPLC差别不大,都能满足大多数样品中真菌毒素最低限量标准检测的要求.因此,ECLEIA方法对于真菌毒素的监控有很大的应用前景.
3 结论用以鲁米诺-HRP-H2O2-对羟基联苯为体系的增强化学发光酶联免疫分析法(ECLEIA)对FB1含量进行了测定,方法检测限为91.3 μg/L,线性范围为200~1 400 μg/L,与其他常用检测方法(HPLC法和ELISA法)进行方法学比较,得出了ECLEIA法具有高灵敏度和高特异性,检测快速,样品前处理简单,适用于大批量样本的检测,能够对谷物中的痕量真菌毒素进行监测,并有望实现现场检测.
| [1] |
SHIN J, KIM J, MALAPI-WIGHT M, et al. Protein phosphatase 2A regulatory subunits perform distinct functional roles in the maize pathogen fusarium verticillioides[J]. Molecular plant pathology, 2013, 14(5): 518-529. DOI:10.1111/mpp.2013.14.issue-5 (  0) 0) |
| [2] |
GRENIER B, BRACARENSE A P, SCHWARTZ H E, et al. The low intestinal and hepatic toxicity of hydrolyzed fumonisin B1 corre-lates with its inability to alter the metabolism of sphingolipids[J]. Biochemical pharmacology, 2012, 83(10): 1465-1473. DOI:10.1016/j.bcp.2012.02.007 (  0) 0) |
| [3] |
VOSS K A, RILEY R T, GELINEAU-VAN W J, et al. Fumonisin B1 induced neural tube defects were not increased in LM/Bc mice fed folate-deficient diet[J]. Molecular nutrition and food research, 2014, 58(6): 1190-1198. DOI:10.1002/mnfr.201300720 (  0) 0) |
| [4] |
RHEEDER J P, MARASAS W F O, THIEL P G, et al. Fusarium moniliforme and fumonisins in corn in relation to human esophageal cancer in Transkei[J]. Phytopathology, 1992, 82(3): 353-357. DOI:10.1094/Phyto-82-353 (  0) 0) |
| [5] |
SANDRA J, MILICA Z B, ZELJKO M, et al. Extraction without organic solvents in the determination of fumonisins B1, B2, and B3 in maize by HPLC-FLD and ELISA tests[J]. Food analytical methods, 2015, 8(6): 1446-1455. DOI:10.1007/s12161-014-0030-5 (  0) 0) |
| [6] |
WANG Y T, XIAO C X, GUO J, et al. Development and application of a method for the analysis of 9 mycotoxins in maize by HPLC-MS/MS[J]. Journal of food science, 2013, 78(11): 1752-1756. DOI:10.1111/1750-3841.12187 (  0) 0) |
| [7] |
任文洁, 黄志兵, 许杨, 等. 伏马菌素B1胶体金免疫层析快速检测试纸条的研制[J]. 食品工业科技, 2015, 36(24): 58-63. (  0) 0) |
| [8] |
介明沙, 张卫民, 于斐, 等. 谷物中伏马菌素B1残留的直接竞争ELISA检测方法研究[J]. 河南工业大学学报(自然科学版), 2013, 34(3): 35-38. (  0) 0) |
| [9] |
张荷, 胡琼波, 刘承兰. 伏马菌素的毒性及其作用机理[J]. 西北农林科技大学学报(自然科学版), 2016, 44(1): 162-168. (  0) 0) |
| [10] |
金海涛, 张晓波, 任红波, 等. 高效液相色谱质谱法快速测定小麦中DON、ZON、T-2的残留方法研究[J]. 粮食加工, 2016(1): 73-75. (  0) 0) |
| [11] |
LING S M, PANG J, YU J J, et al. Preparation and identification of monoclonal antibody against fumonisin B1 and development of detection by Ic-ELISA[J]. Toxicon, 2014, 80(15): 64-72. (  0) 0) |
| [12] |
林金明, 赵利霞, 王栩. 化学发光免疫分析[M]. 北京: 化学工业出版社, 2008.
(  0) 0) |
 2017, Vol. 49
2017, Vol. 49


