食物的品质极易受微生物影响,单核细胞增生李斯特氏菌(Listeria monocytogenes, L. monocytogene),简称单增李斯特菌,是国际上公认的四大食源性致病菌之一[1],该菌在自然界中分布广泛,容易污染食品,其中在水产品及肉制品中的污染最为严重[2].
三文鱼,又名大马哈鱼或鲑鱼,因其肉质鲜美,营养价值高,口感好,是制作刺身的良好材料,也是最成功的水产养殖品种之一[3],但三文鱼容易因微生物酶和脂质自氧化而变质[4].目前最常见的三文鱼保鲜技术是低温、辐照、保鲜剂、真空包装等[5].在这些保鲜技术中,冰的贮藏被广泛应用,除了经济效益以外,冰还能提供低温和高湿环境,然而细菌在普通自来水冰中不能被有效灭活[6].因此,改进三文鱼冰鲜贮藏方法是一个亟待解决的问题.
大气压低温等离子体作为一种新型的物理杀菌技术,已被广泛应用于食品安全领域.等离子体活性成分复杂,其中活性氧(reactive oxygen species, ROS)被认为是杀菌的主要成分,它可以对细胞DNA、蛋白质、脂质和糖类等生物大分子造成氧化损伤,从而导致细胞死亡[7].此外,研究发现大气压低温等离子体中的电子、激发态原子、紫外线、自由基等成分在液面下可以和水分子相互作用产生更多种类的活性物质,这种被等离子体处理后富含活性成分的水溶液被称为大气压低温等离子体活化水(plasma-activated water, PAW)[8].近年来,PAW对多种食源性致病菌的杀灭效果也逐渐被发现[9-10],具有高效、简单、便携、安全等特点,极有可能替代和辅助传统食品杀菌技术.随着对PAW杀菌研究的不断深入,人们普遍认为PAW的杀菌能力归因于溶液的高氧化还原电位(oxidation-reduction potential, ORP)、低pH值以及过氧化氢的积累[8-10].PAW在低温环境下制备成的冰被称为等离子体活化水冰(PAW-ice),这是一个全新的概念.与自来水冰相比,PAW-ice不但具有冰的特性,可以提供低温环境,而且还具有PAW的特性,能够杀灭多种细菌.因此,PAW-ice有望成为一种全新的冰鲜杀菌技术.据文献所知,目前还没有关于PAW-ice在水产品杀菌保鲜方面的报道.
因此,本文首次探究PAW-ice对纯培养及接种于新鲜三文鱼片表面单增李斯特菌的杀灭效果.首先研究不同制备体系PAW-ice的杀菌效率和ORP、pH值、电导率等物理化学特性;并通过发射光谱技术检测等离子体中主要激发态活性物质;同时检测染菌三文鱼片在冷藏过程中总挥发性盐基氮(total volatile basic nitrogen, TVB-N)含量和pH值的变化.
1 实验材料与方法 1.1 实验材料 1.1.1 材料准备实验所用菌株为单核细胞增生李斯特氏菌(Listeria monocytogenes, L. monocytogene),菌种购买于中国普通微生物菌种保藏管理中心,菌株编号为ATCC 19115.
供试材料为新鲜三文鱼.三文鱼在当地家乐福超市购买,运回实验室后放置于4 ℃的冰箱储藏,直至使用.
1.1.2 细菌培养与三文鱼接种细菌培养:取0.1 mL甘油保藏的单增李斯特菌接种到30 mL胰蛋白胨大豆肉汤(tryptone soya broth, TSB)培养基中,37 ℃、180 rpm摇床培养24 h,之后平板划线,37 ℃恒温箱倒置孵育24 h.挑取单菌落到30 mL的TSB液体培养基中,37 ℃、180 rpm摇床培养16 h,测定OD值,稀释若干梯度后,最终得到菌液浓度为1×106 CFU/mL,以备下面处理菌悬液和浸染三文鱼片使用.
三文鱼片表面接种单增李斯特菌:将三文鱼从冰箱中取出,并切成约为2 cm×4 cm的片状(约5 g).并置于超净工作台紫外灯管下正反面照射20 min.然后将三文鱼片置于无菌培养皿中,在其两侧均匀涂抹1 mL上述准备好的菌悬液,置于超净工作台中充分晾干,每侧30 min.
1.1.3 大气压低温等离子体发生装置及PAW-ice的制备大气压低温等离子体发生装置:本研究采用一种空心电极介质阻挡放电装置产生大气压低温等离子体.该装置由高压交流电源(电压峰值为25 kV,频率为20 kHz)、铜制电极和绝缘介质石英管构成.本实验所用工作气体为空气,气体流速为300 slm,放电电压为100 kV,放电电流为0.48 mA.
PAW-ice制备:将等离子体射流末端置于无菌水液面下20 mm处进行放电处理制备PAW,然后再用改良过的制冰机将PAW制成PAW-ice.PAW-ice1是100 mL无菌水经等离子体活化30 min后制成冰;PAW-ice2、PAW-ice3分别是500 mL无菌水经等离子体活化30 min、60 min后制成冰.
1.2 PAW-ice处理 1.2.1 PAW-ice处理纯培养的单增李斯特菌悬液取0.5 mL上述准备好的菌悬液分别与9.5 mL的SW-ice、PAW-ice1、PAW-ice2和PAW-ice3分别作用0 min、5 min、15 min、30 min,其中SW-ice处理组设为对照组.
1.2.2 PAW-ice处理染菌三文鱼片因处理三文鱼片所需的冰较多,考虑到PAW-ice的制备成本,选用PAW-ice2用于后续实验.将人工染菌的三文鱼片分别置于1 500 mL PAW-ice(分3批制备,每批500 mL)和SW-ice上,每组5片,置于4 ℃保存5天,贮藏期间保证冰盒中的冰每天更换一次,其中SW-ice处理组设为对照组.
1.3 发射光谱诊断等离子体中的活性物质发射光谱法(optical emission spectrum, OES)是诊断等离子体中活性物质的常用方法[10].采用光谱仪(AvaSpec-2048-8, Avantes, 荷兰)检测等离子体在100~900 nm波长范围内的发射光谱信号.
1.4 PAW-ice主要理化特性测定本研究通过测定ORP、pH值和电导率来评估PAW-ice的物理化学特性.将制备好的PAW-ice在50 ℃水浴锅中快速融化,采用pH/ORP测量仪(Mettler-Toledo, LE501, 瑞士)和电导率仪(DDB-303A,上海雷磁)对刚制备好的PAW-ice的ORP、pH值及电导率进行即时检测.
1.5 PAW-ice的杀菌效果测定采用平板菌落计数法对细菌总数进行测定.纯培养单增李斯特菌杀菌效果评价:PAW-ice对细菌悬液处理结束后立即将混合物置于40 ℃水浴锅中融化2 min,取100 μL混合液用无菌水进行稀释涂布、计数.每组3个平行实验,结果以菌落总数的对数lg CFU/mL表示.
人工染菌三文鱼片杀菌效果评价:PAW-ice处理染菌三文鱼片5天,期间每天同一时间点取5 g三文鱼片于无菌均质袋中,加入45 mL无菌水,用均质器处理3 min,制成匀浆液,然后取100 μL匀浆液用无菌水进行稀释涂布、计数.每个时间点5个平行实验,结果以菌落总数的对数lg CFU/g表示.
1.6 三文鱼总挥发性盐基氮(TVB-N)测定总挥发性盐基氮(total volatile basic nitrogen, TVB-N)是评价鱼类品质的重要指标.本实验采用Lin等的方法测定三文鱼的TVB-N含量[11].每个时间点5个平行实验,结果以mg N/100 g表示.
1.7 三文鱼pH测定取5 g三文鱼片剪碎,加入90 mL蒸馏水漩涡震荡15 min后静置5 min,过滤后测定滤液pH.
1.8 统计学分析实验指标进行3次独立重复实验.数据以平均值±方差表示,并采用分析软件SPSS 17.0进行数据处理.冰的ORP、电导率、pH值、纯培养单增李斯特菌数以及同一处理组在不同贮藏时间的三文鱼表面单增李斯特菌数、鱼片pH值、TVB-N值数据的分析方法为Student-Newman-Keul’s法,P≤0.05表示数据间具有显著性差异;不同处理组在相同贮藏时间的三文鱼表面单增李斯特菌数量、鱼片TVB-N值、pH值数据的分析方法为配对t检验(paired-sample t-test),显著性差异表示为*P≤0.05、**P≤0.01、***P≤0.001.实验数据图均采用Origin 8.0作图.
2 结果与讨论 2.1 发射光谱诊断等离子体活性成分结果OES是诊断大气压低温等离子体中激发态活性成分的常用技术,可以根据谱线的位置分析得到粒子的种类,从而判断等离子体主要成分.如图 1所示,以空气为气源的大气压低温等离子体激发时,发射光谱以位于300~420 nm的N2第二正带系(C3Пu—B3Пg)、400~520 nm的N2+第一负带系(B2Σu—X2Σg)、560~730 nm的N2第一正带系(B3Пg—A3Пu)、730~900 nm的氮原子(N)和777 nm、844 nm的氧原子(O)为主[12].其中激发态N与O主要通过高能电子碰撞N2与O2解离产生的,途径如下:e+N2→N(4S)+N(2D)+e; e+O2→O(3P)+O(1D)+e[13].其次,在311~316 nm附近也检测到羟基自由基(OH)的谱峰,推测OH很可能是通过高能电子碰撞水蒸气解离产生的,途径为e+H2O→H+OH+e[14].
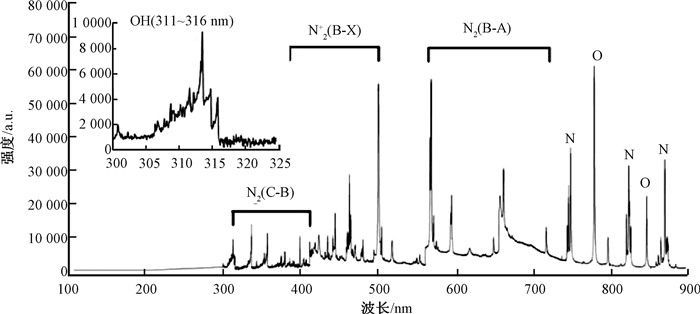
|
图 1 空气等离子体放电的发射光谱图. Fig. 1 End-on optical emission spectra of air plasma discharge |
强氧化性(高ORP值)可以破坏细胞,导致细菌的氧化损伤[10],因此ORP是评估PAW-ice是否具有杀菌能力的一个重要指标.如图 2(a)所示,最初SW-ice的ORP为187 mV,经过等离子体处理后,PAW-ice1、PAW-ice2、PAW-ice3的ORP分别显著上升至539 mV、571 mV、575 mV(P≤0.05),呈现强氧化性.其次,随着PAW制备时间延长,PAW-ice3的ORP仅略高于PAW-ice2,两者并没有显著差异(P>0.05),这说明对于500 mL制备体系而言,PAW-ice中的氧化性物质在等离子体处理30 min后就会达到饱和水平.
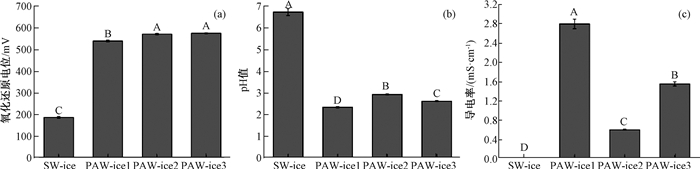
|
图 2 不同处理组氧化还原电位、pH、电导率的数值 Fig. 2 The values of ORP, pH and electrical conductivity in different groups A~D表示不同处理组数值具有显著性差异(P≤0.05). |
如图 2(b)所示,SW-ice的pH值为6.72,经过等离子体处理后,PAW-ice1、PAW-ice2、PAW-ice3的pH值分别显著下降至2.32、2.91、2.60(P ≤ 0.05).推测pH降低主要是由于大气压低温等离子体中带正电荷的离子与水分子发生置换反应产生H+(M++H2O→H2O++M; H2O++H2O→H+(H2O)+ ·OH)[15]或者由于以空气为工作气体产生硝酸和亚硝酸等酸性物质[14].对于相同的等离子体处理时间(PAW-ice1、PAW-ice2),随着PAW-ice制备体积增大,PAW-ice的pH值显著提高(P≤0.05),说明增大制备体积会导致酸性物质浓度降低;对于相同的制备体积(PAW-ice2、PAW-ice3),随着等离子体处理时间的延长,PAW-ice的pH值显著降低(P≤0.05),说明酸性物质含量随着处理时间的增加而累积.
电导率能反应溶液传导电流的能力,溶液中的带电离子越多,电导率越大[8].如图 2(c)所示,与SW-ice(电导率为1.96 μS/cm)相比,PAW-ice1、PAW-ice2、PAW-ice3的电导率均显著上升至2.8 mS/cm、0.58 mS/cm、1.6 mS/cm(P≤0.05).此结果表明大气压低温等离子体在PAW-ice中产生大量带电离子,推测这些带电离子可能是由于水分子和自由电子或带电粒子相互作用产生RONS或其他活性成分,在PAW-ice杀菌过程中发挥重要作用.对于相同的制备体积,PAW-ice3电导率明显高于PAW-ice2(P≤0.05),说明随着处理时间的增加,带电离子在PAW-ice中不断积累;对于相同的制备时间,PAW-ice1电导率明显高于PAW-ice2(P≤0.05),说明随着处理体积的增大,PAW-ice中的带电离子浓度降低.
2.3 PAW-ice对单增李斯特菌的杀菌效果 2.3.1 PAW-ice对纯培养李斯特菌的杀菌效果单增李斯特菌经过不同处理组(SW-ice、PAW-ice1、PAW-ice2、PAW-ice3)处理不同时间(0 min、5 min、15 min、30 min)的菌落总数结果如图 3所示.菌落的初始数量为6.2 lg CFU/mL,SW-ice处理5 min后,菌落数量下降至6.0 lg CFU/mL.随着处理时间的延长,菌落数量几乎维持不变(P>0.05),表明冰提供的低温环境并不能有效抑制细菌生长.但经PAW-ice处理后的细菌总数可以降低1~3 lg CFU/mL,显著低于SW-ice组(P≤0.05),说明PAW-ice对单增李斯特菌的杀菌效果主要是因为PAW具有较强的杀菌性能,而非冰提供的低温环境.
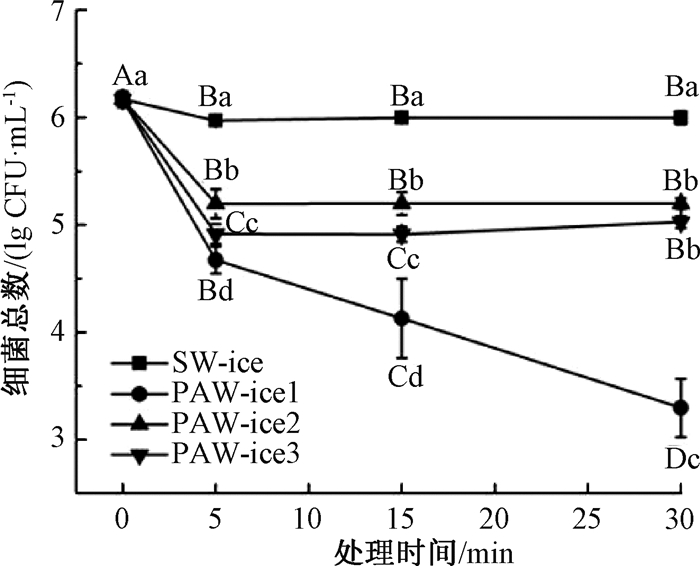
|
图 3 PAW-ice对纯培养的单增李斯特菌杀菌效率 Fig. 3 PAW-ice inactivation efficacy against pure cultured L.monocytogenes a~d表示在相同处理时间下不同处理组的杀菌效率具有显著性差异(P≤0.05);A~D表示在相同处理组中不同处理时间的杀菌效率具有显著性差异(P≤0.05). |
对于PAW-ice2、PAW-ice3组,与细菌作用5 min后,菌落数分别降低至5.2 lg CFU/mL和4.9 lg CFU/mL,具有显著性差异(P≤0.05).但随着处理时间增加,菌落总数维持不变(P>0.05).说明两者杀菌效果接近,且与细菌作用5 min后,PAW-ice的杀菌成分耗尽,因此杀菌效率并未随处理时间的增加而提高.
对于PAW-ice1组,细菌总量随处理时间的增加而显著下降(P≤0.05),在5 min、15 min、30 min处的细菌数量分别为4.7 lg CFU/mL、4.1 lg CFU/mL、3.3 lg CFU/mL.因此,PAW-ice处理时间相同时,PAW-ice1的杀菌效率显著高于PAW-ice2、PAW-ice3的杀菌效率(P≤0.05).推测可能是由于PAW-ice1的pH值与电导率明显高于PAW-ice2、PAW-ice3(图 2(b)、(c)),说明pH值与电导率是评估PAW-ice杀菌效率的重要指标.
以上结果表明PAW-ice对单增李斯特菌具有较强的杀菌效果,其杀菌效率依赖于PAW的制备体积、制备时间和PAW-ice与细菌的作用时间.PAW制备体积越小、制备时间越长,PAW-ice处理细菌越久,PAW-ice的杀菌效果越好,这为PAW-ice在今后的杀菌应用提供了理论参考.
鉴于研究PAW-ice对接种于三文鱼片表面单增李斯特菌的杀菌效果需要制备大量的PAW-ice,因此采用大的制备体积(PAW-ice2、PAW-ice3)将会更加节能,并且PAW-ice2、PAW-ice3在5 min时能够降低1 lg CFU/mL(杀菌率为90%),在实际应用中也是具有价值的;此外PAW-ice2与PAW-ice3的杀菌效率接近,因此选用短的制备时间(PAW-ice2)将会更加节能.综合以上两点,在接下来研究PAW-ice对接种于三文鱼片表面单增李斯特菌杀菌效果及三文鱼片在冷藏过程中TVB-N与pH值的影响时均采用PAW-ice2.
2.3.2 PAW-ice对接种于三文鱼片表面单增李斯特菌的杀菌效果图 4为两组三文鱼片在4 ℃贮藏5天过程中单增李斯特菌菌落总数的变化情况.两组三文鱼片单增李斯特菌数量初始值为2.7 lg CFU/mL.随着贮藏时间的延长,SW-ice处理组单增李斯特菌数量显著提高(P≤0.05),到第5天时,菌落总数已经达到5.1 lg CFU/mL.PAW-ice处理组单增李斯特菌数量在前3天缓慢下降至2.5 lg CFU/mL,之后显著提高(P≤0.05),到第5天时,菌落总数为3.6 lg CFU/mL,远低于SW-ice组(P≤0.001).此结果表明,PAW-ice对接种于三文鱼片表面的单增李斯特菌也有很好的杀菌效果,在5天的贮藏时间内,能够有效抑制细菌增殖.
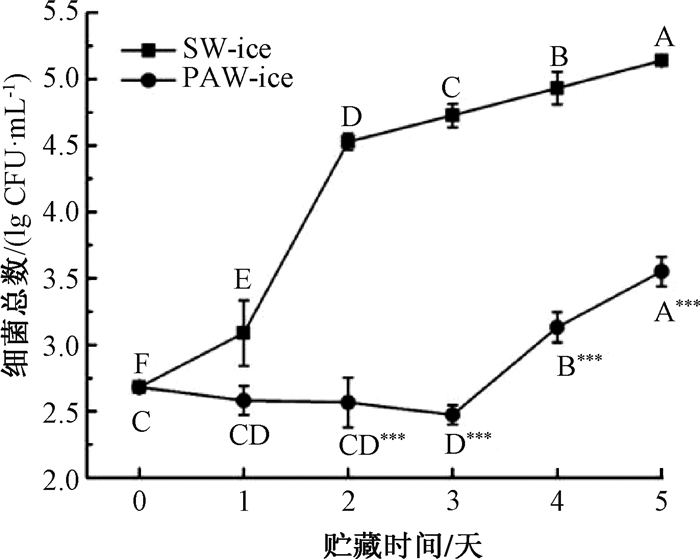
|
图 4 PAW-ice对接种于三文鱼片表面单增李斯特菌在4 ℃、5天贮藏过程中的杀菌效果 Fig. 4 PAW-ice inactivation efficacy against L.monocytogenes inoculated on salmon strips during storage at 4 ℃ for 5 days A~F表示在相同处理组中不同贮藏时间的杀菌效率具有显著性差异(P≤0.05).在相同的贮藏时间下,PAW-ice与SW-ice的数据显著性差异表示为* P≤0.05、** P≤0.01、*** P≤0.001. |
在微生物和内源酶的作用下,蛋白质被分解为三甲胺、二甲胺、氨、氮类及其他碱性小分子物质,这些物质统称为挥发性盐基氮(TVB-N)[16].三文鱼片在4 ℃贮藏5天过程中TVB-N值的变化情况如图 5所示.两组三文鱼片TVB-N的初始值为5.77 mg N/100 g,随着贮藏时间的延长,两组TVB-N值均呈现上升趋势(P≤0.05),但PAW-ice组TVB-N值始终低于SW-ice组,主要是PAW-ice能有效抑制三文鱼表面单增李斯特菌的增殖,从而减少微生物对蛋白质的分解.到第5天时,SW-ice组的TVB-N值为13.2 mg N/100 g,而PAW-ice组则远低于SW-ice组(P≤0.01),为8.43 mg N/100 g,仍属于一级鲜度[17].此结果表明,PAW-ice可以显著减少三文鱼片中TVB-N的形成,提高三文鱼的新鲜程度.
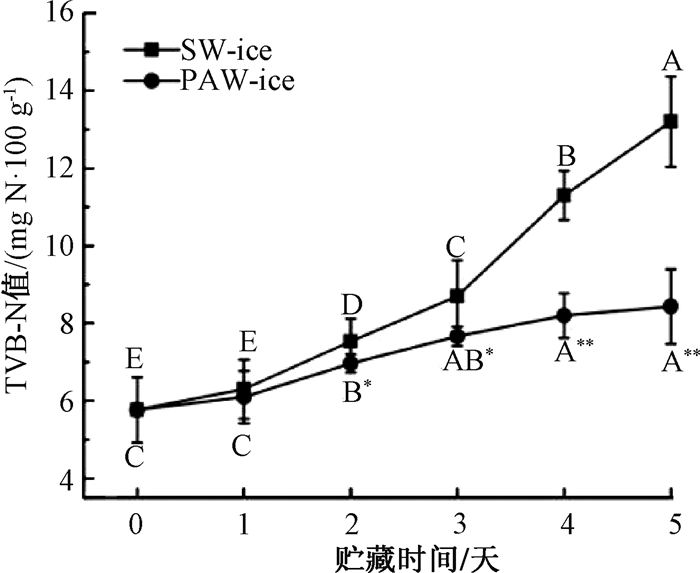
|
图 5 PAW-ice对三文鱼片在4 ℃、5天贮藏过程中TVB-N值的影响 Fig. 5 Effects of PAW-ice treatments on TVB-N value of salmon strips during storage at 4 ℃ for 5 days A~E在表示在相同处理组中不同贮藏时间的TVB-N值具有显著性差异(P≤0.05).在相同的贮藏时间下,PAW-ice与SW-ice的数据显著性差异表示为* P≤0.05、** P≤0.01、***P≤0.001. |
pH值是评判鱼肉品质高低的重要指标之一,鱼肉的腐败程度和pH值成正比[16].两组三文鱼片在4 ℃贮藏5天过程中pH值的变化情况如图 6所示,随着贮藏时间的延长,样品pH值呈现增长趋势(P≤0.05).结合TVB-N的结果分析可知,这主要是由于随着贮藏时间的延长,细菌分解蛋白质产生氨和胺类等碱性物质使pH值升高.由于PAW-ice起到抑制细菌繁殖的作用,使得PAW-ice组的pH值整体显著低于SW-ice组(P≤0.001).这与庞彩霞[18]等用银杏叶提取物处理金线鱼鱼丸后pH值的变化结果相似.

|
图 6 PAW-ice对三文鱼片在4℃、5天贮藏过程中pH值的影响 Fig. 6 Effects of PAW-ice treatments on pH value of salmon strips during storage at 4 ℃ for 5 days A~D表示在相同处理组中不同贮藏时间的pH值具有显著性差异(P≤0.05).在相同的贮藏时间下,PAW-ice与SW-ice的数据显著性差异表示为* P≤0.05、** P≤0.01、*** P≤0.001. |
人们对水产品品质和安全性的要求越来越高,目前常用的低温贮藏等方法已不能满足水产品加工保鲜的要求.因此,本文首次提出了一种新型冷杀菌保鲜技术——大气压低温等离子体活化水冰(PAW-ice),并研究了PAW-ice对纯培养与接种于三文鱼片表面单增李斯特菌的杀菌效果,以及对在冷藏过程中的三文鱼片TVB-N及pH值的影响.结果表明:PAW-ice能够有效杀灭单增李斯特菌,其杀菌效率与PAW的制备时间、制备体积以及PAW-ice处理时间密切相关;其次,PAW-ice能够有效抑制接种于三文鱼片表面单增李斯特菌的生长繁殖,同时显著减缓三文鱼片pH值、TVB-N值的升高,提高三文鱼片的新鲜程度.因此,PAW-ice有望成为一种应用于食品安全领域的新型杀菌技术.本研究仅对PAW-ice在水产品杀菌领域进行初步探索,今后将对PAW-ice杀菌机理、PAW-ice对水产品感官品质以及营养成分的影响进一步探索,并研发适用于大规模工业化应用的大气压低温等离子体装置,从而加快PAW-ice在食品工业中的应用进程.
| [1] |
GARNER D, KATHARIOU S. Fresh produce-associated listeriosis outbreaks, sources of concern, teachable moments, and insights[J]. Journal of food protection, 2016, 79(2): 337-344. DOI:10.4315/0362-028X.JFP-15-387 (  0) 0) |
| [2] |
姜晨, 增田泰伸, 木村守, 等. 复配抑菌剂对单增李斯特菌的抑制作用及其保鲜效果[J]. 食品工业科技, 2017, 38(8): 92-97. (  0) 0) |
| [3] |
ASCHE F, ROLL K H, SANDVOLD H N, et al. Salmon aquaculture: larger companies and increased production[J]. Aquaculture economics and management, 2013, 17(3): 322-339. DOI:10.1080/13657305.2013.812156 (  0) 0) |
| [4] |
LERFALL J, ROTH B, SKARE E F, et al. Pre-mortem stress and the subsequent effect on flesh quality of pre-rigor filleted Atlantic salmon (Salmo salar L.) during ice storage[J]. Food chemistry, 2015, 175: 157-165. DOI:10.1016/j.foodchem.2014.11.111 (  0) 0) |
| [5] |
张新林, 谢晶, 杨胜平, 等. 三文鱼气调保鲜技术的研究进展[J]. 食品工业科技, 2016, 37(4): 395-399. (  0) 0) |
| [6] |
LI J B, LIN T, LU Q, et al. Changes in physicochemical properties and bactericidal efficiency of acidic electrolyzed water ice and available chlorine decay kinetics during storage[J]. LWT-food science and technology, 2014, 59(1): 43-48. DOI:10.1016/j.lwt.2014.05.043 (  0) 0) |
| [7] |
JOSHI S G, COOPER M, YOST A, et al. Non-thermal dielectric-barrier discharge plasma-induced inactivation involves oxidative DNA damage and membrane lipid peroxidation in Escherichia coli[J]. Antimicrobial agents and chemotherapy, 2011, 55(3): 1053-1062. DOI:10.1128/AAC.01002-10 (  0) 0) |
| [8] |
TIAN Y, MA R N, ZHANG Q, et al. Assessment of the physicochemical properties and biological effects of water activated by non-thermal plasma above and beneath the water surface[J]. Plasma processes and polymers, 2015, 12(5): 439-449. DOI:10.1002/ppap.v12.5 (  0) 0) |
| [9] |
MA R N, WANG G M, TIAN Y, et al. Non-thermal plasma-activated water inactivation of food-borne pathogen on fresh produce[J]. Journal of hazardous materials, 2015, 300: 643-651. DOI:10.1016/j.jhazmat.2015.07.061 (  0) 0) |
| [10] |
QI Z H, TIAN E Q, SONG Y, et al. Inactivation of shewanella putrefaciens by plasma activated water[J]. Plasma chemistry and plasma processing, 2018, 38(5): 1035-1050. DOI:10.1007/s11090-018-9911-5 (  0) 0) |
| [11] |
LIN C M, KUNG H F, HUANG Y L, et al. Histamine production by Raoultella ornithinolytica in canned tuna meat at various storage temperatures[J]. Food control, 2012, 25(2): 723-727. DOI:10.1016/j.foodcont.2011.12.019 (  0) 0) |
| [12] |
XIAO D Z, CHENG C, SHEN J, et al. Characteristics of atmospheric-pressure non-thermal N2 and N2/O2 gas mixture plasma jet[J]. Journal of applied physics, 2014, 115(3): 033303. DOI:10.1063/1.4862304 (  0) 0) |
| [13] |
YU S, CHEN Q Z, LIU J H, et al. Dielectric barrier structure with hollow electrodes and its recoil effect[J]. Applied physics letters, 2015, 106(24): 244101. (  0) 0) |
| [14] |
KANAZAWA S, KAWANO H, WATANABE S, et al. Observation of OH radicals produced by pulsed discharges on the surface of a hiquid[J]. Plasma sources science and technology, 2011, 20(3): 034010. DOI:10.1088/0963-0252/20/3/034010 (  0) 0) |
| [15] |
SHAINSKY N, DOBRYNIN D, ERCAN U, et al. Plasma acid: water treated by dielectric barrier discharge[J]. Plasma processes and polymers, 2012, 9: 555-629. DOI:10.1002/ppap.201290015 (  0) 0) |
| [16] |
LIN T, WANG J J, LI J B, et al. Use of acidic electrolyzed water ice for preserving the quality of shrimp[J]. Journal of agricultural and food chemistry, 2013, 61(36): 8695-8702. DOI:10.1021/jf4019933 (  0) 0) |
| [17] |
丁婷, 李婷婷, 励建荣. 0 ℃冷藏三文鱼片新鲜度综合评价[J]. 中国食品学报, 2014, 14(11): 252-259. (  0) 0) |
| [18] |
庞彩霞, 王利民. 银杏叶提取物对冷藏金线鱼鱼丸的保鲜效果研究[J]. 食品研究与开发, 2017, 38(13): 194-198. DOI:10.3969/j.issn.1005-6521.2017.13.042 (  0) 0) |
 2019, Vol. 51
2019, Vol. 51


