三氮烯类化合物又称重氮氨基化合物,其主要的官能团为—NN=N—[1].自1955年Clarke等[2]报道了三氮烯化合物对小鼠肉瘤S180具有抑制活性后,科研工作者对三氮烯类药物的抗癌活性进行了大量的研究.随着研究的深入,1959年开发出了治疗癌症的药物达卡巴嗪(Dacarbazine).达卡巴嗪是为数不多的具有三氮烯结构的抗癌药物之一,它的出现给恶性黑素瘤的治疗带来了希望,但这类药物的最大缺点是毒性较大.基于此,可选用毒性较低的天然产物查尔酮代替咪唑酰胺,以期降低其毒性.查尔酮类化合物的主要结构为1,3-二苯基丙烯酮,是一种广泛存在于药用植物体内天然产物的母核结构,它常常作为一种合成黄酮类结构的前体物质存在.天然查尔酮具有消炎、抗菌、抗艾滋病、抗寄生虫、抗氧化、抗病毒、抑制和清除氧自由基、抗癌[3-5]等多种药理活性.
根据生物活性叠加原理,本文将具有抗癌活性的查尔酮类结构与含有三氮烯的结构单元有机衔接在一起,以期得到更加高效低毒的抗癌化合物.首先采用经典的重氮盐与二级胺的偶联反应生成三氮烯,再经过Claisen-Schmidt反应,设计合成了12个未见文献报道的新化合物,并对这12个新化合物进行了体外抗癌活性的筛选.
1 实验部分 1.1 仪器与试剂CP214电子天平(奥豪斯仪器有限公司);Rc-52-99型旋转蒸发器(上海亚荣生化仪器厂);XT5A显微熔点测定仪(北京市科仪电光仪器厂);Nicoiet-8700型红外光谱仪(美国热电公司),KBr压片;DPX-400型超导核磁共振仪(德国-瑞士布鲁克公司);Omnistar-200型质谱仪(瑞士Balzers公司).
无水碳酸钾、二甲胺(天津市科密欧化学试剂有限公司);苯甲醛衍生物(上海晶纯试剂有限公司).
1.2 实验方法 1.2.1 合成路线新型丙烯酮类化合物及两种取代醛1′d和1′h的合成路线见图 1.
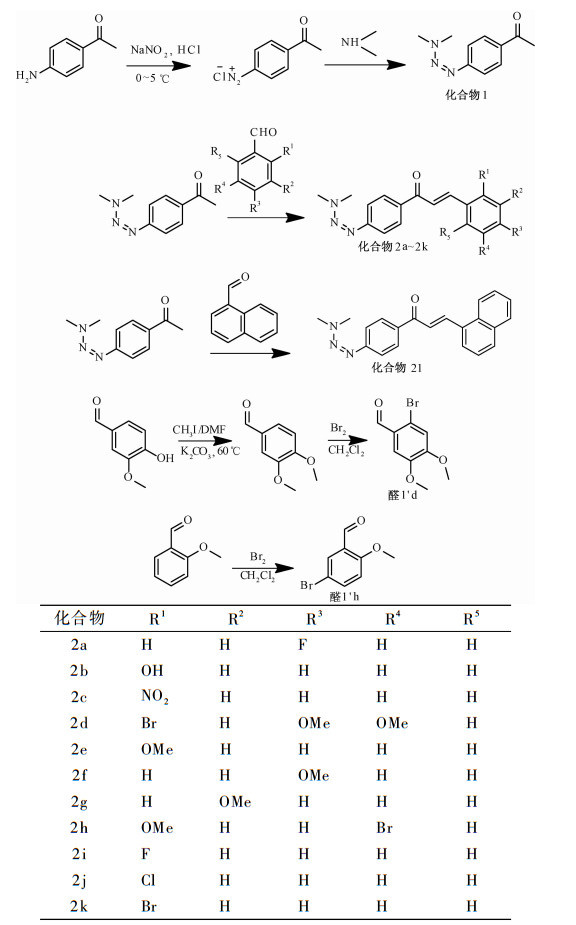
|
图 1 新型丙烯酮类化合物的合成 Figure 1 Synthesis of new acrylic ketone derivatives |
取50 mL干燥圆底烧瓶,加入0.675 9 g(5 mmol)对氨基苯乙酮和10 mL稀HCl(1 mol/L),冰浴搅拌下缓慢滴加3 mL NaNO2(17 mol/L)溶液,体系逐渐由黄色变成淡红色并伴有沉淀生成.反应40 min后,将上述体系暂时保存在冰浴条件下.取另一圆底烧瓶,加入0.683 0 g二甲胺(33%水溶液)、5 mL水、0.6 g Na2CO3,冰浴条件下搅拌10 min后,将之前冰浴保存的重氮盐体系缓慢滴入,继续反应3 h.反应结束后用浓HCl调节pH为3~4,用15 mL乙酸乙酯萃取3次,合并有机相,无水硫酸镁干燥,过滤后减压蒸去溶剂.用石油醚-乙酸乙酯(体积比5:1) 作为洗脱剂,经柱层析分离得0.668 9 g淡黄色固体,收率71.6%.
1.2.3 2-溴-4,5-二甲氧基苯甲醛(醛1′d)的合成取50 mL干燥圆底烧瓶,加入1.53 g(0.01 mol)香草醛、5.43 g(0.04 mol)无水K2CO3和15 mL DMF,室温搅拌30 min后滴加1.24 mL CH3I,油浴升温至60 ℃,继续反应1 h.冷却至室温后加20 mL蒸馏水,用15 mL乙酸乙酯萃取3次,合并有机相,再用10 mL饱和食盐水洗涤3次,无水硫酸镁干燥,抽滤后减压蒸去溶剂,得1.54 g黄色固体,收率81%.取20 mL圆底烧瓶,加入0.83 g(5 mmol)3,4-二甲氧基苯甲醛和6 mL CH2Cl2,搅拌溶解.冰浴条件下滴加0.5 mL Br2 (10 mmol),搅拌10 min后撤去冰浴,室温继续反应1 h,之后用乙酸乙酯萃取,乙醇重结晶得0.847 0 g白色絮状固体,收率65%.
1.2.4 5-溴-2-甲氧基苯甲醛(醛1′h)的合成合成方法参照1.2.3.
1.2.5 (E)1-[4-(3,3-二甲基-1-三氮烯基)苯基]-3-苯基-2-丙烯酮类化合物(化合物2a~2l)的合成取50 mL干燥圆底烧瓶,按物质的量之比为1:1.2加入4-(3,3-二甲基-1-三氮烯基)苯乙酮和取代苯甲醛,溶于无水乙醇中,冰浴下滴加10% NaOH水溶液,然后逐渐升至室温,继续反应3 h.结束后稀HCl调节pH为4~5,冷却后抽滤,滤饼用95%乙醇重结晶得产物.
2 结果讨论 2.1 化合物2a~2l的表征化合物2a为淡黄色晶体,收率89.8%,熔点182~183 ℃.ESI-MS[M+H]+298.νc=o=1 623 cm-1.1HNMR (400 MHz,CDCl3) δ:8.04 (d,J=8.9 Hz,2H),7.78 (d,J=15.8 Hz,1H),7.64 (dd,J=8.6、5.6 Hz,2H),7.52 (dd,J=12.5、5.6 Hz,3H),7.11 (t,J=8.6 Hz,2H),3.57 (s,3H),3.26 (s,3H).
化合物2b为黄色晶体,收率76.8%,熔点122~123 ℃.ESI-MS[M+H]+296.νc=o=1 632 cm-1. 1HNMR (400 MHz,CDCl3) δ:8.042 (d,J=8.8 Hz,2H),7.785 (d,J=15.7 Hz,1H),7.535 (dd,J=5.4 Hz,3H),7.306~6.892 (m,4H),5.635(s,1H),3.546 (s,3H),3.277 (s,3H).
化合物2c为黄色晶体,收率69.1%,熔点156~158 ℃.ESI-MS[M+H]+325.νc=o=1 635 cm-1. 1HNMR (400 MHz,CDCl3) δ:8.079 (d,J=8.8 Hz,2H),7.96 (d,J=14.9 Hz,1H),7.65 (dd,J=8.2 Hz,3H),7.31 (dd,J=8.2、2.5 Hz,3H),7.54 (t,J=8.1 Hz,2H),3.36 (s,3H),3.1 (s,3H).
化合物2d为黄色针状晶体,收率71.2%,熔点197~198 ℃.ESI-MS[M+H]+419.νc=o=1 637 cm-1.1HNMR (400 MHz,CDCl3) δ:8.07 (d,J=15.8 Hz,1H),8.02 (d,J=8.6 Hz,2H),7.53 (d,J=8.6 Hz,2H),7.35 (d,J=15.2 Hz,1H),7.21 (s,1H),7.08 (s,1H),3.96 (s,3H),3.92 (s,3H),3.56 (s,3H),3.27 (s,3H).
化合物2e为黄色晶体,收率62.7%,熔点103~104 ℃.ESI-MS[M+H]+310.νc=o=1 632 cm-1. 1HNMR (400 MHz,CDCl3) δ:8.12 (d,J=15.5 Hz,1H),8.04 (d,J=8.6 Hz,2H),7.71~7.62 (m,2H),7.52 (d,J=8.4 Hz,2H),7.37 (t,J=7.8 Hz,1H),7.00 (t,J=7.6 Hz,1H),6.94 (d,J=8.3 Hz,1H),3.92 (s,3H),3.55 (s,3H),3.26 (s,3H).
化合物2f为黄色晶体,收率56.1%,熔点141~143 ℃.ESI-MS[M+H]+310.νc=o=1 626 cm-1. 1HNMR (400 MHz,CDCl3) δ:8.03 (d,J=8.2 Hz,2H),7.79 (d,J=15.3 Hz,1H),7.61 (d,J=8.7 Hz,2H),7.52 (d,J=8.6 Hz,2H),7.47 (d,J=15.4 Hz,1H),6.94 (d,J=8.7 Hz,2H),3.85 (s,3H),3.56 (s,3H),3.26 (s,3H).
化合物2g为黄色晶体,收率69.6%,熔点109~110 ℃.ESI-MS[M+H]+310.νc=o=1 636 cm-1,1HNMR (400 MHz,C3D6O) δ:8.18 (d,J=8.5 Hz,2H),7.94 (d,J=15.6 Hz,1H),7.78 (d,J=15.6 Hz,1H),7.54 (d,J=8.5 Hz,2H),7.41 (dd,J=18.4、10.6 Hz,3H),7.04 (d,J=7.5 Hz,1H),3.90 (s,3H),3.61 (s,3H),3.27 (s,3H).
化合物2h为黄色针状晶体,收率73.3%,熔点126~128 ℃.ESI-MS[M+H]+389.νc=o=1 641 cm-1. 1HNMR (400 MHz,CDCl3) δ:8.08~8.00 (m,3H),7.75 (d,J=2.3 Hz,1H),7.61 (d,J=15.8 Hz,1H),7.52 (d,J=8.5 Hz,2H),7.44 (dd,J=8.8、2.5 Hz,1H),6.81 (d,J=8.9 Hz,1H),3.89 (s,3H),3.56 (s,3H),3.26 (s,3H).
化合物2i为黄色晶体,收率85.4%,熔点129~130 ℃.ESI-MS[M+H]+298.νc=o=1 621 cm-1. 1HNMR (400 MHz,CDCl3) δ:8.05 (d,J=8.5Hz,2H),7.91 (d,J=15.9 Hz,1H),7.67 (dd,J=17.8、11.7 Hz,2H),7.53 (d,J=8.5 Hz,2H),7.38 (dd,J=14.1、6.7 Hz,1H),7.20 (t,J=7.5 Hz,1H),7.16~7.09 (m,1H),3.57 (s,3H),3.26 (s,3H).
化合物2j为黄色晶体,收率82.5%,熔点133~134 ℃.ESI-MS[M+H]+314.νc=o=1 625 cm-1. 1HNMR (400 MHz,CDCl3) δ:8.027 (d,J=8.8 Hz,2H),8.005 (d,J=15.7 Hz,1H),7.518 (d,J=8.6 Hz,3H),7.382 (dd,J=8.0、2.4 Hz,3H),7.357 (t,J=8.4 Hz,2H),3.541 (s,3H),3.273 (s,3H).
化合物2k为黄色晶体,收率80.8%,熔点139~140 ℃.ESI-MS[M+H]+359.νc=o=1 630 cm-1. 1HNMR (400 MHz,CDCl3) δ:8.01 (d,J=8.6 Hz,2H),8.15 (d,J=15.5 Hz,1H),7.46 (dd,J=8.5 Hz,3H),7.26 (dd,J=7.9、2.2 Hz,3H),7.45 (t,J=8.2 Hz,2H),3.56 (s,3H),3.28 (s,3H).
化合物2l为黄色晶体,收率77.2%,熔点131~133 ℃.ESI-MS[M+H]+330.νc=o=1 609 cm-1. 1HNMR (400 MHz,CDCl3) δ:8.66 (d,J=15.4 Hz,1H),8.28 (d,J=8.4 Hz,1H),8.10 (d,J=8.5 Hz,2H),7.91 (dd,J=13.1、5.9 Hz,3H),7.67 (d,J=15.4 Hz,1H),7.62~7.49 (m,5H),3.56 (s,3H),3.26 (s,3H).
2.2 目标化合物的结构特征在碱性乙醇溶液中于适当温度下,用含三氮烯基取代的苯乙酮与取代的苯甲醛发生Claisen-Schmidt缩合反应,合成了目标化合物.1HNMR数据表明,每个化合物均含有1个碳碳双键,其中2个氢对应2个双重峰,偶合常数均在14~16 Hz,说明该双键为反式构型,即形成E型化合物[6].由于苯环与α-β不饱和酮的共轭作用,在IR光谱中C=O特征峰的吸收频率有所降低.
2.3 影响缩合产物收率的因素由于苯乙酮与苯甲醛在碱溶液中发生交叉羟醛缩合反应属于亲核加成,当苯甲醛上的取代基为卤素时,产物的收率比没有取代基时要高,且卤原子的电负性越大,产物的收率越高;而当苯甲醛邻、对位上的取代基为甲氧基时,产物的收率明显降低.
2.4 活性筛选结果利用细胞活性检测(MTT)法,在药物测试量为10 mmol和20 mmol的条件下,对所合成的化合物进行了抗膀胱癌活性实验,测定了目标化合物对突变型5637细胞的细胞毒活性,初筛实验结果见表 1.
|
|
表 1 化合物2a~2l对5637细胞的细胞毒活性 Table 1 The cytotoxicity of compounds 2a~2l on 5637 cell |
从表 1中可以发现,合成的新化合物均具有一定的抗癌活性.对比活性顺序后得到如下规律:通过化合物2e~2g的存活率可知,在查尔酮B环引入甲氧基后,以甲氧基在对位取代的化合物2f表现出较高的活性,这可能是由于在此位置上的空间较为有利,使查尔酮母环结构的共面性较好[7];在B环引入多个甲氧基后,如化合物2d,活性下降非常明显,这可能与酚羟基烷基化后失去抗氧化活性有关[8].分析构效关系可以得到,不同的取代基有不同的活性,含有吸电子基团比供电子基团的化合物具有更强的活性,活性顺序为F > Cl > Br > NO2 > OH > OMe.
3 小结用含三氮烯基取代的苯乙酮与取代的苯甲醛发生Claisen-Schmidt反应,合成了12个新型丙烯酮类化合物.用细胞活性检测法对所合成的化合物进行体外抗癌活性的筛选,发现这些新化合物均具有一定的抗癌活性.
致谢:药理活性实验由郑州大学药学院张雁冰教授及其硕士研究生协助测定.
| [1] |
雷强, 张高鹏, 赵丽, 等. 新型三氮烯类化合物的合成与表征[J]. 郑州大学学报(理学版), 2014, 46(2): 77-79. (  0) 0) |
| [2] |
CLARKE D A, BARCLAY R K, STOCK C C, et al. Triazenes as inhibitors of mouse sarcoma 180[J]. Experimental biology and medicine, 1955, 90(2): 484-489. DOI:10.3181/00379727-90-22073 (  0) 0) |
| [3] |
YADAV N, DIXIT S K, BHATTACHARYA A, et al. Antimalarial activity of newly synthesized chalcone derivatives in vitro[J]. Chemical biology and drug design, 2012, 80(2): 340-347. DOI:10.1111/jpp.2012.80.issue-2 (  0) 0) |
| [4] |
吴建章, 李物兰, 陈玲姿, 等. 查尔酮及其螺杂环衍生物的合成、晶体结构、抗氧化活性研究[J]. 有机化学, 2012, 32(11): 2141-2147. (  0) 0) |
| [5] |
戴红, 苗文科, 刘建兵, 等. 新型含2-取代-1, 3-噻唑烷的查尔酮类化合物的合成及其生物活性[J]. 有机化学, 2012, 32(9): 1690-1694. (  0) 0) |
| [6] |
于德泉, 杨峻山. 分析化学手册第七分册:核磁共振波谱分析[M]. 2版. 北京: 化学工业出版社, 1999.
(  0) 0) |
| [7] |
LOPEZ S N, CASTELLI M V, ZACCHINO S A, et al. In vitro antifungal evaluation and structure-activity relationships of a new series of chalcone derivatives and synthetic analogues, with inhibitory properties against polymers of the fungal cell wall[J]. Bioorganic and medicinal chemistry, 2001, 9(8): 1999-2013. DOI:10.1016/S0968-0896(01)00116-X (  0) 0) |
| [8] |
LIMASSET B, DOUCEN C, DORE J C, et al. Effects of flavonoids on the release of reactive oxygen species by stimulated human neutrophils: multivariate analysis of structure-activity relationships (SAR)[J]. Biochemical pharmacology, 1993, 46(7): 1257-1271. DOI:10.1016/0006-2952(93)90476-D (  0) 0) |
 2017, Vol. 49
2017, Vol. 49


