卡那霉素是一种由土壤中链霉菌素产生的氨基糖苷类抗生素,具有良好的水溶性和广谱的抗菌性,它对多数肠杆菌科细菌均有良好的抗菌作用,通常作为抗菌药物用于动物饲养,是我国畜牧业常用的兽药之一.然而,氨基糖苷类抗生素具有耳毒性、肾毒性、以及神经肌肉阻滞引起的心肌抑制、呼吸衰竭等毒副作用[1].动物体内过量的卡那霉素残留,通过食物链的富集,对人类健康具有潜在的威胁,因此,检测食品中卡那霉素的残留十分重要.目前检测氨基糖苷类抗生素残留常用的方法主要包括高效液相色谱(high performance liquid chromatography,HPLC)法[2]、免疫学检测法[3]等.其中HPLC等色谱方法虽然灵敏度高,但对技术的要求较高,并且样品处理比较复杂,测试成本高,不适合快速筛查大批量样品[4].免疫学检测法作为一种快速、特异和灵敏的检测技术,被广泛应用于小分子药物残留的检测.在本研究中,我们制备了卡那霉素单克隆抗体,建立了间接竞争酶联免疫吸附试验(indirect competitive rapid enzyme-linked immunosorbent assay, ciELISA)方法.
1 材料与方法 1.1 材料3只6周龄的雌性BALB/c小鼠由本实验室动物房饲养;卡那霉素(KAN)、碳二亚胺(EDC)购于Solarbio公司;弗氏完全佐剂(Freund complete adjuvant,FCA)、弗氏不完全佐剂(Freund incomplete adjuvant,FIA)购自Sigma公司.
1.2 方法 1.2.1 EDC法合成完全抗原将100 mg卡那霉素标准品与20 mg BSA或20 mg OVA溶到2 mL 50 mmol/L磷酸盐缓冲液(PBS)中,此溶液称为1号液,将25 mg EDC溶于1 mL PBS(50 mmol/L)中,此溶液称为2号液.将1号液和2号液混合,在室温下缓慢搅拌1 h,然后在4 ℃下搅拌3 d.将所得反应混合物用10 mmol/L PBS(3 L)透析3次并收集于1.5 mL试管中,该方法制备的偶联物命名为KAN-BSA和KAN-OVA,放置于-20 ℃冰箱保存.采用Bradford蛋白浓度测定试剂盒测定完全抗原浓度,琼脂糖凝胶电泳鉴定结果.
1.2.2 动物免疫及杂交瘤细胞的筛选将KAN-BSA作为免疫抗原,并对每只小鼠进行皮下注射50 μg/200 μL,使用KAN-OVA作为包被抗原,通过间接ELISA测定小鼠免疫血清效价,并选择具有高效价的小鼠,将脾细胞与SP2/0骨髓瘤细胞融合,经3轮亚克隆筛选阳性杂交瘤细胞株,具体实验步骤参照文献[5].
1.2.3 单克隆抗体的大量制备及鉴定将筛选到的杂交瘤细胞株转移至细胞培养瓶中,并用RPMI1640/10完全培养基在细胞培养瓶内扩大培养,当细胞达到对数增长状态时,向石蜡致敏的经产母鼠腹腔中注射每毫升1×106个细胞,约10天后小鼠腹部肿胀,此时,收集腹水,离心收取上清液,采用辛酸-硫酸铵法纯化腹水[6],用SDS-PAGE鉴定纯化的单克隆抗体,并通过间接ELISA法测其效价与亲和力.
1.2.4 确定最适抗原包被量及单克隆抗体稀释度采用棋盘法连续倍比稀释包被抗原KAN-OVA和卡那霉素单克隆抗体,抗原包被量分别为800、400、200、100、50 ng/孔,单克隆抗体稀释倍数从1:800开始2倍比稀释至1:204 800.
1.2.5 间接竞争ELISA的建立及标准曲线的绘制以KAN-OVA作为包被抗原,包被量为200 ng/孔,4 ℃孵育过夜;PBST洗6次,用封闭液37 ℃封闭2 h.PBST洗6次后分别将各质量浓度标准品溶液(KAN:用双蒸馏水配制卡那霉素标准品,用0.01 M PBS倍比稀释到质量浓度为128、64、32、16、8、4、2、1、0.5、0.25、0.125 ng/mL)与最适稀释倍数的单克隆抗体等体积混合作为一抗,向各孔中加入100 μL混合液,同时设置阳性、阴性和空白对照组,二抗加入100 μL 1:4 000稀释的羊抗鼠IgG,TMB显色8 min,2 mmol/L H2SO4终止反应,OD450 nm条件下测定OD值.
1.2.6 间接竞争ELISA准确度分析在同一批ELISA酶标板上进行6组竞争ELISA平行试验,作批内变异系数分析;同时,包被6批酶标板,分别各进行一次竞争ELISA检测,做批间变异系数分析,研究不同标准品浓度测定结果的准确性.
1.2.7 交叉反应率的确定链霉素、妥布霉素、卡那霉素B、新霉素、新霉胺以及庆大霉素属于卡那霉素结构类似物[7],以相同的竞争ELISA方法测定这几种药物的IC50,根据式CR=IC50(KAN)/IC50(其他)×100%[8]计算单克隆抗体对于链霉素、妥布霉素、新霉素、庆大霉素等的交叉反应率.
1.2.8 样品加标回收率的测定牛奶样品处理方法:选取牛奶,向不含卡那霉素的牛奶样品中添加卡那霉素标准品,12 000 r/min,4 ℃离心10 min后,除去上层脂肪层及沉淀物,用0.01 mol/L PBS将中间清液分别稀释2、4、8倍,使不同稀释倍数的牛奶中含卡那霉素终质量浓度分别为6.25、12.5、25 ng/mL.间接竞争ELISA方法用于检测牛奶样品中的卡那霉素,根据公式(实际检测浓度/添加浓度×100%),计算其回收率.用不同稀释倍数的牛奶,分别测定20个不含卡那霉素牛奶样品的平均值,根据其平均值加上3倍标准偏差再乘以样品稀释倍数,得到其最低检测限.
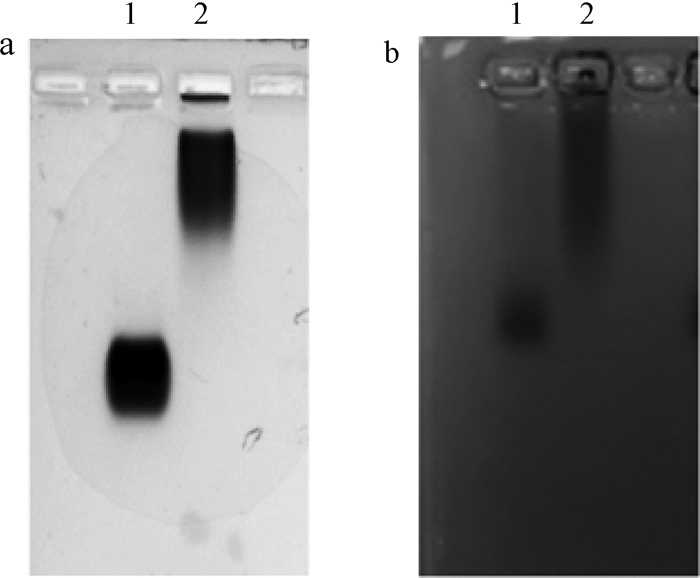
2 结果与分析 2.1 KAN-BSA、KAN-OVA完全抗原的制备与鉴定将制备得到的KAN-BSA和KAN-OVA完全抗原,经琼脂糖凝胶电泳分析,结果如图 1所示.KAN-BSA和KAN-OVA比BSA和OVA有明显的拖尾现象,表明KAN与BSA、OVA偶联成功.采用Bradford蛋白浓度测定试剂盒测定KAN-BSA和KAN-OVA的质量浓度分别为3.9 mg/mL、4 mg/mL.
|
图 1 琼脂糖凝胶电泳鉴定完全抗原 Fig. 1 Agarose gel electrophoresis analysis of complete antigen a1:BSA; a2:KAN-BSA; b1:OVA; b2:KAN-OVA |
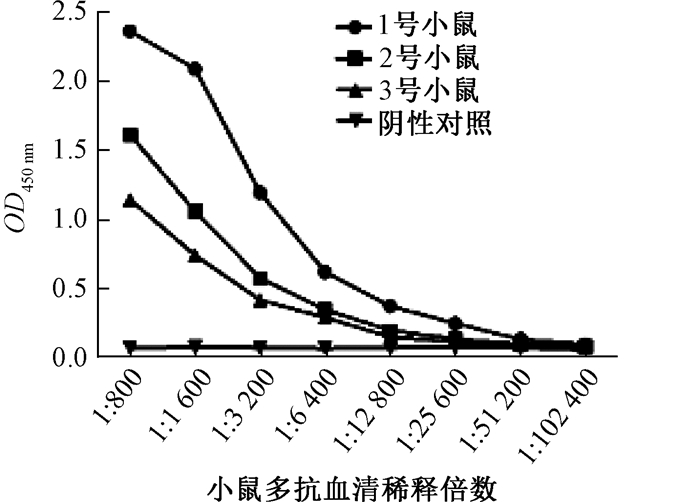
间接ELISA测定小鼠免疫血清效价,结果显示,3只小鼠均能产生特异性抗体,其中1号小鼠抗体效价为1/25 600(图 2),所以选取1号小鼠取其脾脏做细胞融合用于制备抗KAN单克隆抗体.
|
图 2 多抗血清效价测定 Fig. 2 Multi-antiserum titer determination |
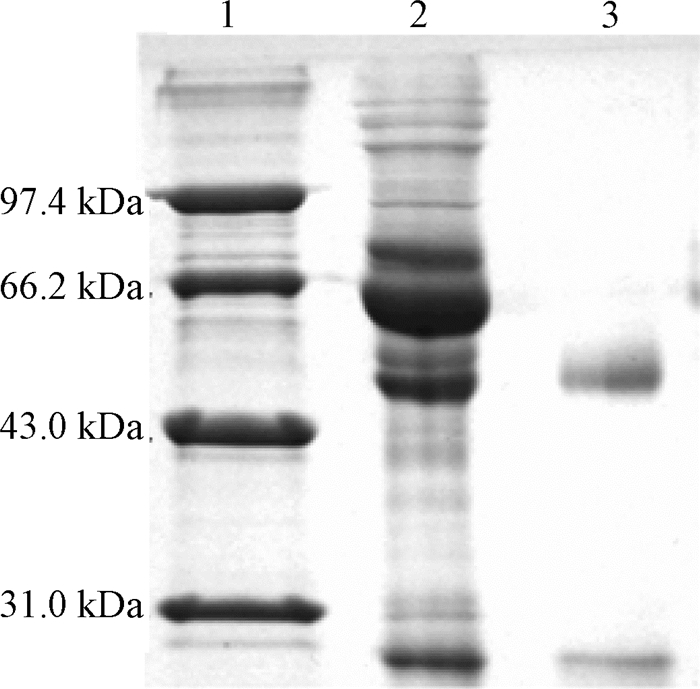
细胞融合后,经3次亚克隆获得1株阳性杂交瘤细胞株(1E1),并通过体内诱生法大量制备腹水,经辛酸-硫酸铵法纯化获得单克隆抗体,经SDS-PAGE鉴定分析,结果如图 3所示,纯化后1E1含有两条特异性条带,分子量大小分别为50 kD和25 kD,与IgG的重链和轻链大小相一致.
|
图 3 1E1单克隆抗体纯化的SDS-PAGE分析 Fig. 3 SDS-PAGE analysis of 1E1 mAb purification 1:Marker;2: 1E1单克隆抗体纯化前;3: 1E1单克隆抗体纯化后 |
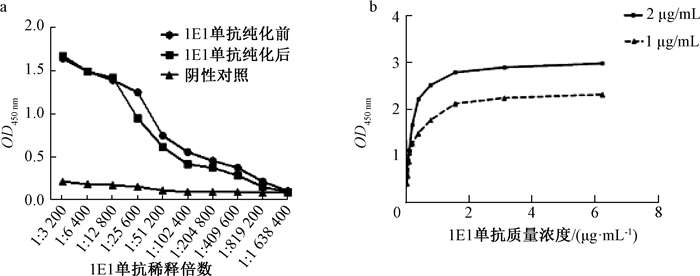
间接ELISA测定单克隆抗体1E1纯化前、后效价,结果显示其效价均达到1:819 200(图 4a);根据亲和常数计算公式可以得出1E1单克隆抗体的亲和常数Ka为2.8×109 L/mol(图 4b).
|
图 4 a:1E1单克隆抗体效价的测定;b:1E1单克隆抗体亲和常数分析 Fig. 4 a: Titer of 1E1 mAb; b: Affinity analysis of 1E1 mAb |
棋盘法确定抗原包被量及单克隆抗体稀释度,以OD450 nm为1.0左右的组合为最佳模式.考虑到节约检测原KAN-OVA,适量使用单克隆抗体原则,最后确定间接竞争ELISA最佳包被抗原KAN-OVA的包被量为200 ng/孔,最适单克隆抗体稀释度为1:51 200(表 1).
|
|
表 1 抗原包被量和单克隆抗体最佳稀释倍数的确定 Tab. 1 Determination of antigen coating quantity and optimum dilution multiplication of monoclonal antibody |
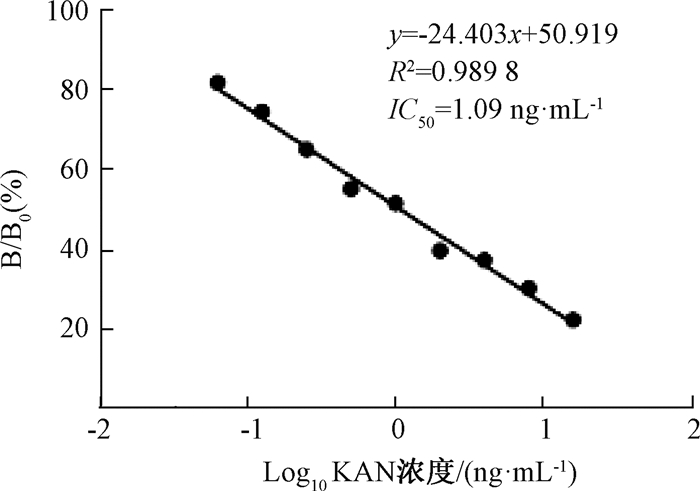
以添加卡那霉素质量浓度的对数值为横坐标,抑制率为纵坐标,绘制标准曲线(图 5),拟合标准曲线后得到的线性方程为y=-24.403x+50.919(R2=0.989 8).以抑制率为50%时对应的质量浓度为IC50,测得1E1的IC50值为1.09 ng/mL.
|
图 5 单克隆抗体敏感性测定 Fig. 5 Sensitivity test of 1E1 mAb |
各标准品浓度批内变异系数范围是5.48%~8.72%,平均变异系数为6.52%.各标准品浓度批间变异系数范围是6.86%~8.76%,平均变异系数为8.04%.这表明本实验建立的间接竞争ELISA检测方法具有高稳定性.
|
|
表 2 板内与板间变异系数 Tab. 2 Coefficient of variation within and between plates |
分别选用链霉素、妥布霉素、卡那霉素B、新霉素、新霉胺以及庆大霉素进行交叉反应性试验,如表 3所示,采用间接竞争ELISA法测得抗卡那霉素单克隆抗体对妥布霉素、卡那霉素B的交叉反应率分别为53.4%和45.6%,与其他氨基糖胺类化合物的交叉反应率低于0.01%.
|
|
表 3 交叉反应试验结果 Tab. 3 Cross-reaction test results |
不含卡那霉素的牛奶样品中分别加入卡那霉素,使终质量浓度分别为6.25、12.5、25 ng/mL,测定样品加标回收率,根据1.2.8的计算方法,结果如表 4所示,当牛奶稀释2倍时回收率范围为42%~78%,最低检测限为1.72 ng/mL;稀释4倍时回收率范围为64.4%~89.6%,最低检测限为1.92 ng/mL;稀释8倍时回收率范围为53%~95.7%,最低检测限为3.52 ng/mL.综合分析上述结果,考虑到灵敏性及最低检测限,稀释4倍作为最适样品稀释倍数.此时样品加标回收率范围为64.4%~89.6%,最低检测限为1.92 ng/mL.
|
|
表 4 ciELISA检测牛奶样品的添加回收试验 Tab. 4 Recovery of milk samples by ciELISA |
卡那霉素为小分子半抗原,检测困难,常规检测方法复杂且价格高昂,需要昂贵的仪器设备及专业技术人员.卡那霉素结构中不含有共轭双键,无紫外吸收峰[9],因此,不能采用紫外分光光度法对完全抗原进行鉴定.因为BSA和OVA的等电点在4.6~4.7之间,在琼脂糖凝胶电泳缓冲溶液中带负电,将其与KAN偶联后其等电点会升高,从而导致其在电泳缓冲溶液中所带负电荷减少,同样条件下电泳速度减慢.所以本研究通过琼脂糖凝胶电泳的方法对合成的完全抗原进行鉴定,结果显示与载体蛋白相比,合成的完全抗原有明显的滞后和拖尾现象,表明KAN与载体蛋白偶联成功.
经免疫BALB/c小鼠,选用经典的杂交瘤细胞融合技术获得一株稳定分泌抗KAN单克隆抗体的单克隆杂交瘤细胞株,用小鼠体内诱生腹水并经辛酸-硫酸铵法纯化获得单克隆抗体1E1,间接ELISA测其效价为1:819 200,亲和力常数为2.8×109 L/moL.建立了基于单克隆抗体1E1的间接竞争ELISA检测KAN的方法,结果显示1E1与妥布霉素的交叉反应率为53.4%,与卡那霉素B的交叉反应率为45.6%,与其他氨基糖苷类化合物没有交叉反应,该特性与CHEN等[10]制备的单克隆抗体情况类似.经分析,卡那霉素B、妥布霉素与卡那霉素具有相似的C-环结构,其他氨基糖苷类抗生素与卡那霉素的C-环结构有明显差异,所以与妥布霉素和卡那霉素B交叉反应性高,可能是因为它们具有相似的C-环结构.因此推测此单克隆抗体能够与卡那霉素类的抗生素反应.
单克隆抗体在牛奶样品稀释4倍时最低检测限为1.92 ng/mL,根据我国《食品安全国家标准动物性食品中兽药最大残留限量》规定,卡那霉素最大残留限量为肌肉100 μg/kg、奶150 μg/kg、肝脏600 μg/kg.本研究最低检测限1.92 ng/mL,可完全满足检测限量要求.该方法具有准确、敏感、快速、操作简便且费用低廉的优点,为卡那霉素残留的快速检测提供了有效检测方法,保障了畜产品的安全.
| [1] |
DENG J K, LIU Y Q, LIN X D, et al. A ratiometric fluorescent biosensor based on cascaded amplification strategy for ultrasensitive detection of kanamycin[J]. Sensors and actuators B: chemical, 2018, 273: 1495-1500. DOI:10.1016/j.snb.2018.07.065 (  0) 0) |
| [2] |
张杨慧, 蒋孟虹, 秦峰. 柱后衍生化-HPLC法测定硫酸卡那霉素注射液及滴眼液的含量[J]. 中国抗生素杂志, 2018(10): 1-6. (  0) 0) |
| [3] |
LI C, ZHANG Y Y, EREMIN S A, et al. Detection of kanamycin and gentamicin residues in animal-derived food using IgY antibody based ic-ELISA and FPIA[J]. Food chemistry, 2017, 227: 48-54. DOI:10.1016/j.foodchem.2017.01.058 (  0) 0) |
| [4] |
许耀心, 龚云飞, 陈宗伦, 等. 庆大霉素人工抗原及多克隆抗体的制备与鉴定[J]. 现代食品科技, 2014, 30(6): 152-157. (  0) 0) |
| [5] |
周景明, 耿玥, 马文利, 等. 抗传染性支气管炎病毒N蛋白单克隆抗体的制备及鉴定[J]. 郑州大学学报(理学版), 2018, 50(4): 75-79. (  0) 0) |
| [6] |
肖增鸿, 黄昭亮, 林月霞, 等. 腹水型单克隆抗体纯化方法的研究[J]. 中国医药生物技术, 2013, 8(6): 425-428. DOI:10.3969/cmba.j.issn.1673-713X.2013.06.005 (  0) 0) |
| [7] |
胡小莉, 刘绍璞, 罗红群, 等. 氮基糖苷类抗生素分析方法的研究进展[J]. 分析科学学报, 2005, 21(3): 316-321. DOI:10.3969/j.issn.1006-6144.2005.03.026 (  0) 0) |
| [8] |
赵兵洁, 赵金宝, 齐小花, 等. 基于BHHCT-Eu3+@SiO2荧光稀土二氧化硅纳米颗粒的免疫层析试纸条检测卡那霉素[J]. 分析化学, 2017, 45(10): 1467-1474. DOI:10.11895/j.issn.0253-3820.170015 (  0) 0) |
| [9] |
王金凤, 杨化新, 朱俐, 等. HPLC-NQAD和HPLC-ELSD法测定硫酸卡那霉素注射剂的含量[J]. 药物分析杂志, 2014, 34(4): 644-648. (  0) 0) |
| [10] |
CHEN Y, WANG Z, TANG S, et al. Rapid enzyme-linked immunosorbent assay and colloidal gold immunoassay for kanamycin and tobramycin in swine tissues[J]. Journal of agricultural and food chemistry, 2008, 56(9): 2944-2952. DOI:10.1021/jf703602b (  0) 0) |
 2019, Vol. 51
2019, Vol. 51


