2. 河南龙宇煤化工有限公司 河南 永城 476600
2. He′nan Longyu Coal Chemical Co., Ltd, Yongcheng 476600, China
烟草属于双子叶植物纲,管状花目茄科的一年生或有限多年生草本植物,目前全球发现的烟属共有66个种,主要分布在南美洲、南亚及中国[1].烟草是重要的模式植物,也是重要的经济作物,我国是烟草种植面积和产量最大的国家[2].烟草的早花是生产上存在的一个问题,主要是不正常气候或环境胁迫条件下,烟株早熟开花的一种现象[3].ROS是细胞有氧代谢的产物,逆境胁迫下,会造成大量活性氧的产生和积累,活性氧分子在介导植物体的生长发育中作为一种信号分子,对生物与非生物胁迫响应、蛋白修饰和基因表达调控方面具有重要功能.有研究表明,低温诱导和喷施外源活性氧在一定时间上都可以促进烟草开花[4-5].活性氧作为信号分子的研究大多集中在活性氧如何影响模式植物营养器官的生长发育,很少关注ROS在生殖器官发育中的作用,尤其对植物花发育调控的分子机制尚未有深入研究.MADS-box基因家族的成员FLOWERING LOCUS C(FLC)是开花抑制基因,调节开花时间,抑制FLOWERING LOCUS T (FT)和SUPPRESSOR OF OVEREXPRESSION OF CONSTANS 1 (SOC1)的表达[6-7].LEAFY(LFY)是重要的花分生组织决定基因,调控植物的成花转变.不同的成花诱导途径通过调控FLC、SOC1、FT来调节LFY的表达,LFY在成花转变早期高表达,并在花发育过程中持续表达,促进植物开花[8-11].甲基紫精(MV)是除草剂百草枯的有效成分,在植物体内作为电子受体将PSI的电子传递给O2,在光下产生O2-,分解产生H2O2,诱导细胞出现氧化逆境,常被用于植物氧化胁迫逆境研究[12].本研究以烟草K326为实验材料,通过盆栽实验,探究外源活性氧对烟草体内ROS代谢变化、保护酶活性的变化及花芽分化情况,同时从分子水平上探索开花基因FLC、LFY表达的变化,探讨ROS可能作为信号分子对烟草成花转变的影响,对了解植物的开花机制,尤其花启动的机制有重要理论意义,具有一定的创新性和科研价值.
1 材料与方法 1.1 实验材料本试验采用烟草K326作为供试品种.
1.2 实验方案试验采用格盘漂浮育苗方法,烟苗生长至10真叶时,选取长相一致、健康茁壮的烟株挂牌标记叶位,随后移栽到容土5 kg的塑料盆中.将材料分为实验组和对照组,实验组分为5个处理,标记为T1、T2、T3、T4、T5,返苗后分别喷施甲基紫精溶液(外源超氧阴离子O2-源)5 d、10 d、15 d、20 d、25 d.实验组每天下午5点在烟草叶片正反面均匀喷施甲基紫精溶液(5 μmol/L),以溶液不成股流下为宜,对照组同时喷施等量清水,每个处理3个重复.分别于处理后4 h、8 h、12 h、16 h、20 h、24 h、5 d、10 d、15 d、20 d、25 d取样,分析烟草对外源超氧阴离子的快速响应变化和长期反应变化;于喷施甲基紫精5 d、10 d、15 d、20 d、25 d,取茎尖,进行开花相关基因FLC、LFY的表达分析.
各组处理结束之后,正常条件培养,每天观察记录烟苗生长状况,每隔5 d观察记录烟草花芽分化情况,适时选取茎尖固定保存,统计烟草现蕾叶片数.
1.3 生理指标测定及方法 1.3.1 超氧阴离子(O2-)含量测定在王爱国[13]等人的方法基础上加以改进[14]:取烟草新鲜叶片,加磷酸缓冲液,冰浴研磨,在上清液中加入盐酸羟胺,反应后加三氯甲烷,取上层红色萃取液测定A530.
1.3.2 过氧化氢(H2O2)含量测定采用Sergiev[15]等的方法,样品加入三氯乙酸(TCA)溶液研磨,在上清液中加入碘化钾,反应结束后,390 nm测定吸光值.
1.4 开花基因表达量的测定使用郑州贝贝生物科技有限公司的总RNA提取试剂盒提取RNA,通过1%琼脂糖凝胶电泳和微量核酸蛋白分析仪测定OD值,检测RNA完整性和浓度;使用北京爱普拜生物技术有限公司的Hiscript cDNA合成试剂盒进行反转录,反应体系为:总RNA最大5 μg,Primer(Oligo dT) 0.5 μL,加Nuclease-free water至11.7 μL,70 ℃孵育5 min,立即置于冰水中至少5 min,之后加入5×RT buffer 4 μL,MgCl2 2 μL,dNTPs 1 μL,RNase抑制剂0.3 μL,MMLV逆转录酶1 μL,PCR仪上进行反转录,反应条件为25 ℃,5 min;42 ℃,1 h;75 ℃,15 min.
烟草目的基因LFY(GenBank: JQ686928.1)以及内参基因β-actin(GenBank: NO.U60495)的引物通过软件DNA man设计,FLC引物参照文献[16].LFY基因引物F:TAAGCCAAAAATGCGACACT,R:GTTCAGAATGGCAAAGCTGG;FLC基因引物F:CTCAAGAAAATAGCAGCCTTCC,R:TCTCCTTATTGCTCCTCACACA;β-actin基因引物F:ATGCCTATGTGGGTGACGAAG,R:TCTGTTGGCCTTAGGGTTGAG,均由上海生工合成.
实时荧光定量PCR试剂盒为FastStart Universal SYBR Green Master(Roche),反应仪器为Roche LightCycler® 480 Ⅱ全自动荧光定量PCR系统.20 μL反应体系为:HiTaq SYBR Green Mastermix(2x) 10 μL,Forward Primer(10 mM) 0.4 μL,Reverse Primer(10 mM) 0.4 μL,cDNA 1 μL,ddH2O(灭菌蒸馏水)8.2 μL.
反应条件为:95 ℃预变性2 min;95 ℃变性15 s;60 ℃退火20 s;72 ℃延伸20 s,40个循环.
1.5 观察花芽解剖结构并记录现蕾叶片数花芽解剖结构的观察:处理结束后每隔5 d取茎尖,标记后FAA固定液保存,用体式显微镜Nikon SMZ800观察并拍照.FAA固定液配比:38%甲醛5.0 mL,冰乙酸5.0 mL,75%乙醇90.0 mL[17].
根据烟株上挂牌标记的叶位,及时观察并记录烟草现蕾时的叶片数.
1.6 数据处理Real-time PCR实验中每个样品均做3个技术重复,Real-time PCR实验中得各样品Ct值及其平均值,扩增曲线、溶解曲线等均由计算机自带软件导出,根据公式ΔCt=Ct(目的基因)-Ct(内参基因),用2-ΔΔCt法计算各基因表达量.以对照组5 d时基因扩增结果作为对照,将其表达水平设置为1.实验所得的数据用Excel 2010和SPSS 19.0进行统计分析和方差分析.
2 结果与分析 2.1 外源甲基紫精处理对烟草活性氧含量的影响外源甲基紫精处理下烟草体内O2-和H2O2含量变化的快速响应变化如图 1所示.在喷施4 h后,O2-迅速积累,并显著高于对照,是对照含量的1.25倍;8 h后下降,与对照组差异不显著.本课题组张静研究表明,高浓度的O2-迅速激活了烟草体内保护酶SOD,使O2-得到有效清除[4-5].喷施甲基紫精也同样使烟草体内H2O2含量迅速升高,喷施4 h和8 h后都显著高于对照,可能是高水平的O2-在SOD酶作用下转化为H2O2,另外可能是外源活性氧引起其他途径的H2O2形成;随后在保护酶和抗氧化物质的清除作用下,H2O2含量有所下降,与对照组差异不显著.说明烟草自身的应激机制能够清除短期的活性氧胁迫,这是植株适应能力的体现.
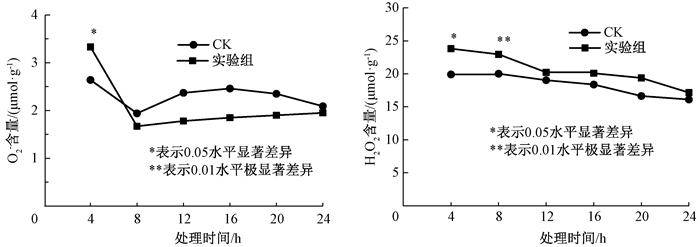
|
图 1 外源甲基紫精处理下烟草叶片O2-和H2O2含量的快速响应 Figure 1 Rapid response of O2- and H2O2 content in tobacco under exogenous methylviologen condition |
长时间外源甲基紫精处理下,烟草体内O2-含量变化如表 1所示,T1在处理第5天、第10天时O2-含量显著高于对照,随后得到有效清除,含量下降;T2在处理10 d后O2-含量显著高于对照,随后得到有效清除,含量下降;T3在处理第15天时O2-含量极显著高于对照,处理结束后下降.随着喷施时间延长,体内O2-的积累量越来越高,T4和T5处理体内O2-含量随着处理时间延长持续升高,一直显著高于对照.由此可见,喷施外源甲基紫精使烟草体内O2-含量升高,喷施15 d以下的处理,喷施停止后,在保护体系的清除下体内活性氧能恢复到正常水平.喷施时间越长,体内积累的O2-含量越高,同时保护体系在后期也超过了耐受阈值,不能及时有效地清理O2-,O2-持续维持在较高水平.
|
|
表 1 长期外源甲基紫精处理下烟草叶片O2-含量的变化 Table 1 The change of O2- contentin tobacco under long-time exogenous methylviologen treatment |
长期喷施甲基紫精的烟草体内H2O2含量均高于对照(表 2),而喷施结束一定时间后H2O2含量会有所回落.T1组在处理第5天显著高于对照组,处理结束后,体内H2O2也随即降低,与对照差异不显著.T2组在处理第10天、15天时分别比对照增加了18.6%、33.4%,第20天开始下降.长期喷施甲基紫精对烟草体内H2O2代谢影响较大,同时也使保护体系受到抑制,清除能力下降,喷施时间越长,体内H2O2积累越多.喷施15 d、20 d、25 d的T3、T4和T5组随着处理时间延长,H2O2含量一直显著高于对照.烟草体内长期较高水平的H2O2使烟草受到活性氧伤害,严重影响了烟草的生长发育.
|
|
表 2 长期甲基紫精处理下烟草叶片H2O2 含量的变化 Table 2 The change of H2O2 content in tobacco under long-time methylviologen condition |
总之,外源甲基紫精的处理使烟草体内O2-积累,H2O2含量激增,同时激活了烟草体内的保护机制清除活性氧,在一定程度上保护烟草细胞不遭受氧化损伤,但是长时间的外源活性氧处理会导致保护酶氧化损伤,保护酶活性受到抑制,不能及时有效清除活性氧.一定时间的外源活性氧处理后,烟草体内的抗氧化机制能够一定程度地逐渐恢复,使活性氧含量趋于平稳,在此过程中可能会改变细胞的氧化还原状态,影响花发育.
2.2 外源甲基紫精对基因FLC、LFY表达量的影响外源甲基紫精对烟草开花抑制基因FLC表达量的影响如表 3所示,外源甲基紫精作用下FLC表达量整体呈下降趋势.喷施5 d的T1组在处理15 d时迅速下降接近最低点,并且从第15天开始FLC表达量显著低于对照;T2组在前期FLC的表达量并没有显著差异,第25天显著低于对照;T3、T4、T5的变化趋势比较类似,整体呈下降趋势,但差异与对照不显著.总之,外源甲基紫精处理烟草5 d和10 d都表现出对开花抑制基因FLC表达的抑制,但喷施时间过长,对FLC表达抑制作用不明显.
|
|
表 3 外源甲基紫精对基因FLC表达量的影响 Table 3 The effects of expression of FLC in tobacco under exogenous methylviologen |
外源甲基紫精对LFY表达量的影响如表 4所示,整体上是外源甲基紫精作用下LFY表达量呈升高的趋势,表明外源甲基紫精可以促进烟草成花基因的表达,但是促进的程度并不一致.喷施5 d的T1组在处理10 d时LFY表达量有明显的增强,20 d、25 d后增幅分别为63.1%、87.1%,与对照差异显著;喷施10 d的T2组LFY表达量也一直呈上升的趋势,前期与对照差异不明显,在25 d时差异极显著.T3、T4、T5组LFY表达量与对照差异不显著.
|
|
表 4 外源甲基紫精对基因LFY表达量的影响 Table 4 The effects of expression of LFY in tobacco under exogenous methylviologen |
图 2是喷施外源甲基紫精22 d后各组的花芽分化图,其中CK处于营养生长期,T1处于雌蕊原基分化期,处于花芽分化的末期.T2处于雄蕊原基和雌蕊原基分化期,花瓣原基、雄蕊原基和雌蕊原基都已经分化,但是雄蕊原基内侧还没有形成凹陷,分化进程略晚于T1.T3处于花瓣、雄蕊原基分化期,图 2 T3中可见5个雄蕊原基微微凸起,在其外侧与其互生的是花瓣原基,最内侧的圆形凸起是雌蕊原基,尚未分化.T4、T5均处于花萼原基分化期,以上结果表明,外源甲基紫精处理使T1、T2、T3、T4、T5各组花芽分化都有不同程度的提前,喷施时间不同,促进发育的程度也有差异,喷施5 d和10 d的T1、T2处理促进效果最为明显,喷施15 d的T3处理次之.这与外源甲基紫精喷施5 d和10 d的T1、T2处理组的开花抑制基因FLC表达量显著下调,同时花分生组织基因LFY表达量显著上调的结果一致.
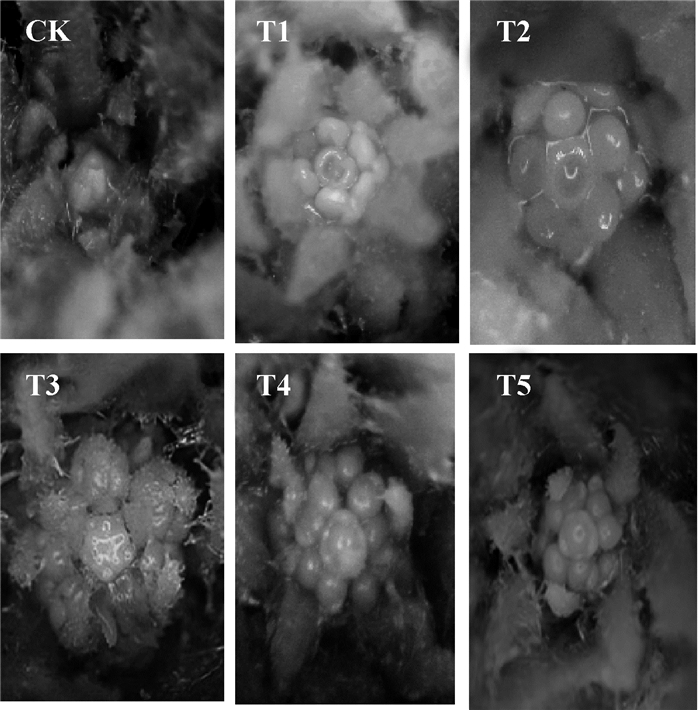
|
图 2 外源甲基紫精条件下烟草花芽分化情况 Figure 2 The flower bud differentiation of tobacco under exogenous methyl viologen |
由图 3可知,外源甲基紫精处理下,T1、T2、T3、T4、T5处理组烟草的现蕾叶片数与CK相比分别减少了3.75、3.75、4、2.25、1.5片真叶,现蕾均有提前.T1与T3与对照差异显著,T2与对照差异极显著.这与花芽解剖观察结果基本一致,喷施甲基紫精5 d、10 d、15 d使烟草体内活性氧含量在一定时间内升高,抑制了开花抑制基因FLC表达,促进了花分生组织基因LFY的表达,从而促进了烟草花发育,但喷施时间过长,超过15 d后,体内活性氧含量一直维持高浓度,细胞氧化损伤严重,对开花促进基因LFY表达不利.
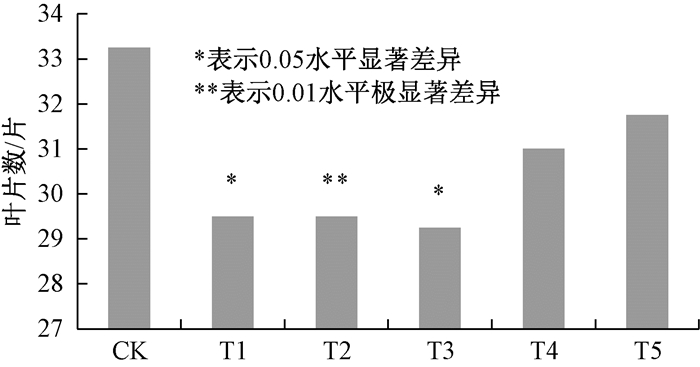
|
图 3 外源甲基紫精条件下烟草现蕾叶片数 Figure 3 Leaf number of tobacco when buds occur under exogenous methyl viologen |
开花是植物从营养生长转换为生殖生长的生理发育过程,受光周期、温度、激素、年龄等多个因素诱导,在植物生长和物种进化中处于核心地位[18].在拟南芥中已经鉴定出5个关键开花整合子,分别是FLC、FT、SOC1、LFY和SVP,主要位于细胞核内,编码的植物特有的转录因子在生殖生长过程中扮演着开花时间促进基因和花分生组织决定基因双重角色[19].FLC是开花抑制基因,在植物营养生长阶段表达量较高,抑制下游花发育正调控因子的表达.LFY是开花促进基因,在成花转变早期高表达,促进下游花器官发育基因的表达,促进成花.
正常生长条件下,植物细胞中ROS维持在较低的水平,逆境胁迫下,会造成大量活性氧的产生和积累.在植物体内活性氧主要包括以下几种类型:超氧根阴离子(O2-)、氢氧根离子(OH-)、羟基自由基(·OH)、过氧化氢(H2O2)等[20].为了减少活性氧造成氧化伤害,植物体内存在一套复杂健全的活性氧清除体系,该体系分为两大类:酶类清除系统,包括超氧化物歧化酶(superoxide dismutase, SOD)、过氧化氢酶(catalase, CAT)、过氧化物酶(peroxidase, POD)等;以及非酶类清除系统,抗坏血酸-谷胱甘肽(ASA-GSH)循环是植物体内清除ROS的重要途径.活性氧分子作为一种信号分子,在介导植物的生长发育、对生物及非生物胁迫响应、蛋白修饰和基因表达调控方面具有重要功能.参与调控的生物学过程包括生长、细胞周期、程序性细胞凋亡、胁迫反应、抗病反应、发育过程等[21].许多研究表明,活性氧信号与钙信号协同参与了植物的逆境胁迫信号的转导[22].在植物体生长发育、气孔开闭、胁迫响应、根毛发育和生长过程中,ROS介导的信号支路在细胞内与植物激素如水杨酸(SA)、吲哚乙酸(IAA)、赤霉素(GA)和脱落酸(ABA)以及其他小分子物质,例如一氧化氮(NO)等信号支路相互整合,形成复杂的信号网络来应对多种不同环境变化和刺激[23].
活性氧被证实参与多种生理生化反应,影响植株的生长发育.研究发现20种被子植物的花都有H2O2积累,特别是在柱头[24].文献[25]对两种景观树种研究结果表明,ROS参与了多种花器官早期的发育阶段,在花发育早期,ROS水平在所有花组织中水平较高,然后在发育后期降至低水平,ROS水平在雄蕊中最高.文献[26]进行了荔枝盆栽实验,分别进行低温、中温和高温处理,中温组的树木进行ROS处理后促进了开花.本实验研究发现,低温胁迫和外源过氧化氢处理都引起烟草体内活性氧代谢失衡,烟草现蕾时叶片数减少,烟草花芽分化提前完成[4-5].而有关ROS作为信号分子对植物成花转变及花发育的调控的分子机制还没有深入研究报道.
本实验通过喷施外源甲基紫精诱导烟草细胞产生大量O2-,模拟逆境条件下的氧化应激反应,通过对烟草体内O2-、H2O2代谢变化、花芽分化进程,以及对开花基因FLC、LFY表达变化的研究,初步探讨活性氧对烟草花芽分化影响的分子机制.外源甲基紫精处理使烟草体内O2-和H2O2含量迅速升高,显著高于对照,短期内烟草体内的保护体系能够在一定程度上清除活性氧,保护烟草细胞免受氧化伤害.长时间的外源甲基紫精处理,烟草体内活性氧清除体系受到伤害抑制,不能及时有效地清除活性氧,活性氧大量积累,不利于烟草的生长发育.分子水平的研究表明,外源甲基紫精处理一定程度上改变了花发育基因的表达,喷施5 d和10 d的处理组烟草开花抑制基因FLC的表达受到显著抑制,而花分生组织基因LFY的表达显著上调,同时这两个处理组烟草花芽分化提前,现蕾时叶片数显著减少;喷施时间大于15 d时,烟草体内长期高浓度的ROS对烟草造成的氧化伤害突出,对开花促进基因LFY表达不利,不利于茎尖的成花转变,现蕾时叶片数和花发育进程与对照差异不大.由此可见,作为信号物质活性氧只有在一定时间和一定程度范围内的代谢变化,才能有效引起茎尖分生组织发育方向的改变,促进成花,而长期高水平的活性氧不利于或导致活性氧促发的花发育进程受到抑制或逆转.结果表明,活性氧信号在转录水平上通过开花整合子FLC和LFY参与了烟草花芽分化的调控.本实验仅从活性氧水平和两个开花转录因子转录变化水平上探讨了活性氧参与花发育的可能机制,而关于活性氧信号与植物花发育进程之间的信号调控通路还有待深入研究.
| [1] |
任民, 王志德, 牟建民, 等. 我国烟草种质资源的种类与分布概况[J]. 中国烟草科学, 2009, 30(S1): 8-14. (  0) 0) |
| [2] |
李静. 优质烟草栽培技术[J]. 江西农业, 2016(17): 9. (  0) 0) |
| [3] |
岳彩鹏, 韩锦峰, 陈卫华. 烟草开花研究进展[J]. 烟草科技, 2001, 34(9): 36-40. DOI:10.3969/j.issn.1002-0861.2001.09.014 (  0) 0) |
| [4] |
张静, 李园园, 岳彩鹏, 等. 低温胁迫下活性氧代谢与烟草花芽分化的研究[J]. 作物杂志, 2015, 167(4): 74-80. (  0) 0) |
| [5] |
张静.低温条件下烟草活性氧代谢及花发育调控的研究[D].郑州: 郑州大学, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10459-1015301127.htm
(  0) 0) |
| [6] |
MICHAELS S D, HIMELBLAU E, SANG Y K, et al. Integration of flowering signals in winter annual Arabidopsis[J]. Plant physiology, 2005, 137(1): 149-156. DOI:10.1104/pp.104.052811 (  0) 0) |
| [7] |
WIGGE P A. Integration of spatial and temporal information during floral induction in Arabidopsis[J]. Science, 2005, 309(5737): 1056-1059. DOI:10.1126/science.1114358 (  0) 0) |
| [8] |
张亚萍, 习珺珺, 于丽霞. LEAFY(LFY)基因在花发育网络调控中的研究进展[J]. 现代农业科技, 2012(9): 11-13. DOI:10.3969/j.issn.1007-5739.2012.09.001 (  0) 0) |
| [9] |
PARCY F. Flowering: a time for integration[J]. Int J Dev Biol, 2005, 49(5/6): 585-593. (  0) 0) |
| [10] |
YANOFSKY M F. Floral meristems to floral organ: genes controlling early events in arabidopsis flower development[J]. Annu Rev Plant Phys, 1995, 46: 167-188. DOI:10.1146/annurev.pp.46.060195.001123 (  0) 0) |
| [11] |
王利琳, 梁海曼, 庞基良, 等. 拟南芥LEAFY基因在花发育中的网络调控及其生物学功能[J]. 遗传, 2004, 26(1): 137-142. DOI:10.3321/j.issn:0253-9772.2004.01.026 (  0) 0) |
| [12] |
行冰玉, 朱楠, 张洪培, 等. 甲基紫精对丹参培养细胞抗氧化防护系统的影响[J]. 植物生态学报, 2014, 38(5): 507-514. (  0) 0) |
| [13] |
王爱国, 罗广华. 植物的超氧物自由基与羟胺反应的定量关系[J]. 植物生理学通讯, 1990, 26(6): 55-57. (  0) 0) |
| [14] |
李忠光, 龚明. 植物中超氧阴离子自由基测定方法的改进[J]. 云南植物研究, 2005, 27(2): 211-216. DOI:10.3969/j.issn.2095-0845.2005.02.012 (  0) 0) |
| [15] |
SERGIEV I, ALEXIRVA V, KARANOV E. Effect of spermine, atrazine and combination bewteen them on some endogenous protective systems and stress markers in plants[J]. Compt Rend Acad Bulg Sci, 1997, 51(2): 121-124. (  0) 0) |
| [16] |
李元元.低温诱导烟草早花研究与烟草MADS-box基因的同源克隆[D].北京: 中国农业科学院, 2011. http://cdmd.cnki.com.cn/article/cdmd-82101-1011158947.htm
(  0) 0) |
| [17] |
段玉琪, 晋艳, 杨宇虹. 体式显微镜法观察烤烟花芽分化的研究[J]. 中国农学通讯, 2011, 27(3): 143-146. (  0) 0) |
| [18] |
刘永平, 杨静, 杨明峰. 植物开花调控途径[J]. 生物工程学报, 2015, 31(11): 1553-1566. (  0) 0) |
| [19] |
李念祖.芥菜开花整合子FLC与SVP相互作用的研究[D].重庆: 西南大学, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10635-1013265000.htm
(  0) 0) |
| [20] |
郭玉双, 李祥羽, 任学良. 植物体内活性氧(ROS)的产生及其作用研究进展[J]. 黑龙江农业科学, 2011(8): 146-148. DOI:10.3969/j.issn.1002-2767.2011.08.053 (  0) 0) |
| [21] |
丁顺华, 陈珊, 卢从明. 植物叶绿体谷胱甘肽还原酶的功能研究进展[J]. 植物生理学报, 2016, 52(11): 1703-1709. (  0) 0) |
| [22] |
王海波, 黄雪梅, 张昭其. 植物逆境胁迫中活性氧和钙信号的关系[J]. 北方园艺, 2010(22): 189-194. (  0) 0) |
| [23] |
MITTLER R, VANDERAUWE S, SUZUKI N. ROS signaling: the new wave[J]. Trends in plant science, 2011, 16(6): 300-309. DOI:10.1016/j.tplants.2011.03.007 (  0) 0) |
| [24] |
MUTHUGAPATTI K, ELIZABETH C, RODER B, et al. Arabidopsis ARP7 is an essential actin-related protein required for normal embryogenesis, plant architecture, and floral organ abscission[J]. Plant physiology, 2005, 138(4): 2019-2032. DOI:10.1104/pp.105.065326 (  0) 0) |
| [25] |
LIU N, LIN Z F. Reactive oxygen species and alternative respiration in the developing flowers of two subtropical woody plants[J]. Journal of plant grouth regulation, 2013, 32(1): 83-91. DOI:10.1007/s00344-012-9278-4 (  0) 0) |
| [26] |
LU X Y, LI J J, CHEN H B, et al. RNA-seq analysis of apical meristem reveals integrative regulatory network of ROS and chilling potentially related to flowering in Litchi chinensis[J]. Sci Rep, 2017, 7(1): 10183. DOI:10.1038/s41598-017-10742-y (  0) 0) |
 2018, Vol. 50
2018, Vol. 50

