氧化亚氮 (N2O) 是重要的温室气体之一,与二氧化碳 (CO2) 的全球增温潜势 (GWP) 相比,N2O在100年时间尺度上的增温潜势约为CO2的298倍[1],且其在大气中的浓度以每年0.2%~0.3%的速率增长[2]。菜地生态系统因其耕作频繁、复种指数高和氮肥施用量大等特点导致一系列环境问题[3–4],例如氮肥利用率低、硝酸盐累积、土壤酸化[5–6],以及N2O的大量排放[7]等。土壤pH降低导致N2O/N2比值更高,增加N2O排放的环境风险[6]。
生物质炭 (biochar) 被认为能够改善土壤特性,增加作物产量,通过吸持作用降低酸性土壤交换性H+ 的水平,提高盐基饱和度和土壤pH[8–10]。研究表明,施用生物质炭可有效缓解农田土壤N2O排放[11–12],或没有显著影响[13–14],或增加N2O排放[15],因此施用生物质炭对N2O排放的作用具有不确定性。已有研究表明,生物质炭减少N2O排放的可能原因主要有:1) 增加吸附土壤NO3–,降低基质有效性[16];2) 增加土壤孔隙而降低反硝化作用[17];3) 提高土壤pH而促进N2O还原为N2[18];4) 由于自身含有乙烯而抑制硝化作用和NO3–的形成[19]。近来的研究开始从微生物角度揭示生物质炭对土壤N2O排放的影响机理,主要包括土壤的硝化 (amoA) 和反硝化 (nirK、nirS和nosZ) 功能基因群落的组成和结构[20–22],但其研究结果尚未统一。王晓辉等[21]研究发现施用生物质炭显著提高了nirK基因的群落丰度,但对nirS和nosZ基因丰度没有显著影响。由于N2O形成途径复杂、产生N2O的生态系统具有多样性,生物质炭对菜地土壤N2O排放的微生物作用机制并不明确。本研究采用室内培养和荧光定量PCR技术,探究酸性菜地田间施用生物质炭后对相关功能基因丰度和N2O排放的影响,为揭示生物质炭对菜地土壤N2O排放的微生物学机理提供科学依据。
1 材料与方法 1.1 试验点概况试验地点位于江苏省南京市高桥门镇上坊村 (32°01′N,118°52′E) 集约化种植菜地 (具有15年的种植历史)。该地区属于典型的长江中下游亚热带季风气候,年均气温15.4℃,年均降水量1.11 × 103 mm。一年可以种植3~5季蔬菜,是南方集约化蔬菜生产的典型代表。试验地土壤属于黄棕壤,质地为粉粘壤土 (粘粒30.1%、粉粒64.7%和砂粒5.2%)。初始土壤pH为5.5,容重1.2 g/cm3,有机碳 (SOC) 15.6 g C/kg,总氮 (TN) 1.9 g/kg,阳离子交换量 (CEC) 31.2 cmol/kg。
1.2 试验设计田间试验设置4个处理:对照 (CK);氮肥 (N);生物质炭 (Bc);氮肥+生物质炭 (N + Bc)。每个小区面积为 6 m2 (3 m × 2 m),每个处理设置3次重复。田间管理包括蔬菜品种、施肥量和施用方法、耕作、灌溉、除虫和杂草控制,与当地农民管理方式保持一致。氮肥施用量为常规施用量N 1.25 × 103 kg/(hm2·a),施氮处理均使用复合肥,其N∶P2O5∶K2O比例为15∶15∶15。生物质炭于2012年4月一次性施入土壤中,施用量为40 t/hm2,翻耕混匀,生物质炭施用后近3年内共种植9季蔬菜,不同处理种植蔬菜种类和农业管理措施等保持一致。生物质炭为河南三利新能源有限公司生产,由小麦秸秆在500℃条件下高温热分解制得,pH 9.4、总碳量46.7 g/kg、全氮 5.6 g/kg、CEC 24.1 cmol/kg、表面积 8.9 m2/g、灰分20.8%。土壤样品于2014年9月蔬菜成熟季采集,在每个小区内均匀分布采样,用土钻获得0—20 cm土层鲜土,取15 g用于土壤理化性质测定,2 g置于–80℃冰箱供微生物测定,其余置于4℃冰箱供室内培养。
1.3 室内培养取出贮存于4℃冰箱的鲜土,过2 mm筛,分别称取相当于30 g烘干土的新鲜土样于250 mL培养瓶内,置于 (28 ± 1)℃恒温培养箱中预培养24 h。预培养结束后,用注射器均匀添加N 200 mg/kg (NH4)2SO4溶液,并调节含水量至65%土壤持水量 (water holding capacity,WHC)。然后置于 (28 ± 1)℃恒温培养5周,培养期间每天用称重法添加蒸馏水以保持土壤含水量。整个试验期采样测定N2O浓度,第1~2周每天测定1次,第3~5周每周测定2次,采集方式为用20 mL三通阀注射性针筒在培养瓶密闭后0、5 h分别采集气体样品。
1.4 样品分析采用气相色谱仪 (Agilent 7890A,上海) 测定样品中的N2O浓度,检测器为ECD。每个处理分别于第1、7、14、21、28和35 d破坏性取样以测定pH、铵态氮 (NH4+-N)、硝态氮 (NO3–-N) 和amoA、nirS、nirK和nosZ基因丰度。
1.5 土壤理化性质和功能基因丰度测定土壤pH采用精密pH计 (PHS-3C) 测定,土水比为1∶5 (m/v);SOC含量采用重铬酸钾容量法测定,TN含量采用开氏法测定[23],NH4+-N含量测定采用 2 mol/L KCl浸提—靛酚蓝比色法,NO3–-N含量测定采用 2 mol/L KCl浸提—紫外分光光度法。
利用FastDNA Spin Kit for Soil试剂盒 (MP Biomedicals),根据操作指南提取土壤微生物总DNA。由于腐殖酸的存在影响样品的下游分子分析,而菜地土壤中腐殖酸含量较高,因此本研究采用5.5 mol/L异硫氰酸胍 (Guanidine thiocyanate) 反复清洗DNA,除去腐殖酸,并将DNA溶解于100 μL无菌水后于零下–20℃保存待用。
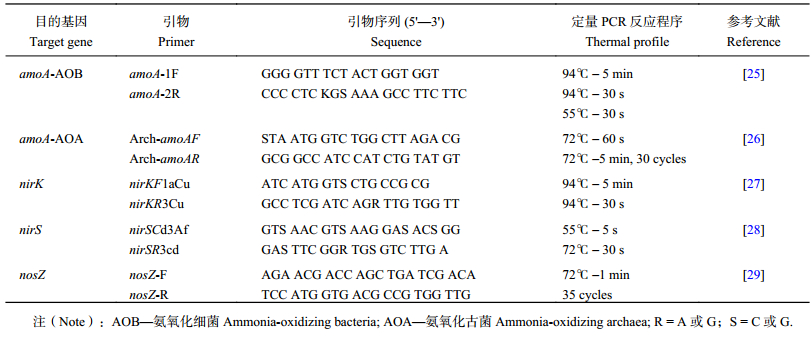
土壤氨氧化细菌氨单加氧酶基因 (amoA-AOB)、氨氧化古菌 (amoA-AOA),亚硝酸盐还原酶基因 (nirK、nirS) 和氧化亚氮还原酶基因 (nosZ) 定量PCR扩增引物和反应条件如表1所示。定量PCR标准曲线采用含有古菌和细菌的amoA、nirK、nirS和nosZ基因的克隆进行制备。首先采用特定引物分别扩增目标基因,构建克隆文库后,将含有目标基因的克隆在LB营养液中过夜培养,提取质粒纯化并测定质粒浓度,根据摩尔常数计算目标基因的拷贝数,并将质粒连续稀释8~10个数量级,从而获得各目标基因的标准曲线[24]。实时荧光定量PCR于CFX96 Real-Time PCR System (Bio-Rad公司) 上完成。定量PCR扩增反应体系为20 μL,包括SYBR Green (TaKaRa 日本)10 μL、Rox DYEII 0.2 μL、DNA模板1 μL、上下游引物 (10 μmol/L) 各0.4 μL、灭菌水8.0 μL。每次试验均设置严格的阴性对照,采用灭菌双蒸水代替DNA作为反应模板。
1.6 数据分析采用Microsoft Excel 2003和SigmaPlot 12.5软件进行数据计算和图表制作,采用JMP 9.0软件对培养期间土壤理化性质 (pH、SOC、TN、NH4+-N、NO3–-N) 和各功能基因丰度的动态变化进行重复测量方差分析,用Tukey法对田间试验各处理的土壤理化性质和培养期间N2O累积排放量进行多重比较 (α = 0.05),采用SigmaPlot 12.5软件对培养期间各处理N2O排放速率与土壤性质及相关功能基因丰度的动态变化进行相关性分析。
| 表1 荧光实时定量PCR扩增引物和反应条件 Table 1 The amplification primer and reaction condition of quantitative PCR |
 |
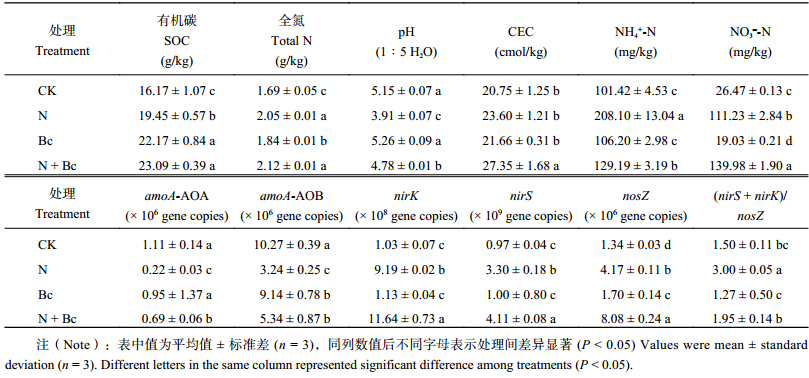
由表2可见,田间试验施用生物质炭近3年后,与CK处理相比,施用氮肥 (N) 显著降低土壤pH (P < 0.05),对CEC没有显著影响;单施生物质炭 (Bc) 显著提高土壤SOC含量27.1%和TN含量8.2% ( P < 0.05),土壤pH则没有显著改变。与N处理相比,N + Bc处理显著增加SOC含量24.4%、pH值18.2%和CEC含量13.7% ( P < 0.05)。
与CK处理相比,N处理均显著降低amoA-AOA和amoA-AOB丰度,增加nirK、nirS和nosZ丰度。Bc处理显著增加nosZ丰度 (P < 0.05),amoA-AOA、nirK和nirS丰度则均没有改变。与N处理相比,N + Bc处理均显著增加amoA-AOA、amoA-AOB、nirK、nirS和nosZ丰度,增幅分别为68.1%、39.3%、21.1%、19.8%、48.4% (P < 0.05)。N + Bc处理的 ( nirS + nirK)/nosZ比值显著低于N处理 (P < 0.05)。
| 表2 田间施用生物质炭3年后土壤基本性质 Table 2 Soil physicochemical properties after 3 years of field treatment with N fertilizer and biochar application in the acidic vegetable field |
 |
采集前述田间试验处理土壤样品进行室内培养,在初始添加 (NH4)2SO4溶液后,CK和Bc处理培养期间未出现明显的N2O排放峰;在第14~21 d,N2O排放量略高于培养前期 (0~14 d)(图1)。而N和N + Bc处理的N2O排放速率显著增加,在1~5 d出现N2O排放峰,排放速率分别为N 1.70 × 103和1.76 × 103 ng /(kg·h),但N和N + Bc处理的排放速率差异不显著 (P > 0.05);在7~15 d,N和N + Bc处理N 2O排放速率迅速降低,且此阶段N处理N2O排放速率显著高于N + Bc处理 (P < 0.05)。方差分析表明,培养时间、处理以及其交互作用均显著影响培养期间N 2O排放速率 (P < 0.01)。
培养期内CK和Bc处理N2O累积排放量显著低于N和N + Bc处理,且二者之间没有显著差异;N处理N2O累积排放量显著高于CK处理 (P < 0.001),是CK处理的6.7倍 ( 图1);与N处理相比,N + Bc处理显著降低N2O累积排放量33.3% (P < 0.001)。双因子方差分析结果显示,氮肥和生物质炭对N 2O累积排放量的影响具有显著的交互作用 (P < 0.001)。
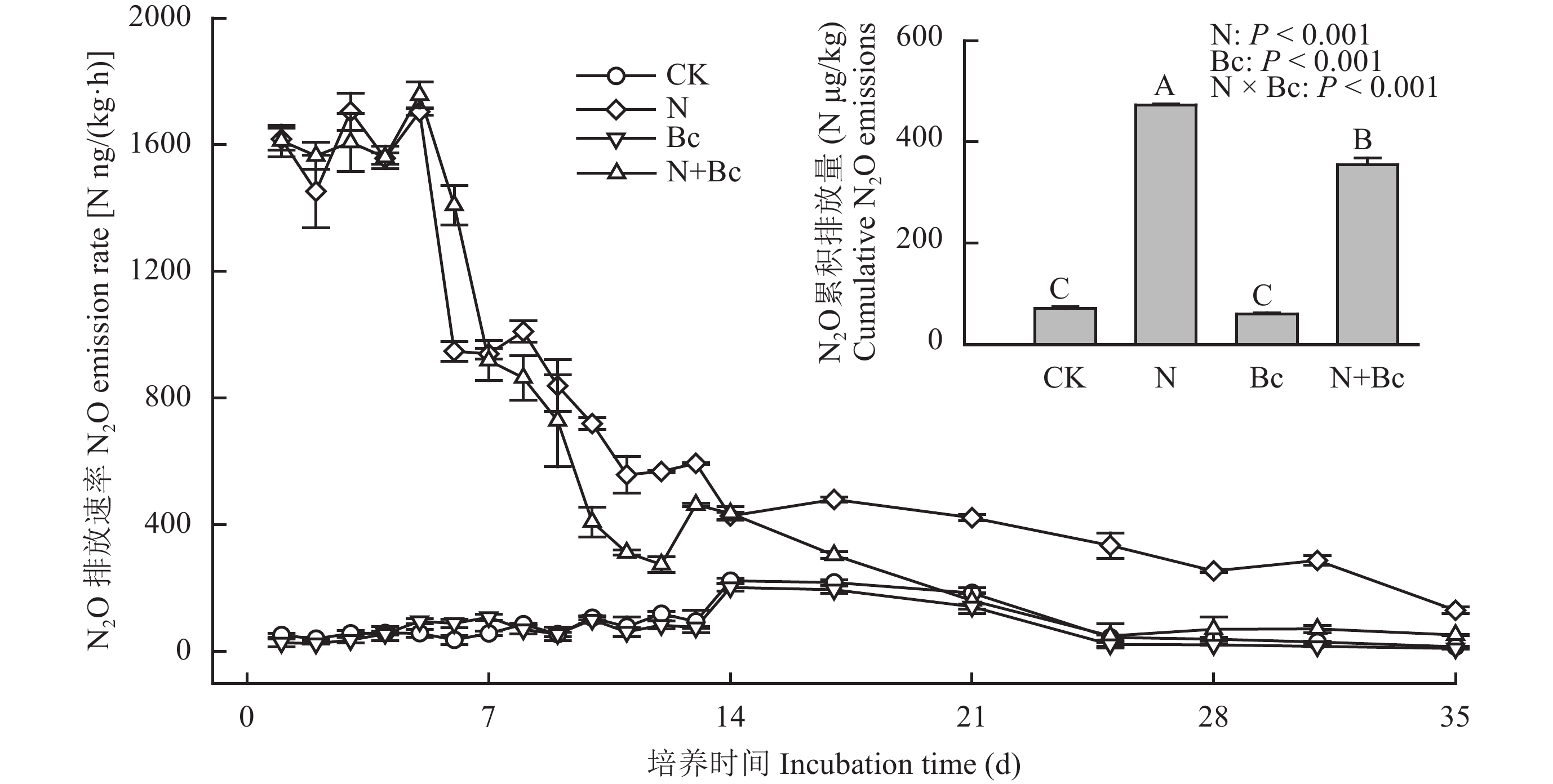 |
| 图1 室内培养各处理N2O排放的动态变化及累积排放量 Fig. 1 Dynamics of N2O fluxes and cumulative N2O emissions during the 35-day incubation [注(Note):柱上不同大写字母表示处理间N2O累积排放量差异显著Different capital letters above the bars represented significant difference among treatments in cumulative N2O emissions.] |
采集前述田间试验处理土壤样品进行室内培养,在初始加入 (NH4)2SO4溶液后,各处理土壤pH值都呈现降低的趋势 (图2a);N处理土壤pH值在7 d后则呈现缓慢上升的趋势;整个培养期间N处理的pH值均显著低于N + Bc处理 (P < 0.05)。
N和N + Bc处理土壤NH4+-N含量在初始加入 (NH4)2SO4溶液后,迅速上升后则呈现缓慢降低的趋势,CK和Bc处理土壤NH4+-N含量降幅更加显著 (图2b)。整个培养期间N处理的NH4+-N含量显著高于N + Bc处理,且显著高于CK和Bc处理 (P < 0.05);CK和Bc处理之间土壤NH 4+-N含量差异不显著。
CK和Bc处理土壤NO3– 含量呈现持续上升趋势,施用氮肥的N和N + Bc处理培养期内土壤NO3– 含量呈现降低趋势 (图2c)。整个培养期间,施用氮肥的N和N + Bc处理土壤NO3–-N含量基础值显著高于CK处理 (P < 0.05);N + Bc处理的NO 3–-N含量均显著高于N处理 (P < 0.05);除第28 d外,CK和Bc处理的土壤NO 3– 含量没有显著差异。方差分析表明,培养时间、处理以及其交互作用均显著影响土壤NO3–-N含量 (P < 0.01)。
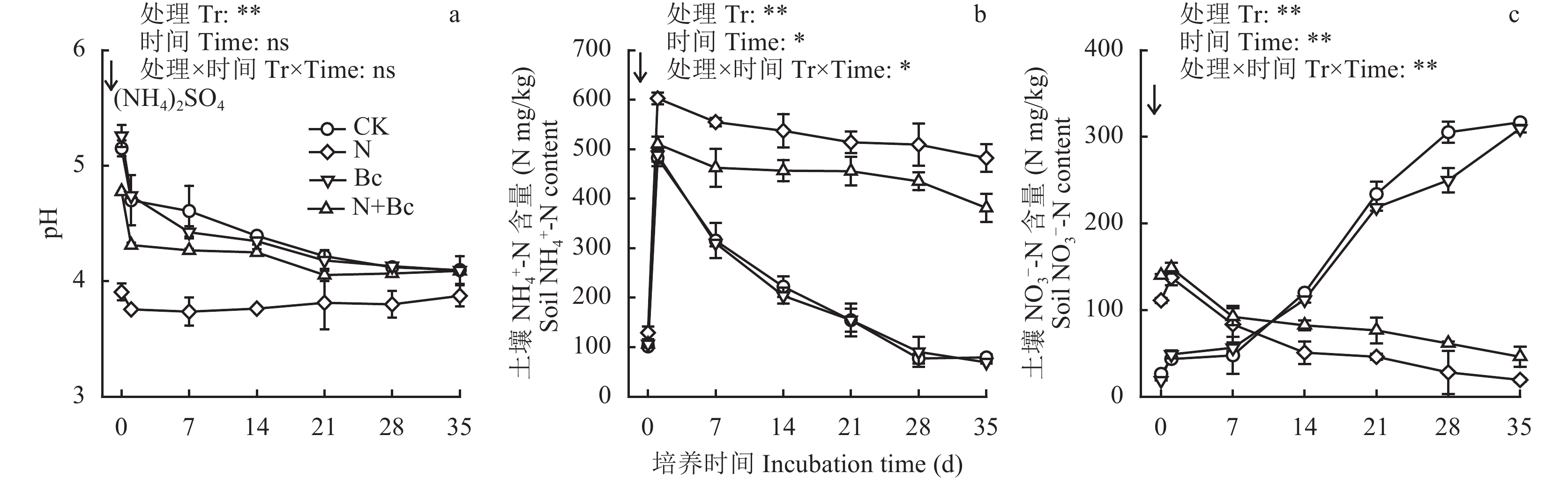 |
| 图2 室内培养中土壤pH、NH4+-N content和NO3–-N变化趋势 Fig. 2 Dynamics of soil pH, NH4+-N and NO3–-N content during incubation of four treatments with (NH4)2SO4 addition [注(Note):箭头表示加入 (NH4)2SO4溶液The arrows indicated the addition of (NH4)2SO4; Tr—Treatment; ns表示差异不显著 ns denoted not significant; *和**表示处理间在0.05和0.01水平上差异显著Represented significant difference at 0.05 and 0.01 levels, respectively.] |
采集前述田间试验处理土壤样品进行室内培养,在初始加入 (NH4)2SO4溶液后,CK和Bc处理土壤amoA-AOB和amoA-AOA功能丰度均迅速上升,amoA-AOB丰度在第1 d达到峰值,分别为24.3 × 107 (CK)、20.3 × 107 (Bc) 拷贝数g–1d.w.s,之后逐渐下降;而amoA-AOA丰度在第14 d达到峰值,分别为19.1 × 105 (CK)、18.7 × 105 (Bc) 拷贝数g–1d.w.s,14~21 d迅速下降,之后趋于平缓 (图3a, 3b)。N处理土壤在整个培养期间amoA-AOB和amoA-AOA丰度均呈缓慢上升,但其amoA-AOB和amoA-AOA丰度均显著低于CK处理 (P < 0.05)。N + Bc处理的 amoA-AOB和amoA-AOA丰度在第1 d显著降低,但降幅不同;随后amoA-AOB丰度缓慢上升,amoA-AOA丰度呈现缓慢降低的趋势。
培养期间各处理土壤nirK、nirS丰度显著增加,之后均呈现缓慢降低的趋势 (图3c,图3d);CK和Bc处理土壤nirK、nirS丰度没有显著差异 (除第14 d,Bc处理的nirS基因丰度显著高于CK处理)。N处理土壤nirK、nirS功能基因丰度均显著高于CK处理 (P < 0.05),N + Bc处理土壤 nirK、nirS基因丰度均显著高于N处理 (P < 0.05)。
培养期间CK和Bc处理土壤nosZ功能基因丰度呈现上下波动趋势,波动幅度不大 (图3e);N和N + Bc处理土壤nosZ基因丰度迅速上升,在第14天达到峰值,14~35 d迅速下降;N和N + Bc处理土壤nosZ基因丰度均显著高于CK处理。除第1、28和35 d外,N + Bc处理的nosZ功能基因丰度均显著高于N处理 (P < 0.05)。
方差分析表明,培养时间、处理以及其交互作用均显著影响amoA-AOA和nosZ (P < 0.01),而该交互作用对 nirK、nirS丰度没有显著影响。
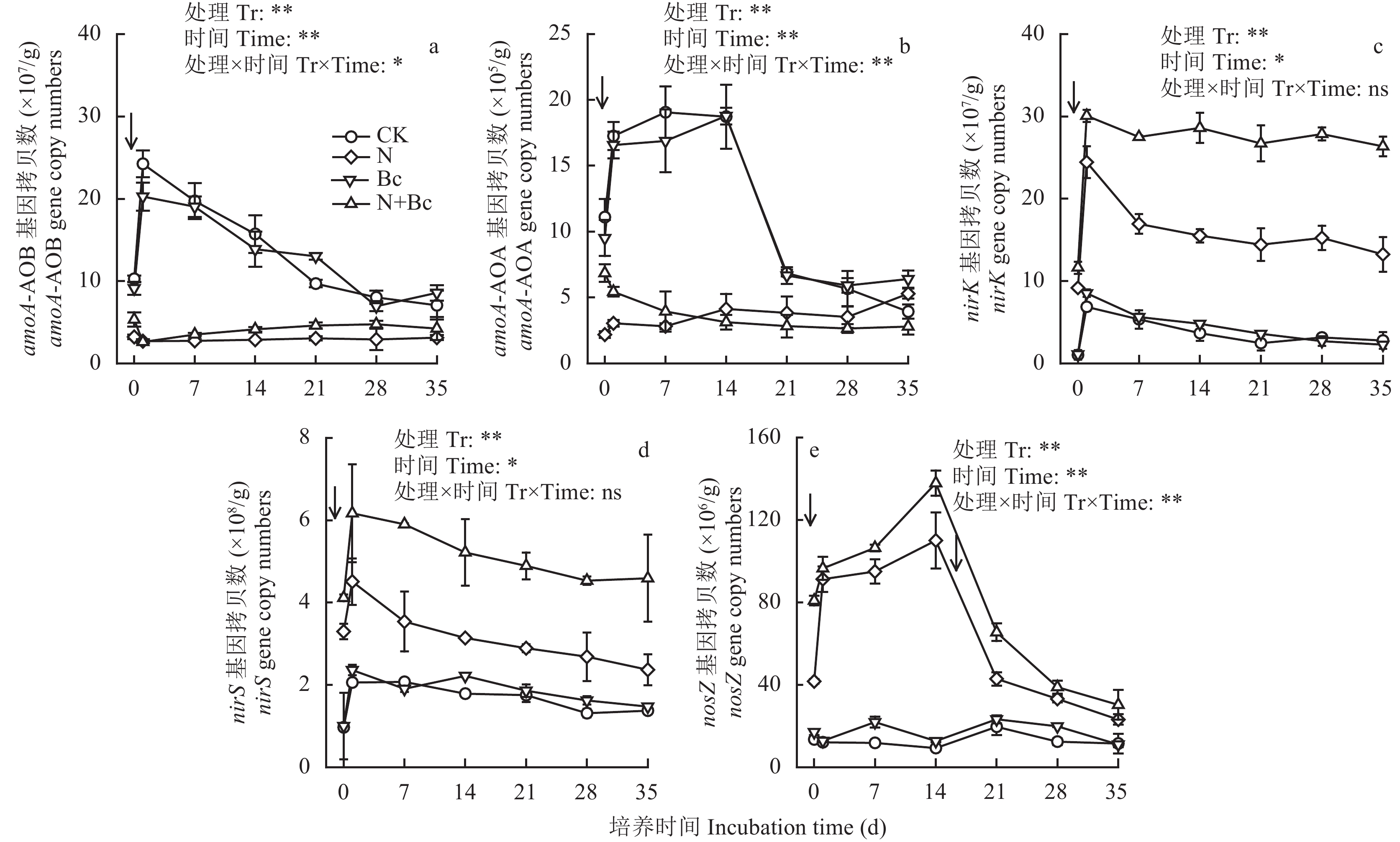 |
| 图3 室内培养中不同处理amoA-AOB、amoA-AOA、nirK、nirS 和nosZ 基因丰度变化趋势 Fig. 3 Dynamics in the abundance of amoA-AOB, amoA-AOA, nirK,nirS, 和nosZ genes during incubation under four treatments based on qPCR analysis [注(Note):箭头表示加入 (NH4)2SO4溶液The arrows indicated the addition of (NH4)2SO4; Tr—Treatment; ns表示差异不显著 ns denoted not significant; *和**表示处理间在0.05和0.01水平上差异显著Represented significant difference at 0.05 and 0.01 levels, respectively.] |
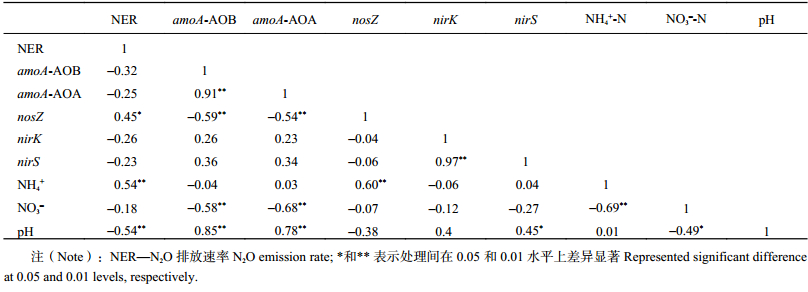
菜地各处理土壤室内培养期间,amoA-AOB、amoA-AOA基因丰度与pH呈显著正相关 (r分别为0.85、0.78,P < 0.01)( 表3),与NO3–-N呈显著负相关 (r分别为–0.58、–0.68,P < 0.01),nosZ基因丰度与NH4+-N呈显著正相关 (r = 0.60,P < 0.01),nirS基因丰度与pH呈显著正相关 (r = 0.45,P < 0.05)。N 2O排放速率与氧化亚氮还原酶的标记基因nosZ基因拷贝数呈显著正相关 (r = 0.45,P < 0.05),与NH 4+-N含量也呈现显著正相关 (r = 0.54,P < 0.01),与pH则呈显著负相关 ( r = –0.54,P < 0.01)。
| 表3 N2O排放速率与氨氧化古菌基因、氨氧化细菌、以及亚硝酸盐还原酶基因、氧化亚氮还原酶基因与土壤理化性质间的相关关系 (r) Table 3 Correlation coefficients among N2O emission rate, soil physiochemical properties and ammonia-oxidizing archaea (amoA-AOA), ammonia-oxidizing bacteria (amoA-AOB), abundance of nitrite reductase (nirK, nirS) gene, N2O reductase (nosZ) gene during incubation |
 |
微生物主导的N2O产生包括多种过程,如硝化作用、硝化细菌反硝化作用、反硝化作用、联合反硝化及硝酸盐异化还原过程[30],受土壤pH、无机氮含量、SOC含量等众多因素的影响。本研究CK和Bc处理的N2O累积排放量很低 (图1),培养期间土壤NH4+-N含量迅速下降,NO3–-N含量相应地迅速上升,具有较强的硝化作用,同时反硝化作用较弱,推测硝化作用并不是该菜地土壤N2O产生的主要来源。CK和Bc处理反硝化作用弱,N2O排放量也很低 (图1)。
大量研究表明,氮肥施用是农田生态系统N2O排放的重要来源[1],施用氮肥能够显著增加酸性土壤N2O排放[31–33]。本研究添加外源氮肥后,与CK和Bc处理相比,N和N + Bc处理显著刺激土壤的N2O排放 (图1)。这可能是由于:1) 长期施用N肥显著增加土壤SOC含量 (表2,P < 0.05),为反硝化微生物的生长提供充足的碳源 [34];2) 较高的NO3– 含量为反硝化微生物提供充足的底物[35] (表2)。培养期间N和N + Bc处理NO3–-N与NH4+-N含量变化不成比例 (图2);添加外源氮肥后,各施氮处理土壤NH4+-N浓度维持较高水平,NO3–-N被明显消耗,NO3–-N浓度维持在较低水平,表明该菜地施氮处理土壤硝化作用较弱,反硝化作用较强,因此推测N和N + Bc处理土壤N2O排放主要来源于反硝化过程。前人研究也表明,酸性菜地土壤中硝化作用较弱[36]。
施用生物质炭能够减缓N2O排放[37–39]。本研究中施用生物质炭显著减少培养期间菜地土壤N2O累积排放量 (图1),与该地区施用相同生物质炭的大田试验结果一致[31, 40]。在本研究中,施用生物质炭提高了土壤pH (表2),因此土壤pH增加可能是减少酸性菜地土壤N2O排放的原因之一[6]。Cayuela等[11]分析发现,施用生物质炭平均降低54%农田生态系统N2O的排放,推测主要是由于生物质炭的“石灰效应”影响土壤理化性质和微生物数量,进而影响N2O排放。
3.2 氮肥和生物质炭联合施用对菜地土壤氮循环相关功能基因丰度的影响氮肥施用影响土壤NH4+-N、NO3–-N的含量以及pH值,进而影响硝化过程功能基因amoA-AOA、amoA-AOB[41]以及反硝化过程功能基因nirK、nirS、nosZ丰度 (表2,图3)。经过近3年田间试验后,与CK和Bc相比,N和N + Bc显著降低了amoA-AOA和amoA-AOB丰度。据报道,长期施用氮肥导致南方红壤和北方黑土中的amoA-AOA丰度降低[42-43]。尽管诸多研究表明,无机氮添加能够显著刺激AOB种群数量的增长[44],但本研究结果显示,氮肥施用显著降低amoA-AOB的丰度,可能是由于长期的氮肥施用导致土壤酸化,从而超出了细菌生长的阈值。Geisseler等研究表明,amoA-AOB生长的最适pH是5.5[45]。本研究相关分析表明amoA-AOA丰度与pH呈正相关 (r = 0.97,P < 0.05),说明 amoA-AOA拷贝数随土壤的酸化而显著降低。Nicol等对pH梯度为4.9~7.5的草地土壤进行的研究则发现amoA-AOA数量随土壤pH降低而明显升高[46],与本研究结果相反,可能与供试土壤养分浓度有关。此外,amoA-AOB丰度与NO3–-N呈显著负相关关系 (P < 0.01,表3),因此推测土壤中较高NO3–-N含量会对amoA-AOB造成不利的影响[45]。
本研究结果表明,生物质炭田间施用近3年后显著增加amoA-AOA和amoA-AOB丰度 (表2),培养期间二者差异不显著 (图3)。Ducey等[22]研究也表明,培养6个月后,生物质炭显著增加了amoA-AOB丰度;也有研究表明,生物质炭同时显著增加amoA-AOA和amoA-AOB丰度[47]。生物质炭添加对硝化作用amoA-AOA、amoA-AOB丰度和反硝化作用nirS、nirK、nosZ丰度的影响不一致[11, 22, 47]。本研究通过近3年田间试验结果显示,N + Bc处理显著提高土壤nirK、nirS、nosZ型反硝化功能基因丰度 (表2,P < 0.05),这可能是由于N + Bc显著增加NO 3–和SOC含量 (P < 0.05,表2),为反硝化微生物提供充足底物,刺激反硝化微生物生长。因此,一方面生物质炭对nirK和nirS基因丰度的增加促进了土壤反硝化作用进程,并促进反硝化作用产生N2O;另一方面提高nosZ基因丰度,加速N2O还原为N2释放到大气中,促进土壤反硝化作用完全进行[11, 46]。重复方差分析表明,N2O排放具有显著的培养时间效应 (P < 0.01,表3)。本研究中N2O排放主要集中在培养前期,推测主要是生物质炭中含有的溶解性有机碳刺激反硝化微生物。已有研究表明,当土壤中溶解性有机碳的含量增加时,N2O排放增加,这可能是由于溶解性有机碳为反硝化菌的活动提供了能量[48–49]。Jones等研究表明,生物质炭添加增加土壤溶解性有机碳浓度,本身含有的溶解性有机碳在培养36 h以内就会被土壤微生物分解[50]。本研究中生物质炭施用在一定程度上改变了反硝化微生物的组成,显著增加nosZ型反硝化基因丰度 (图3e),降低土壤 (nirS+nirK)/nosZ比值,使得N2O消耗多于产生,最终降低其排放量,与前人研究结果一致[51]。这可能是生物质炭能够减少菜地土壤N2O排放的重要原因。Cayuela等[11]研究了15种农业土壤后也指出,生物质炭作为反硝化微生物的电子受体实现“电子穿梭”,把电子转化到土壤反硝化微生物基团中,促进N2O还原为N2,降低N2O/(N2O + N2) 的比例,表明生物质炭促进反硝化作用的最后一步。另外生物质炭的酸性缓冲能力和较大的比表面积以及电子转移特性,促进N2O还原为N2[52–53]。本研究中N + Bc处理的反硝化基因 (nirK、nirS、nosZ) 丰度最高,说明其反硝化作用较强;相关分析也表明,(nirS + nirK)/nosZ比值与pH值呈显著负相关 (r = –0.99,P < 0.01),表明生物质炭在酸性土壤中是通过增加土壤pH、改变反硝化的产物比 [6],进而减缓N2O排放。
本研究结果表明,生物质炭显著影响反硝化微生物的功能基因丰度 (nirK、nirS、nosZ),对硝化过程中氨氧化微生物功能基因没有显著影响 (amoA-AOA、amoA-AOB)。因此推测生物质炭主要是通过促进反硝化作用最后一步,实现减缓酸性菜地土壤的N2O排放。
4 结论在蔬菜生态系统中氮肥和生物质炭联合施用可以有效缓解菜地土壤酸化,提高土壤质量,减少菜地土壤N2O排放,这主要归因于酸性土壤反硝化作用中的nosZ基因丰度增加,菜地土壤中 (nirS + nirK)/nosZ比值降低,反硝化作用进行完全,促进N2O还原为N2。但是土壤中N2O排放是物理、化学、生物学等多方面因素综合作用的结果,生物质炭对菜地土壤微生物的影响机制,尤其是田间长期效应及影响机制仍需深入研究。
| [1] | IPCC. Climate change 2013: The physical science basis. Contribution of working group I to the fifth assessment report of the intergovernmental panel on climate change [M]. Cambridge, United Kingdom and New York, USA: Cambridge University Press, 2013. |
| [2] | Smith P, Martino D, Cai Z, et al. Greenhouse gas mitigation in agriculture[J]. Philosophical Transactions of the Royal Society B, 2008, 363: 789–813. DOI:10.1098/rstb.2007.2184 |
| [3] | Ju X T, Kou C L, Zhang F S, et al. Nitrogen balance and groundwater nitrate contamination: comparison among three intensive cropping systems on the North China Plain[J]. Environmental Pollution, 2006, 143(1): 117. DOI:10.1016/j.envpol.2005.11.005 |
| [4] | Rashti M R, Wang W, Moody P, et al. Fertiliser-induced nitrous oxide emissions from vegetable production in the world and the regulating factors: A review[J]. Atmospheric Environment, 2015, 112: 225–233. DOI:10.1016/j.atmosenv.2015.04.036 |
| [5] | Ren T, Christie P, Wang J G, et al. Root zone soil nitrogen management to maintain high tomato yields and minimum nitrogen losses to the environment[J]. Scientia Horticulturae, 2010, 125(1): 25–33. DOI:10.1016/j.scienta.2010.02.014 |
| [6] | Qu Z, Wang J, Almøy T, et al. Excessive use of nitrogen in Chinese agriculture results in high N2O/(N2O+N2) product ratio of denitrification, primarily due to acidification of the soils [J]. Global Change Biology, 2014, 20(5): 1685–1698. DOI:10.1111/gcb.2014.20.issue-5 |
| [7] | Zhang W F, Dou Z X, He P, et al. New technologies reduce greenhouse gas emissions from nitrogenous fertilizer in China[J]. Proceedings of the National Academy of Sciences, 2013, 110(21): 8375–8380. DOI:10.1073/pnas.1210447110 |
| [8] | Novak J M, Cantrell K B, Watts D W, et al. Designing relevant biochars as soil amendments using lignocellulosic-based and manure-based feedstocks[J]. Journal of Soils and Sediments, 2014, 14(2): 330–343. DOI:10.1007/s11368-013-0680-8 |
| [9] | Khan S, Chao C, Waqas M, et al. Sewage sludge biochar influence upon rice (Oryza sativa L) yield, metal bioaccumulation and greenhouse gas emissions from acidic paddy soil [J]. Environmental Science & Technology, 2013, 47(15): 8624–8632. |
| [10] | Rees F, Simonnot M O, Morel J L. Short-term effects of biochar on soil heavy metal mobility are controlled by intra-particle diffusion and soil pH increase[J]. European Journal of Soil Science, 2014, 65(1): 149–161. DOI:10.1111/ejss.12107 |
| [11] | Cayuela M L, Sánchez–Monedero M A, Roig A, et al. Biochar and denitrification in soils: when, how much and why does biochar reduce N2O emissions [J]. Scientific Reports, 2013, 3(7446): 1732. |
| [12] | Nelissen V, Saha B K, Ruysschaert G, Boeckx P. Effect of different biochar and fertilizer types on N2O and NO emissions [J]. Soil Biology & Biochemistry, 2014, 70: 244–255. |
| [13] | Suddick. An estimation of annual nitrous oxide emissions and soil quality following the amendment of high temperature walnut shell biochar and compost to a small scale vegetable crop rotation[J]. Science of the Total Environment, 2013, 465: 298–307. DOI:10.1016/j.scitotenv.2013.01.094 |
| [14] | Wang J, Chen Z, Xiong Z, et al. Effects of biochar amendment on greenhouse gas emissions, net ecosystem carbon budget and properties of an acidic soil under intensive vegetable production[J]. Soil Use & Management, 2015, 31(3): 375–383. |
| [15] | Clough T J, Bertram J E, Ray J L, et al. Unweathered wood biochar impact on nitrous oxide emissions from a bovine-urine-amended pasture soil[J]. Soil Science Society of America Journal, 2010, 74(3): 852–860. DOI:10.2136/sssaj2009.0185 |
| [16] | Zwieten L V, Kimber S, Morris S, et al. Influence of biochars on flux of N2O and CO2 from Ferrosol [J]. Soil Research, 2010, 48(6): 555–568. |
| [17] | Yanai Y, Toyota K, Okazaki M. Effects of charcoal addition on N2O emissions from soil resulting from rewetting air-dried soil in short-term laboratory experiments [J]. Soil Science & Plant Nutrition, 2007, 53(2): 181–188. |
| [18] | Cornelissen G, Rutherford D W, Arp H P H, et al. Sorption of pure N2O to biochars and other organic and inorganic materials under anhydrous conditions [J]. Environmental Science & Technology, 2013, 47(14): 7704–7712. |
| [19] | Spokas K A, Baker J M, Reicosky D C. Ethylene: Potential biochar amendment impacts[J]. Plant and Soil, 2010, 333(1-2): 443–452. DOI:10.1007/s11104-010-0359-5 |
| [20] | Ball P N, Mackenzie M D, Deluca T H, et al. Wildfire and charcoal enhance nitrification and ammonium-oxidizing bacterial abundance in dry montane forest soils[J]. Journal of Environmental Quality, 2010, 39(4): 1243–1253. DOI:10.2134/jeq2009.0082 |
| [21] |
王晓辉, 郭光霞, 郑瑞伦, 等. 生物炭对设施退化土壤氮相关功能微生物群落丰度的影响[J].
土壤学报, 2013, 50(3): 624–631.
Wang X H, Guo G X, Zheng R L, et al. Effect of biochar on abundance of N-related functional microbial communities in degraded greenhouse soil[J]. Acta Pedologica Sinica, 2013, 50(3): 624–631. |
| [22] | Ducey T F, Ippolito J A, Cantrell K B, et al. Addition of activated switchgrass biochar to an aridic subsoil increases microbial nitrogen cycling gene abundances[J]. Applied Soil Ecology, 2013, 65(2): 65–72. |
| [23] |
鲍士旦. 土壤农化分析[M]. 北京: 中国农业出版社, 2000. 355–356.
Bao S D. Soil and agricultural chemistry analysis [M]. Beijing: China Agriculture Press, 2000. 355–356. |
| [24] |
郭赟, 吴宇澄, 林先贵, 等. 3次连续重复提取DNA能较好反映土壤微生物丰度[J].
微生物学报, 2012, 52(7): 894–901.
Guo Y, Wu Y C, Lin X G, et al. Three successive extractions reduce quantification bias of microbial communities associated with incomplete DNA recovery in soil[J]. Acta Microbiologica Sinica, 2012, 52(7): 894–901. |
| [25] | Francis C A, Roberts K J, Beman J M, et al. Ubiquity and diversity of ammonia-oxidizing archaea in water columns and sediments of the ocean[J]. Proceedings of the National Academy of Sciences of the United States of America, 2005, 102(41): 14683–14688. DOI:10.1073/pnas.0506625102 |
| [26] | Rotthauwe J H, Witzel K P, Liesack W. The Ammonia monooxygenase structural gene amoA as a functional marker: molecular fine-scale analysis of natural ammonia-oxidizing populations [J]. Applied & Environmental Microbiology, 1997, 63(12): 4704–4712. |
| [27] | Hallin S, Lindgren P E. PCR detection of genes encoding nitrite reductase in denitrifying bacteria[J]. Applied & Environmental Microbiology, 1999, 65(4): 1652–1657. |
| [28] | Guo G X, Deng H, Qiao M, et al. Effect of pyrene on denitrification activity and abundance and composition of denitrifying community in an agricultural soil[J]. Environmental Pollution, 2011, 159(7): 1886–1895. DOI:10.1016/j.envpol.2011.03.035 |
| [29] | Kloos K, Mergel A, Rösch C, et al. Denitrification within the genus Azospirillum and other associative bacteria[J]. Australian Journal of Plant Physiology, 2001, 28(9): 991–998. |
| [30] | Sanchezgarcía M, Roig A, Sanchezmonedero M A, et al. Biochar increases soil N2O emissions produced by nitrification-mediated pathways [J]. Frontiers in Environmental Science, 2014, 2(2): 25. |
| [31] |
李博, 张曼, 熊正琴. 施用氮肥与生物质炭对菜地净综合温室效应的影响[J].
中国科技论文, 2014, 9(9): 1057–1062.
Li B, Zhang M, Xiong Z Q. Effects of nitrogen fertilizer and biochar on net global warming potential of intensively managed vegetable fields[J]. China Science Paper, 2014, 9(9): 1057–1062. |
| [32] | Cheng Y, Wang J, Zhang J B, et al. Mechanistic insights into the effects of N fertilizer application on N2O-emission pathways in acidic soil of a tea plantation [J]. Plant and Soil, 2015, 389(1): 45–57. |
| [33] |
张洪培. 生物质炭对旱作农田N2O排放及硝化作用的影响[D]. 陕西杨凌: 西北农林科技大学硕士学位论文, 2016.
Zhang H P. Effects of biochar on N2O emissions and soil nitrification in dry land farming ecosystem [D]. Yangling, Shanxi: MS Thesis of Northwest A & F University, 2016. |
| [34] | Dambreville C, Hallet S, Nguyen C, et al. Structure and activity of the denitrifying community in a maize-cropped field fertilized with composted pig manure or ammonium nitrate[J]. Fems Microbiology Ecology, 2006, 56(1): 119–131. DOI:10.1111/fem.2006.56.issue-1 |
| [35] | Wrage N, Velthof G L, Beusichem M L V, et al. Role of nitrifier denitrification in the production of nitrous oxide[J]. Soil Biology & Biochemistry, 2001, 33(12-13): 1723–1732. |
| [36] | Zhu T, Zhang J, Cai Z, et al. The N transformation mechanisms for rapid nitrate accumulation in soils under intensive vegetable cultivation[J]. Journal of Soils and Sediments, 2011, 11(7): 1178–1189. DOI:10.1007/s11368-011-0384-x |
| [37] | Karhu K, Manila T, Bcrgstrom I, et al. Biochar addition to agricultural soil increased CH4 uptake and water holding capacity-Results from a short term pilot field study [J]. Agriculture, Ecosystems & Environment, 2011, 140(1/2): 309–313. |
| [38] | Zhang A, Cui L, Pan G, et al. Effect of biochar amendment on yield and methane and nitrous oxide emissions from a rice paddy from Tai Lake Plain, China[J]. Agriculture, Ecosystems & Environment, 2010, 139(4): 469–475. |
| [39] | Zhang A, Liu Y, Pan G, et al. Effect of biochar amendment on maize yield and greenhouse gas emissions from a soil organic carbon poor calcareous loamy soil from Central China Plain[J]. Plant and Soil, 2012, 351(1/2): 263–275. |
| [40] |
贾俊香, 熊正琴. 秸秆生物质炭对菜地N2O、CO2与CH4排放及土壤化学性质的影响
[J].
生态与农村环境学报, 2016, 32(2): 283–288.
Jia J X, Xiong Z Q. Impact of application of maize stalk-derived biochar on soil properties of and N2O, CO2 and CH4 emissions from vegetable fields [J]. Journal of Ecology and Rural Environment, 2016, 32(2): 283–288. DOI:10.11934/j.issn.1673-4831.2016.02.017 |
| [41] |
侯海军, 秦红灵, 陈春兰, 等. 土壤氮循环微生物过程的分子生态学研究进展[J].
农业现代化研究, 2014, 35(5): 588–594.
Hou H J, Qin H L, Chen C L, et al. Research progress of the molecular ecology on microbiological processes in soil nitrogen cycling[J]. Research of Agricultural Modernization, 2014, 35(5): 588–594. |
| [42] |
张苗苗, 王伯仁, 李冬初, 等. 长期施加氮肥及氧化钙调节对酸性土壤硝化作用及氨氧化微生物的影响[J].
生态学报, 2015, 35(19): 6362–6370.
Zhang M M, Wang B R, Li D C, et al. Effects of long-term N fertilizer application and liming on nitrification and ammonia oxidizers in acidic soils[J]. Acta Ecologica Sinica, 2015, 35(19): 6362–6370. |
| [43] |
周晶, 姜昕, 周宝库, 等. 长期施用尿素对东北黑土中氨氧化古菌群落的影响[J].
中国农业科学, 2016, 49(2): 294–304.
Zhou J, Jiang X, Zhou B K, et al. Effects of long term application of urea on ammonia oxidizing archaea community in black soil in Northeast China[J]. Scientia Agricultura Sinica, 2016, 49(2): 294–304. |
| [44] | Hermansson A, Lindgren P E. Quantification of ammonia-oxidizing bacteria in arable soil by real-time PCR[J]. Applied and Environmental Microbiology, 2001, 67(2): 972–976. DOI:10.1128/AEM.67.2.972-976.2001 |
| [45] | Geisseler D, Scow K M. Long-term effects of mineral fertilizers on soil microorganisms - A review[J]. Soil Biology & Biochemistry, 2014, 75: 54–63. |
| [46] | Nicol G W, Leininger S, Schleper C, Prosser J I. The influence of soil pH on the diversity, abundance and transcriptional activity of ammonia oxidizing archaea and bacteria[J]. Environmental Microbiology, 2008, 10(11): 2966–2978. DOI:10.1111/emi.2008.10.issue-11 |
| [47] | Xu H J, Wang X H, Li H, et al. Biochar impacts soil microbial community composition and nitrogen cycling in an acidic soil planted with rape[J]. Environmental Science & Technology, 2014, 48(16): 9391. |
| [48] | Jahangir M M R, Khalil M I, Johnston P, et al. Denitrification potential in subsoils: a mechanism to reduce nitrate leaching to groundwater[J]. Agriculture, Ecosystems and Environment, 2012, 147: 13–23. DOI:10.1016/j.agee.2011.04.015 |
| [49] | Troy S M, Lawlor P G, O’Flynn C J, et al. Impact of biochar addition to soil on greenhouse gas emissions following pig manure application[J]. Soil Biology & Biochemistry, 2013, 60: 173–181. |
| [50] | Jones D L, Murphy D V, Khalid M, et al. Short-term biochar-induced increase in soil CO2 release is both biotically and abiotically mediated [J]. Soil Biology & Biochemistry, 2011, 43: 1723–1731. |
| [51] | Harter J, Krause H M, Schuettler S, et al. Linking N2O emissions from biochar-amended soil to the structure and function of the N-cycling microbial community [J]. Isme Journal, 2013, 8(3): 660. |
| [52] | Baggs E M. Soil microbial sources of nitrous oxide: recent advances in knowledge, emerging challenges and future direction[J]. Current Opinion in Environmental Sustainability, 2011, 3(5): 321–327. DOI:10.1016/j.cosust.2011.08.011 |
| [53] | Harter J, Weigold P, El Hadidi M, et al. Soil biochar amendment shapes the composition of N2O reducing microbial communities [J]. Science of the Total Environment, 2016, 562: 379–390. DOI:10.1016/j.scitotenv.2016.03.220 |
 2018, Vol. 24
2018, Vol. 24  doi:
doi: 

