2. 浙江农林大学农业与食品科学学院/浙江省农产品品质改良重点实验室,浙江临安 311300
2. College of Agricultural and Food Science/Key Laboratory of Quality Improvement of Agricultural Products of Zhejiang Province, Zhejiang A&F University, Lin’an 311300, China
八仙花 (Hydrangea macrophylla) 又名大花绣球、阴性绣球等,属虎耳草科八仙花属,原产于中国和日本,在我国广泛用作观赏灌木和盆栽花卉。八仙花品种繁多,主要的花色有红色、粉色、白色、蓝色等[1]。研究发现,八仙花颜色会由于栽培方式、周围环境变化而变化,如八仙花花色与土壤 pH 值有关,在中性或碱性土壤中呈现粉红色,在酸性土中呈蓝色[2–3]。Ito 等[4]发现蓝色品种八仙花花瓣内 Al3+ 含量比红色品种高 39 倍。Schreiber 等 [5]分析了多个红色、紫色和蓝色八仙花品种色素及 Al3+ 含量,发现红色品种花瓣 Al3+ 含量范围为 0~10 μg/g FW,紫色品种含量范围为 10~40 μg/g FW,蓝色品种 Al3+ 含量大于 40 μg/g FW,并提出八仙花呈现不同颜色是因为不同浓度的 Al3+ 与飞燕草素-3-葡萄糖苷形成的复合物呈色反应不同造成的。在酸性条件下,苹果酸等会激活 Al3+ 运输通道,从而促进根系 Al3+ 的吸收[6]。在八仙花花瓣内,Al3+ 的积累主要是通过两个铝离子转运蛋白来实现,分别位于质膜和液泡膜上 [其编码基因分别为质膜铝转运基因 plasma membrane Al transporter (PALT) 和液泡膜铝转运基因 vacuolar Al transporter (VALT)],均属于水通道蛋白家族。质膜铝离子转运蛋白将 Al3+ 从细胞外运输到细胞质中,继而由液泡膜铝转运蛋白运输到液泡并储存起来[7],与液泡中的飞燕草素-3-葡萄糖苷形成复合物。
我国八仙花品种繁多,当前研究主要关注八仙花组织培养、耐铝毒害机制等[8–9]。本研究以浙江省主要的八仙花品种之一‘蓝色妈妈’为材料,分析了不同浓度 Al2(SO4)3 处理对其花色、花青苷含量、Al3+ 含量及 Al3+ 跨膜运输相关基因表达的影响,探讨通过控制根域 Al3+ 浓度调控八仙花花色,满足市场需求。
1 材料与方法 1.1 试验设计采用八仙花品种为‘蓝色妈妈’,种苗购自浙江虹越花卉有限公司。2015 年 4 月,在扦插苗中选取整齐一致的幼苗移入标准 1 加仑营养盆中进行处理,栽培基质为混合基质 (珍珠岩∶蛭石∶草炭之比为 1∶1∶1,pH 6)。试验设置 3 个处理:1) CK,根系添加 pH 为 6 的柠檬酸缓冲液;2) 根系添加 2‰ Al2(SO4)3,用柠檬酸缓冲液将 pH 调节至 6;3) 根系添加 4‰ Al2(SO4)3,用柠檬酸缓冲液将 pH 调节至 6。在植株出现花蕾约 1 cm 时开始进行处理,以后每周处理 1 次,直至现蕾,每处理 4 次重复。开花盛期时拍照进行花色分析,取花瓣鲜样进行色素含量分析,取样品液氮冷冻放入 –80℃ 冰箱供基因表达水平分析。
1.2 花青苷含量测定与质谱分析提取方法参照考 Park 等[10]的方法并略作修改。取 5 g 鲜样,加入 10 mL 5% 甲酸溶液,研磨至匀浆,超声 30 min,4000 rpm/min 离心,上清液过 0.45 μm 滤膜,得到提取液。将提取液进高效液相色谱 (LC-20AT,日本岛津公司) 进行分析。色谱柱为 InertSustain C18 (4.6 mm × 250 mm,5 μm),流动相 A 相为 5% 甲酸水溶液,B 相为 5% 甲酸乙腈,进样量 20 μL,流速 1.0 mL/min。线性洗脱梯度:0 min,5% B;8~13 min,13%B;13~20 min,17% B;20~23 min,17% B;23~30 min,20%B;30~40 min,20% B;40~40.1 min,5% B;40.1~50 min,5%B。检测波长 520 nm。样品定量采用外标法,标准品为矢车菊-3,5-双葡萄糖苷 [11],标准曲线为 y = 15188.01x – 16778.39 (R2 = 0.999)。质谱分析采用高效液相色谱离子质谱联用仪 (6460 Triple Quad LC/MS,美国安捷伦科技有限公司)。质谱条件参照宋亚等[12]的方法,采用综合色谱相对保留时间、质谱分子离子峰和碎片离子峰等确定其分子结构。
1.3 金属离子含量分析称取花瓣样品 10 g,将其放入到烘箱中烘干至恒重,样品经磨碎、过 0.425 mm 筛,用 V(H2SO4)∶V(H2O2) = 3∶1 消煮样品,利用 ICP-AES (inductively coupled plasma atomic emission spectroscopy) 测定离子含量。
1.4 基因表达分析RNA 提取采用基于 Trizol 法的 RNA 试剂盒 (Simgen) 进行,按说明书操作提取 RNA。反转录生成 cDNA,在荧光定量 PCR 反应体系混合液中加入 2 μL 稀释后的 cDNA 模板,充分混匀。然后放置于 ABI PRISM®7000 荧光 PCR 仪中进行荧光定量 PCR。PCR 程序为 95℃ 变性 1 min;聚合反应阶段 95℃ 5 s,60℃ 33 s,40 次循环;95℃ 15 s,60℃ 20 s,95℃ 15 s。各基因和内参基因 PCR 引物采用 Negishi 等[7]设计的引物,18S rRNA 为内参基因,各基因引物如下:VALT,5′-GGCCCTAGCAGAGTTCTTCTCT-3′,5′-AATGTAATGTTCCCACCAAGGA-3′;PALT1,5′-ACCTGTAACTCCAGGGACTCCT-3′,5′-TATGAACTCAGCTCCCACCTTT-3′;18S rRNA,5′-GGAAGTTTGAGGCAATAACAGG-3′,5′-ATTGCAATGATCTATCCCCATC-3′。
2 结果与分析 2.1 花色变化由图 1 可知,在对照 (CK) 植株中,‘蓝色妈妈’颜色为粉红色略带白色,是该品种的典型颜色,2‰ Al2(SO4)3 处理后,花瓣颜色呈现淡紫色,4‰ Al2(SO4)3 处理 21 d 后,花瓣颜色转为蓝紫色。试验表明,Al2(SO4)3 处理后能明显改变‘蓝色妈妈’花瓣颜色。
 |
| 图1 Al2(SO4)3 处理对‘蓝色妈妈’花色的影响 Fig. 1 Effects of the Al2(SO4)3 application on flower colour in ‘mama blue’ |
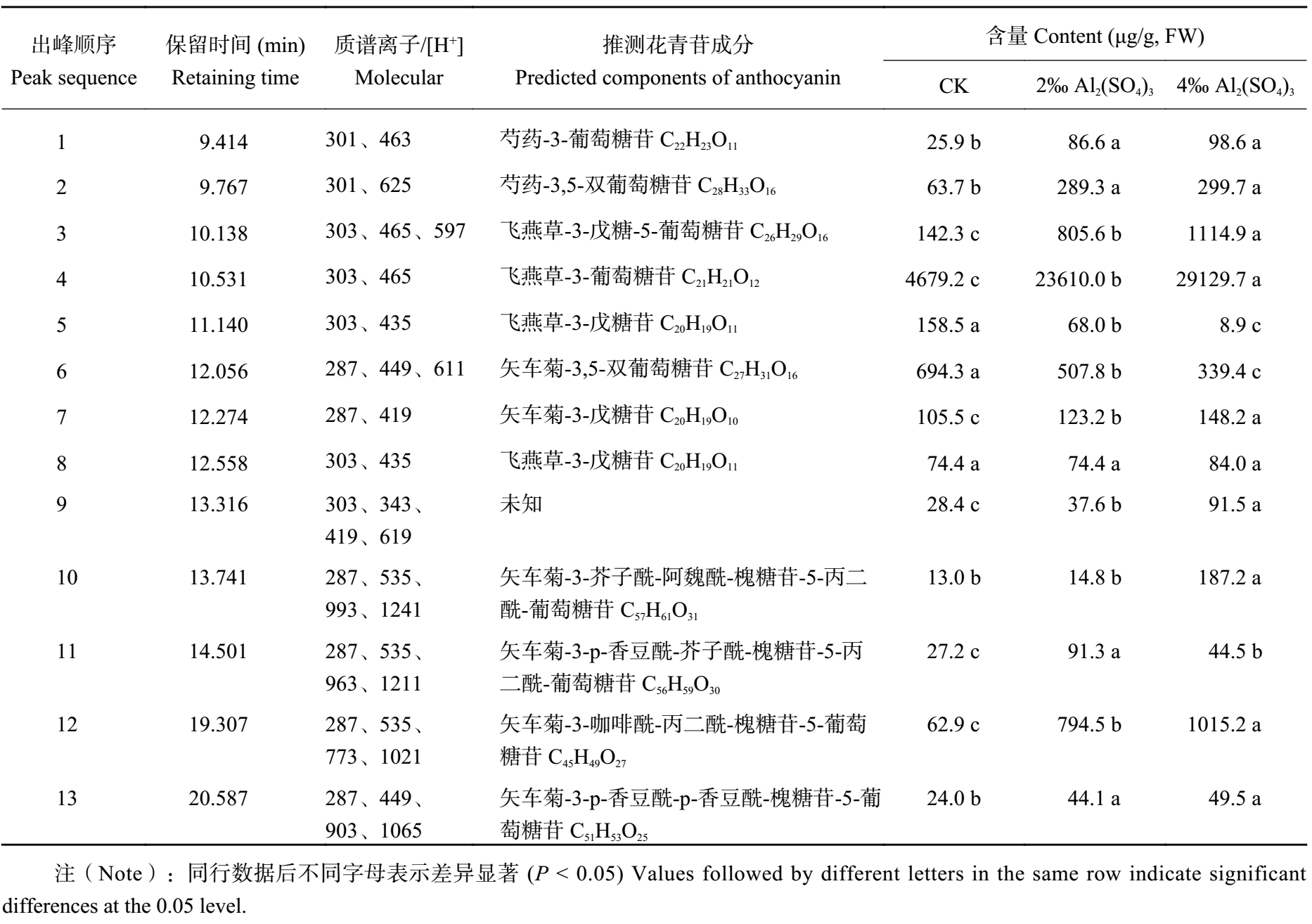
经质谱分析,‘蓝色妈妈’花瓣中检测到了 12 种花青苷 (图 2),其中 11 种为芍药花素-3-葡萄糖苷、芍药花素-3,5-双葡萄糖苷、飞燕草素-3-戊糖-5葡萄糖苷、飞燕草素-3-葡萄糖苷、飞燕草素-3-戊糖苷、矢车菊素-3,5-双葡萄糖苷、矢车菊素-3-戊糖苷、矢车菊素-3-芥子酰-阿魏酰-槐糖苷-5-丙二酰-葡萄糖苷、矢车菊素-3-p-香豆酰-芥子酰-槐糖苷-5-丙二酰-葡萄糖苷、矢车菊素-3-咖啡酰-丙二酰-槐糖苷-5-葡萄糖苷和矢车菊素-3-p-香豆酰-p-香豆酰-槐糖苷-5-葡萄糖苷,另一种成分未知 (表 1)。
| 表1 八仙花花青苷主要成分及含量 Table 1 The main composition and contents of anthocyanins of Hydrangea macrophylla |
 |
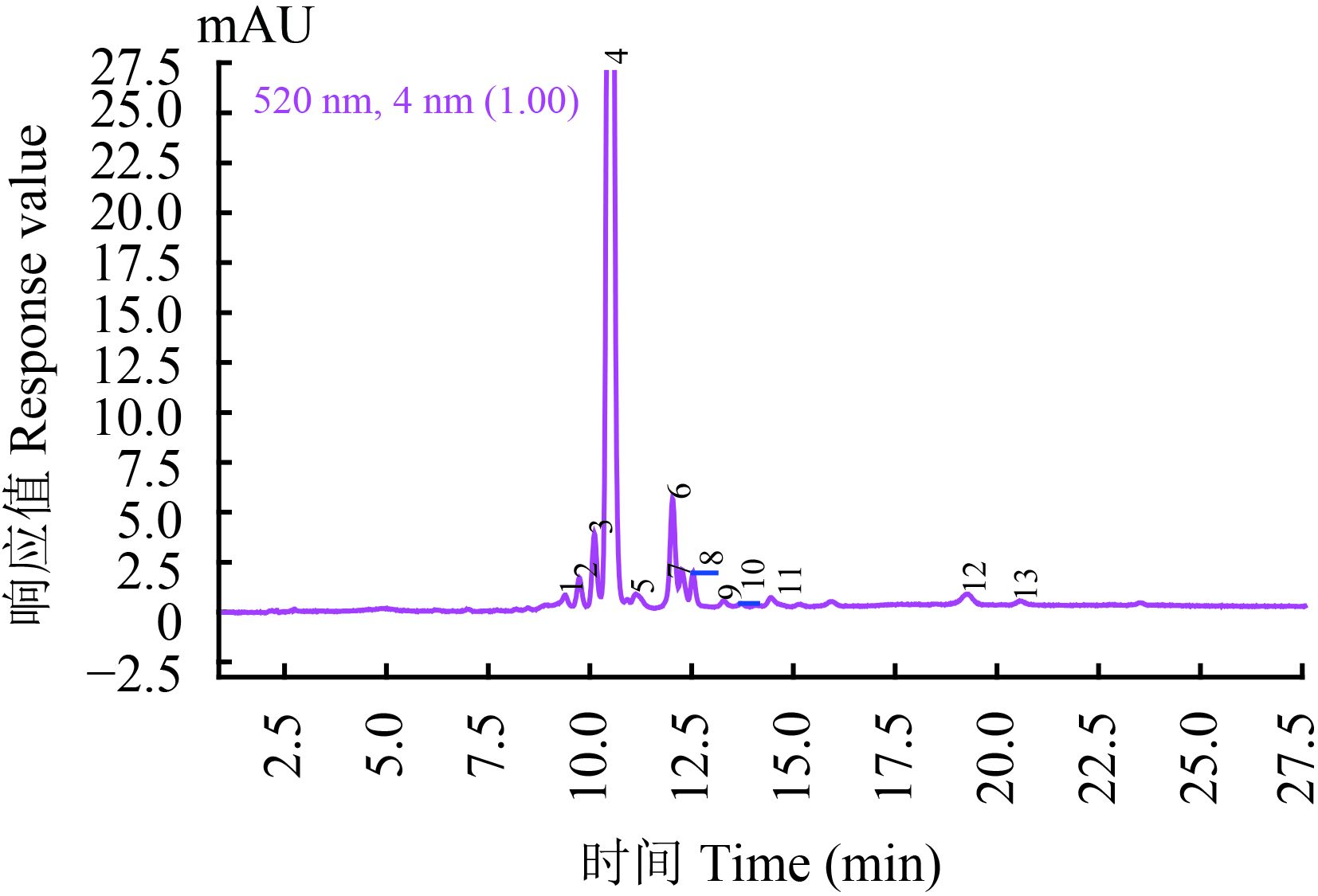 |
| 图2 ‘蓝色妈妈’花瓣花青苷组分色谱图 Fig. 2 The anthocyanins components chromatogram of ‘mama blue’ petal |
从生色团 (chromophores) 类别上来说,飞燕草素苷中,随着 Al2(SO4)3 处理浓度的增加,飞燕草素-3-戊糖-5葡萄糖苷、飞燕草素-3-葡萄糖苷含量显著 (P < 0.05) 提高;其中,飞燕草素-3-戊糖-5葡萄糖苷含量从 142.3 μg/g FW 增加到 805.6 μg/g FW 和 1114.9 μg/g FW,而飞燕草素-3-葡萄糖苷含量从对照的 4679.2 μg/g FW 增加到 23610.0 μg/g FW 和 29129.7 μg/g FW。此外,保留时间为 11.14 min 的飞燕草素-3-戊糖苷含量相比对照显著 ( P < 0.05) 降低,而保留时间为 12.558 min 的飞燕草素-3-戊糖苷则不受 Al 2(SO4)3 处理的影响。对于矢车菊素苷,矢车菊素-3-戊糖苷和矢车菊素-3-咖啡酰-丙二酰-槐糖苷-5-葡萄糖苷的含量相比对照显著提高,尤其是矢车菊素-3-咖啡酰-丙二酰-槐糖苷-5-葡萄糖苷,含量从 62.9 μg/g FW 增加到 794.5 μg/g FW 和 1015.2 μg/g FW;矢车菊素-3-p-香豆酰-芥子酰-槐糖苷-5-丙二酰-葡萄糖苷含量在 2‰ Al2(SO4)3 处理后显著增加,而在 4‰ Al2(SO4)3 处理中相比前者略微降低,但仍显著高于对照;同时,矢车菊素-3,5-双葡萄糖苷含量在 Al2(SO4)3 处理后降低,且下降幅度和 Al2(SO4)3 浓度呈正相关。芍药花素苷中,芍药花素-3-葡萄糖苷、芍药花素-3,5-双葡萄糖苷含量均在 2‰ Al2(SO4)3 处理后大幅增加,然而提高 Al2(SO4)3 处理浓度对于增幅影响不明显。从花青苷总体含量而言,矢车菊素苷、飞燕草素苷和芍药花素苷含量均随着 Al2(SO4)3 处理浓度增加而显著增加。2‰ Al2(SO4)3 和 4‰ Al2(SO4)3 处理处理后,矢车菊素苷含量从 CK 的 926.8 μg/g FW 增加到 1575.7 μg/g FW 和 1784.0 μg/g FW;飞燕草素苷含量从 CK 的 5159.9 μg/g FW 增加到 24681.2 μg/g FW 和 30485.7 μg/g FW;芍药花素苷含量从对照的 99.7 μg/g FW 增加到 375.9 μg/g FW 和 399.2 μg/g FW。
2.3 金属离子含量从表 2 可知,2‰ Al2(SO4)3 处理显著 (P < 0.05) 提高了花瓣 Al 3+ 含量,4‰ Al2(SO4)3 处理后 Al3+ 含量进一步提高,且显著 (P < 0.05) 高于 2‰ Al 2(SO4)3 处理,分别从对照的 2.24 μg/g FW 增加到 5.12 μg/g FW 和 11.83 μg/g FW。与对照相比,2‰ 和 4‰ 的 Al2(SO4)3 处理均显著 (P < 0.05) 提高了 Mn 2+ 和 Mg2+ 含量,但两浓度处理之间无显著差异。Al2(SO4)3 处理对 Fe3+ 含量无显著影响。
| 表2 硫酸铝处理对几种金属离子含量的影响 (μg/g,FW) Table 2 Effects of the Al2(SO4)3 application on several metal ions contents |
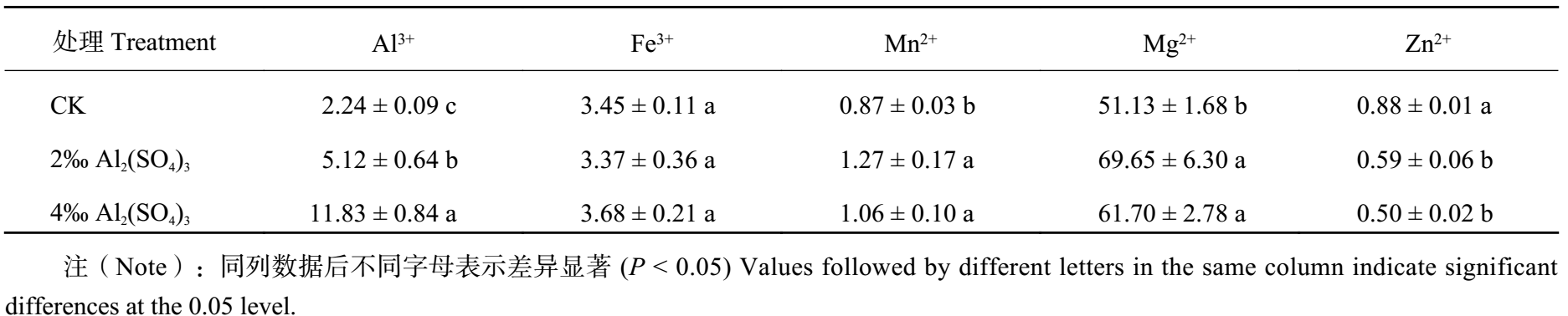 |
图 3 表明,2‰ Al2(SO4)3 处理显著 (P < 0.05) 提高了花瓣 PALT 基因和 VALT 基因的表达水平,4‰ Al2(SO4)3 处理进一步提高了两基因的表达水平,且均显著 (P < 0.05) 高于 2‰ Al 2(SO4)3。
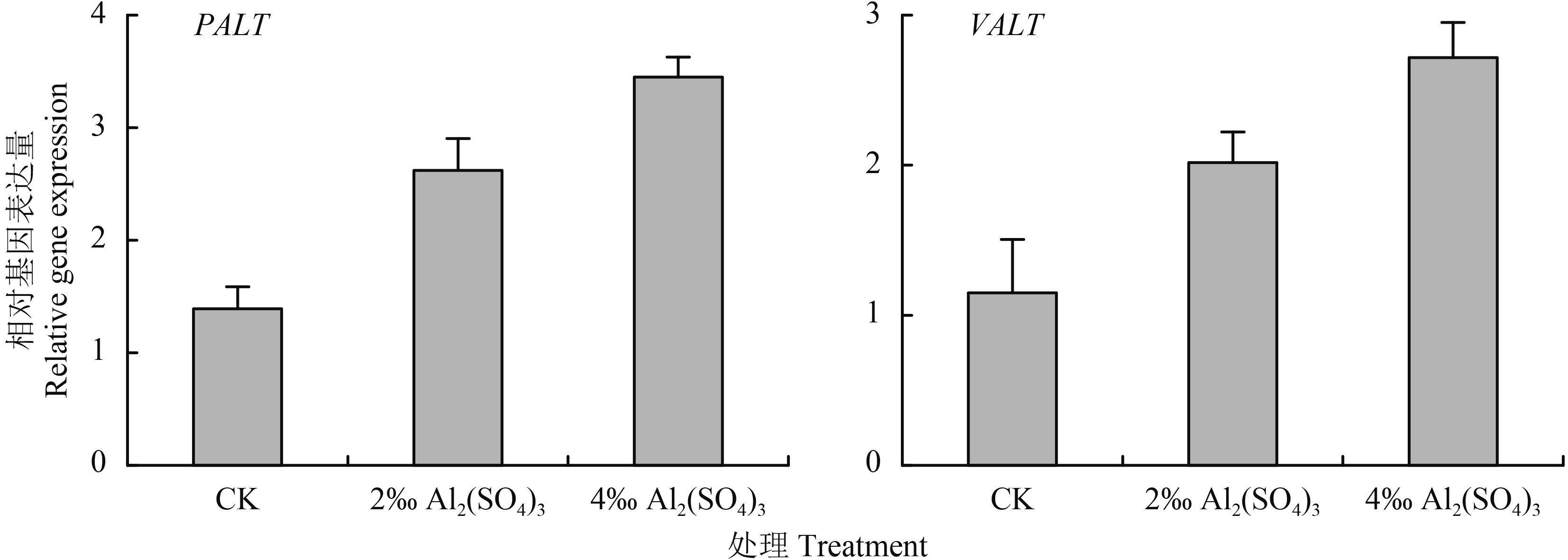 |
| 图3 Al2(SO4)3 处理对 PALT 和 VALT 表达的影响 Fig. 3 Effects of the Al2(SO4)3 application on expression of PALT and VALT |
八仙花品种多样,颜色丰富,观赏性强,其颜色受外界环境条件等因素影响。本研究发现,通过在根系施用不同浓度的 Al2(SO4)3,‘蓝色妈妈’八仙花花色能从粉红色转变为淡紫色和蓝紫色。这与 Neumann 等[13]的研究结果相一致,Neumann 还发现施用 Al2(SO4)3 改变八仙花颜色存在品种特异性,部分品种花色不会受到 Al2(SO4)3 影响。
花青苷是主要的呈色物质之一。八仙花主要的呈色物质均由飞燕草素-3-葡萄糖苷衍生物单体衍生而来,不同颜色花瓣中,所含有的花青素生色团不同,蓝色花瓣中以飞燕草素-3-葡萄糖苷衍生物为主,在粉色花瓣中包含了天竺葵素生色团或矢车菊素生色团[14]。本研究分析了八仙花所含花青苷种类和含量,‘蓝色妈妈’花瓣中含有 12 种花青苷 (表 1)。在粉色花瓣中含有一定量的矢车菊素苷,含量最高的是飞燕草素-3-葡萄糖苷,这与贾洪菊[15]的研究结果相类似。施用 Al2(SO4)3 后,伴随着颜色从粉色转为紫色和蓝紫色,飞燕草素苷 (尤其是飞燕草素-3-戊糖-5葡萄糖苷和飞燕草素-3-葡萄糖苷花青苷) 的含量大幅度提高。Al2(SO4)3 处理后,矢车菊素苷含量出现明显上升,说明其也受 Al3+ 诱导。这说明花青苷组成和含量变化是外源 Al2(SO4)3 改变八仙花颜色的原因之一。
在八仙花中,Al3+ 能与飞燕草素-3-葡萄糖苷形成复合物,介导花色变蓝[16]。在不同颜色的花瓣中,Al3+ 含量与花瓣颜色密切相关。本研究发现,伴随着施用 Al2(SO4)3 浓度的提高,花瓣中 Al3+ 含量显著提高,施用 4‰ Al2(SO4)3 的后,花瓣中 Al3+ 含量达到 11.83 μg/g FW。与 Schreiber 等[5]提出的蓝色花瓣 Al3+ 含量范围相比,本研究中含量数值略低,一方面可能是由于花的颜色并未呈现典型的蓝色,而是介于蓝色和紫色之间,另一方面也可能是由于根域 pH 值高于 Al3+ 吸收的最适 pH 范围 (4.2~4.7)[13],影响了 Al3+ 的吸收。
在八仙花花瓣中,Al3+ 的积累主要依赖于水通道蛋白转运基因 PALT 和 VALT。其中 PALT 编码的水通道蛋白将 Al3+ 从质膜外运输到细胞质中,接着由 VALT 编码的水通道蛋白将 Al3+ 输送至液泡中贮存起来[7, 17]。本研究发现,Al2(SO4)3 处理后,PALT 和 VALT 基因的表达均显著上调,说明转运 Al3+ 进入花瓣液泡的能力显著增强,有利于 Al3+ 的积累。这与本研究观测到的 Al2(SO4)3 处理后花瓣中 Al3+ 含量显著增加的结果相符合。
综合上述分析,一定浓度的 Al2(SO4)3 处理,诱导了八仙花 PALT 和 VALT 的表达,提高了花瓣 Al3+ 的积累,增加了花瓣中飞燕草素-3-葡萄糖苷类含量,从而有利于形成飞燕草素-3-葡萄糖苷和 Al3+ 复合体,促进了八仙花从粉红色转变为蓝色。本研究为进一步揭示观赏植物的花色分子调控机制提供了理论基础,为培育满足市场需求的新型花卉奠定了基础。
| [1] |
刘焕新. 八仙花的花色调控[J].
天津农林科技, 2004, (5): 21.
Liu H X. The regulation of flower colour in Hydrangea macrophylla [J]. Science and Technology of Tianjin Agriculture and Forestry, 2004, (5): 21. DOI:10.3969/j.issn.1002-0659.2004.03.010 |
| [2] | Anderson N, Weiland J, Pharis J, et al. Comparative forcing of Hydrangea macrophylla ‘Bailer’as a florist's hydrangea [J]. Scientia Horticulturae, 2009, 122(2): 221–226. DOI:10.1016/j.scienta.2009.05.003 |
| [3] |
徐慧, 刘超, 钟汉东. 不同光照强度对八仙花开花的影响[J].
北方园艺, 2014, (1): 81–82.
Xu H, Liu C, Zhong H D. Effects of different light intensity on the blossom of Hydrangea macrophylla [J]. Northern Horticulture, 2014, (1): 81–82. |
| [4] | Ito D, Shinkai Y, Kato Y, et al. Chemical studies on different color development in blue-and red-colored sepal cells ofHydrangea macrophylla [J]. Bioscience, Biotechnology, and Biochemistry, 2009, 73(5): 1054–1059. DOI:10.1271/bbb.80831 |
| [5] | Schreiber H D, Jones A H, Lariviere C M, et al. Role of aluminum in red-to-blue color changes in Hydrangea macrophylla sepals [J]. BioMetals, 2011, 24(6): 1005–1015. DOI:10.1007/s10534-011-9458-x |
| [6] | Ma J F, Ryan P R, Delhaize E. Aluminum tolerance in plants and the complex role of organic acids[J]. Trends in Plant Science, 2001, 6(6): 273–278. DOI:10.1016/S1360-1385(01)01961-6 |
| [7] | Negishi T, Oshima K, Hattori M, et al. Tonoplast and plasma membrane-localized aquaporin-family transporters in blue Hydrangea sepals of aluminum hyper accumulating plant [J]. Plos One, 2012, 7(8): e43189. DOI:10.1371/journal.pone.0043189 |
| [8] |
雷亚灵, 李周岐. 八仙花茎段组织培养技术研究[J].
西北林学院学报, 2008, (4): 101–103.
Lei Y L, Li Z Q. Tissue culture of stem segment of Hydrangea macrophylla [J]. Journal of Northwest Forestry University, 2008, (4): 101–103. |
| [9] |
彭尽晖, 陈海霞, 龚雯, 等. 铝胁迫对八仙花离体植株质膜透性与抗氧化系统的影响[J].
湖南农业大学学报 (自然科学版), 2013, 39(1): 42–44.
Peng J H, Chen H X, Gong W, et al. Effects of aluminium stress on membrane permeability and antioxidant system in vivo Hydrangea macrophylla plants [J]. Journal of Hunan Agricultural University (Natural Sciences), 2013, 39(1): 42–44. |
| [10] | Park S, Arasu M V, Jiang N, et al. Metabolite profiling of phenolics, anthocyanins and flavonols in cabbage (Brassica oleracea var. capitate) [J]. Industrial Crops and Products, 2014, 60: 8–14. DOI:10.1016/j.indcrop.2014.05.037 |
| [11] |
张淑江, 马越, 徐学玲, 等. 芸薹属5种紫红色蔬菜花青素苷含量及组分分析[J].
园艺学报, 2014, 41(7): 1451–1460.
Zhang S J, Ma Y, Xu X L, et al. Components and amounts of anthocyanins in several Brassica vegetables [J]. Acta Horticulturae Sinica, 2014, 41(7): 1451–1460. |
| [12] |
宋亚, 杨静, 朱祝军. 紫结球甘蓝功能性成分的提取, 鉴定与分析[J].
园艺学报, 2016, 43(1): 100–108.
Song Y, Yang J, Zhu Z J. Identification and analysis of the functional compounds in red cabbage[J]. Acta Horticulturae Sinica, 2016, 43(1): 100–108. |
| [13] | Neumann A, Horst W J. Effect of aluminium supply on aluminium uptake, translocation and blueing of Hydrangea macrophylla (Thunb.) Ser. cultivars in a peat clay substrate [J]. The Journal of Horticultural Science and Biotechnology, 2003, 78(4): 463–469. DOI:10.1080/14620316.2003.11511651 |
| [14] | Yoshida K, Mori M, Kondo T. Blue flower color development by anthocyanins: from chemical structure to cell physiology[J]. Natural Product Reports, 2009, 26(7): 884–915. DOI:10.1039/b800165k |
| [15] |
贾洪菊. 八仙花红色素分子结构分析及在压花上应用[D]. 哈尔滨: 东北林业大学硕士学位论文, 2011.
Jia H J. A research on red Hydrangea macrophylla molecular structure and application in pressed flower protecting [D]. Harbin: MS Thesis of Northeast Forestry University, 2011. |
| [16] | Oyama K, Yamada T, Ito D, et al. Metal complex pigment involved in the blue sepalcolor development of Hydrangea [J]. Journal of Agricultural and Food Chemistry, 2015, 63(35): 7630–7635. DOI:10.1021/acs.jafc.5b02368 |
| [17] | Kochian L V, Piñeros M A, Liu J, et al. Plant adaptation to acid soils: the molecular basis for crop aluminum resistance[J]. Annual Review of Plant Biology, 2015, 66: 571–598. DOI:10.1146/annurev-arplant-043014-114822 |
 2017, Vol. 23
2017, Vol. 23  doi:
doi: 

