2. 扬州大学江苏省作物遗传生理重点实验室,江苏扬州 225009
2. Key Laboratory of Crop Genetics and Physiology of Jiangsu Province, Yangzhou University, Yangzhou, Jiangsu 225009, China
根尖是根系生理活性中最活跃的部分,对土壤环境的反应比较敏感,具有响应和传递环境信号、感知重力方向、吸收养分与水分以及合成物质等重要功能[1–2]。根尖细胞的线粒体、内质网、核糖体、液泡、高尔基体、质膜 ATPase 和微体等对执行根的功能发挥重要作用[3–4]。根系的结构与功能及其与作物生长发育的关系一直是水稻根系研究的一个热点。水分与氮肥是作物生长发育过程中不可或缺的重要因素,水分和氮肥因子融为一体,对改善作物生长环境和提高肥料的利用效率有着重要作用[5]。国内外学者就氮钾用量、氮素形态、水分胁迫、外源激素、重金属污染、盐分胁迫等方面对根细胞超微结构及根系代谢功能进行了众多的研究[6–17],表明当土壤水分和养分等条件改变,根重、根数、根长、根系氧化力等形态生理指标还没有明显变化时,根尖细胞中细胞器如高尔基体、线粒体、内质网、核糖体等数目已有明显不同[6, 8, 16]。不同组织以及不同细胞器对干旱胁迫的敏感程度不同[8],在通气条件下根尖细胞中的核糖体和线粒体脊明显多于嫌气条件下[16]。过量施氮后,作物细胞中线粒体失去完整的膜结构,嵴结构较为模糊,原生质体收缩,细胞失水严重,明显影响作物生长[17],可见根系细胞超微结构与根的生长发育、根系生理活性及产量形成均有密切的关系[16],但有关水氮耦合对于根系细胞超微结构及功能的研究较少,且大多集中在番茄、生姜、甘草、马蔺、小麦、玉米、棉花等旱作植物上,这些植物水分管理方式与水稻完全不同。根系分泌物中有机酸种类及含量与根系合成的激素等物质一起构成根系化学信号,向根际周围及地上部输出,从而对根际及地上部作物的生长起调控作用[18–21]。水氮耦合下根际分泌物中有机酸有何差异?与根系活力及细胞超微结构数量变化有何关系?前人对此研究较少。本试验通过对水分的动态控制,研究整个生育期不同水氮条件对水稻根系细胞器数量及根系代谢功能的影响,以此探索水氮耦合机理,为水稻高产高效及根际生态学提供理论依据。
1 材料和方法 1.1 材料与试验点概况试验于 2014~2015 年在河南科技大学盆栽场进行。供试品种为新稻 20,试验地气候属温带半湿润半干旱大陆性季风气候,年降水量 600 mm,年辐射量 491.5 kJ/cm2,年日照时数 2300~2600 h,无霜期 215~219 d。试验采用盆栽方式,塑料大棚挡雨。盆钵为直径 25 cm,高 30 cm,盆钵内装过筛土 15 kg 左右。土壤为粘壤土,土壤有机质 14.9 g/kg、碱解氮 65.3 mg/kg、有效磷 5.9 mg/kg、速效钾 115.6 mg/kg。
1.2 试验设计进行灌溉方式和氮肥水平 2 因素随机试验。设计 3 种灌溉方式:保持浅水层 (分蘖末期进行晒田,其余生育期保持 1~2 cm 水层)、轻度水分胁迫 (分蘖末期进行晒田,其余生育期先灌 1~2 cm 水层,至土壤水势降到 –20 kPa 再灌浅水层,如此反复)、重度水分胁迫 (分蘖末期进行晒田,其余生育期先灌 1~2 cm 水层,至土壤水势降到 –40 kPa 再灌浅水层,如此反复),盆钵内用负压计测定土壤水势,陶土头底部置于 15 cm 土层处,生育期间塑料大棚挡雨。全生育期氮肥水平为 3 个水平:不施氮肥,适量氮 (N 1.18 g/pot,相当于大田 N 240 kg/hm2) 和高氮 (N 1.77 g/pot,相当于大田 360 kg/hm2),氮肥运筹按照 4∶1∶5 于移栽前 1 d、移栽后 7 d 和穗分化期 (二次枝梗分化期) 施用。磷、钾肥各处理均一致,移栽前施用过磷酸钙 (P2O5 13.5%) 300 kg/hm2 和氯化钾 (K2O 52%) 195 kg/hm2。大田育秧,5 月 6 日播种,6 月 10 日移栽,每盆栽插 3 穴,每穴 2 苗,每个处理 30 盆,全生育期严格监测水分及病虫害,其余管理与高产田一致。
1.3 测定项目与方法1.3.1 根系细胞超微结构测定 分别于分蘖盛期及穗分化始期,取主茎或 1 次分蘖不定根的根尖,各处理取样 3 穴,参考 Hayashi[1]及 Zhang等[22] 方法观察根尖细胞的超微结构。用锋利刀片分别在距离根端 1.5~2.0、2.1~3.0、3.1~4.0、4.1~5.0 和 5.1~6.0 mm 处截断,材料离体后立即投入到预冷的 2.5% 戊二醛中进行固定;2 h 后用 pH 7.2 的 0.1 mol/L 磷酸缓冲液 (PBS) 清洗 3 次,每次 15 min;再用 1% OsO4 固定,2 小时后再用 PBS 清洗,方法同上;再经梯度浓度乙醇脱水,环氧丙烷过渡,环氧树脂浸透和包埋,聚合成包埋块后在 Ultra-Jung 超薄切片机上切成 50~70 nm 的切片,醋酸双氧铀和柠檬酸铅双重染色,最后置于 Philips Tecnai12-TWIN 透射电镜下观察、摄影并记录。每次取样重复 5 次[22]。
1.3.2 根系氧化力测定 分别于分蘖盛期、穗分化始期、抽穗期和成熟期,各处理取样 3 穴,用 α-萘胺法测定根系氧化力[22]。
1.3.3 根系伤流液收集 分别于分蘖盛期、穗分化始期、抽穗期和抽穗后 20 天 (成熟期取样伤流液极少,故取抽穗后 20 天),各处理取样 3 穴,于下午 6 时在茎离土表约 12 cm 处剪去植株地上部分,将预先称重的带有脱脂棉的玻璃试管倒套于留在田间的稻茎的剪口处,盖上塑料薄膜,于第 2 天早 8 时取回试管称重,两次的差值即为根系伤流量[22]。
1.3.4 根系分泌物中有机酸含量测定 分别于分蘖盛期、穗分化始期、抽穗期和成熟期,各处理取样 3 穴,用自来水和蒸馏水洗净后,置于装有去离子水的烧杯 (800 mL) 中并封上烧杯口,每杯放 1 穴 (水分胁迫处理在水中加入 PEG-6000,轻度水分胁迫为 10%,重度水分胁迫为 30%)。在光下 [光强为 700~800 μmol/(m2·s),冠层温度 28~30℃] 培养 4 h,收集烧杯中的溶液,用高效液相色谱 (HPLC,Waters) 测定溶液中有机酸浓度[23]。
1.4 数据处理与分析试验数据用 SAS/STAT (version 6.12,SAS Institute,Cary,NC,USA) 进行方差分析,SigmaPlot 10.0 软件绘制图表。
2 结果与分析 2.1 水氮耦合对水稻细胞超微结构的影响不同水氮处理对根细胞超微结构的影响不同。无氮水层条件下,根冠细胞在发育的前后期均未出现细胞裂解现象,但细胞壁较其他处理明显增厚[图 1 (1~4)]。轻度水分胁迫条件下,在胁迫后期,细胞器数量明显减少,核膜在胁迫的前后期均比较清晰、细胞壁与无氮水层处理相比则显著变薄,细胞间隙增多,细胞中的嗜锇体 (是次生代谢产物产生变化所致) 数量增多 [图 1 (5~8)]。重度水分胁迫条件下,前期细胞器数量具有减少趋势,后期细胞扭曲皱缩,细胞器降解,细胞基质中仅存细胞器碎片,细胞壁出现断裂 [图 1 (9~12)]。
中氮水层条件下,细胞基本能够维持正常形态,细胞间隙较多,细胞质电子密度较低,发育后期胞间隙剧烈增大,细胞器的数量较少,细胞核有扭曲现象,说明发育受到一定的影响 [图 1 (13~16)]。中氮轻度水分胁迫条件下,细胞结构特征典型;核膜界限清晰;液泡数量较多。中氮重度水分胁迫条件下,前期嗜锇体增多,细胞质电子密度较高 [图 1 (17~20)]。
长期高氮对水稻根冠结构具有明显的破坏作用 [图 1 (25~32)]。高氮水层条件下,前期细胞中液泡数量较多,具有一定量的细胞器;到了发育后期,细胞完全扭曲变形,细胞器完全解体,仅存碎片,但细胞壁完整,未出现断裂情况 [图 1 (25~28)]。高氮轻度水分胁迫条件下,细胞发育前期细胞结构正常,后期细胞壁局部剧烈变厚 [图 1 (29~32)]。高氮重度水分胁迫条件下,前期嗜锇体和淀粉体较多,细胞器也比较丰富,发育后期细胞器数量则明显减少,细胞间隙明显增多、增大 [图 1 (33~36)]。
从以上分析可知,在同一氮肥水平下,轻度水分胁迫后细胞中细胞器数量均比其它处理多,细胞结构正常;而重度水分胁迫条件下,细胞器数量减少,后期细胞扭曲皱缩,细胞壁出现断裂;在同一灌溉方式下,中氮处理根细胞中细胞器数量多,核膜界限清晰;长期高氮对水稻根冠结构具有明显的破坏作用。从水氮耦合方面分析,中氮轻度水分胁迫对水稻根冠结构的影响具有正面效应,细胞中细胞器数量较多,结构特征典型。
 |
随着生育进程,根系氧化力表现为先增加后降低的趋势,在幼穗分化期达到峰值 (图 2)。在同一施氮量条件下,轻度水分胁迫明显提高新稻 20 根系氧化力,如分蘖盛期根系活性增加了 25.6%~32.0%;在同一灌溉方式下,根系氧化力在中氮下最高,进一步增施氮肥反而降低根系活力,如分蘖盛期至抽穗期,根系氧化力降低了 6.6%~9.8%,说明重施氮肥并不能显著提高根系氧化力的大小。从水氮耦合来看,中氮轻度水分胁迫下根系氧化力最强。
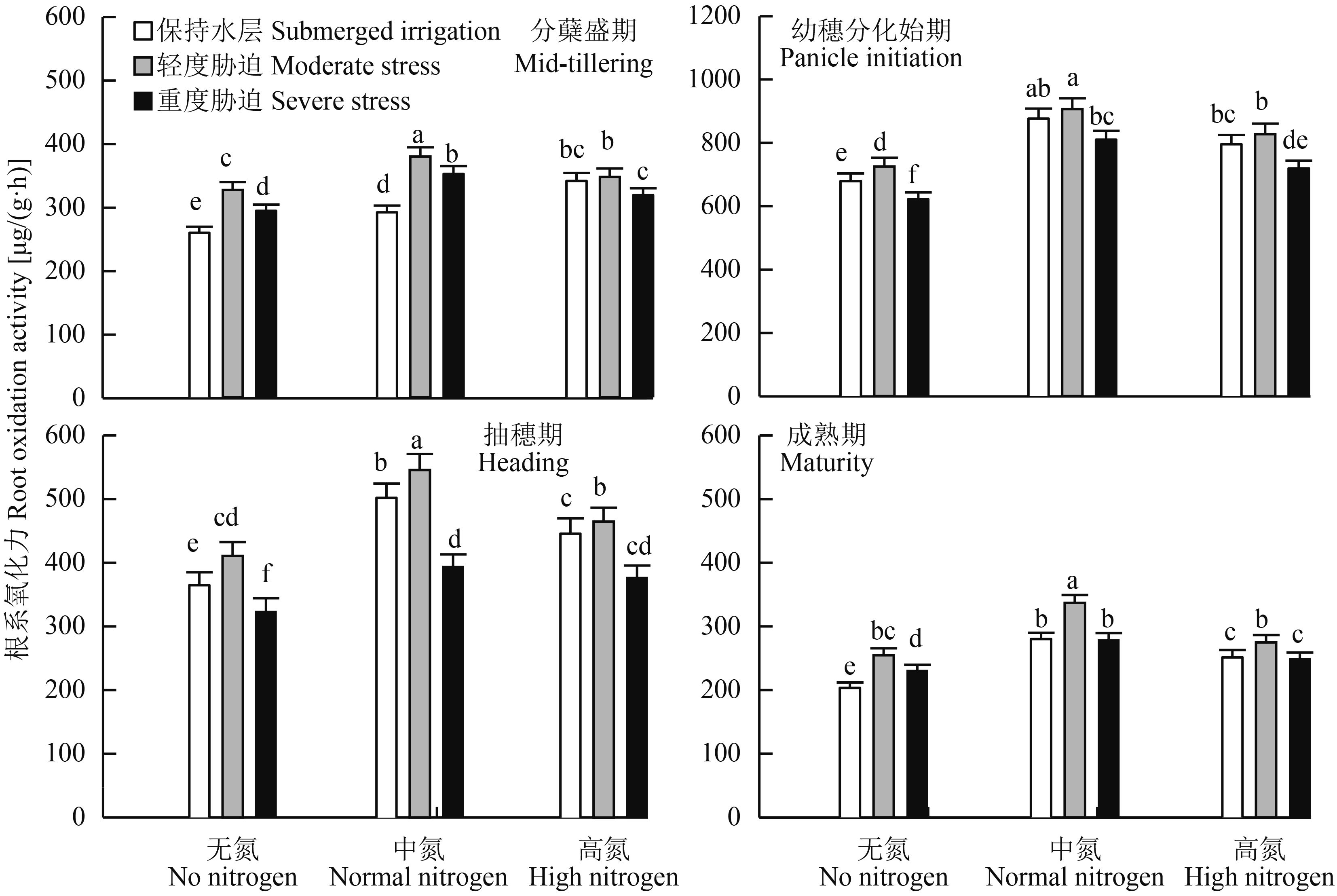 |
|
图2
水氮耦合对水稻生育过程中根系氧化力的影响
Fig. 2
Effect of water and nitrogen coupling on root oxidation activity during the growth and development of rice
|
随着生育进程,根系伤流先增加后降低,在抽穗期达到峰值 (图 3)。在同一氮肥水平下,轻度水分胁迫增加根系伤流量,分蘖盛期根系伤流量平均增加 14.5%;重度水分胁迫则显著降低根系伤流量,不同生育期表现一致。在同一灌溉方式下,根系伤流量在中氮下最高,进一步增施氮肥反而降低根系活力,说明重施氮肥并不能明显提高根系活力。从水氮耦合来看,中氮轻度水分胁迫下根系活力最大。
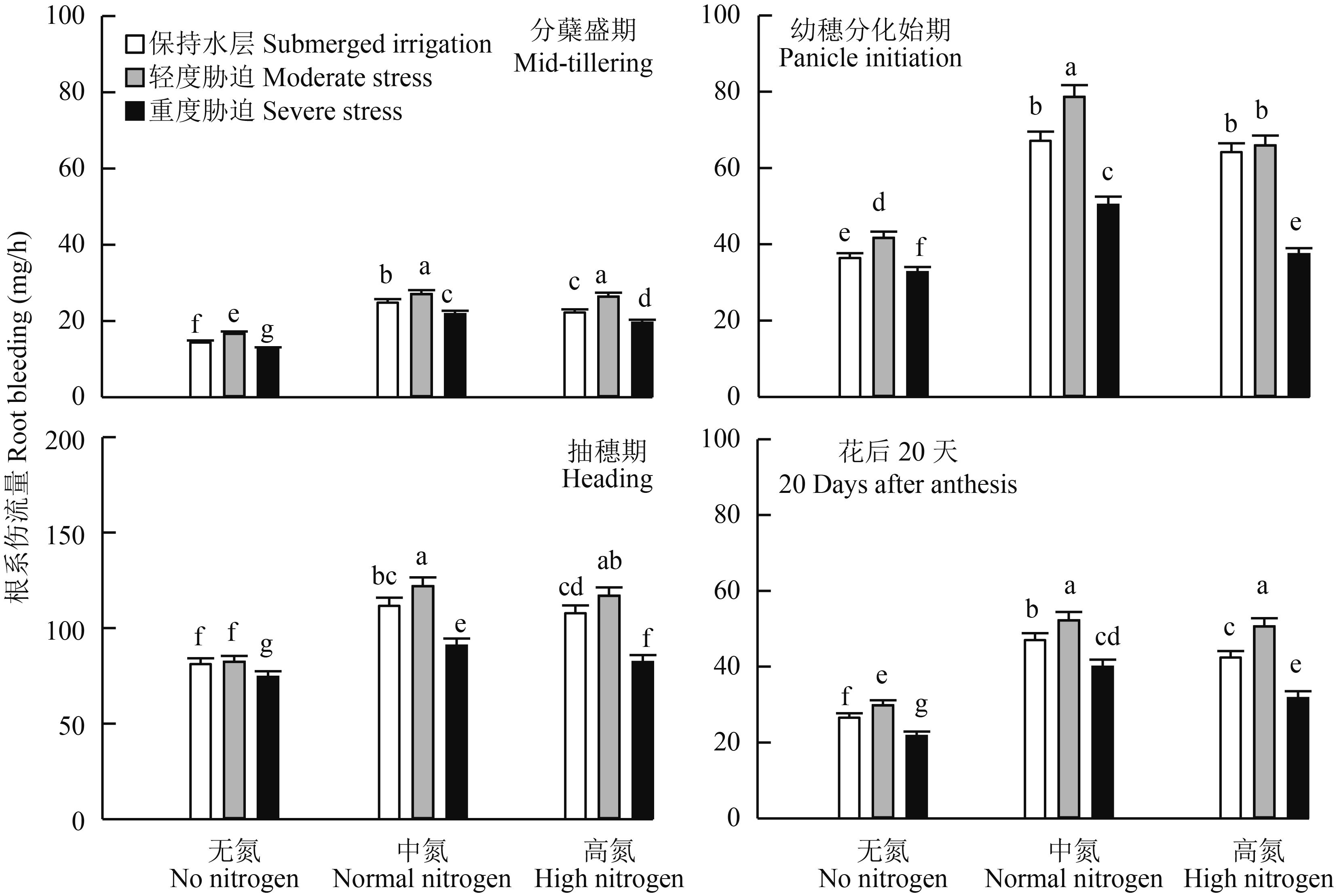 |
|
图3
水氮耦合对水稻生育过程中根系伤流强度的影响
Fig. 3
Effect of water and nitrogen coupling on root bleeding during the growth and development of rice
|
不同水氮耦合下根系分泌物中有机酸总量存在明显差异 (图 4)。随着生育进程,根系分泌物中有机酸总量先增加后降低,在抽穗期达到峰值。在同一氮肥水平下,轻度水分胁迫增加根系有机酸总量。分蘖盛期至幼穗分化始期,轻度水分胁与对照保持水层相比分别增加 18.5% 及 14.3%,重度水分胁迫则显著降低根系有机酸总量,不同生育期表现一致,与对照保持水层相比,有机酸总量平均降低 22.8%。在同一灌溉方式下,根系分泌物中有机酸在中氮下最高,进一步增施氮肥反而降低有机酸总量,如分蘖盛期至幼穗分化始期,与中氮相比,高氮根系分泌物中有机酸含量降低了 7.7% 及 15.4%,说明重施氮肥并不能明显提高有机酸总量。从水氮耦合来看,中氮轻度水分胁迫下根系分泌物中有机酸总量最高。
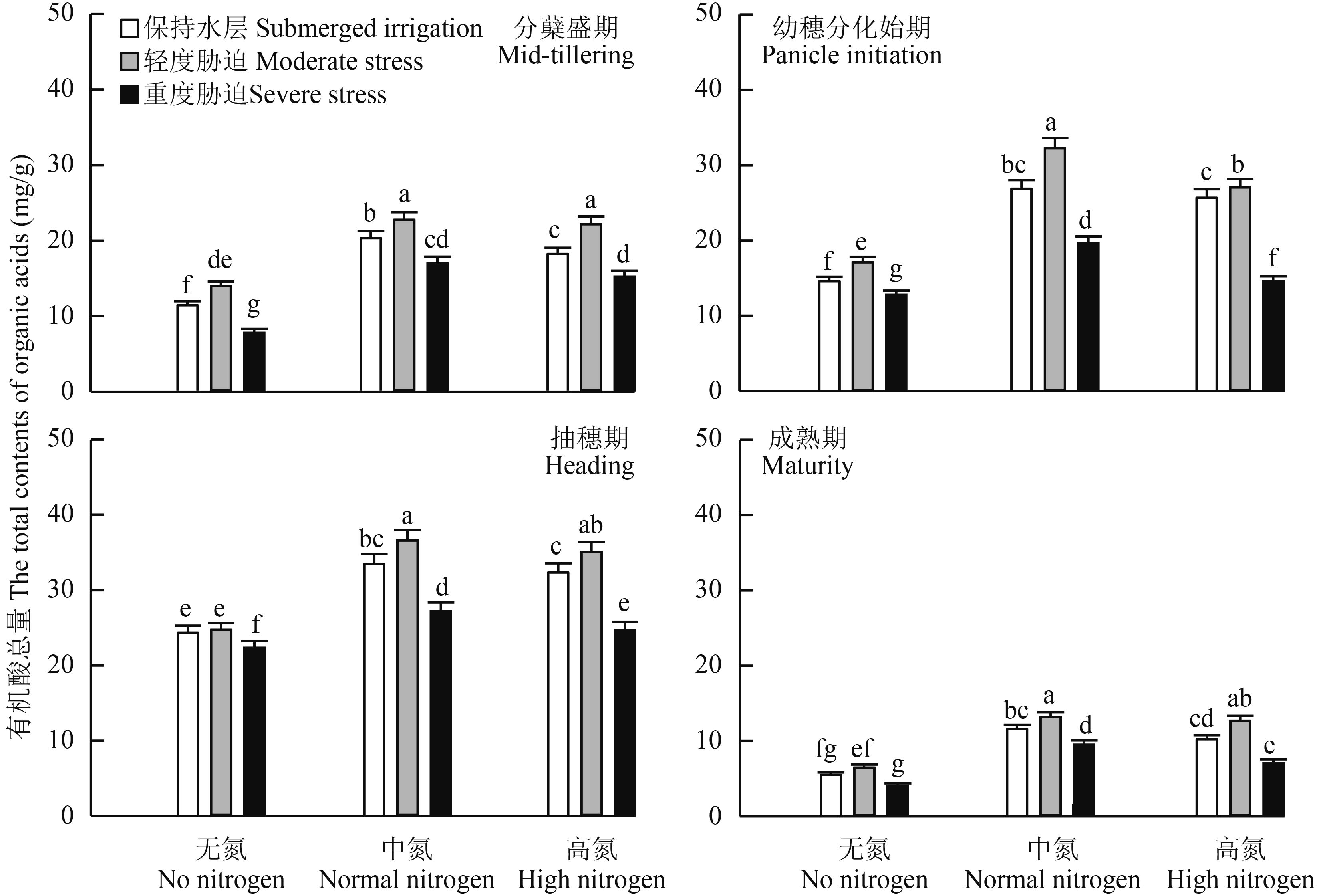 |
|
图4
水氮耦合对水稻生育过程中根系有机酸总量的影响
Fig. 4
Effect of water and nitrogen coupling on root organic acid contents during the growth and development of rice
|
水分和养分是作物生长发育的两大重要因素,合理的水肥管理有利于作物高产和资源的高效利用。根系作为水分和养分吸收的主要器官,其形态结构和功能与作物生长发育及产量品质形成有着非常密切的关系。良好发育的根系超微结构,能够提高细胞生理功能,有利于根系各种生理代谢,促进地上部生长发育。
氮素的施用对于细胞超微结构的影响较为明显,合理施用氮肥可以改善细胞的超微结构,提高水稻的单位面积产量[6, 23]。本研究结果表明,不施氮肥根细胞在前期基本能够维持正常形态,幼穗分化后细胞器的数量较少,说明根细胞发育受到一定的影响。在生长前期水稻生长发育较慢,从土壤中吸收的养分基本能够满足根系及地上部的生长需要,对水稻胁迫较小,根细胞超微结构功能得以维持;幼穗分化后,水稻吸收养分急剧增加,此时土壤释放的养分已经不能满足植株生长的需求,胁迫程度加重,根系形态及细胞发育受到限制,影响其功能的发挥。王秀娟等[17]研究发现,在施氮量太多的环境之下,番茄植株的细胞会表现出质壁分离的状况。在高氮胁迫环境之下,美国白蜡的细胞核降解非常明显,细胞核中染色质的浓度降低[24]。本试验结果表明,长期高氮对水稻根冠结构具有明显的破坏作用。前期根细胞中液泡数量较多,具有一定量的细胞器;但到了发育后期,细胞完全扭曲变形,细胞器完全解体,仅存碎片。说明高氮下水稻根细胞超微结构受损,细胞核内外物质的相互交换遭到破坏,细胞核的代谢活力受到很大抑制,从而影响到整个细胞的完整代谢过程,抑制根系功能的发挥。
许振柱等[25]的试验表明,水分胁迫环境下,小麦细胞的线粒体膜发生内陷,线粒体膜的某些部分产生破损,而重度水分胁迫环境下,小麦细胞的某些线粒体膜产生开裂,基本上观察不到嵴的存在。刘艳等[8]研究得出,随着干旱胁迫时间的延长,甘草细胞核变形,线粒体内腔空化,叶绿体基粒片层结构逐渐模糊,淀粉粒降解。可见水分胁迫对细胞器结构有着明显的影响,但前人研究多数集中在旱作条件下,不同土壤水势对水稻根细胞超微结构影响如何?Hayashi[1]曾比较水稻种子发芽过程中处于嫌气和通气条件下根尖细胞的超微结构,发现在通气条件下根尖细胞中的线粒体脊和核糖体明显多于嫌气条件。本试验结果表明,轻度水分胁迫后细胞中线粒体、高尔基体和内质网细胞器数量均比其它处理多,细胞结构正常;而重度水分胁迫条件下,细胞器数量减少,后期细胞扭曲皱缩,细胞壁出现断裂。这可能是由于轻度水分胁迫后土壤通透性增加,根系土壤含氧量提高,降低还原性物质对细胞的伤害程度,有利于根细胞中各器官的发育,而重度水分胁迫后土壤含水量急剧下降,细胞渗透势改变,导致细胞膜内不饱和脂肪酸的减少,引起膜蛋白的不稳定性和膜结构功能的丧失,可见适宜的土壤水分对于水稻根细胞结构的维持及功能的发挥有着重要的作用。
本试验还表明,轻度水分胁迫耦合中氮下,水稻根细胞超微结构 (如线粒体、高尔基体、液泡等的结构) 完整且个数较多,质膜清楚,细胞结构功能较优。这些结果启示我们:在生产实际中,设置适宜的水氮组合,有利于改善水稻根系超微结构,促进根系功能的发挥,能够为水稻的生长发育提供良好的根际环境。
3.2 水氮耦合对水稻根系活性的影响根系代谢特性与养分吸收利用及地上部生长发育关系密切。根系分泌的有机酸、糖、酚及各种氨基酸等物质可以通过改变根际理化性质,调节根际微生态功能,从而提高根系对养分的吸收利用和外界环境的适应[26–27]。关于根系分泌物中有机酸的研究,单因子的试验较多,而对于水氮耦合下根系分泌特性研究仍然较少。常二华等[28]的研究表明,水稻缺少氮素时会抑制根系有机酸的分泌。本研究表明,中氮条件下根系分泌的有机酸含量整体较高,而高氮则抑制了根系分泌有机酸,说明重施氮肥后根系分泌受到抑制,不利于根系功能的发挥。常二华等的研究关注的是低氮条件下根系的分泌特性,当氮素含量较低时,水稻可以从土壤中吸收的 NO3– 就比较少,这个时候根系分泌的有机酸含量就相对较低。本试验观察了中氮及高氮条件下的根系分泌特性,更加贴近生产实际,对于不同的氮肥用量下根系分泌观察更为系统。本试验得出,轻度干湿交替灌溉后根系分泌物中有机酸含量明显增加,而重度干湿交替灌溉则明显降低。这与 Henry 等[29]研究保持一致。轻度水分胁迫下水稻根系处于良好的根际环境中,根细胞分裂旺盛,功能结构突出,根系能够主动分泌有机酸,从而提高根系的生理功能,为地上部的生长发育提供物质与能量;而重度水分胁迫下根细胞器数量减少,后期细胞扭曲皱缩,从而影响到整个细胞的完整代谢过程,抑制根系分泌能力,从而影响根系的生理功能。
根系活性的高低影响其吸收、合成和分配等生理功能的发挥。有研究表明[5],增施氮肥可以减轻因土壤含水量减少而对根系活性所造成的不利影响,生长发育后期提高土壤含水量、增施氮肥可以保持根系活性。另有一些研究则表明[30],生长发育中期施氮量较高,后期施氮不能提高根系活力。本试验表明,根系活性在轻度水分胁迫耦合中氮处理下最大,进一步增施氮肥并不能显著提高根系活性,降低“以肥调水”的效果,加剧土壤水分胁迫的程度,说明适宜的水分胁迫及施氮量才能改善根系的生理状况,促进根系功能的发挥。
4 结论水稻根细胞超微结构及活性在不同水氮处理间存在明显差异。中氮轻度水分胁迫创造良好的根际环境,具有根细胞超微结构完整、根系氧化力较强及根系分泌物中有机酸含量较高的特点。重度水分胁迫则破坏根细胞器形态结构、抑制根系代谢特性,降低“以肥调水”的效果。通过适宜的水氮耦合提高水稻根系细胞形态功能,提高根系代谢能力,协调地上地下部生长,能为水稻生长创造良好的环境。
| [1] | Hayashi S. Effect of limiting oxygen supply on the ultrastructure of root tip cells in the germinating stage of rice seeds[J]. Japanese Journal of Crop Science, 1998, 67: 41–48. DOI:10.1626/jcs.67.41 |
| [2] | Sievers A, Braun M, Monshausen G B. The root cap: structure and function[A]. Waisel Y, Eshel A, Kafkafi U. Plant roots: the hidden half[C]. New York: Marcel Dekker, 2002. 33–47. |
| [3] | Zhang M P, Zhang C J, Yu G H, et al. Changes in chloroplast ultrastructure, fatty acid components of thylakoid membrane and chlorophyll a fluorescence transient in flag leaves of a super-high-yield hybrid rice and its parents during the reproductive stage[J]. Journal of Plant Physiology, 2010, 167: 277–285. DOI:10.1016/j.jplph.2009.09.017 |
| [4] | HaWes M C, Gunawardena U, Miyasaka S. The role of root border cells in plant defense[J]. Trends in Plant Sciences, 2000, 5: 128–133. DOI:10.1016/S1360-1385(00)01556-9 |
| [5] | Li Y J, Chen X, Shamsi I H, et al. Effects of irrigation patterns and nitrogen fertilization on rice yield and microbial community structure in paddy soil[J]. Pedosphere, 2012, 22(5): 661–672. DOI:10.1016/S1002-0160(12)60051-4 |
| [6] |
张金政, 刘岳路, 李晓东, 等. 过量施氮对嵌合体‘金旗’玉簪叶色、氮代谢关键酶活性及叶绿体超微结构的影响[J].
草业学报, 2011, 20(5): 93–101.
Zhang J Z, Liu Y L, Li X D, et al. Effects of excessive application of nitrogen fertilizer on leaf color, key enzymes activities of nitrogen metabolism and chloroplast ultrastructure of a chimera Hosta ‘Gold Standard’ [J]. Acta Prataculturae Sinica, 2011, 20(5): 93–101. DOI:10.11686/cyxb20110513 |
| [7] |
冯立娟, 苑兆和, 尹燕雷, 等. 多效唑对大丽花叶片光合特性和超微结构的影响[J].
草业学报, 2014, 23(4): 114–121.
Feng L J, Yuan Z H, Yin Y L, et al. Effects of paclobutrazol on the photosynthetic characteristics and ultrastructure of Dahlia pinnata leaves [J]. Acta Prataculturae Sinica, 2014, 23(4): 114–121. DOI:10.11686/cyxb20140414 |
| [8] |
刘艳, 岳鑫, 陈贵林. 水分胁迫对甘草叶片和根系细胞超微结构与膜脂过氧化的影响[J].
草业学报, 2010, 19(6): 79–86.
Liu Y, Yue X, Chen G L. Effects of water stress on ultrastructure and membrane lipid peroxidation of leaf and root cells of Glycyrrhiza uralensis [J]. Acta Prataculturae Sinica, 2010, 19(6): 79–86. DOI:10.11686/cyxb20100611 |
| [9] | Yuan H Y, Guo Z, Huang S Z. Effects of Pb on growth, heavy metals accumulation and chloroplast ultrastructure of Iris lactea var. Chinensis [J]. Acta Ecologica Sinica, 2011, 31(12): 3350–3357. |
| [10] |
刘冉, 石峰, 刘伟成, 等. 不同形态氮素对盐胁迫下番茄细胞超微结构与光合作用的影响[J].
园艺学报, 2011, 31(12): 3350–3357.
Liu R, Shi F, Liu W C, et al. Effect of nitrogen forms on cell ultrastructure and photosynthesis of tomato under salinity[J]. Acta Horticulturae Sinica, 2011, 31(12): 3350–3357. |
| [11] |
张黛静, 马建辉, 杨淑芳, 等. 硅对铜胁迫下小麦幼根细胞超微结构的影响[J].
应用生态学报, 2014, 25(8): 2385–2389.
Zhang D J, Ma J H, Yang S F, et al. Effects of silicon on the ultrastructures of wheat radical cells under copper stress[J]. Chinese Journal of Applied Ecology, 2014, 25(8): 2385–2389. |
| [12] |
李文娟, 何萍, 金继运. 钾素对玉米茎髓和幼根超微结构的影响及其与茎腐病抗性的关系[J].
中国农业科学, 2010, 43(4): 729–736.
Li W J, He P, Jin J Y. Effect of potassium on ultrastructure of maize stalk pith and young root and their relation to resistance to stalk pot[J]. Scientia Agricultura Sinica, 2010, 43(4): 729–736. |
| [13] | Lucía G, Mercedes F P, Daniel G S, et al. Spent metal working fluids produced alterations on photosynthetic parameters and cell-ultrastructure of leaves and roots of maize plants[J]. Journal of Hazardous Materials, 2013, 260: 220–230. DOI:10.1016/j.jhazmat.2013.05.026 |
| [14] |
李秀, 巩彪, 徐坤. 外源亚精胺对高温胁迫下生姜叶片内源激素及叶绿体超微结构的影响[J].
中国农业科学, 2015, 48(1): 120–129.
Li X, Gong B, Xu S. Effect of exogenous spermidine on levels of endogenous hormones and chloroplast ultrastructure of ginger leaves under heat stress[J]. Scientia Agricultura Sinica, 2015, 48(1): 120–129. DOI:10.3864/j.issn.0578-1752.2015.01.12 |
| [15] |
姜艳丽, 史华平, 杨艳兵, 等. NaCl胁迫对棉花叶片及根系超微结构的影响[J].
华北农学报, 2014, 29(3): 95–100.
Jiang Y L, Shi H P, Yang Y B, et al. Effect of NaCl stress on ultrastructure of mesophyll cells and root cells in cotton[J]. Acta Agriculturae Boreali-Sinica, 2014, 29(3): 95–100. DOI:10.7668/hbnxb.2014.03.018 |
| [16] | Yang J C, Zhang H, Zhang J H. Root morphology and physiology in relation to the yield formation of rice[J]. Journal of Integrative Agriculture, 2012, 11(6): 920–926. DOI:10.1016/S2095-3119(12)60082-3 |
| [17] |
王秀娟, 袁兴福, 娄春荣, 等. 不同氮钾用量对番茄生长和叶片超微结构的影响[J].
中国土壤与肥料, 2014, (3): 44–48.
Wang X J, Yuan X F, Lou C R, et al. Effect of N, K amount on growth and leaf ultrastructure[J]. Soil and Fertilizer Science in China, 2014, (3): 44–48. DOI:10.11838/sfsc.20140309 |
| [18] | Kato N H, Ino T, Sata N, Yamamura S. Isolation and identification of a potent allelopathic substance in rice root exudates[J]. Physiologia Plantarum, 2002, 115(3): 401–405. DOI:10.1034/j.1399-3054.2002.1150310.x |
| [19] | Sunghyun K, Hyewon L, Insook L. Enhanced heavy metal phytoextraction by Echinochloa crus-galli using root exudates [J]. Journal of Bioscience and Bioengineering, 2010, 109(1): 47–50. DOI:10.1016/j.jbiosc.2009.06.018 |
| [20] | Zhou N, Liu P, Wang Z Y, Xu G D. The effects of rapeseed root exudates on the forms of aluminum in aluminum stressed rhizosphere soil[J]. Crop Protection, 2011, 30(6): 631–636. DOI:10.1016/j.cropro.2011.02.011 |
| [21] |
徐国伟, 李帅, 赵永芳. 秸秆还田与施氮对水稻根系分泌物及氮素利用的影响研究[J].
草业学报, 2014, 23(2): 140–146.
Xu G W, Li S, Zhao Y F, et al. Effects of straw and nitrogen fertilizer application on root secretion and nitrogen utilization of rice[J]. Acta Prataculturae Sinica, 2014, 23(2): 140–146. DOI:10.11686/cyxb20140217 |
| [22] | Zhang H, Xue Y G, Wang Z Q, et al. Morphological and physiological traits of roots and their relationships with shoot growth in " super” rice[J]. Field Crops Research, 2009, 113(1): 31–40. DOI:10.1016/j.fcr.2009.04.004 |
| [23] |
戢林, 李廷轩, 张锡洲, 等. 水稻氮高效基因型根系分泌物中有机酸和氨基酸的变化特征[J].
植物营养与肥料学报, 2012, 18(5): 1046–1055.
Ji L, Li Y X, Zhang X Z, et al. Characteristics of organic acid and amino acid in root exudates of rice genotype with high nitrogen efficiency[J]. Plant Nutrition and Fertilizer Science, 2012, 18(5): 1046–1055. DOI:10.11674/zwyf.2012.12036 |
| [24] |
杨静, 陈金林, 徐柏森, 等. 盐胁迫对美国白蜡和滨梅根系超微结构的影响[J].
西南林学院学报, 2009, 29(5): 23–27.
Yang J, Chen J L, Xu B S, et al. Effect of salt stress on root ultrastructure of Fraxinus americana and Prunus maritima[J]. Journal of Southwest Forestry College, 2009, 29(5): 23–27. |
| [25] |
许振柱, 于振文, 董庆裕, 等. 水分胁迫对冬小麦旗叶细胞质膜及叶肉细胞超微结构的影响[J].
作物学报, 1997, 23(3): 370–375.
Xu Z Z, Yu Z W, Dong Q Y, et al. Effect of water on cell membrane and the ultrastructure of flag cell in winter wheat[J]. Acta Agronomica Sinica, 1997, 23(3): 370–375. |
| [26] | Marzieh T, Mohsen J. Influence of organic acids on kinetic release of chromium in soil contaminated with leather factory waste in the presence of some adsorbents[J]. Chemosphere, 2016, 155: 395–404. DOI:10.1016/j.chemosphere.2016.04.063 |
| [27] |
吴林坤, 林向民, 林文雄. 根系分泌物介导下植物-土壤-微生物互作关系研究进展与展望[J].
植物生态学报, 2014, 38(3): 298–310.
Wu L K, Lin X M, Lin W X. Advances and perspective in research on plant-soil-microbe interactions mediated by root exudates[J]. Chinese Journal of Plant Ecology, 2014, 38(3): 298–310. |
| [28] |
常二华, 张慎凤, 王志琴, 等. 结实期氮磷营养水平对水稻根系和籽粒氨基酸含量的影响[J].
作物学报, 2008, 34(4): 612–618.
Chang E H, Zhang S F, Wang Z Q, et al. Effect of nitrogen and phosphorus on the amino acids in root exudates and grains of rice during grain filling[J]. Acta Agronomica Sinica, 2008, 34(4): 612–618. |
| [29] | Henry A, Doucette W, Norton J, et al. Changes in crested wheatgrass root exudation caused by flood, drought, and nutrient stress[J]. Journal of Environmental Quality, 2007, 36(3): 904–912. DOI:10.2134/jeq2006.0425sc |
| [30] |
王余龙, 姚庆友, 刘宝玉, 等. 不同生育时期氮素供应水平对杂交水稻根系生长及其活力的影响[J].
作物学报, 1997, 23(6): 699–705.
Wang Y L, Yao Q Y, Liu B Y, et al. Effect of nitrogen supplying levels and timings on the development of roots in hybrid indica rice[J]. Acta Agronomica Sinica, 1997, 23(6): 699–705. |
 2017, Vol. 23
2017, Vol. 23  doi:
doi: 
