2. 中国农业科学院农业资源与农业区划研究所/农业部农业微生物资源收集与保藏重点实验室,北京 100081
2. Institute of Agricultural Resources and Regional Planning, Chinese Academy of Agricultural Sciences/Key Laboratory of Microbial Resources Collection and Preservation, Ministry of Agriculture, Beijing 100081, China
大蒜 (Allium sativum L.) 属于百合科葱属,含有丰富的营养物质,是深受世界各国人民喜爱的保健蔬菜,又是重要的调味品和医药原料[1–2]。随着大蒜市场需求量的不断攀升,农民为追逐经济效益,主产区的连作现象日益严重,导致在正常管理下大蒜生长弱、病害频发、土壤板结、有效养分含量下降等连作障碍问题,严重影响大蒜的产量和品质,已成为制约大蒜生产可持续发展亟待解决的重要问题[3–6]。大量研究表明,某些植物根际促生菌 (PGPR) 不仅能够产生多种抗生素和嗜铁素、蛋白酶等与拮抗相关的次级代谢产物,有效地抑制土传病害[7–9];同时某些拮抗菌具有固氮、溶磷、产 ACC 脱氨酶、产 IAA 等功能特性,可以促进植物生长、改善土壤的微生态环境[10–11]。如果将这些拮抗菌在连作大蒜土壤中使用,必将有效缓解、克服大蒜连作导致的植物生长势弱、病害严重等问题,提高大蒜产量。因此,筛选多功能拮抗菌,探索抗病促生机理,研制防控大蒜土传病害的微生物肥料,对发展“高产、优质、高效、生态、安全”的大蒜产业具有十分重要的理论和现实意义。
1 材料和方法 1.1 供试材料供试细菌 70 株,为实验室前期从山东省金乡县连作大蒜根部分离保藏的微生物资源。大蒜根腐病病原真菌拟枝孢镰刀菌 (Fusarium sporotrichioides) ACCC37402 和大蒜叶枯病病原真菌链格孢属菌株 (Alternaria sp.) D14011-1 由中国农业微生物菌种保藏管理中心 (Agriculture Culture Collection of China, ACCC) 提供。供试土壤采集自山东省金乡县马庙镇卓庙村张庄连作大蒜 20 年以上的土壤。
1.2 培养基PDA 培养基:葡萄糖 20 g,马铃薯 200 g,蒸馏水 1000 mL,琼脂 15~20 g,pH 自然。
牛肉膏培养基:牛肉膏 3 g,蛋白胨 10 g,NaCl 5 g,琼脂 15~20 g,蒸馏水 1000 mL,pH 7.0。
King’s B 培养基:甘油 10 mL,蛋白胨 20.0 g,MgSO4·7H2O 1.5 g,K2HPO4 1.5 g,1.8% 琼脂,pH 7.2。
蛋白酶检测培养基:蛋白胨 10.0 g,NaCl 5.0 g,CaCl2 0.1 g,脱脂奶粉 10.0 g,1.8% 琼脂,115℃ 灭菌 30 min,pH 7.2~7.4。
有机磷卵黄培养基:NaCl 5.0 g,牛肉膏 5.0 g,蛋白胨 10.0 g,蒸馏水 1000 mL,pH 7~7.5 (临用时每 50 mL 中加入新鲜蛋黄液 3 mL,蛋黄液按无菌生理盐水与鸡蛋黄 1∶1 配置)。
无机磷培养基:KCl 0.2 g,NaCl 0.2 g,(NH4)2SO4 0.5 g,Ca3(PO4)2 5.0 g,MgSO4·7H2O 0.1 g,FeSO4·7H2O 0.03 g,MnSO4·H2O 0.02 g,葡萄糖 10.0 g,蒸馏水 1000 mL,琼脂 20.0 g,pH 7~7.5。
无氮培养基[12]:K2HPO4·3H2O 0.5 g,NaCl 0.12 g,CaCO3 1.0 g,MgSO4·7H2O 0.2 g,琼脂 20.0 g。
DF培养基:KH2PO4 4.0 g,Na2HPO4 6.0 g,MgSO4·7H2O 0.2 g,(NH4)2SO4 2.0 g,葡萄糖 2.0 g,葡萄糖酸钠 2.0 g,柠檬酸 2.0 g,组分一、组分二溶液各 0.1 mL,蒸馏水 1000 mL,pH 7.2。组分一:MnSO4·H2O 11.19 mg,CuSO4·5H2O 78.22 mg,ZnSO4·7H2O 124.6 mg,H3BO3 10.0 mg,MoO3 10.0 mg 溶于 100 mL 无菌水中。组分二:FeSO4·7H2O 100.0 mg 溶于 10 mL 无菌水中。
ADF 培养基:ACC 溶于去离子水后过滤灭菌,加到不含 (NH4)2SO4 且灭好菌的 DF 培养基中,ACC 终浓度为 3.0 mmol/L。
1.3 两点对峙实验方案利用两点对峙法,测定菌株对病原真菌的拮抗能力[13]。选用 PDA 平板,在距离平板中心 2 cm 的位置做上两点圆点标记,将大蒜土传根腐病病原真菌 ACCC37402 和大蒜叶枯病病原真菌 D14011-1 分别准确接在其中一点上,并将取 2 μL 待测菌液点于另一圆点,设置 3 个重复。在培养箱里面 28℃ 培养 7 d 后,观察实验结果,拍照记录实验数据,测定其抑菌半径。抑菌直径和抑菌率计算:
抑菌直径 = 对照病原真菌直径 – 与拮抗菌对峙的病原真菌直径
抑菌率 = (对照病原真菌直径 – 与拮抗菌对峙的病原真菌直径)/对照病原真菌直径 × 100%
1.4 菌株16S rDNA序列测定与系统发育分析挑取少量单菌落,放入盛有 100 μL 无菌水的 EP 管中,95℃ 加热 15 min 后迅速放入 –20℃ 冰箱 1 min,12000 r/min 离心 2 min,4℃ 保存,用时取上清液为模板[14]。
PCR 扩增 16Sr DNA 序列,引物采用 16S rDNA 的通用引物,DNA 片段大小约 1500 bp,由上海生工合成。引物 1 (27f),5′-AGAGTTTGATCCTGGCTCAG-3′;引物 2 (1492r),5′-TACGGTTACCTTGTTACGACTT-3′。PCR 扩增反应体系[15]:2 × mixTaq (购自 TaKaRa 公司) 25 μL,引物 (10 μmol/L) 1 μL,模板 2 μL,用去离子水补足到 50 μL 体系。反应程序:95℃ 预变性 5 min、95℃ 变性 1 min、55℃ 退火 1 min、72℃ 延伸 2 min,35 个循环,最后 72℃ 再延伸 10 min,4℃ 保存。
PCR 产物用含有 0.5 μg/mL 溴化乙锭的 1% 的琼脂糖凝胶电泳检测,取 4 μL 的扩增产物和 1 μL loading buffer 混匀上样,200 V,电泳 15 min,于凝胶成像系统中观察并拍照,送北京生工有限责任公司测序。获得序列在EzTaxon数据库上进行序列在线比对,采用Mega软件进行系统发育分析。
1.5 菌株拮抗特性测定项目及方法1.5.1 抗生素敏感性能力检测 采用抑制菌圈法测定拮抗菌对抗生素敏感性[16]。将拮抗菌培养液均匀地涂布于 NA 平板表面,同时以无菌镊子夹取含氨节青霉素钠、链霉素、盐酸四环素等 11 种常见抗生素的纸片 (纸片含量 10 μL/纸片) 置于含菌平板上,30℃ 培养 48 h 后,取出观察测定抑菌圈的大小。
1.5.2 产蛋白酶能力检测 采用透明圈法测定[17]。将待测菌株接种于蛋白酶检测培养基,置于 30℃ 培养 2 d。观察菌落周围透明圈大小可判断菌株的蛋白质水解能力。
1.5.3 产 HCN 能力检测 King’s B 培养基中加入 4.4 g/L 的甘氨酸,将拮抗菌培养液均匀地涂布于 King’s B 培养基中,用无菌镊子夹取浸入过 0.05% 苦味酸 (三硝基苯酚) 和 2% Na2CO3 混合溶液的滤纸,置于培养皿中间,平皿四周用封口膜封住防止漏气。置于 30℃ 培养 2 天。HCN 与苦味酸在 Na2CO3 存在下颜色发生变化,依次呈现深黄、橘色、橘棕、深棕,由此可判断 HCN 的产生[18]。
1.5.4 产铁载体能力检测 菌株产铁载体能力定性测定参考 Schwyn 等蓝色定性检测培养基[19]。然后按每皿 30 mL 倾注于培养皿 (Φ 90 mm) 中,以在 CAS 检测平板上出现橘黄色晕圈的菌株为供试菌株,定性为产铁载体阳性菌。
1.6 菌株促生特性测定项目及方法1.6.1 溶磷能力测定 采用平板筛选法测定溶磷能力[20]。活化供试菌株,制成菌悬液,分别取 2 μL 点接于有机磷和无机磷培养基平板上,无机磷源为 Ca3(PO4)2,有机磷源为新鲜蛋黄液,每各处理三个重复,28℃ 培养 14 天。观察菌株周围能否形成透明圈,判断其是否具有溶磷能力。
1.6.2 固氮能力测定 将待测菌株分别接种于无氮平板上,再从无氮平板上挑取菌落在新的无氮平板上划线,28℃ 培养,在第 3 天目测其生长状况,平板上有菌落的为阳性。筛选有固氮能力的细菌进行固氮酶活性测定。
采用乙炔还原法[15]测定菌株固氮酶活性。15 mm × 150 mm 螺口试管中加入 5 mL 无氮培养基制成斜面,接种固氮菌。28℃ 培养 72 h 后换橡胶塞,注入乙炔气体至终浓度为 10%,继续培养 72 h。取 100 μL 反应气体,气相色谱仪测定乙烯生成量;菌体蛋白量测定用 5 mL 生理盐水洗涤、收集上述固氮酶测定后的斜面菌体,加入 3 mL 0.5 mol/L NaOH 煮沸 5 min,加入 3 mL 0.5 mol/L HCl,离心,取上清 1.0 mL 加入 5 mL 考马斯亮蓝,混合、显色 3 min,测定 595 nm 处的吸光值。根据牛血清白蛋白标准曲线计算菌体蛋白量。固氮酶活性 [nmol/(mg·h), protein] = C 2H4 (nmol)/[菌体蛋白量 (mg, protein) × 反应时间 (h)]。
1.6.3 IAA 能力测定 采用比色法测定菌株产 IAA 的能力[21]。菌株在 DF 培养基中过夜生长,然后转移到含 0.1% L-色氨酸的 DF 培养基中。菌株在 28℃ 条件下培养 7 天,然后 8000 r/min 离心 10 分钟。1 mL 的悬浮液混合 2 mL 的 Fe-H2SO4 溶液 (取 1 mL 的 0.5 mol/L FeCl3·6H2O 溶液到 74 mL 的 6.13 mol/L H2SO4 中) 暗室放置 45 min,IAA 浓度计算通过测量样品和标准品的吸光度在 450 nm 处的标准曲线。
1.6.4 ACC 脱氨酶活性菌株的筛选 参考 Glick 的方法[22],将菌种接入 5 mL 固氮液体培养基,28℃ 200 r/min 振荡培养 24 h,吸取 0.1 mL 悬浮液至 5 mL 的 DF 培养基中,同条件继续培养 24 h,吸取 0.1 mL 悬浮液至 5 mL 的 ADF 培养基中,同条件继续培养 24~48 h。将可在 ADF 培养基中生长的菌种再转接一次,用不含 ACC 的 ADF 培养基为阴性对照。分别以不接菌的 ADF 和不含 ACC 的 ADF 培养基调零,测定 600 nm 处菌液的吸光度值,确定 ACC 脱氨酶的阳性菌株。
1.7 温室条件下多功能菌 Bacillus sp. DD3 (DD3) 对大蒜根腐病 ACCC37402 的抗病能力试验设计处理分别为接种大蒜根腐病原真菌 ACCC37402 的孢子液 (后简称 37402)、37402 + DD3 菌悬液、37402 + DD3 的无菌发酵液,对照为不接菌。将大蒜根腐病病原真菌 ACCC37402 接到 PDA 液体培养基中,28℃、150 r/min 培养 7 d,用血球计数板计算孢子数量,用无菌水配制成浓度为 2 × 10 7 cfu/mL 的孢子液;将 DD3 接到牛肉膏培养基中,28℃、160 r/min 培养 2 d,用无菌水配制为 OD600 = 1、有效活菌数为 1.8 × 10 6 cfu/mL 菌悬液。
将肥料与灭菌土壤搅拌均匀后装到花盆中,浇透水备用。将大蒜剥皮后在水中浸泡一夜沥干放入 4℃ 冰箱内 12 小时拿出。选取重量、蒜高基本一致的蒜种播种于花盆中,每个花盆种 5 个蒜瓣 (如果出苗不好,后期需要补苗),处理和对照各 2 盆。待大蒜苗高约 5 cm 时,每株大蒜处理 1 为接 10 mL 根腐病病原真菌 37402 + 10 mL 清水,处理 2 为接 10 mL 根腐病病原真菌 37402 + DD3 菌悬液 10 mL,处理 3 为接 10 mL 根腐病病原真菌 37402 + 无菌发酵液 10 mL,对照加 20 mL 清水。40 d 后,观察大蒜的感病和抗病情况,根据张博的方法[23]确定根腐病原菌的致病力,测定大蒜株高、茎粗、株鲜重、株干重,分析 DD3 以及其无菌发酵液对感病大蒜幼苗生长的影响。根据大蒜植株茎基部与根部发病情况,统计发病率与防治效果[23]。防治效果 = (对照组发病株数 – 防治组发病株数)/对照组发病株数 × 100%
1.8 温室条件下菌株 DD3 对大蒜幼苗的促生能力试验设计处理为接种 OD600 = 1、有效活菌数为 1.8 × 10 6 cfu/mL 的 DD3 菌悬液、DD3 无菌发酵液,对照为不接菌。将菌株 DD3 接到牛肉膏培养基中,28℃、160 r/min 下培养 2 d。
将肥料与灭菌土壤搅拌均匀后装到花盆中,浇透水备用。将大蒜剥皮后在水中浸泡一夜沥干放入 4℃ 冰箱内 12 h 拿出。选取重量、蒜高基本一致的蒜种播种于花盆中,每个花盆种 2 个蒜瓣 (如果出苗不好,后期需要补苗),处理和对照各 5 盆。待大蒜苗高约 5 cm 时,每株大蒜接 DD3 菌悬液 10 mL、无菌发酵液 10 mL,对照处理加 10 mL 清水。40 d 后,观察大蒜的长势,测定大蒜株高、茎粗、株鲜重、株干重,分析多功能菌 DD3 及其无菌发酵液对大蒜幼苗生长的影响。
1.9 数据处理单因素方差分析采用 SPSS16.0 对数据进行方差齐性检验 (F > 0.05),处理间多重比较采用 LSD 法。
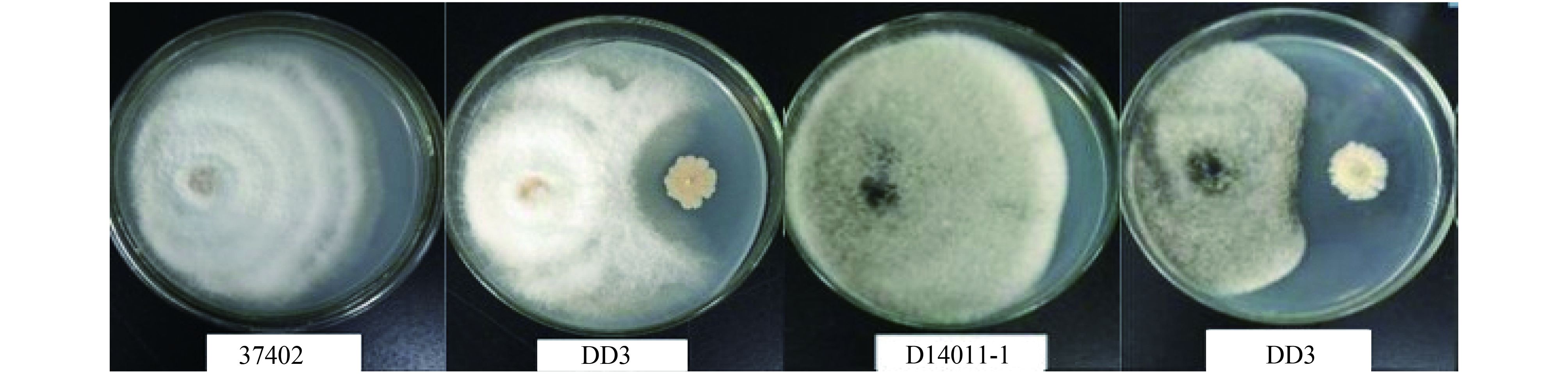
2 结果与分析 2.1 大蒜根腐病和叶枯病拮抗菌的筛选以实验室前期从山东省金乡县连作大蒜根部分离的 70 株细菌为研究对象,以大蒜根腐病病原真菌拟枝孢镰刀菌 (Fusarium sporotrichioides) ACCC37402 和大蒜叶枯病病原真菌链格孢属菌株 (Alternaria sp.) D14011-1 为对峙菌株,经两点对峙实验筛选获得一株细菌 DD3 对大蒜根腐病 ACCC37402 和叶枯病 D14011-1 均具有明显的拮抗效果 (图 1),抑菌率均为 45%。
 |
|
图1
菌株 Bacillus sp. DD3 对大蒜根腐病和叶枯病病原真菌的拮抗能力
Fig. 1
Antagonistic ability of Bacillus sp. DD3 against pathogenic fungi of garlic root rot and garlic leaf blight
|
以筛选获得的高效拮抗菌 DD3 的总 DNA 为模板,采用 16S rDNA 通用引物 27F 和 1492R,PCR 扩增到 16S rDNA 基因大小约 1.5 kb。测序结果经 http://ezbiocloud.net/ 数据库在线比对,结果显示菌株 DD3 的 16S rDNA 基因序列最高相似性菌株为沙漠枯草芽胞杆菌 Bacillus subtilis subsp. inaquosorum KCTC 13429T (AMXN01000021),最高相似度为 99.36%。采用邻近法,构建菌株 DD3、5 株与其高相似性芽胞杆菌属 (Bacillus) 菌株以及两个类芽胞杆菌属菌株的 16S rDNA 基因序列系统进化发育树 (图 2),结果显示高效拮抗菌 DD3 与其 16S rDNA 基因序列最高相似性菌株 Bacillus subtilis subsp. inaquosorum KCTC 13429T 位于同一分支,说明它们具有高度同源性。经 16S rDNA 序列分析,将菌株 DD3 初步鉴定为芽胞杆菌属菌株 Bacillus sp。
 |
| 图2 菌株 Bacillus sp. DD3 系统进化发育树 Fig. 2 Phylogenetic tree of Bacillus sp. DD3 |
表 1 结果显示,菌株 DD 对氨苄青霉素钠、硫酸卡那霉素、青霉素钠、噻孢霉素等 11 种抗生素均无耐受性。
| 表1 菌株 Bacillus sp. DD3 的功能特性 Table 1 The functional characterizations of Bacillus sp. DD3 |
 |
菌株 DD3 能在蛋白酶检测平板上出现明显透明水解圈 (图 3),表明其具有蛋白水解能力;在 King’s B 培养基上,含菌株 DD3 的滤纸出现深黄色变化 (图 3),说明其具有产 HCN 能力;菌株 DD3 可以使 CAS 蓝色检测液产生橘黄色透明圈 (图 3),说明其具有产铁载体能力。
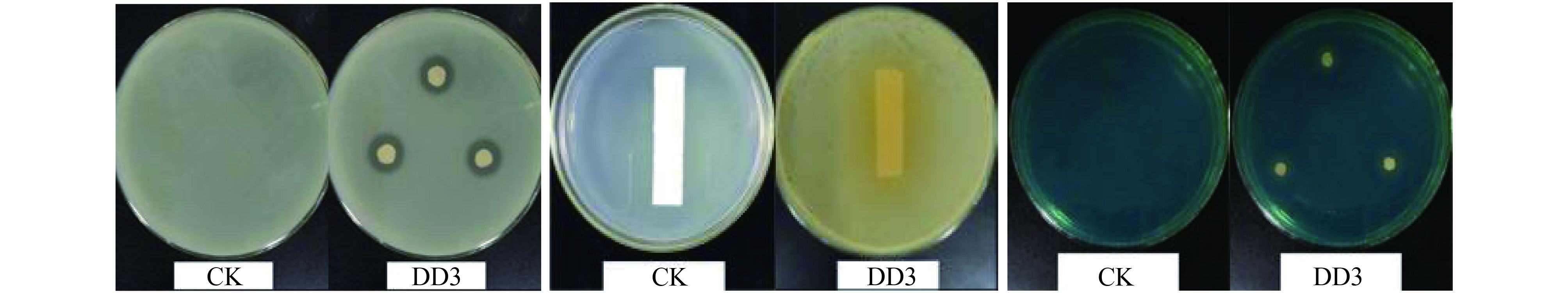 |
| 图3 菌株 Bacillus sp. DD3 水解蛋白、产 HCN、产铁载体能力 Fig. 3 Capacity of producing hydrolysis protein, HCN and siderophore of Bacillus sp. DD3 |
菌株 DD3 经过两次检测,都能在无氮平板上生长,初步判定其都具有固氮能力,经乙炔还原法测定,菌株 DD3 的固氮酶活性为 0.41 ± 0.09 nmol/(mg·h);菌株 DD3 能在有机磷培养基上和无机磷培养基上形成透明圈 ( 图 4),说明其同时具有溶解有机磷和无机磷的能力;在含 0.1% L-色氨酸的 DF 培养基中培养,与 Fe-H2SO4 溶液不能发生颜色反应,说明其不具有产 IAA 能力;在 ADF 培养基中不能生长,说明该菌不具有产 ACC 脱氨酶能力。综上,菌株Bacillus sp. DD3 具有多种抗病和促生特性。
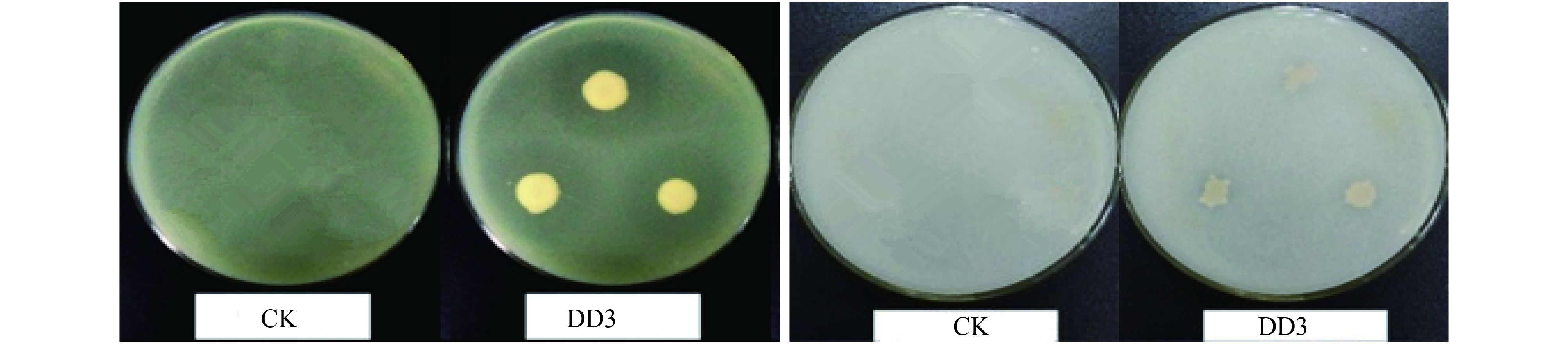 |
| 图4 菌株 Bacillus sp. DD3 溶磷能力 Fig. 4 Phosphate solubilizing ability of Bacillus sp. DD3 |
接入大蒜根腐病病原真菌 ACCC37402 孢子液的大蒜根腐病发病率为 100%,对发病植株病健交界处进行再分离,经鉴定,再分离菌株与接种菌株完全相同,确认 ACCC37402 对大蒜具有致病力。经有效活菌计数,吸光值 OD600 = 1 的 DD3 菌悬液活菌浓度为 1.8 × 10 6 cfu/mL。接入菌悬液后可达到良好的抗病效果,抗病率达 80%,接入无菌发酵液后,抗病率为 30%。感染根腐病后的大蒜幼苗,在接种 DD3 菌悬液和其无菌发酵液后,在株高、茎粗、株鲜重、株干重与感染根腐病的大蒜相比都有增加;SPSS 分析显示,与感病大蒜幼苗相比,接菌悬液和无菌发酵液后大蒜株高、株鲜重和株干重达到显著性差异,茎粗差异不显著。与不接菌对照相比,接菌悬液和无菌发酵液后大蒜各指标差异均不显著 (表 2)。可见,多功能菌 Bacillus sp. DD3 菌悬液可以达到较好的拮抗病原微生物的作用 (图 5)。
| 表2 接种多功能菌 Bacillus sp. DD3 及其无菌发酵液 (AFL) 感病大蒜幼苗的生长 Table 2 Growth of susceptible garlic seedlings inoculated with multifunctional Bacillus sp. DD3 and its axenic fermentation liquid (AFL) |
 |
 |
| 图5 菌株 Bacillus sp. DD3 及其无菌发酵液对大蒜幼苗的抗病效果 Fig. 5 Disease-resistance of garlic seedlings of Bacillus sp. DD3 suspension and its axenic fermentation liquid |
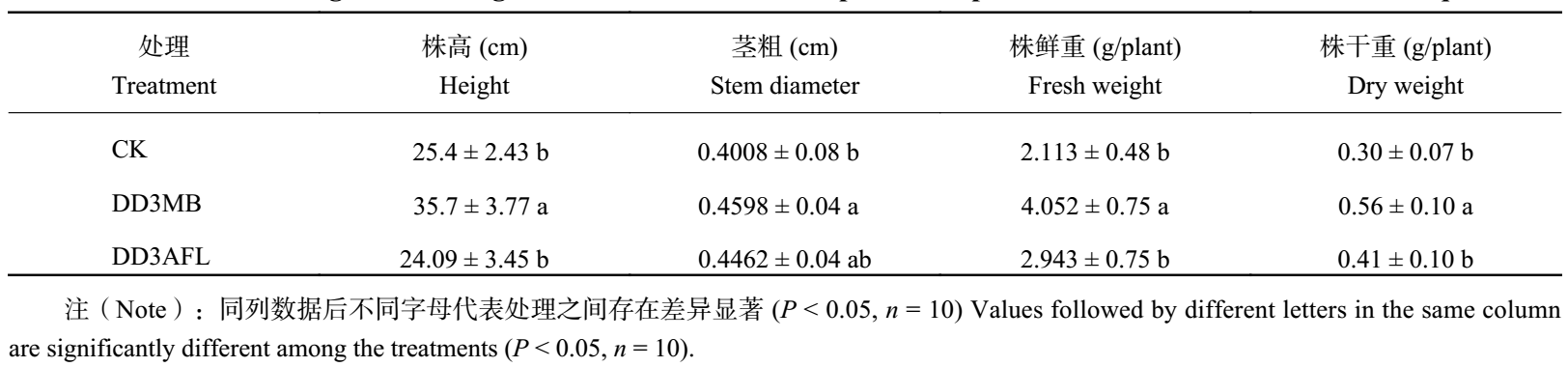
接菌后第 40 天收获蒜,分别测定大蒜株高、茎粗、株鲜重、株干重,结果显示,接种 DD3 菌悬液 (DD3MB) 后大蒜茎粗、株高、株鲜重、株干重等与未接菌对照相比都有增加;接种无菌发酵液 (DD3AFL) 后大蒜茎粗、株高、株鲜重、株干重等与未接菌对照相比也有增加,但增加效果不如菌悬液效果明显 (图 6 )。SPSS 分析显示,与不接菌对照相比,接菌悬液后大蒜株高和茎粗达到显著性差异,株鲜重和株干重达到极显著差异。与不接菌对照相比,接无菌发酵液后大蒜株鲜重和株干重达到显著性差异 (表 3),可见,DD3 菌悬液及其无菌发酵液对大蒜幼苗均具有一定的促生作用,DD3 菌悬液的促生效果更佳。
 |
| 图6 菌株 Bacillus sp. DD3 及其无菌发酵液对大蒜幼苗促生效果 Fig. 6 Promoting effect on garlic seedlings of Bacillus sp. DD3 and its axenic fermentation liquid |
| 表3 接种 Bacillus sp. DD3 菌悬液 (MB) 和无菌发酵液 (AFL) 大蒜幼苗的生长 Table 3 Growth of garlic seedlings inoculated with Bacillus sp. DD3 suspension and its axenic fermentation liquid |
 |
植物根际促生菌 (PGPR) 对土壤中非寄生性根际有害微生物与有害病原微生物起到生防作用,促进植物矿质元素的吸收和利用,可产生利于植物生长的代谢产物,从而促进植物生长发育[24]。芽胞杆菌 (Bacillus) 作为一类重要的能拮抗病原真菌的 PGPR,部分菌株已经在农业生产中应用[25]。崔北米等[26]从大蒜鳞茎中分离内生细菌 19 株,其中菌株 Bacillus axarquiensis DSP6 对 9 种病原真菌具有较强的抑菌作用。Solanki 等[27]分离到使立枯丝核菌 (Rhizoctonia solani) 病害分别减少 69.8% 和 61.5% 的解淀粉芽孢杆菌 (Bacillus amyloliquefaciens) MB101 和枯草芽胞杆菌 (Bacillus subtilis) MB14。枯草芽孢杆菌 (Bacillus subtilis) 是一类好氧产芽孢的革兰氏阳性杆状细菌,具有丰富多样的生理特征,在自然界中大量存在,并能产生抗逆性休眠体—芽孢,进而适应恶劣的环境,存活期较长[28]。枯草芽孢杆菌能产生多种抑制植物病原真菌的抗菌物质,且对人畜无害,不污染环境,因而在生物防治植物病害中起着重要的作用[29]。本研究从大蒜根际分离筛选获得的细菌 Bacillus sp. DD3,16S rDNA 序列最高相似性菌株为沙漠枯草芽胞杆菌 Bacillus subtilis subsp. inaquosorum (99.4%),对大蒜根腐病病原真菌 ACCC37402 和大蒜叶枯病病原真菌 D14011-1 均具有明显的拮抗效果。
研究发现,具有较好应用前景或者已经在农业中广泛应用的抗病植物根际促生菌 (PGPR) 一般都兼具多种抗病促生机制,产生抗生素、蛋白酶、HCN 等与拮抗相关的次级代谢产物的 PGPR,可以有效地抑制土传病害 [8–9];产铁载体 PGPR,可以融合土壤中的铁元素供植物利用,还可以与病原菌争夺铁元素,抑制病原菌繁殖[30];具有固氮、解磷能力的 PGPR,在一定程度上可以为自身和植物提供可利用氮和磷,促进植物生长[20, 24]。Burkholderia sp. 7016 能促进番茄生长,具有固氮、溶磷、产 ACC 脱氨酶活性和拮抗土传病害等功能特性[20]。Pseudomonas aeruginosa PM389 能促进狗尾草藜生长,具有拮抗土传病害、产铁载体、固氮、溶磷等功能特性[30]。Lin 等[11]筛选到能拮抗真菌病害的芽胞杆菌 21 株,同时具有固氮能力和产 IAA 能力,对黄瓜根腐病具有明显抑制作用,并能促进黄瓜生长。本文筛选获得拮抗多种病原真菌的菌株 Bacillus sp. DD3 具有解蛋白能力、产 HCN 能力、产铁载体能力、对大观霉素具有耐受性、固氮能力、溶解有机磷和无机磷的能力。盆栽试验显示,接种 Bacillus sp. DD3 菌悬液可以使大蒜根腐病的防控效果达到 80%,接种 Bacillus sp. DD3 菌悬液及其无菌发酵液后对大蒜幼苗具有一定的促生作用,其中菌悬液要比其无菌发酵液抗病促生效果更强。可见,多功能菌 Bacillus sp. DD3 兼具多种功能特性且对大蒜幼苗具有较好的促生效果,为防治大蒜土传病害、促进大蒜生长提供优良菌种资源。但是,本研究筛选的 Bacillus sp. DD3 功能特性是在室内纯培养的条件下进行,促生试验是在温室可控条件下开展的,在自然条件下菌株的拮抗促生效果一定会受土壤、植物、气候、土著微生物等诸多因素的影响。因此,该菌株是否能作为农业微生物菌剂应用,还需要大量的试验来探讨。
| [1] |
刘素慧, 刘世琦, 张自坤, 等. 大蒜连作对其根际土壤微生物和酶活性的影响[J].
中国农业科学, 2010, 43(5): 1000–1006.
Liu S H, Liu S Q, Zhang Z K, et al. Influence of garlic continuous cropping on rhizosphere soil microorganisms and enzyme activities[J]. Scientia Agricultura Sinica, 2010, 43(5): 1000–1006. |
| [2] |
刘辉志, 韩世平. 大蒜细菌性心腐病的识别与防治[J].
安徽农学通报, 2011, 17(3): 124–125.
Liu H Z, Han S P. Recognition and control of bacterial heart rot of garlic[J]. Anhui Agricultural Science Bulletin, 2011, 17(3): 124–125. |
| [3] |
刘爱华, 徐保民, 陈燕. 不同配方施肥及微生物菌肥对大蒜重茬病防治效果[J].
山东农业科学, 2009, (6): 91–92.
Liu A H, Xu B M, Chen Y. Control effect of different fertilizer and microbial fertilizer on continuous cropping disease of garlic[J]. Shandong Agricultural Sciences, 2009, (6): 91–92. DOI:10.3969/j.issn.1001-4942.2009.03.026 |
| [4] |
程晓兰, 程智慧, 邹燕, 等. 大蒜叶枯病抗性鉴定方法的筛选[J].
华中农业大学学报, 2010, 29(1): 26–30.
Cheng X L, Cheng Z H, Zou Y, et al. Screen of evaluation methodology of garlic resistance to tip blight[J]. Journal of Huazhong Agricultural University, 2010, 29(1): 26–30. |
| [5] |
王桂华. 金乡大蒜重茬病发生原因及防治措施[J].
农业科技通讯, 2011, (12): 165–166.
Wang G H. Control effect and reasons on continuous cropping disease of Jinxiang garlic[J]. Bulletin of Agricultural Science and Technology, 2011, (12): 165–166. DOI:10.3969/j.issn.1000-6400.2011.01.073 |
| [6] |
贾茹, 张迪, 马晓东, 姜百文. 大蒜连作障碍研究进展[J].
北方园艺, 2014, (19): 207–210.
Jia R, Zhang D, Ma X D, Jiang B W. Research progress of continuous cropping obstacle of garlic[J]. Northern Horticulture, 2014, (19): 207–210. |
| [7] | Basha S, Ulaganathan K. Antagonism of bacillus species (strain BC121) towards Curvularia lunata [J]. Current Science, 2002, 82(22): 1457–1463. |
| [8] | Hu H Q, Li X S, He H. Characterization of an antimicrobial material from a newly isolatedBacillus amyloliquefaciens from mangrove for biocontrol of Capsicum bacterial wilt [J]. Biological Control, 2010, 54(3): 359–365. DOI:10.1016/j.biocontrol.2010.06.015 |
| [9] | González-Sánchez M. Evaluation of the effectiveness of biocontrol bacteria against avocado white root rot occurring under commercial greenhouse plant production conditions[J]. Biological Control, 2013, 67: 94–100. DOI:10.1016/j.biocontrol.2013.08.009 |
| [10] | Velusamy P, Immanuel J E, Gnanamanickam S S. Rhizosphere bacteria for biocontrol of bacterial blight and growth promotion of rice[J]. Rice Science, 2013, 20(5): 356–362. DOI:10.1016/S1672-6308(13)60143-2 |
| [11] | Lin Y, Du D, Si C, . Potential biocontrol Bacillus sp, et al. Potential biocontrol Bacillus sp. strains isolated by an improved method from vinegar waste compost exhibit antibiosis against fungal pathogens and promote growth of cucumbers [J]. Biological Control, 2014, 71: 7–15. DOI:10.1016/j.biocontrol.2013.12.010 |
| [12] |
孙建光, 胡海燕, 刘君, 等. 农田环境中固氮菌的促生潜能与分布特点[J].
中国农业科学, 2012, 45(8): 1532–1544.
Sun J G, Hu H Y, Liu J, et al. Growth promotion potential and distribution features of nitrogen-fixing bacteria in field environments[J]. Scientia Agricultura Sinica, 2012, 45(8): 1532–1544. |
| [13] |
陈倩, 胡海燕, 高淼, 等. 一株具有ACC脱氨酶活性固氮菌的筛选与鉴定[J].
植物营养与肥料学报, 2011, 17(6): 1515–1521.
Chen Q, Hu H Y, Gao M, et al. Screening and identification of a nitrogen fixing bacteria with 1-aminocyclopropane-1-carboxylate deaminase activity[J]. Plant Nutrition and Fertilizer Science, 2011, 17(6): 1515–1521. DOI:10.11674/zwyf.2011.1111 |
| [14] |
孙建光, 罗琼, 高淼, 等. 小麦、水稻、玉米、白菜、芹菜内生固氮菌及其系统发育[J].
中国农业科学, 2012, 45(7): 1303–1317.
Sun J G, Luo Q, Gao M, et al. Isolation and phylogeny of nitrogen-fixing endophytic bacteria in wheat, rice, maize, Chinese cabbage and celery[J]. Scientia Agricultura Sinica, 2012, 45(7): 1303–1317. |
| [15] |
孙建光, 徐晶, 胡海燕, 等. 中国十三省市土壤中非共生固氮菌微生物菌种资源研究[J].
植物营养与肥料学报, 2009, 15(6): 1450–1465.
Sun J G, Xu J, Hu H Y, et al. Collection and investigation on asymbiotic nitrogen-fixing microbial resources from 13 provinces over China[J]. Plant Nutrition and Fertilizer Science, 2009, 15(6): 1450–1465. DOI:10.11674/zwyf.2009.0630 |
| [16] |
黄秀梨. 微生物学实验指导[M]. 北京: 高等教育出版社, 1999.
Huang X L. Microbiology experimental guidance [M]. Beijing: Higher Education Press, 1999. |
| [17] |
王雅雅, 付瑞敏, 于烽, 等. 植物土传疾病拮抗菌的筛选及其生防潜力评价[J].
江苏农业科学, 2015, 43(7): 102–106.
Wang Y Y, Fu R M, Yu F, et al. Screening and biocontrol potential evaluation of antagonistic bacteria against plant soil-borne diseases[J]. Jiangsu Agricultural Sciences, 2015, 43(7): 102–106. |
| [18] |
周田甜. 番茄青枯病拮抗菌和的分离鉴定及抗生素2,4-DAPG合成和调控研究[D]. 南京: 南京农业大学博士学位论文, 2012.
Zhou T T. Isolation, Characterization of antagonistic strains against tomato bacterial wilt and study of antibiotic synthesis, regulation 2,4-DAPG [D]. Nanjing: PhD Dissertation of Nanjing Agricultural University, 2012. |
| [19] | Schwyn B, Neilands J B. University Chemical assay for the detection and determination of siderophores[J]. Analytical Biochemistry, 1987, 160: 47–56. DOI:10.1016/0003-2697(87)90612-9 |
| [20] | Gao M, Zhou J, Wang E, et al. Multiphasic characterization of a plant growth promoting bacterial strainBurkholderia sp. 7016 and its effect on tomato growth in the field [J]. Journal of Integrative Agriculture, 2015, 14(9): 1855–1863. DOI:10.1016/S2095-3119(14)60932-1 |
| [21] | Amprayn K, Rose M T, Kecskes M, et al. Plant growth promoting characteristics of soil yeast (Candida tropicalis HY) and its effectiveness for promoting rice growth [J]. Applied Soil Ecology, 2012, 61: 295–299. DOI:10.1016/j.apsoil.2011.11.009 |
| [22] | Glick B R. Modulation of plant ethylene levels by the bacterial enzyme ACC deaminase[J]. FEMS Microbiology Letter, 2005, 251(1): 1–7. DOI:10.1016/j.femsle.2005.07.030 |
| [23] |
张博. 山东省大蒜腐霉根腐病初步研究[D]. 乌鲁木齐: 新疆农业大学硕士学位论文, 2008.
Zhang B. A preliminary study of Shandong garlic Pythium root rot [D]. Urumqi: MS Thesis of Xinjiang Agricultural University, 2008. |
| [24] |
李琬, 刘淼, 张必弦, 等. 植物根际促生菌的研究进展及其应用现状[J].
中国农学通报, 2014, 30(24): 1–5.
Li W, Liu M, Zhang B X, et al. Research progress and application status of plant growth promoting rhizobacteria[J]. Chinese Agricultural Science Bulletin, 2014, 30(24): 1–5. DOI:10.11924/j.issn.1000-6850.2013-3360 |
| [25] |
谢永丽, 马莉贞, 徐志伟, 等. 冻土荒漠区分离低温适生PGPR菌的鉴定及其抗菌促生特性[J].
中国生物防治学报, 2014, 30(1): 94–100.
Xie Y L, Ma L Z, Xu Z W, et al. Identification of low-temperature adapting PGPR strains isolated from frozen desert area and their antimicrobial and growth-promoting activity[J]. Chinese Journal of Biological Control, 2014, 30(1): 94–100. |
| [26] |
崔北米, 潘巧娜, 张陪陪, 等. 大蒜内生细菌的分离及拮抗菌筛选与鉴定[J].
西北植物学报, 2008, 28(11): 2343–2348.
Cui B M, Pan Q N, Zhang P P, et al. Isolation and identification of endogenetic bacteria and screening of their antagonistic bacteria in garlic[J]. Acta Botanica Boreali-Occidentalia Sinica, 2008, 28(11): 2343–2348. DOI:10.3321/j.issn:1000-4025.2008.11.032 |
| [27] | Solanki M K, Robert A S, Singh R K, et al. Characterization of mycolytic enzymes of Bacillus strains and their bioprotection role against Rhizoctonia solani in tomato [J]. Current Microbiology, 2012, 65(3): 330–336. DOI:10.1007/s00284-012-0160-1 |
| [28] |
张彩凤. 生防菌枯草芽孢杆菌的研究进展[J].
现代农村科技, 2015, (11): 47.
Zhang C F. Progress in biocontrol Bacillus subtilis [J]. Modern Science and Technology in Rural Areas, 2015, (11): 47. DOI:10.3969/j.issn.1674-5329.2015.01.040 |
| [29] |
喻子牛. 微生物农药及其产业化[M]. 北京: 科学出版社, 2000.
Yu Z N. Microbial pesticides and industrial [M]. Beijing: Science Press, 2000. |
| [30] | Gupta G, Panwar J, Jha P N, Natural occurrence of Pseudomonas aeruginosa , a dominant cultivable diazotrophic endophytic bacterium colonizing Pennisetum glaucum . (L.) R. Br.[J]. Applied Soil Ecology, 2013, 64: 252–261. DOI:10.1016/j.apsoil.2012.12.016 |
 2017, Vol. 23
2017, Vol. 23  doi:
doi: 

